Для самостоятельного изучения «Биохимия как наука. Этапы развития биохимии. Методы биохимических исследований» (Скоробогатова З. М.)
| Вид материала | Методические рекомендации |
- Для самостоятельного изучения Биохимия как наука. Этапы развития биохимии, 2094.45kb.
- Основы биохимии спорта, 1521.5kb.
- Председатель цикловой методической комиссии, 42.51kb.
- Тема строение белков и ферментативный катализ вопросы лекции, 137.02kb.
- Лекция №6. Структура биологии как науки. Ранние этапы эволюции жизни, 433.89kb.
- Планирование будущего развития с использованием техники сценариев, 15.36kb.
- Тематический план лекций по общей биохимии для студентов 2-го курса лечебного, педиатрического, 1643.39kb.
- Резюмируя можно сказать, что объектом ее изучения являются химические элементы, 71.81kb.
- Курс (8 семестр) 2010/2011уч год специальность «Стоматология» Календарно-тематический, 183.27kb.
- 1. История как наука: этапы становления, предмет, методы исследования, функции исторического, 609.65kb.
Инструкция к практическому занятию
Работа 1. «Исследование термолабильности ферментов»
Принцип работы:
Каталитическая функция – уникальное свойство белков-ферментов, обусловленная их структурными особенностями. Активный центр фермента формируется на высшем структурном уровне белка, является комбинацией радикалов аминокислот в пространстве. Физические факторы могут изменять пространственную конфигурацию полипептидной цепи, следовательно, влиять на каталитическую функцию белков.
Материальное обеспечение: пробирки, 1% раствор крахмала, реактив Люголя, 10% раствор едкого натра (NaOH), 1% раствор сульфата меди (CuSO4)
Ход работы:
В чистую пробирку отливают небольшое количество неразведенной слюны (2-3 мл) и кипятят ее в течение 5-8 мин, после чего охлаждают. В 3 пробирки наливают по 10 капель 1% раствора крахмала. В 1-ю пробирку добавляют 10 капель некипяченой и разведенной в 10 раз слюны, во 2-ю - 10 капель прокипяченной и разведенной в 10 раз слюны, в 3-ю - 10 капель воды в качестве контроля. Все пробирки помещают в термостат при температуре 38°С на 10 мин. После этого содержимое пробирок делят на две части и проводят качественные реакции на крахмал (субстрат) и глюкозу ( конечный продукт расщепления крахмала).
Реакция на крахмал. К 5 каплям исследуемого раствора приливают 1 каплю р-ра Люголя, содержащего йод. В присутствии крахмала появляется синее окрашивание.
Реакция на глюкозу (реакция Троммера). К 5 каплям иследуемой жидкости приливают 5 капель 10% раствора едкого натра и 3 капли 1% раствора сульфата меди. Осторожно кипятят 1 мин до появления красного окрашивания, которое указывает на наличие глюкозы.
Работа 2. «Исследование влияния рН среды на активность ферментов»
Принцип работы:
Высший структурный уровень белка (чаще третичный, либо четвертичный) формируется за счет водородных связей, ионных и гидрофобных взаимодействий радикалов аминокислот. Способность к таким взаимодействиям зависит от степени диссоциации ионогенных групп аминокислот. На последнюю влияет рН среды.
Материальное обеспечение: пробирки, 1% раствор крахмала, реактив Люголя, набор буферных растворов
Ход работы:
Слюну предварительно разводят в 100 раз. Берут 6 пробирок и в каждую наливают по 2 мл буферного раствора с различным значением рН: 6.0, 6,4, 6.8, 7,2, 7,6, 8,0. Затем приливают по 1 мл 1% раствора крахмала и по 1 мл разведенной слюны. Перемешивают содержимое пробирок и термостатируют при 38°С в течение 10 мин. Затем во все пробирки добавляют по 1 капле р-ва Люголя, перемешивают, наблюдают окраску и отмечают рН, при котором амилаза действует наиболее активно.
Работа 3. «Исследование специфичности ферментов»
Принцип работы:
Способность ферментов избирательно превращать определенные субстраты обусловлена комплементарностью между структурой активного центра и субстрата. Это соответствие друг другу по принципу «ключа и замка» связано с набором радикалов аминокислот в активном центре, несущих определенные функциональные группы (-ОН, -SH, -NH3 + , -COO -), поэтому участвующих в связывании и последующем превращении специфических субстратов. Например, амилаза слюны (фермент 1) способна специфически расщеплять крахмал (субстрат1) до декстринов, которые ращепляются затем до мальтозы и глюкозы (продукт 1). Сахараза (фермент 2) расщепляет дисахарид сахарозу (субстрат 2) на глюкозу и фруктозу (продукт 2).
Материальное обеспечение: пробирки, 1% раствор крахмала, 1% раствора сахарозы (тростниковый сахар), р-в Люголя, 10% раствор едкого натра (NaOH), 1% раствор сульфата меди (CuSO4), амилаза, сахараза
Ход выполнения работы:
Для исследования специфичности амилазы (фермент 1) берут слюну, разведенную в 10 раз. Для изучения действия сахаразы (фермент 2) используют профильтрованную вытяжку из дрожжей.
В четыре пронумерованные пробирки согласно таблице последовательно добавляют:
| № про-бирки | Фермент 1 мл | Субстрат 1 мл | Качественная реакция на крахмал с реактивом Люголя | Качественная реакция на глюкозу - реакция Троммера |
| 1 | Амилаза (в разведен- ной слюне) | 1% р-р крахмала | | |
| 2 | Амилаза (в разведен- ной слюне) | 1% р-р сахарозы (тростниковый сахар) | | |
| 3 | Сахараза (вытяжка из дрожжей) | 1% р-р крахмала | | |
| 4 | Сахараза (вытяжка из дрожжей) | 1% р-р сахарозы (тростниковый сахар) | | |
Пробирки оставляют на 15-20 мин при 38°С. Затем в 1-й и 3-й проводят качественную реакцию на крахмал, а во 2-й и 4-й - качественную реакцию на глюкозу. Описание качественных реакций см. в работе1. Результаты опытов записывают в таблицу.
ВЫВОДЫ:
Подпись преподавателя:
Приложение 1
Граф логической структуры
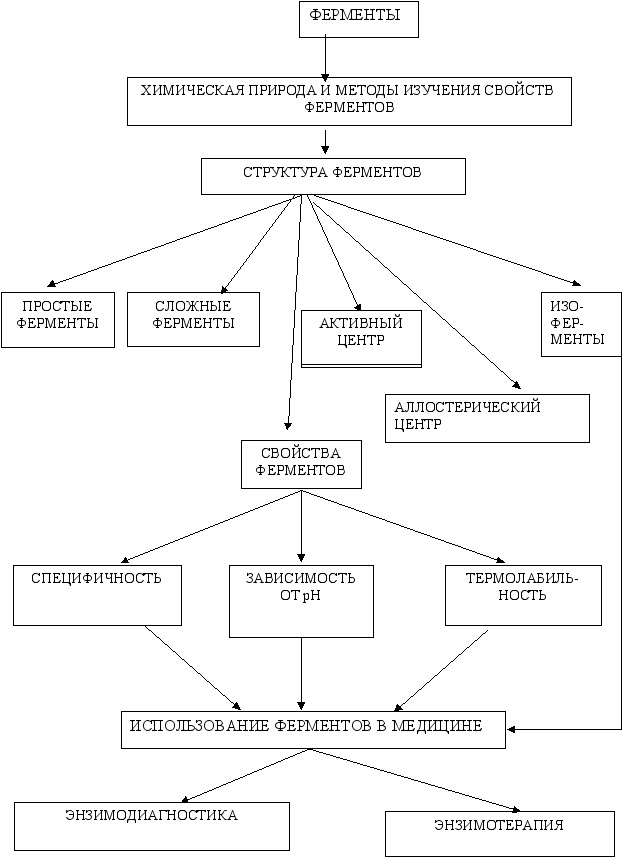
ТЕМА 1.3. ОПРЕДЕЛЕНИЕ АКТИВНОСТИ ФЕРМЕНТОВ. ИССЛЕДОВАНИЕ КИНЕТИКИ ФЕРМЕНТАТИВНОГО КАТАЛИЗА И ВЛИЯНИЯ АКТИВАТОРОВ И ИНГИБИТОРОВ
Актуальность темы
Знания механизмов, посредством которых клетки и целые организмы координируют и регулируют весь набор метаболических процессов, важны при исследованиях в разных областях биомедицинских наук. Сюда можно отнести проблемы карцерогенеза, сердечно – сосудистых заболеваний, старения, действия гормонов и лекарственных препаратов. Во всех этих областях наблюдаются примеры нарушения регуляции работы ферментов, имеющие важное медицинское значение. Из всех факторов, от которых зависит активность фермента - концентрация фермента и субстрата, температура, рН и присутствие ингибиторов, - наибольший клинический интерес представляют два последних.
Активаторы и ингибиторы влияют на активный центр фермента, способствуют формированию его или блокированию. Они могут взаимодействовать с аллостерическим центром и тем самым менять ферментативную активность. Ингибиторами нередко являются продукты промежуточных или конечных реакций какого-либо биохимического процесса. Некоторые природные или синтетические вещества оказывают избирательное ингибирующее действие на ферменты и используются в качестве лекарственных веществ. В больших дозах подобные вещества могут оказаться ядами.
Большинство лекарственных препаратов оказывает свое действие, влияя на соответствующие ферментативные реакции. Многие такие препараты сходны с природными субстратами и потому могут действовать как конкурентные ингибиторы ферментов. Чтобы понять многие процессы, которые существенны для фармакологии и токсикологии, необходимо иметь четкое представление о механизмах ингибирования ферментов.
Теперь ознакомьтесь с целями занятия.
Общая цель
Уметь использовать знания о механизмах регуляции активности ферментов при изучении состояния обмена веществ, а также для обоснования использования препаратов, действующих по принципу ферментативных ингибиторов или активаторов.
Конкретные цели: Цели исходного уровня:
Уметь:
| 1. Интерпретировать основные этапы ферментативного катализа. | 1.Интерпретировать данные о катализе и катализаторах (каф. медицинской и фарм. химии). |
| 2. Дать характеристику основным типам ингибиторов. | |
| 3. Объяснить основные механизмы регуля- ции каталитической активности ферментов. | |
| 4. Определить класс ферментов, основы- ваясь на типе катализируемой реакции. | 2.Интерпретировать и приводить примеры различных типов химических реакций (каф. медицинской и фарм. химии). |
Задания для самопроверки и самокоррекции исходного уровня знаний
Задание 1. Известно, что скорость взаимодействия веществ А и В увеличилась в три раза после добавления вещества К. В качестве конечных продуктов обнаруживается вещество АВК. Является ли вещество К катализатором?
А. Да
В. Нет
Задание 2. В эксперименте установили, что окисление SО2 в SО3 с участием катализатора NО происходит в 100 раз быстрее, чем не катализируемая реакция. Укажите причину изменения скорости реакции:
А. Понижение свободной энергии реакции
В. Понижение энергии активации реакции присутствии катализатора
С. Повышение энергии активации реакции в присутствии катализатора
D. Изменение степени ионизации реагирующих веществ
Е. Изменение кинетической энергии исходных и конечных продуктов
Задание 3.При интенсивной мышечной работе в скелетной мускулатуре накапливается молочная кислота, по следующей реакции:
СН3- С -СООН ↔ СН3-СН-СООН
|| |
О ОН
К какому типу относится приведенная реакция?
А. Окислительно-восстановительная реакция
В. Реакция гидролиза
С. Реакция обмена
D. Реакция электролиза
Е. Реакция синтеза
Задание 4. Вещество А и В взаимодействует по схеме А + В « АВ. При заданной концентрации А и В через 30 минут устанавливается подвижное равновесие, т.е. скорость пямой и обратной реакции уравниваются. Какую из приведенных характеристик реакции изменит внесение катализатора?
А. Скорость прямой реакции
В. Константу равновесия
С. Скорость обратной реакции
D. Время наступления равновесия
Е. Концентрацию продуктов реакции
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению заданий для самопроверки и самоконтроля исходного уровня
2. – В, 4. – D.
Информацию для восполнения исходных знаний можно найти в следующей литературе:
1.Тюкавкина Н.А.,Бауков Ю.И. Биоорганическая химия. –М.: Медицина, 1991. – С.88 -
95.
2.Лекции по биоорганической химии.
Содержание обучения
Содержание обучения должно обеспечивать достижение целей обучения, чему способствует граф логической структуры изучаемой темы (Приложение 1).
Основные теоретические вопросы, позволяющие выполнить целевые виды деятельности:
1.Основные положения теории ферментативного катализа.
2.Активаторы и ингибиторы ферментов и их использование в качестве лекарственных препараторов.
3.Регуляция активности ферментов. Примеры аллостерических ингибиторов и активаторов.
4.Классификация ферментов.
