Клиническое обоснование и оптимизация системы медицинских мероприятий в ранние сроки после радиационных аварий 14. 00. 05 внутренние болезни
| Вид материала | Автореферат диссертации |
- Клиническое и прогностическое значение субъективно неманифестированных форм гипертонической, 1477.2kb.
- Вопрос радиационно-опасные объекты. Аварии с выбросом радиоактивных веществ. Ионизирующее, 129.34kb.
- Федеральная целевая программа "Преодоление последствий радиационных аварий на период, 1444.55kb.
- Обоснование механизмов действия гирудорефлексотерапии в комплексном лечении бронхиальной, 390.9kb.
- Федеральная целевая программа "преодоление последствий радиационных аварий на период, 1187.9kb.
- Экспериментально клиническое обоснование комплексной терапии больных частичной атрофией, 673.15kb.
- Расписание лекций по дисциплине «внутренние болезни», 62.03kb.
- Стратегия диагностики и лечения ишемической болезни сердца в торако-абдоминальной онкохирургии, 788.25kb.
- Оптимизация системного подхода в реабилитации больных сахарным диабетом с высокой коморбидностью, 922.15kb.
- Методы оценки и клиническое значение биомеханических свойств роговицы (клинико-экспериментальное, 429.56kb.
2. Оценка надежности различных организационных подходов к проведению медицинской сортировки лиц, подвергшихся острому облучению, на догоспитальном этапе
Проанализировано шесть организационных подходов к проведению медицинской сортировки лиц, подвергшихся острому облучению, предложенных в различных публикациях. Среди них три подхода предполагали выделение по три лечебно-эвакуаторные группы пострадавших от облучения, и еще три метода – по четыре группы. Поскольку в ходе исследования были получены данные о том, что среди ранних симптомов ОЛБ показатель времени начала рвоты, отсчитанного от момента начала острого облучения, обладает наилучшей надежностью для прогнозирования степени тяжести КМС вне зависимости от особенностей пространственно-временного формирования дозы, именно он был использован для формирования из первых трех основных групп пациентов тех лечебно-эвакуаторных групп, выделение которых предложено авторами. Результаты проведенного анализа представлены в табл. 3.
Таблица 3.
Сравнительная оценка надежности методов медицинской сортировки
пострадавших от общего острого облучения, предложенных в различных
публикациях
-
Публикации
Лечебно-эвакуаторные группы
Рекомендуется использование при видах аварийного облучения
Надежность, %
Доклад № 29 НКРЗ США, 1962
КМС 0-1
КМС 2-3
КМС 4
Все виды
81 – 91 %
А.К. Гуськова и др., 1984
КМС 0
КМС 1-2
КМС 3-4
Все виды
70 - 80 %
Г.М. Аветисов и др., 1997;
В.А. Легеза,
А.Н. Гребенюк,
И.Б. Ушаков, 2004
КМС 0
КМС 1-3
КМС 4
Все виды
78 – 83 %
А.К. Гуськова и др., 1992
КМС 0-1
КМС 2
КМС 3
КМС 4
Импульсное
71 – 80 %
Г.М. Аветисов и др., 1999
КМС 0
КМС 1
КМС 2
КМС 3-4
Относительно равномерное импульсное
72 %
А.И. Воробьев и др., 1971;
А.В. Барабанова и др., 1978;
А.К. Гуськова и др., 1989
КМС 0
КМС 1
КМС 2-3
КМС 4
Относительно равномерное
73 - 77
Оценка надежности различных методов медицинской сортировки позволила выделить среди них более универсальные методы, дающие удовлетворительные результаты медицинской сортировки больных (более 70 %) вне зависимости от типа аварийного облучения. Уровень надежности остальных методов оказался удовлетворительным лишь после воздействия определенных вариантов пространственно-временного формирования доз аварийного облучения. Среди сортировочных подходов, предполагающих выделение трех лечебно-эвакуаторных групп, наилучшие показатели надежности отмечены у метода, предложенного в Докладе № 29 НКРЗ США, 1962. Среди сортировочных подходов, предполагающих выделение четырех лечебно-эвакуаторных групп, наилучшую надежность показал метод, предложенный А.К Гуськовой и соавт., 1992. Выделение трех лечебно-эвакуаторных групп демонстрировало в среднем более высокие показатели надежности медицинской сортировки по сравнению с подходами, предполагающими выделение четырех лечебно-эвакуаторных групп пострадавших. Меньший уровень надежности показали те методы медицинской сортировки, которые предлагали проводить раннее разделение больных ОЛБ легкой степени и лиц, подвергшихся облучению в дозах, не вызывающих развития ОЛБ. Можно полагать, что это обусловлено влиянием модифицирующих факторов на время развитие ранней рвоты, которое более выражено при ОЛБ легкой степени тяжести.
Таким образом, с целью повышения надежности первичной медицинской сортировки пострадавших при радиационной аварии целесообразно больных ОЛБ 4 степени тяжести выделять в самостоятельную лечебно-эвакуаторную группу с надежностью более 90 %, а больных ОЛБ 2 и 3 степени тяжести целесообразно временно объединить в одну лечебно-эвакуаторную группу (надежность 77 %), остальных лиц, у которых прогнозируется КМС 1 или отсутствие ОЛБ, отнести к третьей эвакуаторной группе. Если на этом этапе попытаться дифференцировать больных ОЛБ средней и тяжелой степени, то средний уровень надежности формирования этих групп снизится до 54 %.
3. Оптимизация объема и сроков проведения клинико-инструментальных исследований для вторичной медицинской сортировки пострадавших от преимущественно внешнего острого аварийного облучения
Вторичная медицинская сортировка пострадавших при радиационной аварии производится с целью подразделения лиц, подвергшихся аварийному облучению, на группы в соответствии с прогнозируемой степенью тяжести КМС ОЛБ на основании абсолютного количества лимфоцитов в клеточном составе периферической крови (Баранов А.Е., 2007; Кончаловкий М.В., Баранов А.Е., 1991; Селидовкин Г.Д., 1996).
В соответствии с задачами настоящего исследования было решено определить необходимое количество анализов клеточного состава крови и оптимальные сроки ее взятия у пациентов после острого общего облучения с целью наиболее раннего и надежного прогнозирования степени тяжести КМС. Проведен анализ количества лимфоцитов периферической крови, взятой в течение первых 24 часов после острого общего облучения у 48 пациентов, в течение 24-48 часов – у 92 человек, относящихся к первой и второй основным группам настоящего исследования. В течение 2, 3 и 4 дня болезни выполнено исследование лейкоцитарной формулы крови у 108 лиц из числа пациентов третьей основной группы, затем подсчитан среднее число лимфоцитов в трех анализах. Сравнительная оценка надежности использования числа лимфоцитов в анализах крови, взятой у пациентов в указанные сроки после острого общего облучения, отражена на рис. 5. Очевидно, что наименее надежные результаты прогнозирования степени тяжести КМС ОЛБ по уровню лимфоцитов крови отмечаются в течение первых суток после острого общего облучения (День 0), при этом, средний уровень надежности составил всего 27 %. Надежность прогноза КМС по лимфоцитам на следующий день после облучения (День +1) была чуть выше и составила в среднем 31 %.
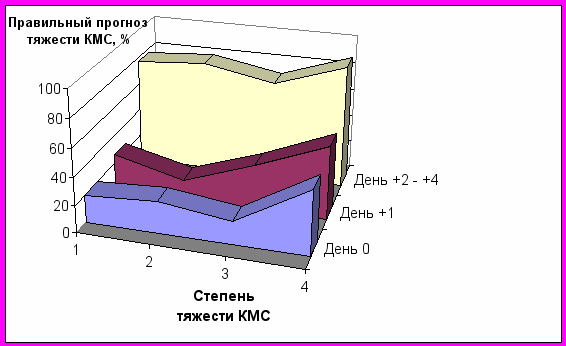
Рис. 5. Оценка надежности сортировки больных ОЛБ по степени тяжести КМС по числу лимфоцитов в анализах периферической крови, взятой у пациентов в различные сроки после острого общего облучения
В обоих случаях надежность прогноза была значительно лучше для КМС крайне тяжелой степени, однако, в целом, ее уровень следует считать неудовлетворительным. Весьма надежным для прогнозирования всех степеней тяжести КМС ОЛБ оказался методический подход с использованием среднего числа лимфоцитов по трем последовательным анализам крови, взятой с Дня +2 по День+4 болезни. При этом надежность прогноза степени тяжести КМС составила в среднем 80 %.
При проведении медицинской сортировки пострадавших от сочетанного аварийного облучения практически важным является раннее выделение больных, у которых по окончании латентного периода сформируется ОМЛП кожи, которое в тяжелых случаях может стать причиной гибели больного. Показана возможность прогнозирования крайне тяжелого течения ОМЛП при появлении первичной эритемы (Барабанова А.В., 1987; Надежина Н.М., Гуськова А.К., Галстян И.А., Гусев И.А., 2000). Поскольку надежных методов раннего прогнозирования развития менее тяжелых ОМЛП не существует, была предпринята попытка разработки нового радиометрического подхода. В качестве сортировочной метки была изучена активность радиоактивного йода в щитовидной железе лиц, подвергшихся сочетанному облучению смесью короткоживущих продуктов ядерного деления. Из третьей основной группы были отобраны 65 человек, на которых имелись данные по поступлению радиоактивного йода в щитовидную железу в первый день аварии на ЧАЭС, среди них были 60 больных ОЛБ с КМС различной степени тяжести. В данной подгруппе проанализирована частота встречаемости ОМЛП кожи в зависимости от величины активности йода в щитовидной железе через сутки после аварии на реакторе. Результаты анализа представлены в табл. 4. Из рассматриваемой таблицы следует, что у больных, в щитовидную железу которых поступил радиоактивный йод в количествах менее 185 кБк, ОМЛП не возникли.
Таблица 4.
Частота встречаемости ОМЛП у больных, имеющих различные уровни активности 131I, поступившей в щитовидную железу в течение первого дня
аварии на ЧАЭС
| Уровень активности 131I, поступившей в щитовидную железу, кБк | Число лиц | Число больных, имевших ОМЛП | Частота встречаемости ОМЛП, % |
| менее 185 | 17 | 0 | 0 |
| 185 - 740 | 31 | 18 | 56 |
| более 740 | 17 | 15 | 88 |
| ИТОГО: | 65 | 33 | 51 |
При поступлении в щитовидную железу активности в пределах 185 – 740 кБк ОМЛП кожи сформировались после завершения латентного периода у 56 % больных. У 88 % больных, в щитовидную железу которых поступило в день аварии более 740 кБк йода, в дальнейшем сформировались ОМЛП различной степени тяжести, площади и локализации. Установить зависимости между активностью йода в щитовидной железе и степенью тяжести ОМЛП или его площадью на проанализированном материале не удалось. С целью подтверждения выявленной нами закономерности были проанализированы опубликованные американскими исследователями клинико-радиометрические данные о сочетанном остром облучении людей на Маршалловых островах вследствие непосредственного контакта с короткоживущими продуктами ядерного деления, образовавшимися в результате наземного ядерного взрыва в 1954 г. (Кронкайт Е.П., Бонд В.П. и Данхем Ч. Л., 1960). Результаты анализа опубликованных данных представлены в табл. 5.
Таблица 5.
Частота встречаемости ОМЛП у лиц с различными уровнями активности 131I, поступившей в щитовидную железу в результате выпадения радиоактивных осадков после ядерного испытания на Маршалловых островах
| Контингент | Косвенная оценка среднего содержания 131I в щитовидной железе в первые сутки по данным Лос-Аламосской лаборатории, кБк | Частота встречаемости ОМЛП, % |
| Туземцы атолла Ронгелеп | 414,4 | 20 |
| Туземцы атолла Эйлингин | 203,5 | 5 |
| Американцы | 98,0 | 0 |
При сопоставлении данных, представленных в табл. 4 и табл. 5, видно, что в обоих случаях острого сочетанного облучения, вызванного короткоживущими продуктами ядерного деления, ОМЛП кожи возникли только у тех больных, у которых содержание йода в щитовидной железе через сутки после поступления превышало уровень 185 - 200 кБк. С увеличением активности, содержащейся в щитовидной железе, возрастал риск развития ОМЛП кожи, который достигал 88 % у больных, в щитовидной железе которых содержалась активность йода свыше 740 кБк.
Таким образом, данные о встречаемости ОМЛП кожи у людей, подвергшихся воздействию ионизирующего излучения, обусловленного короткоживущими продуктами ядерного деления, опубликованные американскими исследователями на основании клинико-радиометрического обследования лиц, пострадавших на Маршалловых островах в 1954 г., и результаты исследований, полученные нами на группе больных, пострадавших в результате аварии на ЧАЭС, позволяют предложить радиометрический критерий для раннего выделения группы больных с возможным развитием ОМЛП. Таким критерием является содержание радиоактивного йода в щитовидной железе человека свыше 185 кБк через сутки после его поступления в организм после крупномасштабной аварии на ядерном реакторе. Можно предполагать, что данный радиометрический критерий не является универсальным, поскольку его надежность может быть ограничена не только типом радиационной аварии и рядом других особенностей сочетанного аварийного облучения.
4. Клинико-физиологическое обоснование необходимости лечебно-охранительного режима и симптоматической терапии в периоде
формирования острого лучевого поражения
Физиологическая оценка адаптационных резервов сердечно-сосудистой системы после относительно равномерного острого облучения была проведена у больных четвертой основной группы. Велоэргометрическая оценка физической работоспособности и активная ортостатическая проба проводились у больных до и через сутки и через неделю после ТТО в дозе 3 Гр. В табл. 6 сопоставлены клиническая выраженность первичной реакции у отдельных больных со степенью снижения уровня физической работоспособности и степенью ухудшения реакции на переход в ортостаз через сутки после острого облучения. Клиническая выраженность первичной реакции после облучения была индивидуальна и по клиническому течению оценивалась от 0 до 3 степени тяжести. У первых двух больных, представленных в рассматриваемой таблице, рвота в периоде первичной реакции не возникла в связи с введением им антиэметиков. Полученные результаты клинико-физиологического анализа свидетельствуют о том, что чем тяжелее протекала первичная реакции после
Таблица 6.
Клиническая выраженность первичной реакции, изменения уровня физической работоспособности и реакции на переход в ортостаз в конце первых суток после ТТО в дозе 3 Гр по сравнению с исходными уровнями
| Ф.И.О. больного | Степень тяжести первичной реакции | Снижения уровня МПК, % | Учащение ЧСС при переходе в ортостаз, % |
| Г.Н.М. | 0 | 0 | 0 |
| Н.Г.Я. | 0 | 0 | 0 |
| К.И.В. | 2 | 18 | 16 |
| П.А.Ф. | 2 | 17 | 15 |
| Т.С.Н. | 2 | 13 | 15 |
| Б.А.В. | 2 | 10 | 10 |
| Л.Т.И. | 3 | 20 | 18 |
| Л.А.В. | 3 | 32 | 28 |
облучения, тем изначительнее снизились резервы адаптации сердечно-сосудистой системы больных к физической нагрузке и перемене положения тела в пространстве. В конце первой недели после ТТО изучаемые физиологические показатели возвращались к исходному уровню.
Физиологическая оценка адаптации к физической нагрузке после крайне неравномерного острого аварийного облучения была проведена у больных пятой основной группы в динамике развития ОМЛП. Динамика уровня физической работоспособности отражена на рис. 6. Средний уровень физической работоспособности в контрольной группе по тесту МПК составил 3,1 л/мин. У пяти больных с ОМЛП рук, обследованных в латентном периоде, средний уровень МПК составил 3,4 л/мин. В фазе клинического разгара ОМЛП у больных пятой основной группы уровень МПК достоверно снизился в среднем до 2,78 л/мин и оставался примерно на этом же уровне в фазе начального восстановления.
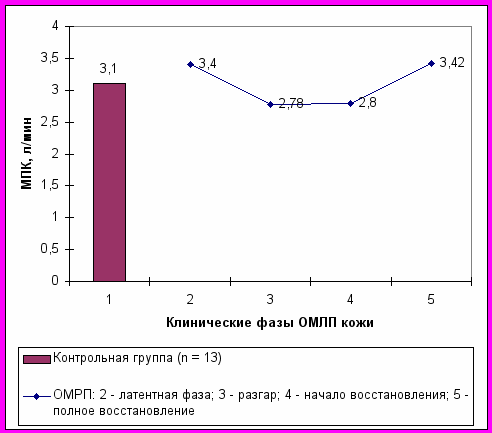
Рис. 6. Динамика среднего уровня физической работоспособности
больных с ОМЛП рук в динамике его клинического развития
После завершения эпителизации и рубцевания в области ОМЛП показатель МПК у больных данной группы возвращался к среднему уровню, отмеченному в латентной фазе. Следовательно, несмотря на небольшую площадь лучевого поражения рук (менее 1 % поверхности тела), отмечались изменения уровня физической работоспособности, связанные с динамикой клинических проявлений ОМЛП. Достоверных признаков снижения адаптации к перемене положения тела в пространстве у больных пятой основной группы не выявлено.
Таким образом, результаты клинико-физиологических исследований динамики показателей адаптации к физической нагрузке и перемене положения до и после возникновения клинических проявлений ОЛП, вызванного относительно равномерным или крайне неравномерным облучением, позволяют заключить, что первичная реакция на общее облучение и клинический разгар ОМЛП вызывают снижение уровня физической работоспособности больного в периоде формирования ОЛП. Кроме того, после общего облучения в периоде первичной реакции снижается адаптация человека к перемене положения тела в пространстве. При ОМЛП рук площадью до 1 % поверхности тела адаптация к перемене положения тела существенно не изменяется. С учетом полученных данных можно считать физиологически обоснованным использование средств симптоматической терапии в периоде первичной реакции ОЛБ в сочетании с лечебно-охранительным режимом. В фазе разгара ОМЛП целесообразно назначение лечебно-охранительного режима.
5. Обоснование критериев для проведения экстренной терапии пострадавших при радиационных авариях
Обоснование клинических критериев для начала
экстренной цитокиновой терапии
В экспериментах на животных показана целесообразность экстренного начала патогенетического лечения КМС ОЛБ отечественным цитокиновым препаратом «Беталейкин», содержащим интерлейкин-1β (Кетлинский С.А., Симбирцев А.С., 1992; Рождественский Л.М. и др., 2008; Баранов А.Е., Рождественский Л.М., 2008). В настоящее время это единственный из цитокиновых препаратов, в инструкции по применению которого указана возможность его подкожного введения в первые 2 часа после острого общего облучения в дозах свыше 1 Гр. Поскольку возможности для клинического применения данного препарата в нашей стране созданы, целесообразно разработать клинические критерии для его экстренного применения у лиц, подвергшихся острому аварийному облучению.
В связи с тем, что наиболее ранние проявления ОЛБ связаны с возникновением диспепсических расстройств (тошнота, рвота и диарея), именно они были проанализированы с целью изучения возможности их использования в указанном качестве после острого аварийного облучения с различным пространственно-временным распределением доз. В исследовании использованы клинические данные о наиболее ранних проявлениях ОЛБ у больных, входящих в состав первых трех основных групп. Данные о частоте возникновения рвоты, начавшейся в первые 2 часа от начала острого общего облучения у больных с КМС различной степени тяжести с учетом пространственно-временного формирования дозы, представлены в табл. 7.
Таблица 7.
Относительное количество пациентов с КМС различной тяжести с рвотой,
начавшейся в первые 2 часа после начала облучения, с учетом
пространственно-временного формирования дозы
| Степень тяжести КМС | Относительное количество больных с начавшейся рвотой после облучения с различным пространственно-временным формированием дозы, % | ||
| Острое равномерное n = 42 | Пролонгирование острого n = 46 | Неравномерное острое n = 76 | |
| 0 | 0 | 0 | 0 |
| 1 | 5 | 0 | 30 |
| 2 | 85 | 35 | 80 |
| 3 | 100 | 55 | 100 |
| 4 | 100 | 90 | 100 |
Из нее видно, что если в качестве клинического критерия для начала экстренной цитокиновой терапии ОЛБ взять начало рвоты, то среди больных первой основной группы (острое равномерное облучение) лечение начнется своевременно у 100 % больных с КМС 3 и 4 степени тяжести, у 85 % больных с КМС средней степени тяжести и 5 % больных ОЛБ легкой степени. Среди больных второй основной группы (общее неравномерное острое облучение) лечение начнется своевременно у 100 % больных с КМС 3 и 4 степени тяжести, у 80 % больных с КМС средней степени тяжести и 30 % больных ОЛБ легкой степени. Экстренному лечению не подвергнутся лица без ОЛБ (КМС 0) первой и третьей основных групп, которым оно не показано. Поскольку, менее мощное острое облучение, которое было характерно для аварии на ЧАЭС (третья основная группа), обуславливает более позднее начало рвоты в периоде первичной реакции ОЛБ, при анализе клинических данных этой группы выяснилось, что лечение начнется своевременно у 90 % больных с КМС 4 степени тяжести, у 55 % больных с КМС 3 степени, у 35 % больных с КМС средней степени тяжести и будет отсутствовать больных ОЛБ легкой степени и у лиц без развития ОЛБ. Использование рвоты, как клинического критерия для начала экстренной цитокиновой терапии пострадавших при крупномасштабной радиационной аварии на ядерном реакторе, приведет к тому, что экстренная патогенетическая терапия у более половины тяжело пораженных (ОЛБ 3-4 степени тяжести) своевременно не начнется, а, следовательно, будет менее эффективной. Это обстоятельство побудило нас рассмотреть в качестве клинических критериев начала экстренной цитокиновой терапии КМС ОЛБ два других ранних симптома ОЛБ – тошноту и диарею. Для исследования из третьей основной группы была сформирована подгруппа лиц в количестве 22 человек, мощность острого облучения которых была менее 3 Гр/ч. Результаты анализа представлены в таблице 8.
Таблица 8.
Относительное количество пациентов с КМС различной тяжести, имевших диспепсические расстройства, начавшиеся в первые 2 часа
от начала острого облучения на ЧАЭС (n = 22)
| Степень тяжести КМС | Тошнота | Рвота | Диарея |
| 0 | 0 | 0 | 0 |
| 1 | 50 | 0 | 0 |
| 2 | 67 | 33 | 0 |
| 3 | 100 | 100 | 0 |
| 4 | 100 | 33 | 35 |
Они свидетельствуют о том, что среди изученных ранних симптомов ОЛБ в качестве клинического критерия начала экстренной цитокиновой терапии после острого пролонгированного относительно равномерного облучения наиболее подходит возникновение тошноты. В этом случае все больные ОЛБ с КМС 3 и 4 степени тяжести, а также 67 % больных ОЛБ средней степени тяжести и 50 % больных ОЛБ легкой степени своевременно получат экстренную цитокиновую терапию. Использование в качестве критерия для начала лечения ОЛБ возникновение ранней рвоты или диареи приведет к тому, что значительная часть тяжело пораженных больных своевременно не получат экстренной патогенетической терапии. Таким образом, в качестве клинического критерия для экстренной цитокиновой терапии ОЛБ интерлейкином-1β в первые два часа после общего облучения с мощностью дозы более 3 Гр/ч следует принять возникновение рвоты в периоде первичной реакции, а при меньших мощностях дозы острого облучения - возникновение тошноты.
Обоснование клинического критерия для повторного приема препаратов
стабильного йода больными ОЛБ, пострадавшими
при аварии на ядерном реакторе
На рис. 7 схематично представлены результаты дискриминантного полифакторного анализа клинико-дозиметрических данных 108 пациентов третьей основной группы, подведшихся облучению в день аварии на ЧАЭС. Рисунок отражает количественную оценку взаимозависимости между изучаемыми факторами. На нем видно, что доза облучения щитовидной железы, зависящая от количества радиоактивного йода, поступившего в организм, связана с пребыванием пациента на месте аварии в течение первого часа от ее начала (0,601) и наличием или отсутствием у него ОЛБ (0,766). Выраженная взаимозависимость между пребыванием на месте аварии в течение первого часа от начала аварии и средней интенсивностью поступления радиоактивного йода в организм (0,885) свидетельствует о том, что наиболее интенсивно йод поступал в организм в течение первого часа аварии. Прием препаратов стабильного йода способствовал снижению интенсивности поступления радиоактивного йода (-0,122).
| | | Доза на щитовидную железу от радиойода | | | | ||||||||||||||
| | 0,766 | 0,486 | | 0,601 | | | |||||||||||||
| Наличие ОЛБ | 0,087 | Средняя скорость поступления радиойода в организм | 0,885 | Присутствие на ЧАЭС в течение 1-го часа после начала аварии | |||||||||||||||
| | | ||||||||||||||||||
| | | | 0,088 | -0,122 | | 0,061 | | | | ||||||||||
| | 0,591 | | | Прием препарата КI | | | | 0,209 | |||||||||||
| Кратность рвоты | 0,209 | Доза внешнего -облучения всего тела | |||||||||||||||||
Рис. 7. Степень взаимозависимости факторов, влияющих на дозу облучения щитовидной железы пострадавших в день аварии на ЧАЭС
Одной из причин невысокой эффективности приема йодистого калия могла быть многократная рвота, которая, по-видимому, препятствовала использованию средств индивидуальной защиты органов дыхания или вызывала частичную потерю принятого внутрь препарата йодистого калия с рвотными массами. Интенсивность рвоты в свою очередь определялась величиной дозы внешнего гамма-облучения, т.е. степенью тяжести ОЛБ. Раннее начало рвоты способствовало снижению уровня средней интенсивности поступления радиоактивного йода в организм больных ОЛБ (0,115), что, по-видимому, может быть объяснено тем, что после появления рвоты многие больные уходили из помещений с высокой концентрацией этого радионуклида в воздухе в более безопасные места.
Таким образом, результаты многофакторного анализа показали, что количество радиоактивного йода, поступившего в организм лиц, пострадавших в результате аварии на ЧАЭС, определялось, прежде всего, временем, пребывания в зоне аварии. Наибольшее поступление радиоактивного йода отмечалось у лиц, находившихся на промплощадке ЧАЭС в течение первого часа после ее начала. Эффективность защитного действия препаратов стабильного йода у рассматриваемой группы в целом была невысокой. Одной из причин этого являлась интенсивная рвота у больных ОЛБ в периоде первичной реакции, приводившая к частичной потере с рвотными массами препарата стабильного йода, принятого внутрь, и препятствовавшая использованию пострадавшими средств индивидуальной защиты органов дыхания. Влияние внутреннего облучения на клиническое течение первичной реакции у больных ОЛБ не отмечалось.
Представленные данные позволяют предложить в качестве клинического критерия для повторного приема внутрь препаратов стабильного йода возникновение рвоты у больных ОЛБ, пострадавших при аварии на ядерном реакторе. Очевидно, что прием внутрь препаратов стабильного йода следует осуществлять только после купирования рвоты путем экстренного парентерального введения противорвотных средств.
Обоснование дозовых критериев для экстренного этиотропного лечения после однократного аварийного поступления радиоактивных веществ
в организм человека
Дозовые критерии для проведения лечения, направленного на снижение доз внутреннего облучения, после однократного поступления радиоактивных веществ в организм человека должны соответствовать действующим нормам радиационной безопасности и учитывать имеющийся клинический опыт их применения.
Нами применение препаратов, ускоряющих выведение РВ из организма человека, исследовано у пациентов шестой основной группой, состоящей из работников СХК, в организм которых ингаляционным путем поступили трансурановые элементы 239Ри и 241Аm в количествах, многократно превышающих допустимые уровни. Для пациентов данной основной группы наличие в легких америция является индикатором присутствия в организме плутония, который труднее детектируется методами прямой радиометрии. С целью изучения особенностей выведения этих радиоактивных металлов из организма человека было предпринято внутривенное трехразовое внутривенное их введение в виде 5 % раствора цинкацина (Zn-ДТПА) в количестве 10,0 мл. Данные прямых радиометрических исследований содержания америция в организме и экскреции суммарной активности трансурановых элементов до и после введения цинкоцина отражены в табл. 8. Представленные в рассматриваемой таблице данные свидетельствуют о многократном (33 - 950 раз) увеличении уровня экскреции -излучателей из организма пациентов на фоне введения средней терапевтической дозы цинкоцина. При этом следует отметить, что кратность усиления экскреции суммарной активности плутония и америция была больше при более высоких уровнях содержания америция в легких пациента. У трех из обследованных пациентов содержание америция в легких находилось в пределах допустимого уровня (ДСА) по НРБ-76/87 (260 Бк). У них кратность усиления экскреции радионуклидов на фоне лечения цинкоцином составляла несколько десятков раз. У остальных больных, содержавших в легких америций в количествах, превышающих допустимый предел, суммарная экскреция после введения препарата ДТПА увеличилась в сотни раз.
Следовательно, выведение РВ из организма под воздействием этиотропного лечения существенно зависело от его содержания в организме. Чем больше было содержание РВ в организме человека, тем эффективнее действовал препарат, вводимой больным в одинаковой дозировке. Полученные клинико-радиометрические данные свидетельствовали о необходимости разработки критериев вмешательства для этиотропного лечения, направленного на снижение формирующихся доз внутреннего облучения, чему была посвящена следующая разработка. В НРБ-99 установлен дозовый критерий для применения препаратов стабильного йода, а именно, в качестве уровня вмешательства А установлена предотвращенная йодной профилактикой доза 25 сЗв/10 суток для взрослых и 10 сЗв/10 суток для детей. При таких дозах облучения развитие детерминированной радиационной патологии не возможно, однако возрастает риск возникновения стохастической патологии, поэтому рекомендуемое НРБ-99 профилактическое лечение направлено на снижение этого риска. Риск возникновения стохастических эффектов радиации принято оценивать величиной эффективной эквивалентной дозы, рассчитываемой умножением дозы в органе на тканевой коэффициент, для щитовидной железы он равен 0,05, а эффективная доза, соответствующая уровню вмешательства А для йодной профилактики равна 1,25 сЗв для взрослых и 0,5 сЗв для детей.
Таким образом, с точки зрения противорадиационной защиты обосновано принятие в качестве критерия вмешательства А для профилактического лечения, направленного на снижение доз внутреннего облучения, эффективную дозу равную 1,25 сЗв для взрослых и 0,5 сЗв для детей. Для подтверждения возможности применения данного дозового критерия вмешательства для этиотропной терапии после поступления внутрь РВ, способных вызывать острые или подострые эффекты облучения, он был сопоставлен с рекомендациями, опубликованными в литературе. Результат проведенного сопоставления представлен в табл. 9. Имеющиеся в ней данные свидетельствуют о близости величин эффективных доз, при которых рекомендуется вмешательство, направленное на ускорение выведения из организма радионуклидов, инкорпорация которых способна вызывать острые или подострые эффекты. Представленные в таблице данные можно рассматривать как практическое подтверждение обоснованности принятия предлагаемого дозового критерия для экстренного этиотропного лечения пострадавших при радиационной аварии, сопровождавшейся однократным поступлением в организм РВ. На основе дозового критерия вмешательства с учетом дозовых коэффициентов были рассчитаны производные радиометрические критерии для экстренного этиотропного лечения, которые соотнесены с уровнями ПГПпер, установленными НРБ-99.
Таблица 9.
Уровни вмешательства, рекомендуемые для проведения этиотропной терапии у взрослых, после однократного поступления внутрь некоторых радионуклидов и эффективная доза, формирующаяся за первые 10 суток
| Радиоизотоп | Уровень вмешательства | Авторы и источник информации | Эффективная доза, сЗв/10 суток |
| 131I | Доза на щитовидную железу 25 сЗв/10 суток | НРБ-99 | 1,25 |
| 210Po | Доза на тело 7,5 сГр за все время после инкорпорации | Пушкарева С.Г., Гуськова А.К., Гастева Г.Н. и соавт., 1985 | 1,5 |
| 137Cs | Допустимая эффективная доза 20 сЗв/год аварийного облучения | НРБ-99 | 1,2 |
| Среднее значение: | 1,31 | ||
Результаты анализа представлены в табл. 10. Из рассматриваемой таблицы следует, что для РВ, однократное поступление которых в организм может приводить к развитию острых или подострых эффектов во внутренних органах человека, критерий для этиотропного медикаментозного вмешательства (уровень А) находится в пределах от 1,04 до 10,42 ПГПпер, а уровень вмешательства Б – превышает 10,4 ПГПпер.Результаты нашего исследования согласуются с международными рекомендациями, основанными преимущественно на экспериментальных исследованиях (Guidebook for the Treatment of Accidental Internal Radionuclide Contamination, 1992), в которых указывается, что при поступлении внутрь активности менее одного ПГПпер. лечение препаратами, ускоряющими выведение РВ из организма, не эффективно и не целесообразно. При поступлении внутрь активности свыше уровня вмешательства А, который соответствует поступлению внутрь 1–10 ПГПпер., показано применение наиболее эффективных методов этиотропной терапии у отдельных пациентов. При инкорпорации РВ более 10 ПГПпер., обосновано комплексное лечебно-профилактическое вмешательство у всех пациентов (уровень вмешательства Б).
Таблица 10.
Ориентировочная оценка активности наиболее практически важных радионуклидов, при остром однократном поступлении которых в организм человека формируются дозы, соответствующие уровням вмешательства А и Б
| Радио-нуклид | Часть дозы, формирующаяся за первые 10 дней, % | Поступившая активность, ПГПпер | |
| эффективная доза 1,25 сЗв/10 суток (уровень вмешательства А) | эффективная доза 12,5 сЗв/10 суток (уровень вмешательства Б) | ||
| 131I | 60 | 1,04 | 10,4 |
| 210Po | 20 | 3,13 | 31,3 |
| 137Cs | 6 | 10,42 | 104,2 |
Подводя итоги проведенного комплекса исследований, мы систематизировали экстренные сортировочные и лечебно-профилактические мероприятия, которые осуществляются при наличии определенного критерия вмешательства (рис. 8).
Рис. 8. Система экстренных сортировочных и лечебно-профилактических мероприятий для пострадавших от аварийного облучения
в дозово-временных координатах
В осях координат мощность дозы облучения и время от его начала определено место первичной медицинской сортировки и современных методов экстренной терапии различной направленности у лиц, пострадавших при радиационных авариях. В зоне выше кривой линии, очерчивающей зону возникновения рвоты в периоде первичной реакции ОЛБ возможно только парентеральное введение препаратов. Клинические критерии используются для начала экстренной патогенетической терапии КМС ОЛБ после внешнего облучения препаратом интерлейкина-1β с целью ускорения восстановления кроветворения и симптоматической терапии антиэметиком из группы селективных блокаторов серотонинэргических рецепторов, когда практически важно поддержание уровня адаптации больного к физической нагрузке и перемене положения тела.
Для экстренной этиотропной терапии после аварийного поступления внутрь РВ используются ситуационные и дозовые критерии вмешательства А и Б, поскольку клинические проявления лучевого поражения при этом отсутствуют. В случаях сочетанного облучения экстренная терапия преимущественно направлена на патогенетическое лечение КМС, а этиотропная терапия осуществляется в соответствии с дозовым критерием вмешательства Б с учетом соотношения доз внешнего и внутреннего облучения. На рис. 9 нами представлена система критериев для принятия решений при проведении медицинских сортировочных и лечебно-профилактических мероприятий в ранние сроки после радиационных аварий. В центре системы лежат дозовые критерии, которые основаны на пределах и порогах доз облучения, установленных на основе изучения радиобиологических закономерностей возникновения радиационных эффектов в организме человека. Поскольку оценка доз аварийного облучения является наиболее трудоемкой задачей, решение которой требует времени, то в ранние сроки после радиационных аварий, в условиях дефицита времени оправдано использование производных критериев.
