Механизмы возникновения боли
| Вид материала | Реферат |
СодержаниеБолевой синдром в спине |
- Пути проведения боли и ее механизмы, 2596.89kb.
- Современные подходы к фармакотерапии послеоперационной боли с применением синтетических, 227.9kb.
- Современные подходы к фармакотерапии послеоперационной боли с применением синтетических, 227.18kb.
- Перечень контрольных заданий для студентов 4-го курса по разделам: кардиология, пульмонология,, 1837.67kb.
- Дар трёх солнц, 419.51kb.
- Закономерности возникновения жизни в космосе, 2791.79kb.
- Курсовая работа по физиологии Нейрофизиологические механизмы эмоций, 222.29kb.
- Принципы интегративной диагностики и лечения боли, 43.75kb.
- Этиология, механизмы возникновения и фармакотерапия пациентов с фибрилляцией предсердий, 195.05kb.
- Образование: неполное среднее, 148.4kb.
Рациональная полифармакотерапия
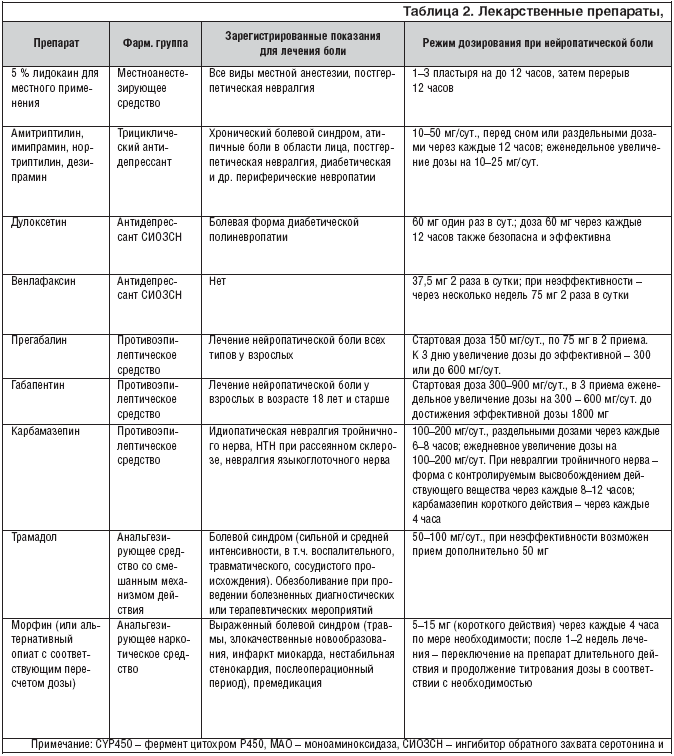
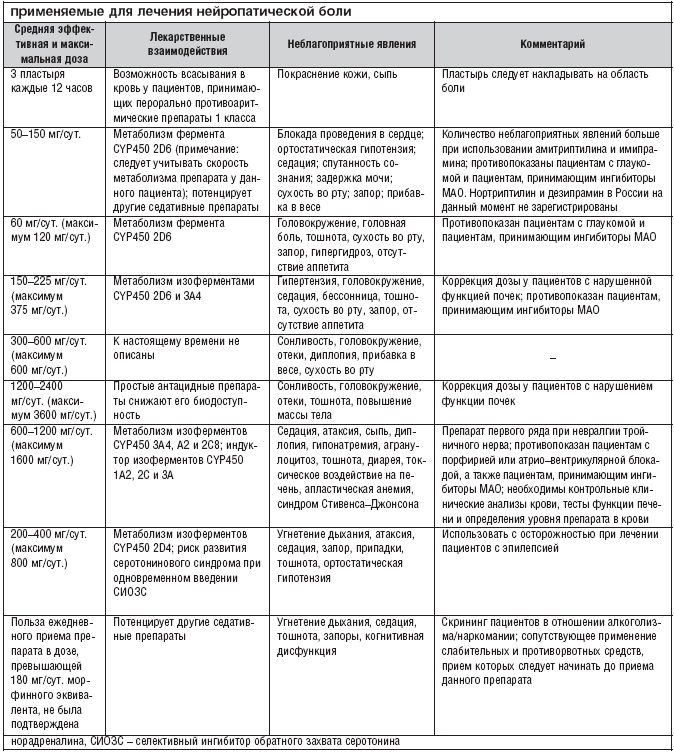
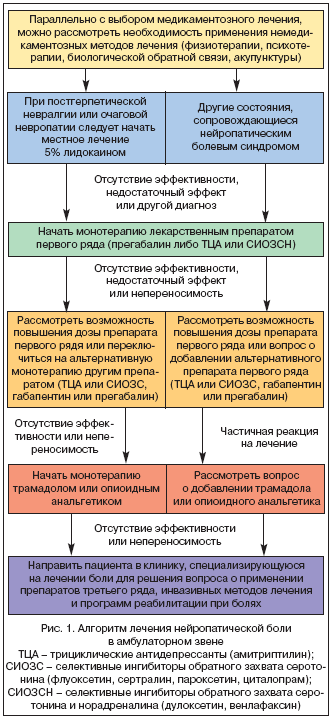
Фармакотерапия при лечении нейропатической боли является основным методом лечения. Однако если на фоне монотерапии препаратами первого ряда не удается полностью купировать болевой синдром, то назначение комбинированной фармакотерапии позволяет повысить эффективность лечения при меньших дозировках препаратов и снизить риск развития побочных явлений. Этот принцип получил название рациональной полифармакотерапии. Многие пациенты с нейропатической болью вынуждены принимать одновременно несколько лекарственных препаратов, несмотря на отсутствие доказательных исследований, подтверждающих пользу таких сочетаний. В последнее время в литературе стали появляться сведения об эффективности различных комбинаций уже известных лекарств. В одном рандомизированном плацебо–контролируемом исследовании, было показано, что сочетание морфина и габапентина превосходит каждый из этих препаратов в отдельности по силе анальгетического эффекта. В другой работе, где участвовали 11 пациентов с нейропатической болью, рефрактерных к габапентину, было продемонстрировано превосходство сочетания габапентина и венлафаксина над монотерапией габапентином. Сегодня очевидна необходимость проведения дальнейших исследований с целью выявления оптимально эффективных сочетаний лекарственных препаратов, подбора доз и наиболее безопасных комбинаций, а также для оценки фармакоэкономических аспектов терапии.
Некоторые аспекты фармакотерапии
Перед назначением любого нового препарата по поводу лечения нейропатической боли необходим тщательный анализ препаратов, уже принимаемых пациентом, с целью исключения лекарственного взаимодействия. В случае полифармакотерапии необходимо отдавать предпочтение препаратам, не имеющим известных лекарственных взаимодействий (например, прегабалину).
В настоящее время описана потенциальная возможность взаимодействия опиоидных анальгетиков и трициклических антидепрессантов, вызывающих серьезные нежелательные явления при передозировке. В случае применения такой комбинации необходимо тщательно взвешивать пользу и риск данного назначения. Нельзя одновременно назначать препараты СИОЗС (например, флуоксетин или пароксетин) и СИОЗСН (например, дулоксетин), поскольку они метаболизируются при участии цитохрома P450, что повышает риск побочных реакций.
Большинство трициклических антидепрессантов, противосудорожных препаратов и опиоидных анальгетиков обладает угнетающим действием на центральную нервную систему. С целью уменьшения выраженности этих и других побочных эффектов в процессе достижения эффективной дозы необходимо использовать постепенное титрование, начиная с минимальной (например,1/4 таблетки амитриптилина, содержащей 25 мг) до максимальной переносимой дозы на протяжении нескольких недель. В этом случае врач и пациент должны осознавать, что облегчение боли будет постепенным. Поскольку трициклические антидепрессанты и карбамазепин у некоторых пациентов быстро метаболизируются, требуется мониторинг уровня препарата в плазме крови, прежде чем безопасно осуществлять дальнейшее повышение дозы в случае отсутствия обезболивающего эффекта на минимальной дозе.
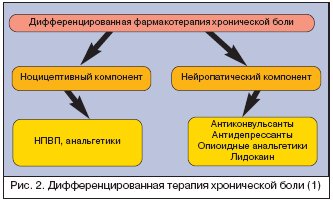
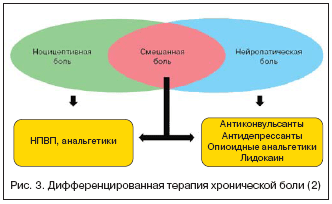
Дифференцированная терапия болевых синдромов
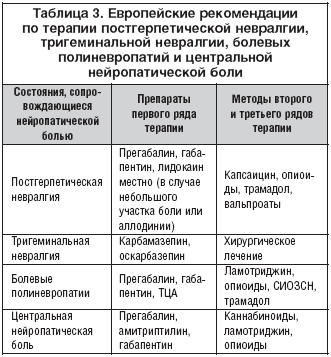
Анализ болевого синдрома с точки зрения его патофизиологических механизмов (ноцицептивная, нейропатическая, смешанная) оказался очень важным прежде всего с точки зрения лечения. Если врач оценивает боль как ноцицептивную, то наилучшими средствами для ее лечения будут простые анальгетики и НПВП. Если боль является нейропатической или имеется нейропатический компонент, то препаратами выбора являются антиконвульсанты (прегабалин), антидепрессанты, опиоидные анальгетики и лидокаин. В случае смешанных болевых синдромов, возможна комбинированная терапия с выбором средств в зависимости от представленности ноцицептивного и нейропатического компонентов.
Таким образом, лечение нейропатической боли в настоящее время остается сложной задачей. Представленные выше принципы и алгоритмы лечения могут помочь врачу проводить наиболее эффективное и безопасное лечение пациентов с нейропатическим болевым синдромом. В будущем успех и перспективы лечения связывают с разработкой препаратов, воздействующих на конкретные патофизиологические механизмы данного синдрома.

БОЛЕВОЙ СИНДРОМ В СПИНЕ
Боль в спине (БС) — это болевой синдром в спине (в международной литературе — дорсалгия), развившийся вследствие дистрофических, воспалительных и функциональных изменений в тканях позвоночно-двигательных сегментов и смежных структур: в дугоотростчатых суставах позвонков, межпозвонковом диске, фасциях, мышцах, сухожилиях и связках. Наиболее часто развивается вследствие поражения нижних шейных позвонков с последующим поражением лучевого нерва или пояснично-крестцового отдела позвоночника с развитием синдрома боли в нижней части спины (low back pain).
Основной причиной первичной БС является спондилоартроз, для которого характерна двусторонняя, паравертебральная боль — артралгия, усиливающаяся при длительном стоянии и разгибании, уменьшающаяся при ходьбе и в положении сидя. По основному механизму развития боль при спондилоартрозе преимущественно ноцицептивная. В не-осложненных случаях поражение пояснично-крестцового отдела позвоночника приводит к развитию хорошо очерченного симптомокомплекса, позволяющего поставить диагноз спондилоартроза уже на догоспитальном этапе. Именно спондилоартроз — самая частая причина доброкачественных болей в пояснице улиц пожилого возраста.
Признаки неосложненной механической боли в нижней части спины:
— боль зависит от физической активности (уменьшается после отдыха);
— внезапный приступ, провоцируемый подъемом тяжестей или поворотом;
— рецидив эпизодов;
— возраст 20—55 лет;
— боль локализуется в спине в верхней части бедра;
— отсутствие изолированного повреждения нервного корешка;
— нормальное общее состояние;
— хороший прогноз (в 90% случаев — выздоровление в течение 6 недель).
Миофасциальный синдром как причину первичной БС диагностируют в случае хронической локальной или региональной, ограничивающей движение мышечной боли, при наличии триггерных точек, локальном напряжении мышц, отсутствии двигательных и чувствительных нарушений. Нейропатическая боль возникает вследствие предшествующего или сопутствующего повреждения центральной нервной системы. Она может развиваться и сохраняться при отсутствии явного периферического болевого раздражителя, часто плохо локализована и сопровождается различными нарушениями поверхностной чувствительности. По сравнению с ноцицептивной нейропатическая боль существенно менее восприимчива к действию опиоидных анальгетиков. Острую первичную скелетно-мышечную БС необходимо дифференцировать с вторичной БС, развивающейся на фоне врожденных аномалий или травм позвоночника, опухолевого процесса, остеопороза, инфекционных заболеваний и патологии внутренних органов.
Дифференциальный диагноз боли в спине:
- инфекционные заболевания (туберкулезный или неспецифический спондилит, эпидуральный абцесс);
- воспалительные заболевания (серо негативные спондилоартропатии, ревматическая полимиалгия);
- метаболические заболевания (остеопороз, гиперпаратиреоз, болезнь Педжета);
- неопластические заболевания (первичные и метастатические опухоли позвоночника, множественная миелома);
- соматические заболевания (аневризма или тромбоз аорты, заболевания поджелудочной железы, мочеполовой системы, желудочно-кишечного тракта, патология забрюшного пространства, гинекологические заболевания).
Таким образом, пациента с острой болью в спине, независимо от причины и уверенности в диагнозе необходимо срочно госпитализировать.
Почечная колика
При почечной колике острая боль является результатом острого нарушения оттока мочи из почки, что приводит к развитию чашечно-лоханочной гипертензии, рефлекторному спазму артериальных почечных сосудов, венозному стазу и отеку паренхимы, ее гипоксии и перерастяжению фиброзной капсулы. Причиной острой боли у пациентов, страдающих мочекаменной болезнью, нередко становится уретеролитиаз или мочеточниковая колика. Окклюзия мочеточника может развиться также при стриктурах, перегибах и перекрутах мочеточника, при обтурации его просвета сгустком крови, слизи или гноя, казеозными массами при туберкулезе почки, отторгнувшимся некротизированным сосочком. Почечная колика протекает с интенсивными коликообразными, периодическими болями, сопровождающимися тошнотой и рвотой. Боли часто иррадиируют по ходу мочеточника в паховую область и половые органы, сопровождаются вздутием живота и беспокойством пациентов. Больные пытаются искать удобную позу, но не находят комфортного положения. Беспокойное поведение специфично для почечной колики и отличает ее от острых хирургических заболеваний органов брюшной полости. Обычно при почечной колике выявляются гематурия и расстройство мочеиспускания. Основной проблемой адекватного догоспитального обезболивания при почечной колике является много раз упоминаемая "боязнь исказить клиническую картину заболевания в случае неверного диагноза СМП, если у больного на самом деле наблюдается острое хирургическое заболевание". Однако, по данным ряда специалистов в абдоминальной хирургии, указанный тезис вовсе не аксиома. Аргументы в пользу срочного эффективного обезболивания пациентов с вероятным догоспитальным диагнозом почечной колики следующие:
- симптомокомплекс почечной колики является достаточно очерченным и в большинстве случаев вызван наличием в анамнезе гиперурикемии или мочекаменной болезни;
- поведение больного с почечной коликой настолько беспокойное, что не позволяет не только исследовать пациента, но и обеспечить его транспортировку в стационар;
- эффективное обезболивание при почечной колике не предполагает назначения морфина и других опиоидов, способных исказить клинические проявления "острого живота".
Согласно литературным данным, у больного с почечной коликой для обезболивания целесообразно применять метамизол в качестве монотерапии или в комбинации со спазмолитиками, НПВП быстрого действия — лорноксикам или кеторолак. Как уже говорилось, критерием отказа от назначения метамизола служит неблагоприятный фармакологический анамнез, критерием отказа от назначения НПВП — наличие указанных выше противопоказаний.
Как известно, для обезболивания на догоспитальном этапе в России традиционно применяется метамизол, более современные препараты из группы НПВП используются редко. Лишь единичные работы посвящены оценке сравнительной эффективности и безопасности ненаркотических анальгетиков и НПВП в парентеральной форме при болевом синдроме различного генеза. Сравнительный анализ эффективности, б
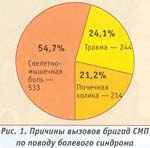 езопасности, а также экономической эффективности применения различных НПВП на догоспитальном этапе был проведен ННПОСМП в 2003-2004 гг. В исследование вошел 991 пациент в возрасте 54,8±0,46 года, все они обратились на СМП с жалобами на острую боль. Из принявших участие в исследовании 533 пациента (54,7%) обратились за неотложной помощью в связи со скелетно-мышечной болью, 244 (24,1%) — по поводу травмы, 214 (21,2%) — с почечной коликой (рис. 1).
езопасности, а также экономической эффективности применения различных НПВП на догоспитальном этапе был проведен ННПОСМП в 2003-2004 гг. В исследование вошел 991 пациент в возрасте 54,8±0,46 года, все они обратились на СМП с жалобами на острую боль. Из принявших участие в исследовании 533 пациента (54,7%) обратились за неотложной помощью в связи со скелетно-мышечной болью, 244 (24,1%) — по поводу травмы, 214 (21,2%) — с почечной коликой (рис. 1). В связи с острой болью пациентам методом случайного выбора назначали терапию диклофенаком натрия (вольтареном) 3,0 2%-ного раствора в/м, кеторолаком (
 кетановом) 1,0 (30 мг) в/м, лорноксикамом (ксефокамом) 8 мг в/м. Анальгезирующая эффективность препаратов оценивали по ВАШ и аналоговой шкале оценки интенсивности боли в баллах от 1 до 5. По ВАШ из исследуемых препаратов наилучшей анальгетической эффективностью обладал лорноксикам, наихудшей — диклофенак (рис. 2).
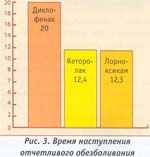
кетановом) 1,0 (30 мг) в/м, лорноксикамом (ксефокамом) 8 мг в/м. Анальгезирующая эффективность препаратов оценивали по ВАШ и аналоговой шкале оценки интенсивности боли в баллах от 1 до 5. По ВАШ из исследуемых препаратов наилучшей анальгетической эффективностью обладал лорноксикам, наихудшей — диклофенак (рис. 2). Идентичные данные получились при оценке эффективности по 5-балльной шкале. Наименьшее время обезболивания было у лорноксикама, наибольшее — у диклофенака.
По времени наступления обезболивания данные препараты можно расположить следующим образом: лорноксикам жеторолак > диклофенак (рис. 3).
Ч
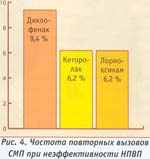 астота повторных вызовов по поводу скелетно-мышечной боли была высока при приеме диклофенака, а при приеме кеторолака и лорноксикама повторные вызовы были значительно реже (рис. 4).
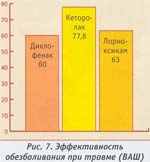
астота повторных вызовов по поводу скелетно-мышечной боли была высока при приеме диклофенака, а при приеме кеторолака и лорноксикама повторные вызовы были значительно реже (рис. 4). Эффективность изученных препаратов существенно различалась при болевом синдроме разного генеза. Динамика интенсивности скелетно-мышечной боли по ВАШ в группе диклофенака составила 57,7±4,б мм, кеторолака — 69,3±1,9 мм, лорноксикама — 70,8±4,7 мм (рис. 5). При почечной колике (рис. 6) динамика интенсивности боли на фоне лечения диклофенаком — 72,4±4,7 мм, кеторолаком — 57,8±3,б мм, а лорноксикамом — 77,8±4 мм. Динамика острой боли травматического генеза на фоне лечения диклофенаком — 60+4,6 мм, кеторолаком — 77,8±1,9 мм, а лорноксикамом — 68,0±4,7 мм (рис. 7).
П


 ри оценке безопасности наиболее надежным оказался лорноксикам, а наибольшее количество осложнений выявлено на фоне лечения диклофенаком (табл. 2).
ри оценке безопасности наиболее надежным оказался лорноксикам, а наибольшее количество осложнений выявлено на фоне лечения диклофенаком (табл. 2). При анализе фармакологической эффективности лечения оказалось, что затраты на единицу эффективности препарата зависят не только от его первоначальной стоимости, но и от эффективности обезболивания и частоты возникновения побочных эффектов. По затратам на единицу эффективности препарата наилучшая позиция оказалась у кеторолака (табл. 3).
| Таблица 3 Фармаккоэкономический анализ лечения (КЭ - боль не менее 50%) | |||
| Показатель | Диклофенак, п =153 | Кеторолак, п =318 | Лорноксикам, п =95 |
| Количество единиц лекарства | 1 ампула (3 мл , 75 мг ) | 1 ампула (3 мл , 30 мг ) | 1 флакон (8 мг ) |
| Стоимость единицы лекарства , руб . | 36,36 | 10,86 | 97,23 |
| Количество повторных вызовов | 9 | 11 | 3 |
| Стоимость повторных вызовов , руб . | 7200 | 8800 | 2700 |
| Общая стоимость лечения , руб . | 12763,08 | 12253,48 | 11936,85 |
| Средние затраты на одного пациента ( С ), руб . | 83,42 | 38,53 | 125,65 |
| Эффективность (Ef),% | 69,9 | 82,4 | 87 |
| Затраты на единицу эффективности ( CEA = C / Ef ), руб . | 1,19 | 0,46 | 1,44 |
Таким образом, лорноксикам оказался наиболее эффективным при почечной колике и скелетно-мышечной боли, кеторолак— при травме. У лорноксикама и кеторолака приблизительно одинаковы время наступления отчетливого обезболивания и частота повторных вызовов по поводу купирования боли. Лорноксикам редко вызывает нежелательные явления. Кеторолак — наиболее экономичный препарат (табл. 4).
| Таблица 4 Сравнительная характеристика НПВП при догоспитальной терапии острых болевых синдромов | |||
| Показатель | Диклофенак , п =153 | Кеторолак , п =318 | Лорноксикам , п =95 |
| Эффективность в целом | + | | |
| Эффективность при скелетно - мышечной боли | + | | ++++ |
| Эффективность при травме | | | ++ |
| Эффективность при почечной кол и ке | ++ | + | + ++ |
| Безопасность | ++ | | |
| Стоимость | | | + |
Онкогенная боль
Ежегодно в мире выявляют около 6 млн. новых случаев онкологических заболеваний, в основном у пациентов старшего возраста. В нашей стране из 500 тыс. случаев с впервые установленным диагнозом злокачественного образования у 20% пациентов диагностируют IV стадию болезни и 30% больных умирают в течение первого года. Установлено, что около 4 млн. онкологических больных ежегодно страдают от болей разной интенсивности. При этом около 40% больных с промежуточными стадиями процесса и 60—87% с генерализацией заболевания испытывают боли отумеренных до сильных.
Помимо развития стойких болей при поражении позвоночника и других отделов опорно-двигательного аппарата у пациентов с онкологическими заболеваниями развиваются стойкие боли, обусловленные деструкцией нервных стволов, внутренних органов и синовиальных оболочек. Тем не менее интенсивность болевого синдрома у онкологических больных прямо не зависит от типа и распространенности поражения тканей и в большинстве случаев — результат суммирования ноцицептивной и невропатической боли. У подавляющего большинства пациентов собственно онкологическая боль развивается в далеко зашедших стадиях заболевания и по сути является персистирующей острой болью. Кроме того, у получающих специфическое лечение онкобольных упорная боль может s том числе развиться в исходе противораковой терапии, при присоединении инфекции или позднего метастазирования.
На догоспитальном этапе лечение пациентов с онкологическим заболеванием сопряжено с рядом трудностей. В первую очередь это обусловлено сложностью внеклинической оценки параметров полиэтиологичной онкогеннои боли, а также отсутствием на СМП регламентации и опыта применения современных эффективных ненаркотических анальгетиков и адъювантных средств у онкологических больных с различной распространенностью бластоматозного процесса. Таким образом, на практике эффективное обезболивание, которое в соответствии с законодательством должно быть бесплатным, оказывается недоступным для большинства онкологических больных, еще не получающих наркотических анальгетиков. С другой стороны, онкологические больные, находящиеся на амбулаторном лечении, нуждаются в перманентном контроле и при необходимости в коррекции терапии, профилактике и устранении нежелательного действия обезболивающих средств.
Согласно рекомендациям ВОЗ, выбор средств для анальгезии базируется на выраженности онкогенной боли. ВОЗ предлагает «шаговую» схему обезболивания онкологических больных, в соответствие с которой сила анальгезии увеличивается постепенно, от 1-го к 4-му уровню, что позволяет достичь удовлетворительного обезболивания у 90% пациентов [13]:
- 1-й уровень: неопиоидные препараты;
- 2-й уровень: неопиоидные препараты + слабые опиоиды;
- 3-й уровень: неопиоидные препараты + сильные опиоиды;
- 4-й уровень: инвазивные методы обезболивания — спинальная анальгезия, использование подкожных аппликаторов и т.д.
В соответствии с концепцией шаговой терапии ВОЗ предложены рекомендации по комплексной плановой терапии боли у пациентов с верифицированным онкологическим заболеванием, находящихся за пределами стационара (табл. 5).
| Таблица 5 Рекомендации ВОЗ по купированию онкогеннои боли | ||
| Шаги | Анальгетики и адъювантные средства | Препараты |
| I. Умеренная боль | Периферические анальгетики | Парацетамол, метамизол (анальгин) |
| II . Сильная боль (шаг I неэффективен) | Периферические анальгетики+анальгетики центрального действия | Парацетамол, метамизол + пентазоцин (фортрал, фортвин) |
| IIIа. Более сильная боль (шаг II неэффективен) | Легкие опиоиды | Трамадол (трамал), тилидин |
| IIIb *. Более сильная боль (шаг Ша неэффективен) | Нейролептики и/или антидепрессанты | Левопромацин , кломипрамин |
| IV . Сильнейшая , нестерпимая боль (шаг III неэффективен) | Опиоиды | Бупренорфин (бупранал), морфин |
| * Нейролептики и/или антидепрессанты могут быть добавлены к любому шагу World HeaLth Organization . Cancer pain relief and palliative care: Report on a WHO expert committee, 1990. Geneva ( Switzerland ). | ||
Традиционное лекарственное оснащение СМП позволяет провести адекватное обезболивание онкологических больных. Тем не менее в практике СМП практически отсутствует опыт применения у онкологических больных современных НПВП с коротким периодом полувыведения (обеспечивающим быстрое развитие и «управляемость» эффекта) и выраженным анальгетическим действием, таких, как лорноксикам.
В целях оценки эффективности и безопасности лорноксикама при догоспитальной терапии онкогенной боли ННПОСМП в 2004 г. было проведено многоцентровое открытое исследование «Применение лорноксикама у онкологических больных на этапе СМП». В исследование вошли 50 пациентов в возрасте 69+11 лет с верифицированным онкологическим заболеванием, обратившихся на СМП по поводу сильного болевого синдрома и не получающих системные наркотические анальгетики. При оказании СМП пациентам однократно в зависимости от тяжести болевого синдрома внутривенно вводили 8 мг или 16 мг лорноксикама. Эффект оценивали по ВАШ исходно и через 20 мин после лечения, по длительности времени от введения лорноксикама до появления выраженного обезболивания. Кроме того, пациенты определяли эффективность анальгезии по пятибалльной шкале через 20 мин и 60 мин после введения препарата и сравнивали эффективность однократного введения лорноксикама и препарата, который они принимали раньше. Из 50 пациентов, принявших участие в исследовании, у 34% больных был рак желудка, у 26% больных — рак легких, у 10%, 14% и 16% — рак матки, поджелудочной железы и молочной железы соответственно.
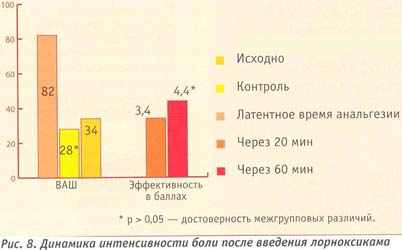
До назначения лорноксикама пациенты наиболее часто применяли трамал и баралгин. Динамика интенсивности болевого синдрома после однократного введения лорноксикама по ВАШ составила 54 балла, эффективность по 5- балльной шкале через 20 мин — 3,4, а через 60 мин — 4,4 (рис. 8).
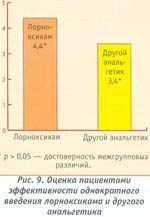
По субъективной оценке пациентов, лорноксикам при однократном введении оказался достоверно эффективнее, чем любой из анальгетиков, ранее применявшихся (рис. 9).
З
 начит, можно сделать следующие выводы:
начит, можно сделать следующие выводы: - лорноксикам — эффективное и безопасное средство догоспитального лечения боли у онкологических больных, не получающих наркотические анальгетики;
- все пациенты, получавшие лорноксикам на догоспитальном этапе, оценили эффективность его однократного введения выше, чем любого другого ненаркотического анальгетика;
- ни в одном случае применение лорноксикама у онкобольных на догоспитальном этапе не привело к развитию значимых побочных эффектов;
- ни один пациент, однократно получивший лорноксикам, в течение суток не вызывал СМП повторно.
Очевидно, что на любом этапе лечения эффективность обезболивания у онкологических больных может быть усилена применением адъювантных средств. К адъювантным средствам относят не только препараты, потенциирующие действие анальгетиков (психотропные, снотворные и т.д.), но и средства для коррекции побочных эффектов (глюкокортикоиды, антибиотики, противокислотные и обволакивающие и т.д.).
Таким образом, на догоспитальном этапе у каждого пациента поиск показаний, выбор препаратов и режимов обезболивания должны базироваться на рекомендациях ВОЗ, ориентированных именно на внегоспитальную помощь онкологическим больным. Однако адъювантные средства специалисты СМП могут применять только для лечения сопутствующих неотложных состояний или в целях коррекции нежелательного действия обезболивающих препаратов.
