Роуз С. Р79 Устройство памяти. От молекул к сознанию: Пер с англ
| Вид материала | Решение |
- «хм «Триада», 9393.37kb.
- Анастази А. А 64 Дифференциальная психология. Индивидуальные и групповые разли- чия, 11288.93kb.
- Роджер Л. М2Э вирус ответственности.: Пер с англ, 2943.44kb.
- Новые поступления литературы (июль сентябрь 2002) математика инв. 62350 в 161., 125.41kb.
- Указатель произведений литературы зарубежных стран (библиотека кф ат и со), 250.17kb.
- Литература для клинических интернов по специальности «терапия» Кафедра факультетской, 55.33kb.
- Куртц П. К93 Искушение потусторонним: пер с англ, 7904.74kb.
- The guilford press, 6075kb.
- The guilford press, 6075.4kb.
- Жизнь счастливого человека (А. Маслоу), 76.37kb.

Ход изменений во времени.
Б. Биохимия переходит в морфологию
Если верна гипотеза об участии гликопротеинов в той или иной форме перестройки синапсов, то нельзя ли в самом деле наблюдать эти изменения в нейронах IMHV? Не так уж трудно приготовить препараты мозговой ткани для изучения в обычном микроскопе (максимальное увеличение в несколько тысяч раз) или с помощью электронного микроскопа (увеличение в сотни тысяч раз). Гораздо сложнее перейти от визуальной качественной оценки микроскопического изображения к количественным характеристикам тех или иных компонентов в изучаемом объекте. Если при обучении не образуется чего-то совершенно нового, на препаратах будут скорее всего заметны лишь небольшие изменения в числе, форме или распределении уже существовавших структур, в частности синапсов. При световой микроскопии нельзя увидеть отдельные синапсы, но можно окрасить нейроны и рассмотреть строение их дендритов, чтобы выявить возникшие изменения. Однако если изменения появятся в нервных окончаниях с пресинаптической стороны, то для их количественной оценки понадобятся методы электронной микроскопии, поскольку световой микроскоп не дает достаточного увеличения.
Такие количественные морфологические наблюдения, т. е. определение формы, числа и величины клеток в мозгу, даже сегодня, при наличии компьютерных систем и весьма совершенных способов анализа изображений, требуют больших затрат времени и, если наблюдатель недостаточно внимателен, таят в себе опасность неверного истолкования. Какую долю клеток из сотен тысяч, имеющихся в каждом крошечном участке мозга, нужно исследовать, чтобы получить репрезентативную картину?
Как можно быть уверенным, что наблюдаемые под микроскопом изменения «действительно» происходят в живом мозгу, а не являются артефактом — искусственно вызванным результатом применения того или иного метода фиксации, приготовления срезов или окрашивания мозговой ткани с целью сделать видимым ее строение? Как можно перенести результаты измерений на двумерных срезах на трехмерную живую ткань? Все эти технические вопросы встали передо мной и моим коллегой Майком Стюартом в начале нашей работы на цыплятах, когда стало ясно, что нам понадобятся измерения такого рода. Майк настолько увлекся этой задачей, что создал действительно первоклассную лабораторию количественной морфологии. Но что именно следовало измерять у цыплят, учитывая множество открывающихся возможностей?
В конце XIX века миланский анатом Камилл о Гольджи почти что неожиданно для себя открыл краситель на основе солей серебра, который окрашивал в срезах очень небольшую (по-видимому, случайную) выборку нейронов, настолько четко выделяя отдельные клетки, что видны были и мельчайшие детали клеточного тела, и дендриты, и даже мириады крошечных шипиков, усеивавших поверхность дендритов. Любопытно, что сам Гольджи, получивший Нобелевскую премию (отчасти и за эту работу), не верил в существование в мозгу отдельных нейронов, представляя себе его ткань как непрерывную сеть волокон. Он упорствовал в этом заблуждении вопреки всем данным, которые доставляла его же собственная методика окрашивания. Значение открытия Гольджи было оценено лишь знаменитым нейроанатомом из Мадрида Раман-и-Кахалом, который тоже стал Нобелевским лауреатом (хотя Гольджи отказывался не только принять его доводы, но даже разговаривать с ним). Каждого, кто видит препараты нейронов, окрашенных по Гольджи, восхищают сложность и изящество их ветвления. Даже сейчас, через десятки лет после того, как я впервые увидел такие препараты, они кажутся мне необычайно красивыми, и я погружаюсь в созерцание клеточной чащи, которая выглядит тем более таинственной, что окраска придает препарату какую-то осязаемость, почти трехмерность. Она делает видимыми лишь некоторые из множества нейронов, так что клетки выступают на общем фоне как облетевшие деревья в тумане (рис. 10.6).


Рис. 10.6. Нейроны IMHV. А. Отдельный нейрон, окрашенный по Гольджи. Б. Дендрит при большем увеличении с шипиками на его поверхности.

Но одно дело восхищаться красотой таких изображений и совсем другое — давать их структуре количественную оценку. Что нужно измерить, чтобы отличить нейрон, изменившийся после обучения? Поверхность всех дендритов, отходящих от тела клетки, покрыта синапсами, возможно, числом до десятка тысяч, которые принадлежат другим нейронам и обеспечивают связь между клетками. Одни синапсы размещаются прямо на самих дендритах, другие на крошечных шипиках, отходящих от их поверхности (они видны на рис. 10.6). Перестройка синаптических связей между нейронами в соответствии с гипотезой Хебба может быть связана с изменением длины дендритов, характера их ветвления или количества шипиков.
Насколько сильно каждый из синапсов будет воздействовать на постсинаптическую клетку, зависит от разных факторов: от близости синапса к телу нейрона, от локализации его на стволе дендрита или многочисленных шипиках и т.д. В синапсе медиатор, выделяемый на пресинаптической стороне, связывается с постсинаптическим рецептором, что приводит к изменению электрических свойств постсинаптической мембраны и возбуждению вокруг нее слабого электрического тока. Действие этого тока на остальную часть дендрита, а потом и на тело клетки в большой степени определяется геометрией участка, окружающего синапс. Расчеты биофизиков показали, что от синапсов, расположенных на шипиках, электрическая реакция распространяется эффективнее, чем от синапсов на самих дендритах, а ток в отдельных шипиках зависит от их формы. Поэтому любое изменение в структуре дендритов или в расположении на них синапсов может изменять нейрофизиологические взаимодействия между пре- и постсинаптическими клетками. Иначе говоря, характер межнейронных связей может изменяться не только при увеличении или уменьшении каждого отдельного синапса (например, синапс может переместиться со ствола дендрита на шипик).
Есть веские основания полагать, что форма и характер ветвления дендритов тоже имеют важное значение и могут изменяться под воздействием обучения или других форм приобретения опыта. Приготовление микроскопических препаратов неизбежно связано с фиксацией и окраской ткани, поэтому то, что мы видим, всегда выглядит как очень жесткая структура. Но в живом организме сеть дендритов подвижна, как ветки деревца при легком ветре [13], и нетрудно предвидеть, что их взаимное расположение будет меняться. Однако анализировать эти изменения не так-то просто. Гораздо проще подсчитывать число дендритных шипиков, и именно этим занимался в середине 80-х годов Санджай Пател, один из диссертантов, работавший в лаборатории Майка Стюарта. Он обучал цыплят и спустя сутки приготовлял препараты правого и левого IMHN, окрашенные по методу Гольджи. После этого он отбирал нейроны определенного типа с длинными аксонами, измерял длину каждой ветви дендрита и подсчитывал на ней шипики, а затем вычислял количество последних на один микрометр (одну миллионную долю метра) длины дендрита.
К нашей общей радости (и, должен сказать, к моему удивлению), результаты подсчета оказались весьма впечатляющими. Через 24 часа после обучения число шипиков на дендритах в левом IMHV увеличивалось на 60% (но практически не изменялось в правом IMHV). Форма шипиков тоже несколько менялась: создавалось впечатление, что кончик у каждого из них раздувался, словно маленький воздушный шарик. Именно это и должно было происходить, согласно биофизической теории, в случае усиления электрической связи между пре- и постсинаптическими областями системы у цыплят, клевавших горькую бусину. К точно такому же изменению должен был приводить повышенный биосинтез гликопротеинов [14].
Итак, мы получили четкие данные о весьма значительном изменении постсинаптических структур в процессе приобретения опыта. Но в арсенале морфологических методов Майка Стюарта была не только световая, но и электронная микроскопия. При том увеличении электронного микроскопа, которое мы обычно используем, ноготь большого пальца имел бы 250 метров в ширину, а упорядоченная картина, выявляемая при окраске по Гольджи, обращается в хаос, истолковать который может только очень дисциплинированное воображение. Электронная микроскопия не позволяет просто увеличить окрашенное изображение и от начала до конца рассмотреть каждую отдельную клетку и все ее связи; изменения шипиков, видимые в обычный микроскоп, трудно отнести к определенным синапсам, выявляемым с помощью электронной микроскопии. Впрочем, опыт и верный глаз помогают разобраться в хаосе электронно-микроскопической картины и различить отдельные синапсы, клеточные тела, аксоны и дендриты, чтобы измерить их. На рис. 10.7 показана электронная микрофотография синапса из IMHV с обозначениями, которые помогут понять, что на ней видно. Если говорить точно, то синапс — это то место, где пресинаптическое окончание тесно сближено с постсинаптической мембраной. На фото это место имеет вид утолщенной, темной полоски, где мембраны двух клеток практически (хотя и не совсем) соприкасаются. Это утолщение представляет собой тот участок постсинаптической мембраны, где имеются рецепторные молекулы, связывающие нейромедиатор после его высвобождения из мелких пузырьков, плотно упакованных в пресинаптическом окончании. В качестве параметров, заслуживающих измерения, сами собой напрашиваются число таких окончаний в данном объеме ткани, их средняя величина (объем) и длина синаптического утолщения. Запасшись временем и терпением (если вы собираете материал для диссертации или просто горите энтузиазмом), можно даже подсчитать число пузырьков в каждом окончании.

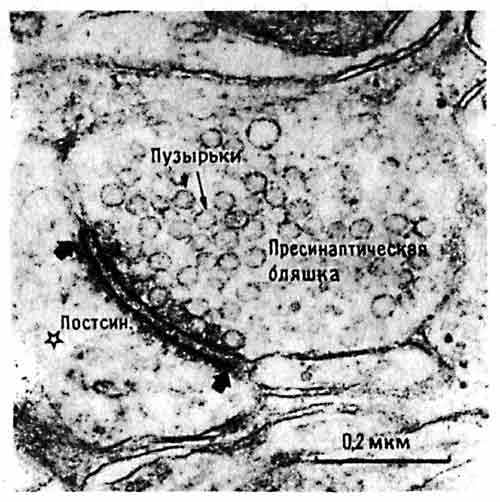
Рис. 10.7. Синапс в IMHV. Отдельный синапс с пузырьками. Звездочкой отмечен синаптический контакт с головкой дендритного шипика. Широкими стрелками показано утолщение постсинаптической мембраны. (Фото любезно предоставил Майк Стюарт.)

Майк, работавшие у него выпускники университета и приезжие стажеры определяли все эти параметры в синапсах IMHV и LPO. В начале наших исследований это делали через сутки после обучения цыплят, исходя их того, что для любого структурного изменения нужно время. В последующем Майк убедился, что изменения можно впервые обнаружить уже через час после клевания бусины. Полученные им данные ясны: происходило увеличение числа синапсов в LPO, числа пузырьков в каждом синапсе и даже длины постсинаптического утолщения в левых IMHV и LPO. Все это наряду с изменением числа и величины шипиков на дендритах было именно тем, чего следовало ожидать, если у цыплят, клевавших бусину и запоминавших связь между этим действием и ощущением горького вкуса, перестраивались синапсы в IMHV и LPO. Такая перестройка кодировала (или отображала) эту новую ассоциацию и связанное с ней изменение поведения — «не клевать» вместо «клевать», когда цыплята вторично видели бусину [15].
Резюмируем все сказанное до сих пор. Как видно из рис. 10.3, можно думать, что клевание горькой бусины запускает у цыпленка каскад биохимических процессов в двух, специфических участках мозга. Вначале происходят кратковременные изменения мозгового кровотока и использования энергии; при этом быстро усиливаются взаимодействия между нейромедиатором и его рецепторами, что ведет к изменению свойств синаптических мембран и к повышению эффективности связи между пре- и постсинаптическим нейронами. Эти изменения в свою очередь порождают сигналы для клеточного ядра, в котором сначала активируются несколько «ранних» генов, а потом и гены, необходимые для синтеза новых компонентов синаптических мембран, особенно гликоцротеинов. В последующие часы эти гликопротеины включаются в синаптические мембраны, увеличивая число шипиков на дендритах и размеры зон синаптического контакта в левом IMHV и в левом и правом LPO. Не так уж мало, если учесть, что цыпленок всего лишь однажды клюнул горькую бусину!

Третий критерий: необходимость и достаточность
Пока все идет хорошо, но самый факт сопутствующих изменений не доказывает, что они необходимы для образования следов памяти. Иными словами, я должен еще проверить ситуацию на соответствие моему третьему, редукционистскому критерию. Пока я этого не сделал, вся сложная последовательность событий, установленная за десять лет работы, может оказаться просто результатом неприятного вкуса во рту цыпленка, не имеющим ничего общего с научением и памятью.
Одним из способов такой проверки мог бы служить довольно грубый опыт Мэри Гиббс, которая помещала метилантранилат в клюв цыплятам с закрытыми глазами и не находила после этого никаких изменений в рецепторах для синаптического медиатора. Однако лишение птенцов способности видеть само по себе отнюдь не безразлично для их реакции, поэтому результаты таких опытов не слишком убедительны. В идеале мне были бы нужны две группы успешно обученных цыплят, в одной из которых цыплята в последующем забывали бы усвоенную связь, а в другой помнили ее. Во втором случае у них должны были выявляться все описанные выше процессы на уровне синапсов, а в первом их не было бы.

Размышляя над решением этой проблемы, я натолкнулся на статью Ларри Беновица, нейробиолога из Гарвардского университета, опубликованную в начале семидесятых годов. В ней описывалось, как цыплят обучали пассивному избеганию и сразу после этого пропускали через голову слабый электрический разряд, что, по-видимому, заставляло их забыть связь между видом и вкусом бусины: при повторном предъявлении они клевали ее так же энергично, как и в первый раз. Но если ток пропускали не ранее десяти минут после обучения, память о приобретенном опыте сохранялась и цыплята избегали повторно клевать бусину [16]. Это можно бьшо объяснить тем, что ранние этапы образования энграмм связаны с электрической активностью нейронов, а она нарушалась при воздействии тока сразу после обучения; при более позднем пропускании тока эти этапы успевали завершиться и процесс мог беспрепятственно идти дальше.
Это сразу же подсказало мне план дальнейших экспериментов. Нужно было обучить цыплят, используя горькую бусину, воздействовать на них электротоком сразу или через несколько минут после обучения и сравнить биохимические изменения у птенцов, забывших связь между видом и вкусом бусины, и у сохранивших это воспоминание. Мы сконструировали небольшое и очень простое устройство, которое позволяло пропустить слабый ток через голову цыпленка, когда его держали в руках; прохождение разряда я контролировал на собственном пальце —- это бьшо всего лишь короткое покалывание, и цыплята едва замечали его. Таким образом я смог проверить данные Беновица. Он оказался прав: если ток пропускали уже через минуту после обучения, у большинства цыплят развивалась амнезия, а при задержке на десять минут цыплята избегали клевать бусину повторно.
Но двух групп было недостаточно для хорошего эксперимента: нужны были шесть групп. Обозначим их буквами. В трех группах, В, ВЭ и В—Э, цыплятам предлагали для обучения бусину, смоченную водой (В), а в трех других, М, МЭ и М—Э, бусину с метилантранилатом (М). В группах В и М цыплят не подвергали электрическому (Э) воздействию (точнее, подвергали «ложному» воздействию — проделывали все те же манипуляции, но при выключенном токе). В группах ВЭ и МЭ ток пропускали сразу после обучения, а в группах В—-Э М—Э несколько позже. Если показателем нейрохимических изменений служило, скажем, повышенное включение фукозы в часы после тренировки, то можно бьшо ожидать различий между группами В и М вследствие обучения и между группами В—Э и М—Э, поскольку цыплята, получавшие шок не сразу после тренировки, клевали бусину и сохраняли память. Наиболее важно сопоставление групп ВЭ и МЭ: цыплята группы МЭ клевали горькую бусину, но не помнили об этом и снова клевали ее при повторном предъявлении. Если биохимические изменения в мозгу отражают лишь факт клевания горькой бусины, то включение фукозы у цыплят группы МЭ будет таким же, как в группах М и М—Э, и выше, чем у всех цыплят, клевавших бусину, смоченную водой (группы В, ВЭ, В—Э). Если же повышенное включение связано с запоминанием, то его изменение в группе МЭ будет таким же, как в группе ВЭ, и слабее, чем в группах М и М—Э. Разумеется, для получения надежных результатов опыты следовало бы повторить на достаточно большом числе цыплят — до 12 в каждой группе, но при анализе данных они уже оказались вполне однозначными, и я не могу удержаться, чтобы не привести их на рис. 10.8 [17].

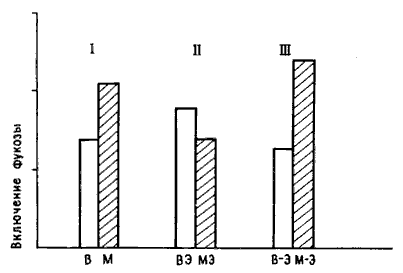
Рис. 10.8. Память и включение фукозы. Высота каждого столбика соответствует количеству включившейся фукозы. Светлые столбики показывают включение у цыплят, клевавших бусину, смоченную водой, а темные — бусину с метилантранилатом. Буквы под каждым столбиком соответствуют обозначению групп в тексте. I — цыплята, не подвергавшиеся шоку, с ожидавшимся повышением включения фукозы после клевания бусины с метилантранилатом; II — цыплята, подвергавшиеся шоку сразу после обучения (включение не повышено); III — цыплята, подвергавшиеся шоку позднее (включение повышено после клевания бусины с метал антран ил атом). Обратите внимание на отсутствие достоверного различия между всеми группами цыплят, клевавших бусину, смоченную водой. Это говорит о том, что сам по себе шок не влиял на включение фукозы.

Повышенное включение фукозы наблюдали только в тех группах, где цыплята помнили предшествующий опыт. У обученных, но забывших об этом цыплят такое повышение отсутствовало. Кроме того, оказалось, что само по себе электрическое воздействие не влияло на этот биохимический показатель, как было видно при сравнении подвергавшихся и не подвергавшихся ему цыплят, клевавших безвкусную бусину. Я был так доволен возможностью иметь столь простой и точный контроль, что использовал его и при изучении некоторых других ключевых стадий каскада; я обнаружил, например, что увеличение числа шипиков на дендритах происходит только у помнящих, но отсутствует у непомнящих цыплят [18].
У меня еще оставались сомнения, но не потому, что я ставил под вопрос разумную логику этого эксперимента, а потому, что было бы лучше провести опыт так, чтобы избежать воздействия на цыплят даже слабым током. Что я имею в виду, говоря о «лучшем» варианте? Эксперименты с использованием электрошока логичны и изящны, но такое воздействие на цыплят неприятно с эстетической (моральной? — я не уверен) точки зрения, каким бы слабым ни было вызываемое им ощущение. Поэтому пару лет назад мы с Костей Анохиным разработали иную процедуру, избавляющую цыплят от малейших неприятных воздействий, даже от клевания горькой бусины. Цыплят помещают на поверхность, усыпанную смесью гранулированного корма с гравием примерно тех же размеров и цвета. Сначала цыплята без разбора клюют и корм, и гравий, но через несколько минут замечают разницу и начинают выбирать кормовые гранулы, избегая гравия (особенно если его частицы приклеены к полу!). Мы разделяли цыплят на две группы и растягивали опыт на два дня. План эксперимента показан на рис. 10.9. Группа К в оба дня служила «спокойным контролем». В первый день цыплят групп Л и М помещали на пол с гравием, но без корма. Цыплят группы Н испытывали в таком же числе сеансов, что и две предыдущие группы, но при наличии корма, так что они учились отличать корм от гравия. На второй день опыт с группами Л и Н повторяли, а цыплятам группы М впервые предлагали и гравий, и корм. Таким образом, на второй день эксперимента только цыплята группы М обучались в первый раз, тогда как в группе Н они повторяли такие же, но усвоенные ранние действии. Во второй день мы сразу по окончании опыта оценивали у цыплят активность одного из «ранних» генов — гена c-jun. У цыплят обеих «деятельных» групп, М и Н, активность этого гена усиливалась по сравнению со «спокойным контролем» (К), но у обучавшихся птенцов (группа М) это усиление было намного более выраженным, чем у цыплят, просто воспроизводивших поведение, усвоенное ранее (группа Н), хотя последние с большей жадностью поедали корм [19].

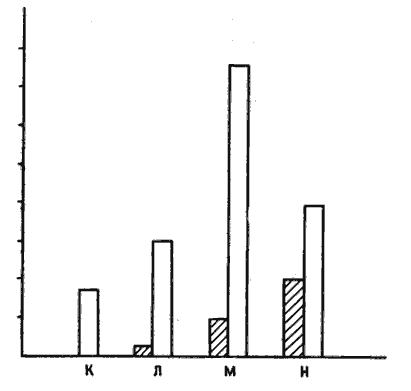
Рис. 10.9. Эксперимент с расспанным по полу гравием. Четыре группы птенцов (К, Л, М и Н) обучали в течение двух дней, как описано в тексте. Темные столбики — частота клевания, а светлые — активность c-jun. Хотя больше всего клюют уже обученные цыплята группы Н, активность c-jun наиболее высока в обучавшейся группе М.


Четвертый критерий: приводит ли подавление биохимических процессов к подавлению памяти?
Логика экспериментов с ингибированием самоочевидна, но на протяжении ряда лет я отказывался от их проведения, так как мне оставалось не ясно, что конкретно может дать применение ингибиторов с широким спектром действия, например ингибиторов белкового синтеза, для познания биохимических процессов, которые я пытался расшифровать. Но когда мы подошли к более детальному изучению отдельных звеньев биохимического каскада, я убедился, что использование достаточно специфических ингибиторов может пролить свет на молекулярные механизмы. Например, мы обнаружили, что если перед началом обучения вводить вещества, блокирующие долговременную потенциацию в гиппокампе и пространственное научение (ингибиторы рецепторов глутамата NMDA-типа), то у цыплят развивается амнезия. К таким же последствиям приводит инъекция в левое полушарие протеинкиназы С перед самым обучением или сразу после него [20].
Но, может быть, самым интересным с моей точки зрения оказался ингибитор, предложенный Рейнхардом Йорком, который работал вместе с Ханс-Юргеном Маттиесом в Магдебурге (тогда еще в ГДР). Группа Маттиеса, как и наша, изучала гликопротеины и продемонстрировала увеличение их синтеза при различных более традиционных формах обучения крыс. Йорк, просматривая литературу в поисках специфических ингибиторов биосинтеза гликопротеинов, натолкнулся на сахар, называемый 2-дезоксигалактозой (2-ДГал) и находящийся в таком же отношении к галактозе, как 2-дГ к глюкозе. 2-дГал очень специфическим образом подавляет синтез тех гликопротеинов, в которых связаны между собой два сахара — галактоза и фукоза; при этом блокируется включение в них фукозы. Вместе с Мапиесом Йорк установил, что введение крысам 2-дГал вызывает амнезию. Я предложил Рейнхарду провести параллельные эксперименты на цыплятах. К нашему восторгу оказалось, что введение 2-дГал перед самым обучением или в первые два часа после него подавляет включение фукозы в гликопротеины мозга; тестирование цыплят спустя сутки выявило амнезию. Таким образом, эксперименты как с электрошоком, так и с ингибиторами показали, что для образования следов памяти необходим биосинтез специфических гликопротеинов [21].
