Процессы детоксикации и утилизации высокотоксичных соединений мышьяка 02. 00. 01 неорганическая химия
| Вид материала | Автореферат |
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Утверждаю, 65.11kb.
- Аннотация дисциплины «Общая и неорганическая химия» Общая трудоемкость дисциплины составляет, 19.38kb.
- «Неорганическая химия», 1345.55kb.
- Конспект лекций по курсу «Неорганическая и аналитическая химия», 18.21kb.
- Синтез и физико-химические свойства координационных соединений рения(V) с производными, 208.83kb.
- Примерная программа наименование дисциплины неорганическая химия рекомендуется для, 263.82kb.
- Рабочая программа дисциплина ‹‹Неорганическая химия›› опд. Ф. 02 Специальность 020101, 343.5kb.
Термодинамический анализ химических процессов является первым этапом решения научных и прикладных задач. Его применение позволяет определить принципиальную возможность и глубину детоксикации ОВ, основные (концентрационные, тепловые и температурные) параметры и характеристики отдельных стадий химического процесса.
Термодинамический анализ реакций восстановления органических и неорганических соединений мышьяка до элементного мышьяка проведен методом Гиббса для гетерофазных систем с использованием автоматизированной системы термодинамических расчетов «Chemical Thermodynamics Calculator» [2]. Получена информация о составе термодинамически обусловленных продуктов реакций и определена область их существования. При проведении расчетов учтено около ста пятидесяти газообразных и конденсированных возможных продуктов превращения органических и неорганических соединений мышьяка. Термодинамические функции для люизита были рассчитаны на основе наших экспериментальных данных по температурной зависимости теплоемкости -хлорвинилдихлорарсина.
Термодинамический анализ реакций восстановления органических и неорганических соединений мышьяка, в первую очередь люизита, показал, что наилучшим восстановителем и акцептором хлора (в хлористый аммоний) является аммиак. Очевидная с термодинамической точки зрения реакция восстановления люизита, ТХМ, сульфида мышьяка до элементного мышьяка газообразным аммиаком оказалась не известной из литературных источников. Термодинамический анализ реакций термораспада и аммонолиза был проведен для всех компонентов люизита, ТХМ, иприта и его смесей с люизитом, сульфидом мышьяка.
На рис. 3 и 4 для примера приведены температурные зависимости парциальных равновесных концентраций газообразных и твердых продуктов термораспада -люизита и его реакции с аммиаком.
 Газовая фаза 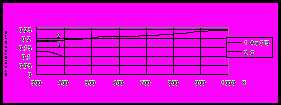 Твердая фаза | 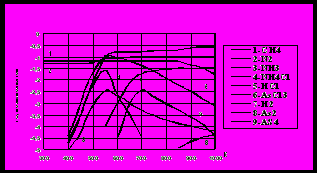 Газовая фаза 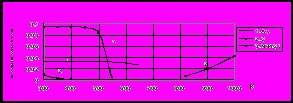 Твердая фаза |
| Рис.3. Термораспад люизита | Рис. 4. Аммонолиз люизита |
Реакция термораспада -люизита, рис. 3. При температуре более 550 К люизит не существует: газообразные продукты реакции состоят из ТХМ, элементного мышьяка, хлористого водорода и метана: в твердой фазе находится лишь углерод. При температуре менее 650 К в твердую фазу частично выпадают мышьяк.
Реакция -люизита с аммиаком, рис. 4. При температуре более 550 К люизит в атмосфере аммиака не существуют: газообразные продукты реакции состоят из ТХМ, элементного мышьяка, хлористого водорода, азота, аммиака и метана. При температуре менее 650 К практически весь мышьяк выпадает в твердую фазу, а хлористый водород нацело связывается в хлористый аммоний. Следует обратить внимание на то, что при конденсации мышьяка в интервале температуры 450 850 К в твердой фазе отсутствует углерод. Этот факт подтверждается экспериментально. Для реакции аммонолиза люизита характерен весьма ограниченный набор газообразных и твердых продуктов, простых по своей химической природе.
Реакция восстановления ТХМ аммиаком протекает аналогично реакции аммиака с люизитом. При температуре менее 650 К практически весь мышьяк выпадает в твердую фазу, а хлористый водород нацело связывается в хлористый аммоний.
Реакция сульфида мышьяка с аммиаком. При температуре более 550 К сульфид мышьяка в атмосфере аммиака не существуют: газообразные продукты реакции состоят из элементного мышьяка, сероводорода азота, аммиака. При температуре менее 650 К весь мышьяк выпадает в твердую фазу, а сероводород остается в газовой фазе.
Термодинамические свойства -хлорвинилдихлорарсина в области 0 330 К при стандартном давлении. В адиабатическом вакуумном калориметре изучена температурная зависимость теплоемкости β-хлорвинилдихлорарсина в области 13 330 К, измерены его температура и энтальпия плавления.
Н
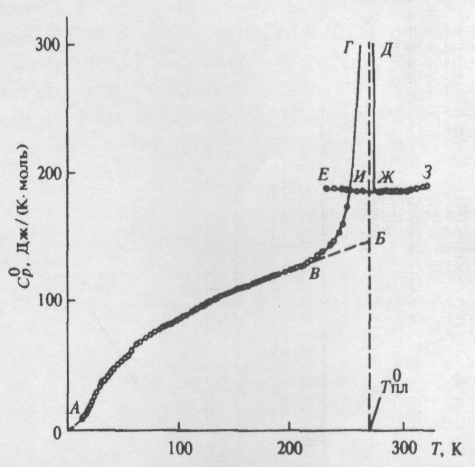 а рис. 5 представлена температурная зависимость теплоемкости -люизита: экспериментальные точки С0р для области 13 330 К, сглаживающие кривые С0р = f(Т) в той же области температуры и кривая С0р = f(Т) в интервале 0—13 К, полученная экстраполяцией экспериментальных данных по функции теплоемкости Дебая. Погрешность измеренных значений С0р в интервале 13-30 К ~1%, в интервале 30-80 К - 0.5%, в области 80-330 К - 0.2%. Суммарное содержание примесей в изученном образце -люизита составляет 0.0098 моля.
а рис. 5 представлена температурная зависимость теплоемкости -люизита: экспериментальные точки С0р для области 13 330 К, сглаживающие кривые С0р = f(Т) в той же области температуры и кривая С0р = f(Т) в интервале 0—13 К, полученная экстраполяцией экспериментальных данных по функции теплоемкости Дебая. Погрешность измеренных значений С0р в интервале 13-30 К ~1%, в интервале 30-80 К - 0.5%, в области 80-330 К - 0.2%. Суммарное содержание примесей в изученном образце -люизита составляет 0.0098 моля. В
Рис.5 Температурная зависимось теплоемкости
β-хлорвинилдихлорарсина
изученной области температуры -люизит существует в кристаллическом (кривая АВ на рис. 5), переохлажденном жидком (кривая ЕИ) и жидком состояниях. Теплоемкость кристаллического -люизита плавно увеличивается с ростом температуры, сравнительно резкое увеличение от 215 К и последующий разрыв графика С0р Т обусловлены плавлением кристаллов (БИ - увеличение теплоемкости при переходе от кристаллического к жидкому состоянию при Тпл0.); теплоемкость жидкости (кривая ЕИЖЗ, рис. 5) с ростом температуры медленно убывает, проходит через минимум при температуре плавления, а затем постепенно возрастает. Подобное изменение теплоемкости жидкостей с ростом температуры сравнительно часто встречается у органических жидкостей.
По полученным данным найдены термодинамические параметры плавления: температура плавления вещества 100%-ной чистоты Т0пл = 270,6±0,2; мольные энтальпия плавления ΔН0пл., кДж/моль = 17,1±0,1; энтропия плавления ΔS0пл., Дж(Kּ моль) = 63.18±0,4; увеличение теплоемкости ΔС0р(Т0пл), Дж(Kּмоль) = 39.1 при переходе -люизита от кристаллического к жидкому состоянию при температуре плавлении.
Вычислены термодинамические функции энтальпии Н°(T)—Н°(0), энтропии S°, функции Гиббса G°(Т)—Н°(0) для области 0-330 К; оценена изохорная теплоемкость (Сυ0) и ее слагаемые: решеточная (Сυ,0реш) и атомная (Сυ,0ат) для области 0 Тпл0.
Найдены первая А = ΔН°пл/R(Т0пл)2 = (0.0281±0.0002)К-1
и вторая В = (1/Т0пл) ΔС0пл.(Т0пл)/2ΔН°пл = (0.0025±0.0001)К-1 (R - универсальная газовая постоянная) криоскопические константы.
Глава 4. Химические аспекты аммиачного восстановления люизита и треххлористого мышьяка
Исследование реакции взаимодействия люизита и ТХМ с газообразным аммиаком. К числу важнейших реакций люизита следует отнести водный и щелочной гидролиз, окисление, восстановление, галогенирование, термораспад, реакции нуклеофильного замещения галоида, аммонолиз, алкоголиз, солеобразование и другие [3]. Высокая реакционная способность люизитов, в особенности -люизита, обусловлена строением его молекулы. Высокой подвижностью обладают не только атомы хлора, непосредственно связанные с трехвалентным атомом мышьяка, но и атом хлора в -хлорвинильном радикале. Сам атом мышьяка легко может переходить из трехвалентного в пятивалентное состояние. Двойная связь -хлорвинильного фрагмента молекулы -люизита способна принимать участие в реакциях полимеризации. - и -Люизиты взаимодействует на холоду (-40С) с аммиаком и алифатическими аминами с образованием неустойчивых солеобразных аддуктов [3]. Но при более высокой температуре реакция люизита с аммиаком была не изучена.
Нами проведены комплексные исследования реакции взаимодействия -люизита и ТХМ с аммиаком от комнатной температуры до 600С. Исследования реакций проводили как в статических, так и в динамических условиях, без растворителя и в растворе диметилформамида (ДМФА). Анализ продуктов реакции аммонолиза люизита и ТХМ осуществлялся методами хромато-масс-спектрометрии (ХМС) и высокоэффективной жидкостной хроматографии (ВЭЖХ), ДТА; углерод, водород и азот определялся элементным анализом. Мышьяк и хлор определялся на ионном хроматографе.
1. В интервале температуры 20 100С жидкий -люизит поглощает 3-3,5 молекулы аммиака с образованием смеси твердых, устойчивых на воздухе и нелетучих веществ: хлорвиниларсинимида (ClC2H2AsNH), хлорвиниларсиндиамида (ClC2H2As(NH2)2) и хлористого аммония. Реакция -люизита с аммиаком идет без выделения газообразных продуктов с высокой скоростью, большим тепловым эффектом, лимитируемой лишь скоростью массообмена.
В растворе ДМФА (универсальный растворитель для всей гаммы люизитов, продуктов их окисления и полимеризации) реакция взаимодействия люизита с аммиаком идет мягко и более глубоко с образованием при поглощении 2 молекул аммиака растворимого хлорвиниларсиндиамида, а при присоединении еще одной молекул аммиака осадка хлорвиниларсинимида и хлористого аммония.
| Осадок | Состав осадка, мас.% |
| Хлорвиниларсинимид и хлористый аммоний ClC2H2AsNH*2NH4Cl | расчет: С - 9,32; H - 4,31; N - 16,2; Cl - 41,21; As - 29,03 найдено: С - 8,38,9; H - 4,394,2; N - 15,3415,65; Cl - 37,041,0; As - 29,930,0 |
Реакция взаимодействия люизита и ТХМ с газообразным аммиаком по существу завершается уже при комнатной температуре.
2ClC2H2AsCl2 + 7NH3 = ClC2H2AsNH + ClC2H2As(NH2)2 + 4NH4Cl (4)
При нагревании твердых продуктов взаимодействия люизита с газообразным аммиаком до 250С происходит диспропорционирование хлорвиниларсиндиамида на хлорвиниларсинимид и аммиак. Хлорвиниларсинимид до температуры 300С является устойчивым соединением и по данным ДТА сублимируются в интервале температуры 230 260С практически без разложения. Кинетику реакций диспропорционирования хлорвиниларсиндиамида и хлорарсиндиамида изучали в статических условиях стандартным манометрическим методом. Для исследования кинетики использовали продукты реакции люизита или ТХМ с аммиаком, полученные при комнатной температуре. На основании кинетических данных была рассчитана температурная зависимость константы скорости реакции термораспада хлорвиниларсиндиамида:
lgK = (0.55±0,02) – (1641±60)/Т E = 31,35 кДж/моль,
и хлорарсиндиамида lgK = (1,26±0,03) – (1578±70)/Т E = 30,10 кДж/моль.
Скорости реакций диспропорционирования хлорвиниларсиндиамида и хлорарсиндиамида незначительно зависят от температуры и характеризуются низкой энергией активации E, поскольку основным продуктом является аммиак. Например, в газообразных продуктах реакции диспропорционирования хлорвиниларсиндиамида при 270С содержание аммиака составляет 93 мол.%.
Выше температуры 300С термораспад хлорвиниларсинимида происходит с образованием сначала неустойчивого нитрида мышьяка и далее элементного мышьяка, азота, хлористого водорода, метана, ароматических углеводородов, ацетилена и частично ТХМ. В атмосфере аммиака хлорвиниларсинимид до 400С нацело восстанавливается до элементного мышьяка, хлористого аммония и углеводородов; ТХМ полностью отсутствует. Аналогично в атмосфере аммиака дихлорвиниларсинамид восстанавливаются до элементного мышьяка. Хлорарсинимид до 300С устойчив, а выше в атмосфере аммиака разлагается с образованием элементного мышьяка, аммиака, азота и водорода.
2. Выше температуры 400С в продуктах аммонолиза люизита заметно изменяется состав легких углеводородов. Например, при аммонолизе люизита в динамических условиях при температуре 500С, наряду с элементным мышьяком и хлористым аммонием образуются газообразные продукты следующего состава (мол.%): азот - 43,8; метан - 18,5; ацетилен - 26,4; этилен - 10,6; водород - 0,7; ароматические углеводороды - 5. Разнообразие углеводородов обусловлено протеканием известных реакций ацетилена и хлорвинильного радикала с аммиаком, термораспада, гидрирования и конденсации с образованием легких углеводородов, азотсодержащих ароматических углеводородов и углерода.
C2H2 + 2NH3 = CH4 + 0,5C2H4 + N2 + H2 (5) 2C2H2 + 2H2 = CH4 + C2H4 + С (6)
| 4C2H2 + nNH3 ClC2H2+ nNH3 | |  | + |  | + |  | + |  | +CH4 + NH4Cl |
| | | бензонитрил 5% | | 1,2-бензодикарбонитрил 20% | | пиридинкар-бонитрил 50% | | пиридин 15% | (7) |
3.Таким образом, установлено, что реакция аммонолиза люизита с получением элементного мышьяка является процессом последовательного аминированиея люизита по хлору; хлор связывается в хлористый аммоний:
ClC2H2AsCl2 ClC2H2AsClNH2 ClC2H2AsNH AsN As + 3NH4Cl (8)
Реакция аммонолиза люизита протекает с большим выделением тепла. Экзотермичность процесса (rH, кДж/моль = -355,9), обусловлена образованием хлористого аммония.
Энтальпии реакций последовательного взаимодействия -люизита и ТХМ с газообразным аммиаком с получением элементного мышьяка определены по нашим экспериментальным данным и справочным стандартным энтальпиям образования компонентов. Энтальпии образования веществ рассчитаны по методу Гиббса и инкриментам гомологических рядов хлорвиниларсинов (люизитов) с применением автоматизированной системы термодинамических расчетов «Chemical Thermodynamics Calculator». Для этой расчетной процедуры нами соответственно был дополнен банк термодинамических функций β-хлорвинилдихлорарсина, триметил-, триэтил- и трипропиларсина.
| Вещество | fH0, кДж/моль |
| ClC2H2AsCl2 | -175,0±9 |
| (ClC2H2)2AsCl | -66,5±5 |
| ClAs=NH | -26,9±1,7 |
| ClC2H2As(NH2)2 | -42,3±3,2 |
| ClC2H2As(NH2)Cl | -101,1±7 |
| (ClC2H2)2AsNH2 | -10,9±0,8 |
| ClC2H2As=NH | 9,8±0,7 |
Последовательность реакций аммонолиза люизита и ТХМ можно описать
следующими уравнениями:
| Реакции замещения rH0(298), кДж/моль | ||
| Хлорвинилхлорарсинамид ClC2H2AsCl2 + 2NH3 = ClC2H2AsClNH2 + NH4Cl | -148,5 | (9) |
| Хлорвиниларсинимид ClC2H2AsClNH2 + NH3 = ClC2H2AsNH + NH4Cl | -157,2 | (10) |
| Хлорвиниларсиндиамид ClC2H2AsClNH2 + 2NH3 = ClC2H2As(NH2)2 + NH4Cl | -163,6 | (11) |
| Термораспад ClC2H2As(NH2)2  NH3 + ClC2H2AsNH NH3 + ClC2H2AsNH | 6,3 | (12) |
| брутто-реакция ClC2H2AsCl2 + 3NH3 = ClC2H2AsNH + 2NH4Cl | -305,7 | (13) |
| реакции с -люизитом (ClC2H2)2AsCl + 2NH3 = (ClC2H2)2AsNH2 + NH4Cl | -163,6 | (14) |
| ТХМ AsCl3 + 3NH3 = ClAsNH + 2NH4Cl | -212,6 | (15) |
Реакции восстановления до элементного мышьяка
| Хлорвиниларсинимид ClC2H2AsNH + NH3 = As + C2H2 + NH4Cl + 1/2N2 | -50,1 | (16) |
| Дихлорвиниларсинамид ClC2H2)2AsNH2 + 2NH3 = As + 2C2H2 + 2NH4Cl + 1/2N2 | -69,5 | (17) |
| Брутто-реакция -люизита ClC2H2AsCl2 + 4NH3 = As +C2H2 + 3NH4Cl + 1/2N2 | -355,9 | (18) |
| Хлорарсинимид ClAsNH + NH3 = As + NH4Cl + 1/2N2 | -454,1 | (19) |
| Термораспад -люизита ClC2H2AsCl2 = AsCl3 + 3/2C + 1/2CH4 | -136,8 | (20) |
| Брутто-реакция ТХМ AsCl3 + 4NH3 = As + 3NH4Cl + 1/2N2 | -241,3 | (21) |
В целом состав продуктов аммонолиза люизита и ТХМ при температуре выше 500С в основном совпадает с результатами термодинамического моделирования реакций.
Термические свойства -хлорвинилдихлорарсина и его производных. Реакция термораспада -люизита не менее важна, чем его реакция с аммиаком. Реакция термораспада -люизита исследована в динамических условиях в диапазоне температуры 250 450С в трубчатом стеклянном безнасадочном реакторе или заполненным стеклом, либо графитом. На выходе из реактора газохроматографическим методом контролируется четыре компонента: сумма низкокипящих углеводородов С1 – С4 (НК на рис. 6), ТХМ, -люизит и димер -люизита (ВК на рис. 6). После серии измерений гравиметрическим методом определяли количество выделившегося элементного мышьяка.
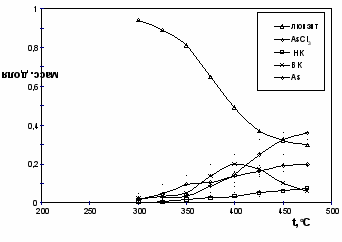 | 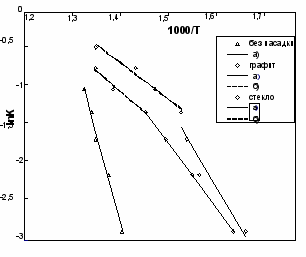 |
| Рис. 6. Температурная зависимость содержания продуктов термораспада люизита в реакторе, заполненном графитовой насадкой | Рис. 7. Температурная зависимость константы скорости термораспада люизита: в безнасадочном реакторе; на поверхности графита, стекла. а) сплошная линия - кинетическая область, б) пунктирная линия - переходная область |
По кинетическим кривым рассчитаны уравнения температурной зависимости константы скорости реакции термораспада -люизита в трубчатом реакторе без насадки, заполненным графитом или стеклом (рис. 7, табл. 1). Из рис. 6 можно видеть, что в интервале температуры 300-400С основными продуктами термораспада -люизита являются ТХМ, мышьяк, димер -люизита и хлорорганические соединения:
nClC2H2AsCl2 = AsCl3 + As + (ClC2H2)2As2 + углеводороды + HCl (22)
С ростом температуры (400-500С) -люизит и его димер разлагаются на легкие углеводороды, более простые хлорорганические соединения, мышьяк и ТХМ:
nClC2H2AsCl2 = AsCl3 + As + C2H2 + CH4 + Cl3C2H + C2H2Cl2 + C2H3Cl (23)
Дальнейшее повышение температуры (>500С) термораспада -люизита приводит к получению еще более простых соединений, исчезновению хлорорганических веществ и появлению углерода: ClC2H2AsCl2 = AsCl3 + HCl + CH4 + C2H4 + C (24)
Таблица 1. Значения коэффициентов уравнения температурной зависимости константы скорости термораспада люизита k = Aexp(-E/RT).
| Материал реактора | Режим | A, с-1 | E, кДж/моль |
| безнасадочный | 450-500С кинетический | (2,22±0,11)х1012 | 184,5±6,5 |
| графит | 325-380С кинетический | (1,19±0,09)х106 | 83,8±4,0 |
| 380-470С дифузионно-кинетический | (3,13±0,12)х102 | 38,1±1,6 | |
| стекло | 340-400С кинетический | (3,72±0,15)х105 | 67,5±3,1 |
| 400-480С дифузионно-кинетический | (5,20±0,2)х102 | 43,3±2,1 |
И
 з рис. 7 видно, что реакция термораспада -люизита в насадочных реакторах протекает, в основном, по гетерогенному механизму. С повышением температуры скорость реакции термораспада -люизита из кинетической области переходит в диффузионную. В реакторе без насадки реакция термораспада -люизита протекает по гомогенному механизму по уравнению реакции первого порядка.
з рис. 7 видно, что реакция термораспада -люизита в насадочных реакторах протекает, в основном, по гетерогенному механизму. С повышением температуры скорость реакции термораспада -люизита из кинетической области переходит в диффузионную. В реакторе без насадки реакция термораспада -люизита протекает по гомогенному механизму по уравнению реакции первого порядка.Исходя из состава продуктов и результатов исследованной нами ранее кинетики реакций термораспада алкильных соединений мышьяка, можно сделать вывод, что реакция термораспада -люизита протекает по свободно-радикальному механизму. Первичными углеводородами, образующимися при разложении -люизита являются хлорвинильный радикал *ClC2H2 и ацетилен. Многообразие легких углеводородов и хлорорганических соединений обусловлено терморападом и реакциями хлорвинильного радикала и ацетилена.
Сравнивая значения энергии активации и скорости реакций термораспада алкильных соединений мышьяка и -люизита (например, при 406°С):
триметиларсин ln k = (33,1±1,7) - (57,3±2,1)/RT (k = 9.х10-5 c-1);
триэтиларсин ln k = (31,1±1,3) - (50,4±1,7)/RТ (k = 193х10-5 c-1);
трипропиларсин ln k = (30,2±1,5) - (48,8±1,9)/RT (k = 257х10-5 c-1);
-люизит ln k = (26,9±1,2) - (44,1±1,6)/RT (k = 302. 10-5 c-1),
можно сделать вывод, что реакция термораспада -люизита протекает по тем же закономерностям, что и термораспад алкильных соединений мышьяка.
Исследование процесса адсорбции триэтиларсина, люизита и ТХМ на активированных углях. Сведений об адсорбции люизита активированными углями в открытой литературе отсутствуют. Нами исследован процесс адсорбции триэтилмышьяка на промышленных активированных углях АР-3, УП-4М, АГН, БАУ, ТХМ и люизита на угле АГ-3, влияние на их адсорбцию аммиака, ацетилена и водяных паров - компонентов газов при аммонолизе люизита, а также рассчитаны параметры адсорбера паров люизита. Исследование процесса адсорбции мышьяксодержащих веществ проводили газохроматографическим методом. При расчете процесса адсорбции были использованы методические приемы, систематизированные в работе [4].
Адсорбция триэтилмышьяка активированными углями АР-3, УП-4М, АГН, БАУ. Особенностью процесса адсорбции соединений мышьяка на активированных углях является первоначальная хемосорбция (необратимая адсорбция) определенной массы вещества. Величина хемосорбции зависит от природы угля и незначительно от строения соединения мышьяка. Это правило является общим для всех элементоорганических соединений и хлоридов элементов V – IV групп.
Нами установлено, что хемосорбция триэтилмышьяка составляет для угля АР-3 – 53.9 %, УП-4М – 8,3 %, АГН – 2,2 %, БАУ – 0,5 % от массы сорбента. При хемосорбции триэтилмышьяка у некоторых углей резко уменьшается удельная поверхность Sуд. Так, для угля АР-3 Sуд изменяется с 320 до 15 м2/г, для угля БАУ Sуд изменяется незначительно. После завершения хемосорбции, дальнейший процесс адсорбции триэтилмышьяка на активированных углях определяется физической адсорбцией. Критерием этого процесса является близость значения теплоты адсорбции к теплоте испарения вещества. Отношение теплоты испарения триэтилмышьяка (39,8 кДж/моль) к дифференциальной теплоте адсорбции составило: 0,83; 0,70; 0,84 и 0,62 на углях АР-3, БАУ, УП-4М и АГН, соответственно.
Для примера на рис. 8 приведены изотермы адсорбции триэтилмышьяка на угле АР-3, полученные газохроматографическим методом. Изотермы адсорбции имеют выпуклый характер и описываются уравнением Ленгмюра. По изотермам адсорбции триэтилмышьяка для каждого угля рассчитана температурная зависимость коэффициента адсорбции. Далее проведен расчет защитных свойств углей относительно триэтилмышьяка. С учетом хемосорбции расчетное время проскока триэтилмышьяка через слой сорбента в относительных единицах составляет для АР-3 – 36,1, УП-4М – 8,4, АГН – 4,7, БАУ – 1. Таким образом, для целей очистки газовых потоков от соединений мышьяка, в том числе и люизита следует применять активированные угли типа АР-3 или современный аналог АГ-3.
Адсорбция треххлористого мышьяка и люизита на угле АГ-3. Высокая адсорбционная емкость люизита на активных углях и недостаточная термическая стабильность вызывает определенные трудности при экспериментальном определении изотермы адсорбции газохроматографическим методом. Однако возможно с высокой степенью достоверности построить расчетным методом изотермы адсорбции одного вещества по экспериментальным изотермам адсорбции другого, с близкими химическими, молекулярными и структурными характеристиками вещества на том же поглотителе, с учетом коэффициента аффинности.
В качестве стандартного вещества для расчета изотерм адсорбции люизита нами был выбран близкий по свойствам ТХМ. Изотермы ТХМ получены в интервале температуры 143-213С. По экспериментальным данным рассчитана температурная зависимость коэффициента адсорбции (Г) ТХМ на угле АГ-3:
lg Г = -(3,440,31) + (216395)1/Т.
Изотермы адсорбции люизита на угле АГ-3 строили сравнительным методом по экспериментально полученными изотермам адсорбции ТХМ с учетом коэффициента аффинности равным 1,33.
Влияние аммиака, ацетилена и водяных паров на процесс адсорбции люизита активированным углем. На рис. 9 представлены изотермы адсорбции люизита, ТХМ, воды, аммиака и ацетилена на активированном угле АГ-3 при 20С, построенные по нашим и литературным данным. Из рис. 9 видно, что адсорбция аммиака и ацетилена на три порядка ниже, чем у люизита, и поэтому на практике они не будут оказывать существенного влияния на сорбцию люизита. Величина адсорбции люизита на активированном угле АГ-3 лишь в несколько раз выше, чем у воды. В связи с этим, адсорбционная способность угля по отношению к люизиту при высокой влажности снизится в 2-3 раза. Это необходимо учитывать при расчете адсорбционных аппаратов.
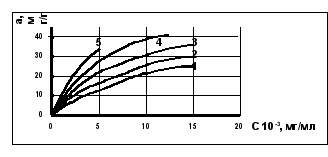 Рис. 8. Изотермы адсорбции ТЭМ на угле АР-3 1 – 433 К; 2 – 453 К; 3 – 473 К; 4 – 493 К; 5 – 513 К | 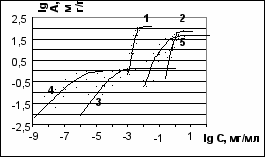 Рис. 9. Изотермы адсорбции на АГ-3 при 20С: 1 - вода; 2 – ацетилен; 3 – ТХМ; 4 – люизит; 5 - аммиак |
Расчет параметров и времени защитного действия адсорбера, заполненного углем АГ-3, был проведен в диапазоне концентраций люизита от 1 мг/м3 до 4500 мг/м3 (концентрация насыщенного пара) при 20С.
Расчет времени защитного действия адсорбционного аппарата проводился по формуле:
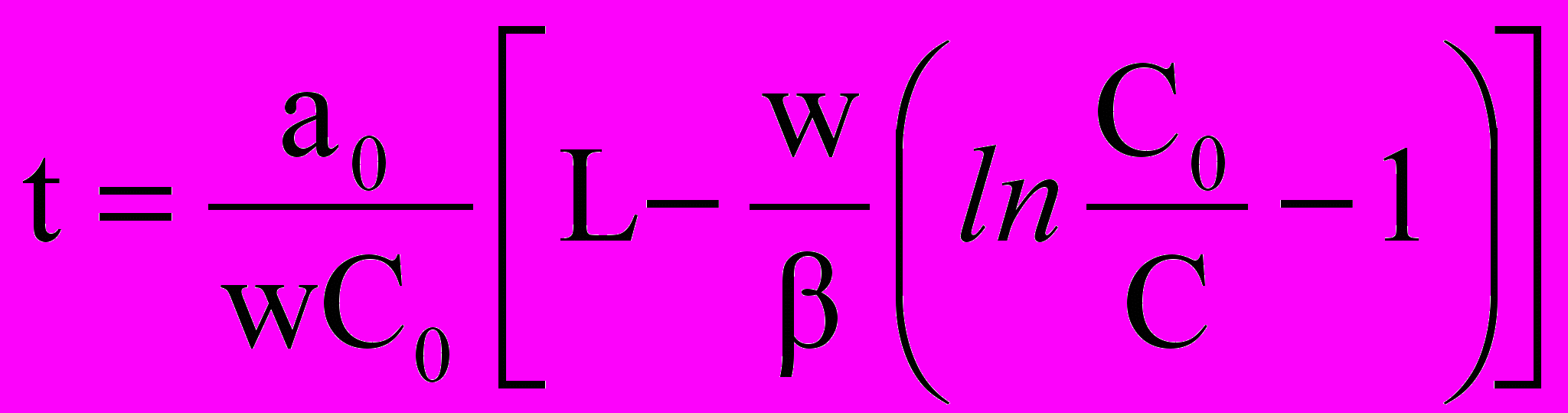 , (25)
, (25)где: t – продолжительность процесса или время защитного действия слоя поглотителя, мин; С0 – содержание люизита в газовом потоке, входящем в слой поглотителя, кг/м3; a0 – количество люизита, поглощенное массовой единицей сорбента, кг/кг; w – фиктивная скорость паро-азотной смеси (скорость, рассчитанная на полное сечение слоя), м/мин; L – длина слоя поглотителя, м; C – концентрация -люизита в смеси, выходящей из адсорбера; - коэффициент массопередачи (1,15х10-2 м/с).
Коэффициент массопередачи при адсорбции паров -люизита был рассчитан с учетом гидродинамических и диффузионных параметров адсорбционного процесса: критерия Рейнольдса (Rе), диффузионных критериев Прандтля (Pr') и Нуссельта (Nu').
Время защитного действия адсорбционного аппарата со следующими параметрами: диаметр адсорбера - 0,5 м; длина слоя поглотителя - 1,0 м; количество паро-азотной смеси, поступающей в адсорбер - 5-10 л/с и линейной скоростью w = 1,5-3 м/мин; концентрация люизита, выходящего из адсорбера C = 2х10-4 мг/м3 (ПДКрз.), при штатном режиме составляет несколько лет, а в аварийном случае не менее 135 часов.
