Масс-спектрометрия и резонансные методы. Часть I. Методы масс-спектрометрии
| Вид материала | Документы |
- Темы лекций курса " Масс-спектрометрия и резонансные методы в хос.": Введение. Классификации, 17.1kb.
- Программа курса лекций «Методы исследования макромолекул», 15.25kb.
- Использование методов ик-фурье спектрометрии, масс-спектрометрии и газовой хроматографии, 133.43kb.
- Густав Лебон Психология народов и масс. Книга II. Психология масс. Оглавление, 1817.62kb.
- Вопросы к экзамену по курсу: «Методы анализа поверхности», 14.9kb.
- Программа проведения Йошкар-Ола зао "скб, 56.45kb.
- Федеральная таможенная служба центральное экспертно-криминалистическое таможенное управление, 757.25kb.
- Российский химико-технологический университет им. Д. И. Менделеева, 124.29kb.
- Методология анализа объектов различного происхождения методами газовой хроматографии-масс-спектрометрии, 1103.9kb.
- Общественная мысль во 2-й четверти XIX века, 85.28kb.
1 2
Масс-спектрометрия и резонансные методы.
Часть I. Методы масс-спектрометрии.
Одними из главных проблем в химии являются идентификация и установление химического строения молекул исследуемого вещества, качественный и количественный анализ. Если в прошлом для решения этих задач использовались лишь химические методы, то в настоящее время для этого используется громадное многообразие физические методы исследования, основой которых служат те или иные физические явления. Особую роль среди
этих методов занимают методы масс-спектрометрия ,число модификаций которых и областей применения постоянно возрастает.
Темы лекций
1. Принципиальные основы
масс-спектрометрии
2. Хромато- масс-спектрометрия
3.Тандемная масс-спектрометрия
4.Качественный и количественный анализ
5. Применение в высокотемпературной химии
6. Применение в органической химии
7. Изотопный анализ
8. Вопросы для самоконтроля.
9.Рекомендуемая литература.
10.Приложения
1 Принципиальные основы масс-спектрометрии .
Масс-спектрометрия относится к ионизационным физическим методам исследования Своим названием все масс-спектрометрические методы исследования обязаны масс-спектрометрам - приборам разных типов и конструкций, в которых полученный из исследуемого вещества (тем или иным способом) пучок ионов (положительных или отрицательных) разделяется на отдельные пучки в соответствии с отношением масс ионов к их зарядам - me а затем количество ионов каждого типа регистрируется в виде масс-спектра
(табличного или графического) Принципиальная схема масс-спектрометра может быть представлена в следующем виде(рис 1.) :




Система Источник Пространствен- Система детек-
ввода ионов и ное или временное тирования и
и



 сследуемого формирование разделение ионов регистрации
сследуемого формирование разделение ионов регистрациивещества пучка ионов по отношению m/e ионов


С


масс-
спектр
(графический
или
табл.)
истема создания и поддержания глубокого
Запись масс-
 вакуума (10-8-10-11 Па.) спектра
вакуума (10-8-10-11 Па.) спектра(
 Создание ,формирование и разделение ионного пучка
Создание ,формирование и разделение ионного пучка
система обра-
ботки экспери-
ментальных
данных
на компоненты происходит в условиях глубокого
 вакуума )
вакуума ) 

ЭВМ
Рис. 1. Блок-схема масс-спектрометра.
Различные системы ввода дают возможность исследовать вещества в газообразном, жидком или твердом состояниях.
Рассмотрим простейший пример получения масс-спектра газовой смеси.
Известно, что атмосферный воздух состоит в основном из N2 (75,5% масс.) и O2 (23,1% масс.). Тогда, в случае ионизации воздуха методом электронного удара по реакциям (1) и (2)
(1) N2 + e- = N2+ + 2e- ( для ионов N2+ m/e = 28)
(2) O2 + e- = O2+ + 2e- (для ионов O2+ m/e = 32)
и предполагая образование только положительно заряженных молекулярных ионов, может быть получен следующий масс-спектр воздуха( рис .2):
Табличный масс-спектр воздуха.
+ ( интенсивности всех ионов рассчитываются по отношению
(Ii ) к наиболее интенсивному)

-
м./е
28
32
о тн. интенсивн.
тн. интенсивн.
100
30.6
 +
+80 N2


+
 40 O2
40 O2





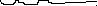

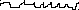
 28 30 32 m/e
28 30 32 m/eРис.2 Масс-спектр воздуха
+
Таким образом, масс-спектр - это графическая зависимость количеств (Ii )
регистрируемых ионов от их m/e , где m - масса иона, e - заряд иона,
индекс i указывает на вид иона. Графический масс-спектр легко может
быть представлен в табличном виде. При компьютерной обработке экспериментальной информации легко получить как графические, так и табличные масс-спектры исследуемых соединений.
Хотя, cтрого говоря масс-спектр вещества не является физической константой однако нет двух таких веществ ионизация которых приводит к одному и тому же масс-спектру Это обстоятельство послужило фундаментом для бурного развития масс-спектрометрии, особенно высокотемпературной масс-спектрометрии неорганических соединений различных классов и структурной масс-спектрометрии органических соединений.
Мощные аналитические возможности масс-спектрального метода, позволяющие проводить качественный и количественный анализ сложных органических и неорганических смесей, включая биологические объекты, получать информацию о химическом строении и энергетических характеристиках сложных молекул и ионов ,способствовали тому ,что сегодня трудно назвать области науки, техники или медицины, включая космическую и спортивную медицину, фармакологические исследования, где бы не применялись масс-спектрометры различных типов и конструкций.
При выборе масс-спектрометра наиболее подходящего для данного исследования обычно сравнивают следующие рабочие характеристики масс-спектрометров: разрешение, чувствительность, дисперсия по массе, диапазон регистрируемых масс.
Одной из важнейших характеристик масс-спектрометра любого типа является его разрешающая сила R (разрешение) - мера способности прибора разделять в масс-спектре два иона с какой-либо определенной разностью масс
∆ М.
Общепринято, что пики разрешены, если (l / L)* 100 < 10 , где L - высота пиков ионов в масс-спектре, а l - высота "седловины"появляющейся из-за перекрывания между интенсивностями соседних пиков - в таком случае говорят о разрешении на уровне 10 % (рис.3), хотя в ряде случаев
могут считаться разрешенными спектры и на уровне 30 или 50% .
+ + +
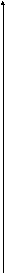 Ii M1 M2
Ii M1 M2

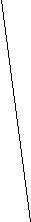
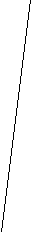



∆ М.=
+ +
L М2 - М1







 l
lm/e
Рис. 3. Схема определения значения разрешения (R) из масс-спектра.
Численное значение R можно получить по формуле: R = M/ ∆ М
Условно принято считать масс-спектрометры с R < 2000 приборами низкого разрешения, а с R> 10000 – масс-спектрометрами высокого разрешения.
Современные масс-спектрометры имеют разрешение более 10000. Приборы с высоким разрешением позволяют точно определять массу регистрируемого иона, а значит и его брутто формулу, что является важным. Этапом интерпретации масс- спектра.
Например, на приборах с низким разрешением ( R 1000) , для массового числа с м/е = 28 в масс-спектре будет регистрироваться один общий пик. На масс-спектрометрах с R 3000 для массового числа
+
с м/е =28 будет регистрироваться мультиплет из четырех ионов : C2H4
+ + + (м/е = 28,031300); CNH2 (m/e = 28,018724) ; N2 ( m/e =28,006148) ; CO (m/e =27,994915).Таким образом , измерив на приборах с высоким разрешением точное значение массы иона, можно найти для него единственно возможную комбинацию атомов , т.е его брутто- формулу.
Чувствительность(минимально определяемое давление паров изучаемого вещества ) - является одной из важнейших характеристик масс-
спектрометров ( наиболее частое обозначение -” S ” ) .Абсолютная чувствительность большинства серийных масс-спектрометров , определяемая конструкцией детектора, лежит в пределах 10 -6- 10-9 г. вещества. Проба вещества, исследуемого масс- спектрометрически , не регенерируется и расходуется полностью. К сожалению, чувствительность ( S ) и разрешение
( R ) масс-спектрометров в классическом варианте обратно пропорциональны: R 1 / S .
Дисперсия по массе Dm - это то расстояние на коллекторе ионов (в мм.) , на которое отстоят друг от друга ионы ,отличающиеся по массе на 1 %.
Важной характеристикой при анализе смесей является “динамический диапазон”. Динамический диапазон в 10 порядков означает, что что примесь в пробе будет обнаружена даже если она составляет 10 мг.всего на 10 тонн основного образца.
"Сердцем" любого масс-спектрометра является его ионный источник. Для создания пучка заряженных частиц используются различные способы ионизации: ионизация электронами определенной энергии(метод электронного удара - ”ЭУ ” ), поверхностная ионизация (ионизация при десорбции исследуемого вещества с нагретой поверхности металлов), метод фото ионизации (A + hv = A+ + e - ), химическая ионизация (ХИ), ионизация в сильном электрическом поле ( полевая ионизация) , ионизация лазером и др.
Метод электронного удара (ЭУ) является исторически первым и к
настоящему времени этим методом ионизации получено громадное количество масс-спектров соединений различных классов, что позволило создать каталоги, компьютерные базы данных масс-спектров. При ионизации методом ЭУ молекулы исследуемого вещества в условиях глубокого вакуума облучаются пучком электронов, имеющих энергию 50-100 эВ, что намного превышает величину энергии , необходимой для ионизации одной из самых “ стойких” органических молекул CH4 (Е ион. = 13 эВ), что в свою очередь вызывает сильную фрагментацию молекул вещества. Поэтому масс-спектры, полученные методом электронного удара содержат большое число осколочных ионов, а сам метод ЭУ относится к “жестким “ способам ионизации.
Кроме молекулярных и осколочных ионов при ионизаии электронным ударом возможно образование метастабильных и перегруппировочных ионов, многозарядных ионов.
В качестве примера рассмотрим схему образования масс-спектра при
столкновении электронов ,обладающих энергией 50-100 эВ, с молекулами пропана С3H8 :
C3H8 + e- C3H8+ + 2e -
возбужденный непрочный
молекулярный ион

(Ii+ )распадается с образованием осколочных ионов C3H7+ , C3H6+, C2H5+, СH2+ и других, а в масс-спектре появляются не только ионы с m/e =47, но и с m/e = 43, 42,29, 14 и другие. Поэтому метод ионизации ЭУ приводит к появлению многолинейчатого масс-спектра, что часто вызывает затруднения при качественном и количественном анализе сложных смесей и идентификации веществ.
Из перечисленных методов лишь "химическая ионизация", "полевая ионизация" и "фотоионизация" являются "мягкими" методами ионизации - т.е. при использовании этих методов из молекул исследуемого вещества при их ионизации образуются в основном молекулярные ионы (ионы, масса которых практически совпадает с массой исследуемой молекулы), а число
осколочных ионов, получающихся при распаде молекулярных ионов обычно невелико - регистрируется малолинейчатый масс-спектр.
Рассмотрим несколько подробнее метод химической ионизации, который с момента своего возникновения в 1966 г. сразу стал широко использоваться при анализе сложных органических соединений, многокомпонентных систем , лекарственных препаратов различных фармакологических групп, как синтетических, так и растительного происхождения, биологических образцов.
Метод требует применение газов-реактантов, из которых методом электронного удара получают ионы-реагенты, которыми могут быть молекулярные и фрагментарные ионы, а также продукты их ионно-молекулярных реакций с молекулами газа-реактанта.
Например, если в качестве газа-реактанта мы возьмем метан CH4, то в результате электронной бомбардировки его молекул при давлении 1 мм.рт.ст. сначала образуются ионы по реакции ( 3)
e- + + +
 CH4 ( CH4 , CH3 , CH2 ) , ( 3 )
CH4 ( CH4 , CH3 , CH2 ) , ( 3 )а затем образовавшиеся ионы вступают в ион-молекулярные реакции с
молекулами газа реактанта по уравнениям типа (4),давая различные ионы-
реагенты.
+ +
CH3 + CH4 = C2H5 + H2 + ( 4 )
Образовавшийся ион-реагент C2H5 реагирует с молекулами исследуе-
мого образца ( М ) и ионизирует их в основном путем протонирования
+ +
M + C2H5 = MH +C2H4 , давая в масс-спектре пик с m/e= ( M+1).
Если,для примера,в качестве исследуемого вещества выбран пропан
C3H8 , то ион-молекулярная реакция + +
 С3H8 +С2H5 C3H9 +C2H4
С3H8 +С2H5 C3H9 +C2H4 вызовет появление в регистрируемом масс-спектре лишь одного иона с
m/e= 45. Относительная простота масс-спектров ,полученных методом химической ионизации и присутствие в масс-спектре квази-молекулярных ионов с m/e лишь на единицу отличающихся от m/e для “настоящего “ молекулярного иона послужило причиной особенно широкого применения этого метода ионизации для масс-спектрометрического анализа различных органических и биологических объектов, лекарственных препаратов.
Таблица 1.
Анализ соединений различных классов методом ХИ с разными газами-
реактантами.
| Г  аз-реактант аз-реактант | Анализируемые соединения | Газ-реактант | Анализируемые соединения |
| метан | алкалоиды опия, антибиотики, амины,аминокис- лоты,метаболиты хинина,барбиту-раты,липиды, спирты,митокси- ны, нитроалканы, стероиды и др. | водород | ароматические соединения,кара- тиноиды,пептиды, порфирины,cте- роидные кетоны. флавоноиды, гетероцикличес- кие соединения и др. |
| о  ксид азота ксид азота | героин,морфин, тропан,желчные кислоты и их производные, стероиды(тестос- терон,холестерин) и др. | инертные газы | декалины,тетра- гидропираны, производные ди- пептидов и др. |
Оказалось ,что специальный подбор газов-реактантов является наиболее плодотворным при получении информации о структуре и молекулярной
массе широкого круга соединений, поскольку характер масс-спектра ХИ
зависит от природы газа-реактанта.(табл.1).
Наряду с масс-спектрами положительных ионов в последние годы в методе ХИ широко исследуются и масс-спектры отрицательных ионов. Оказалось, что газ -реактант при взаимодействии с электронами наряду с образованием положительных ионов газа-реактанта образуются и отрицательные ионы газов-реактантов, применение которых в методе химической ионизации позволило значительно расширить круг изучаемых веществ, поскольку скорости образования отрицательных ионов cущественно выше, чем скорости образования положительных, а значит, при химической ионизации отрицательными ионами повышается и чувствительность.
Необходимым условием регистрации ионов и получения масс-спектра
является предварительное пространственное или временное разделение пучка ионов на отдельные компоненты, отличающиеся по величине m/e (m – масса иона, e- заряд иона).
Для магнитных статических масс-спектрометров, использующих магнитное поле H радиуса r и ускоряющие ионы разность потенциалов V , было получено
следующее важное выражение :
m/e = H2 r2 / 2 V (I)
Современные масс-спектрометры - это передовые научные и инженерные разработки, высокотехнологические вакуумные системы, лучшие конструкционные материалы, цифровая и аналоговая электроника, современные компьютерная техника, сложное программное обеспечение.
2. Хромато-масс-спектрометрия.
Дальнейшее развитие метод масс-спектрометрии получил, использовав хроматографический ввод вещества с помощью газового (ГХ) или жидкостного (ЖХ) хроматографов. Особенно широко такие исследования нащли свое применение в медико-биологических исследованиях
Хромато-масс-спектрометрия - метод анализа газовых смесей,
главным образом органических веществ, и определения следовых количеств
в объеме жидкости, широко используется при структурно- аналитических
исследованиях в органической химии, в медицине, в биохимии, в фармако-
логии,в исследованиях, связанных с сельским хозяйством и охраной
окружающей cреды. Без хромато-масс-спектрометрии сегодня уже немыслим
контроль за незаконным распространением наркотиков, криминалистический
и клинический анализ токсических препаратов, взрывчатых веществ.
Метод основан на комбинации двух самостоятельных методов:
 хроматография и масс-спектрометрия .
хроматография и масс-спектрометрия .(ГХ, ЖХ)
разделение смесей
на компоненты
идентификация и определение строе-
ния вещества, качественный и количественный анализ.
Принципиальная совместимость двух методов ( двух типов приборов) обусловлена тем, что в обоих случаях анализируемые вещества находятся в
газообразном состоянии, рабочие температурные интервалы перекрываются, пределы обнаружения( чувствительность) близки. Различие
состоит в том, что в ионном источнике масс-спектрометра должен поддер-живаться высокий вакуум ( 10 -5 - 10-6 Па),тогда как давление газовой сме-
си на выходе из хроматографической колонки составляет 10 -5 Па. Для
понижения давления используют “молекулярные сепараторы” , которые
одним концом соединяются с выходом из хроматографической колонки,а другим - с ионным источником масс-спектрометра ( рис. 4 ).
Принцип действия молекулярных сепараторов основан либо на разли-
чии в подвижностях молекул газа носителя и анализируемого вещества, вы-
ходящих из хроматографа, либо на их различной проницаемости через полупроницаемую мембрану. В серийных хромато-масс-спектральных приборах(хромасах) чаще применяют струйные (эжекторные) сепараторы, работающие по первому принципу. Молекулярные сепараторы удаляют из газового потока , выходящего из хроматографической колонки, основную часть газа носителя, а исследуемое вещество пропускают в масс-спектрометр.
1 2 3 4 5 6


Интерфейс
(струйный
сепаратор,
капил-
лярная
колонка)


масс-
анали-
затор

детектор (детектирование и усиление
сигнала)

компь-
ютер
газовый
хрома-
тограф
источник
ионов
МС






 (ионизация ЭУ, ХИ,
(ионизация ЭУ, ХИ,полевая иониз.)
ввод исследуе-
мого вещества
(раствор)


масс-фрагментограм-
ма
хроматограмма

масс-спектр
9 8 7
Рис.4. Принципиальная схема хромато-масс-спектрометра (ГХ-МС).
Кроме хромато-масс-спектрометрических систем, включающих газовые хроматографы,в настоящее время очень широко используются системы с жидкостными хроматографами ( ЖХ- МС), хотя практических трудностей соединения жидкостного хроматографа и масс-спектрометра значительно больше, чем в случае (ГХ- МС). Масс-спектрометр в приведенной схеме можно рассматривать как универсальный детектор к хроматографу.
Анализируемое вещество (обычно в виде раствора) вводится в испа-
ритель хроматографа, где мгновенно испаряется, а пары вещества в смеси с
газом носителем под давлением в несколько атмосфер поступают в хроматографическую колонку (1).Здесь происходит разделение смеси, и каждый компонент смеси в токе газа носителя по мере элюирования из колонки поступает в молекулярный сепаратор(2).В сепараторе газ-носитель в основном удаляется и газовый поток, обогащенный исследуемым веществом, поступает в ионный источник (3) масс-спектрометра . Исследуемое вещество должно быть термически стабильным (до температуры 250 o С), хроматографически подвижным и легко переходить в газовую фазу при температуре испарителя. Одновременно с записью хроматограммы в любой ее точке(обычно на вершине хроматографического пика) может быть зарегистрирован масс-спектр, позволяющий установить строение вещества, при этом масс-анализатор (4) должен обеспечивать регистрацию масс-спектра за время гораздо меньшее, чем выход хроматографического пика. В современных приборах, снабженных мощными компьютерами, построение хроматограмм, построение и обработка масс-спектров производится автоматически.
Чувствительность хромато-масс-спектрометрии (обычно 10-6 - 10-9 г.)
определяется чувствительностью детектора масс-спектрометра. Более чувст-
вительной ( 10-12 -10-15 г.) является масс-фрагментография (разновидность
метода хромато-масс-спектрометрии), в которой запись хроматограмм осуществляется не по полному ионному току, а по наиболее характерным для данного вещества ионам. Этот метод хромато- масс- спектрометрии
используется для поиска, идентификации и количественного анализа вещества с известным масс-спектром в составе сложной смеси, например, при
количественном определении следов такого вещества в больших объемах
биологических жидкостей (медицина, фармакология, токсикология, допинг-
контроль, биохимия ). Определение содержания холестерина в плазме человеческой крови может служить примером таких исследований.
3. Тандемная масс-спектрометрия ТМС (системы МС-МС).
Несмотря на огромную информативность масс-спектрометрии, особенно в сочетании с хроматографией, селективность этих методов нередко оказывается недостаточной для определения структуры сложных органических молекул и состава смесей с большим числом компонентов , имеющих близкие характеристики. Информативность масс-спектральных
исследований значительно повышается при сочетании двух или нескольких
масс-спектрометров. В этом случае удается создавать двух стадийные масс-спектральные системы, в которых первая стадия используется для выбора определенных ионов, которые образовались при ионизации, а вторая стадия – для анализа характеристических ионов, которые удалось получить из выделенных на первой стадии. Чувствительность анализа при этом сохраняются, а скорость анализа существенно увеличивается по сравнению с обычный одностадийной масс-спектрометрией. В методе МС-МС значительно улучшается характеристика сигнал/шум, появляется возможность менять разрешение на различных стадиях . Тандемная масс-спектрометрия позволяет : определять структуру больших органических молекул, анализировать сложные смеси органических веществ, изучать химию ионов, проводить прямые измерения времен жизни ионов. ТМС позволяет проводить анализ нескольких сотен сотен соединений в микроколичествах биологического материала. Сегодня в мировой практике здравоохранения ТМС широко используется для проведения массового скрининга новорожденных на наследственные болезни (НБО): в пятне высушенной крови возможно определение аминокислот и ацилкарнитинов. Количественное определение этих веществ позволяет исключить несколько десятков наследственных заболеваний, относящихся к различным классам НВО.
Постоянно растет число работ, где система МС-МС используется совместно с другими методами. Так, недавно опубликованы результаты применения комплекса ЖХ -МС- МС для изучения фармокинетических параметров (адсорбция/проницаемость, объем распространения в организме), которые являются определяющими факторами при обнаружении следов наркотиков.
4. Качественный и количественный анализ.
Масс-спектрометрия традиционно широко применяется для качественного и количественного анализа сложных углеводородных смесей, содержащих большое число близких по составу компонентов. Применение оптических методов анализа сложных углеводородных смесей ( ИК и УФ-спектроскопия) обычно очень затруднено для смесей , имеющих в своем составе более 5 компонент. Обычно в таких случаях прибегали к к низкотемпературной перегонке смеси или к перегонке при высоком давлении. Однако, путем дробной перегонки удается хорошо разделить смесь только при достаточном различии температур кипения компонентов смеси. Ускорить процесс разгонки нельзя , а для проведения полного химического анализа могут потребоваться
многие часы.
Разработанные масс-спектральные методики и современная компьютерная техника позволили в несколько раз сократить время анализа практически без потерь в точности, что дает возможность использовать масс-спектрометры для непрерывного контроля качества продукции в нефтяной
и нефтегазовой отраслях промышленности.
Искровая масс-спектрометрия, масс-спектрометрия вторичных ионов и особенно лазерная масс-спектрометрия успешно используются для качественного и количественного анализа различных твердых образцов, что сделало эти методы особенно востребованными как в микроэлектронной промышленности , так и при особо точных анализах табачных изделий, продовольственных товаров, образцов биологического происхождения (образцы для таких исследований готовятся по специальным методикам). Эти методы различаются не только способами ионизации, аппаратурным оформлением,но и и своими характеристиками (табл.2 ).
Табл.2
Сравнительные характеристики масс-спектрометримеских методов анализа твердых образцов.
| Тип масс-спектрометрии | Чувствительность | Вид анализа | Возможно- -сти послойного анализа | Условия проведения количеств. анализа |
| Искровая | Абсолютная чувствительность на уровне 10-11-10-12 г. | Элементный | Затруднен, т.к. глубина кратеров на поверх. электродов много меньше их диаметра. | Необходимо предварит. определение КОЧ |
| Лазерная | Позволяет Обнаруживать содержание микропримесей на уровне 10-19 г. | Элементный | Принцип. возможен с разрешением по глубине 0,2 мк | Нет необходимости Нахождения КОЧ |
| Вторичная ионная масс- спектрометрия | Позволяет регистрировать до 10-4 монослоя молекул адсорбата на поверхности | Элементный, Но в масс- спектрах оксидов и других сложных сое- динений обнаружены более сложные ионы (Ag2O+,Ag2+ и.т.д.) | Возможен с разрешен. по глубине 50 ангстрем | Необходимо предварит. определение КОЧ |
Особое распространение лазернойй масс-спектрометрии связано с тем обстоятельством, что в условиях воздействия лазерного луча на образец происходит 100% ионизация и диссоциация всех соединений, а поэтому исчезает необходимость предварительного определения КОЧ (коэффициент относительной чувствительности ) при проведении количественных анализов.
5. Применение методов масс-спектрометрии в высокотемпературной химии.
К настоящему времени хорошо известно, что в насыщенном паре над конденсированной фазой разного состава: простые вещества, оксиды, галогениды металлов ,бинарные и тройные системы ( например, пар над твердыми Ag, S, LiF, Al F3 , CuCl, газовая фаза над системами LiF- Al F3 , NaF-Zr4, Bi-Sb-O и др.) наряду с простейшими газовыми молекулами, часто присутствуют более сложные многоатомные ассоциаты, имеющие сложное строение- Ag2, S8, (LiF)2 , (LiF)3, , (Al F3 ) 2 , (CuCl)6 , NaAlF4 , ( NaAlF4 )2 и др.
Сложный молекулярный состав пара позволяет с использованием статических методов определения давления пара определить лишь величину общего давления пара над системой (без учета многообразия газовых ассоциатов) , а с использованием эффузионных камер Кнудсена и уравнения Клаузиуса-Клапейрона рассчитать лишь брутто характер процессов испарения.
Высокотемпературная масс-спектрометрия – это динамический метод , сочетающий масс-спектрометрический анализ газовой фазы с классическим эффузионным методом Кнудсена. Метод позволяет одновременно определять качественный состав газовой фазы, величины парциальных давлений всех компонентов газовой фазы в зависимости от температуры и состава конденсированной фазы. Кроме того достаточно легко определяются термодинамические характеристики систем и реакций с участием газовой и конденсированных фаз. В методе используются эффузионные камеры Кнудсена различных типов.
Экспериментально измеряемая интенсивность ионного тока I связана с равновесным парциальным давлением P , устанавливающемся в эффузионной камере , соотношением:
Pj = к приб./σj * T ∑I ij = Kj T Ij (II) ,
i
где: Pj - парциальное давление j молекул в эффузионной камере,
I ij - интенсивность i –х ионов , образовавшихся из j- х молекул ,
Т – температура эффузионной камеры (0К),
σj - сечение ионизации j- х молекулы,
к приб - коэффициент чувствительности прибора.
Из уравнения (II) видно, что для решения основных задач высокотемпературной масс-спектрометрии исследователю необходимо:
- произвести расшифровку экспериментального масс-спектра , т.е. выделить из общей интенсивности ионного тока с определенным значением (m/e) доли ионного тока, принадлежащие отдельным молекулам,
- определить коэффициенты чувствительности Kj ,
- решить задачу измерения и стабилизации температуры эффузионной ячейки(камеры). Разработанные в рамках метода высокотемпературной масс-спектрометрии методики позволяют решать все указанные выше вопросы. Например, проблему расшифровки масс-спектра можно решить применяя зффузионные камеры разных типов и конструкций (простые, двойные, сдвоенные и.т.д.), изготовленных из различных конструкционных материалов.
Рассмотрим следующий пример: в насыщенном паре над конденсированной системой NaF-AlF3 при Т= 1100 К содержатся молекулы NaF, Na2F2, NaAlF4 , которые при диссоциативной ионизации методом электронного удара образуют осколочные ионы Na+ с m/e= 23 так, что регистрируемая в масс-спектре интенсивность ионов Na+ является суммарной величиной:
INa+ = INa+ (NaF) + INa+ (Na2F2 ) + INa+( NaAlF4 ) .
Если произведена расшифровка экспериментального масс-спектра, то можем записать:
PNaF = k Na+(NaF) I Na+(NaF) T
PNa2F2 = k(Na+ (Na2F2 ) I Na+(Na2F2) T ( III)
PNaAlF4 = k Na+( NaAlF4) I Na+( NaAlF4) T
Образование газовых молекул NaF и Na2F2 в эффузионной камере вызвано протеканием гетерогенных реакций :
NaFТВ = NaFгаз ( i ) с KP (i) = P NaFгаз
2 NaFТВ = Na2F2 ( газ) ( ii ) с KP (ii) = P Na2F2
Выражения для KP (i) и KP (ii) с учетом ( III) можем переписать в следующем виде :
KP (i) = k Na+(NaF) I Na+(NaF) T = const1 I Na+(NaF) T (IV)
KP (ii) = k(Na+ (Na2F2 ) I Na+(Na2F2) T =const2 I Na+(Na2F2) T ( V )
Согласно уравнению изобары Вант-Гоффа
d lnKp/d(1/T) = - ∆ H реакц./R (VI ) ,
зная абсолютные величины KP (i) и KP (ii) при нескольких температурах , легко можно определить теплоты сублимации NaFгаз и Na2F2 ( газ) по реакциям (i) и (ii) . Метод масс-спектрометрии позволяет проводить определение теплот реакций без определения абсолютных величин их КP . Из уравнений (IV) следует, что:
KP (i) I Na+(NaF) T
KP (ii) I Na+(Na2F2) T .
Построив графическую зависимость ln I Na+(NaF) T = f (1/T),
получим теплоту сублимации молекул NaF , а из зависимости ln I Na+(Na2F2) T = f (1/T) – теплоту сублимации молекул Na2F2 (рис.5) . Комбинацией теплот сублимации NaF и Na2F2 легко получить энтальпию диссоциации газовой молекулы Na2F2 на газовые молекулы NaF . Таким же образом масс-спектрометрически можно определить энтальпии (теплоты) различных гетерогенных и гомогенных реакций зная только величины соответствующих ионных токов при разных температурах, но без предварительного определения абсолютных значений констант равновесия. Последнее обстоятельство значительно облегчает получение термодинамических характеристик систем, включающих конденсированную и газовую фазы.
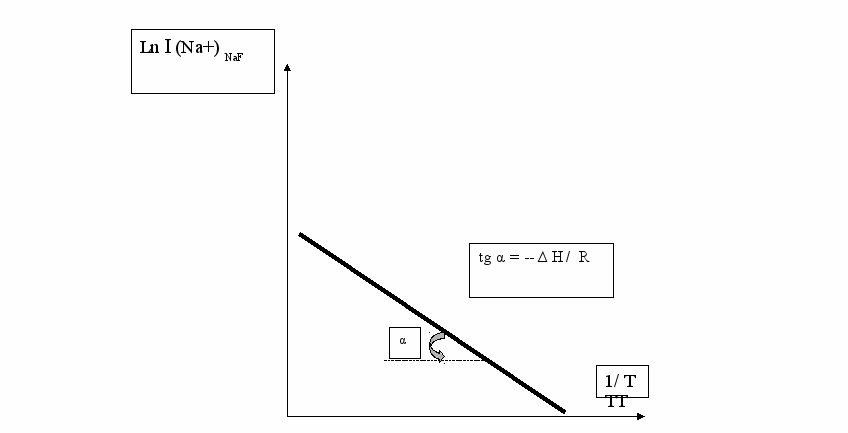
Рис.5 Схема определения ∆ H сублимации молекул NaF.
6. Применение в органической химии.
Масс-спектрометрия уже давно широко используется в органической химии для установления структур неизвестных соединений, используя найденные экспериментально корреляции между молекулярными структурами и масс-спектрами.Теоретическое предсказание масс-спектров затруднено даже для очень простых соединений.
 Масс-спектрометрическое определение структур органических соединений основано на предположении, что структура положительного молекулярного иона не отличается от структуры нейтральной молекулы. Схема такого определения: 1. Определение точной массы молекулярного иона или области масс молекулярного иона (для этого необходимо иметь масс-спектрометры с хорошим разрешением R ), что позволяет определить молекулярную формулу исследуемого соединения. Если интенсивность молекулярных ионов крайне мала обычно выполняют процедуру модификации масс-спектра (повторное получение масс-спектра того же соединения с помощью другого способа ионизации). 2. Анализ полученного масс-спектра с использованием ряда эмпирических закономерностей образования масс-спектров, полученных для различных классов соединений, что позволяет отнести исследуемое соединение к тому или иному классу. 3. Выделение главных осколочных ионов, что ,после установления молекулярной формулы , поможет определить основные направления фрагментации при ионизации. Больщую помощь на данном этапе может оказать обнаружение метастабильных, перегруппировочных и многозарядных ионов. Определив точный молекулярный вес, класс соединения, главные особенности его фрагментации, можно сделать определенные структурные отнесения. На этом этапе очень важно логическое использование имеющейся информации по ИК,УФ и ЯМР спектрам исследуемого соединения, что ,во-первых, даст новую информацию (о насыщенности молекул, о числе протонов и.т.д.) , а также помогает избежать ошибочных выводов.
Масс-спектрометрическое определение структур органических соединений основано на предположении, что структура положительного молекулярного иона не отличается от структуры нейтральной молекулы. Схема такого определения: 1. Определение точной массы молекулярного иона или области масс молекулярного иона (для этого необходимо иметь масс-спектрометры с хорошим разрешением R ), что позволяет определить молекулярную формулу исследуемого соединения. Если интенсивность молекулярных ионов крайне мала обычно выполняют процедуру модификации масс-спектра (повторное получение масс-спектра того же соединения с помощью другого способа ионизации). 2. Анализ полученного масс-спектра с использованием ряда эмпирических закономерностей образования масс-спектров, полученных для различных классов соединений, что позволяет отнести исследуемое соединение к тому или иному классу. 3. Выделение главных осколочных ионов, что ,после установления молекулярной формулы , поможет определить основные направления фрагментации при ионизации. Больщую помощь на данном этапе может оказать обнаружение метастабильных, перегруппировочных и многозарядных ионов. Определив точный молекулярный вес, класс соединения, главные особенности его фрагментации, можно сделать определенные структурные отнесения. На этом этапе очень важно логическое использование имеющейся информации по ИК,УФ и ЯМР спектрам исследуемого соединения, что ,во-первых, даст новую информацию (о насыщенности молекул, о числе протонов и.т.д.) , а также помогает избежать ошибочных выводов.7. Изотопный анализ.
Известно, что большинство элементов имеют целый набор стабильных изотопов (см.приложение 1).Поскольку массы изотопов отличаются, а в масс-спектре измеряются величины m/e , то естественно , что метод масс-спектрометрии стал самым удобным методом для определения изотопного состава образцов. В свою очередь информация по изотопному составу помогает идентифицировать органические соединения и позволяет дать ответы на ряд вопросов, начиная от определения возраста горных пород до обнаружения фальсификатов многих продуктов и установления места происхождения товаров и сырья. Для проведения изотопного анализа обычно используются специально сконструированные масс-спектрометры .
Масс-спектрометрическое изучение радиоактивных изотопов дает возможность идентифицировать носителя определенного излучения по массе, найти ядерные характеристики для отдельных изотопов (сечения реакций, энергии реакций, а в отдельных случаях- период полураспада).
8. Примерный перечень вопросов для самоконтроля при подготовке к контрольным работам по курсу “ Масс-спектрометрия и резонансные методы” -
