Подготовка научных кадров по физико-химической биологии и биотехнологии
| Вид материала | Документы |
- Институт пищевой биотехнологии и геномики Национальной академии наук Украины, 2342.88kb.
- Рабочая программа по дисциплине Аналитическая химия и физико-химические методы анализа, 414.04kb.
- Курсовой или дипломной работы в отделе эволюционной биохимии нии физико-химической, 15.25kb.
- Образовательный стандарт специальность: 170500 [240801] «Машины и аппараты химических, 187.74kb.
- 2005 –№41 Рубрика: Проблемы подготовки, сохранения и развития кадров российской науки, 99kb.
- Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии, 481.05kb.
- Решение этих проблем непосредственно связано с изучением цитоэмбриологических, физиологических, 271.54kb.
- Основанное на научных исследованиях воспроизводство научных и педагогических кадров,, 229.69kb.
- Рабочая программа дисциплины компьютерные моделирующие системы в химической технологии, 239.63kb.
- Вопросы к зачету по курсу "Основы биотехнологии", 27.24kb.
Исследование пространственной структуры и динамики липид-транспортирующего белка чечевицы (Lc-LTP2) в водном растворе и в комплексе с липидами.
Липидтранспортирующий белок Lc-LTP2 из проросших семян чечевицы Lens culinaris состоит из 93 аминокислотных остатков и имеет аминокислотную последовательность: AISCGAVTSDLSPCLTYLTGGPGPSPQCCGGVKKLLAAANTTPDRQAACNCLKSAAGSITKLNTNNAAALPGKCGVNIPYKISTTTNCNTVKF
Пептид содержит в своем составе 7 остатков пролина, общий заряд молекулы +6, пространственная структура стабилизирована четырьмя дисульфидными связями (возможная схема замыкания I-VI, II-III, IV-VII, V-VIII). Рассчитанная пространственная структура представляет связку из 4-х α-спиралей, сформированных остатками Gly5- Leu18, Pro26- Ala37, Thr42- Lys53, Thr64- Cys74. Кроме того, в структуре на участках Ala55-Ser58 и Cys88-Thr90 наблюдаются отдельные витки 310-спирали, а на участке Cys74-Cys88 вблизи от С-концевого фрагмента молекулы находится длинная неупорядоченная петля. Пространственная структура связки из четырёх α-спиралей характерна для всех LTP первого семейства. В составе белка Lc-LTP2 присутствует большое количество гидрофобных остатков, которые обращены во внутреннюю сторону и формируют гидрофобный канал, проходящий через всю молекулу (Рис. 3). Первые три спирали амфифильны и параллельны этому каналу и ограничивают его с одной стороны, с другой стороны канал ограничен четвертой спиралью и С-концевой петлей. Аналогичные гидрофобные каналы наблюдаются в пространственных структурах всех белков семейства LTP. Именно эта гидрофобная полость служит сайтом связывания одиночных липидных молекул.
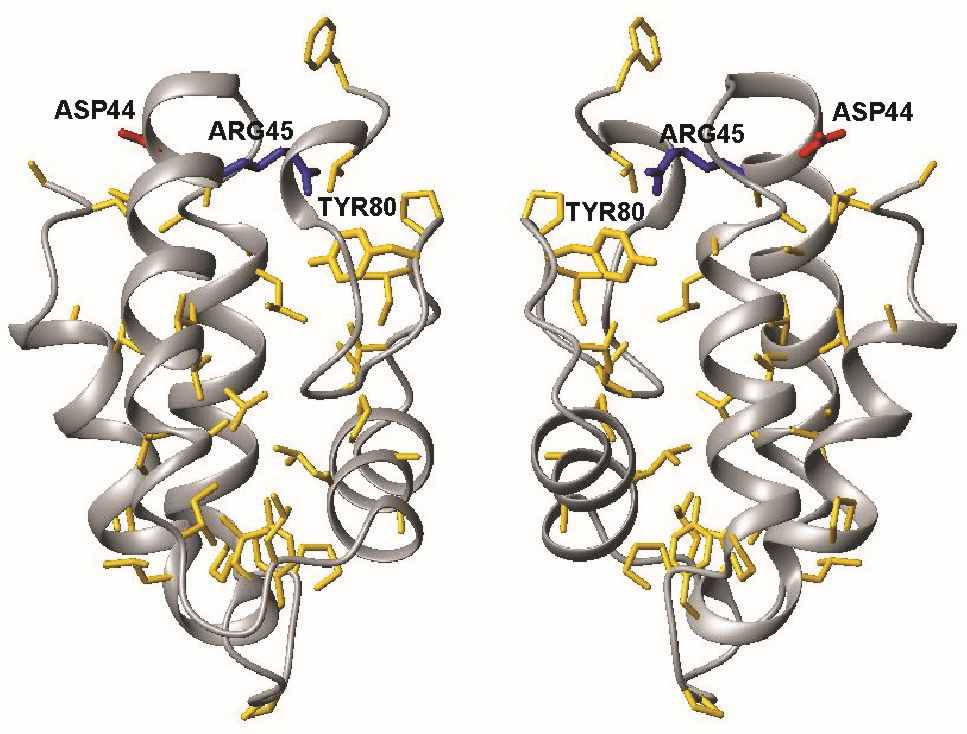 |
| Рис. 3. Распределение гидрофобных (выделены жёлтым цветом) остатков в молекуле Lc-LTP2. Серым цветом показана основная цепь белка. Жирными линиями и цветом показаны консервативные остатки. |
У входа в полость расположены консервативные остатки Tyr80 и Arg45. Согласно литературным данным, остаток Tyr80 образует водородные связи с полярной головкой связанного липида. Боковая цепь заряженного остатка Arg45 направлена внутрь канала. Этот остаток, возможно, отвечает за электростатическое взаимодействие с полярными головками липидов.
Анализ свойств поверхности Lc-LTP2 указывает на отсутствие явно выраженной амфифильности у молекулы белка. Действительно, поверхность молекулы Lc-LTP2 в основном гидрофильна, гидрофобные остатки находятся внутри и формируют канал для связывания липидов.
Для Lc-LTP2 было показано наличие двух конформаций молекулы в водном растворе, соотношение заселённостей двух конформеров составляет 1:2. Скорость реакции конформационного обмена 5,4±0,1 с-1, константа равновесия наблюдаемого процесса K=0,6±0,1 и изменение свободной энергии Гиббса, характеризующее конформационный переход ΔG0=-0,4±0,1 ккал/моль. Следует отметить, что среднее время жизни двух конформационных состояний Lc-LTP2, находящихся в состоянии обмена, составляет около 0,5 и 0,3 секунд. Наиболее сильные изменения химических сдвигов в процессе конформационного обмена наблюдаются у остатков из спиралей S2 и S3, и межспиральной шпильки S2-S3 (остатки 26-58), а также у нескольких остатков, чьи боковые цепи находятся в тесном контакте со спиралями S2 и S3. Возможно, наблюдаемый процесс конформационного обмена связан с изменением положения спиралей S2 и S3 относительно других участков белка, индуцированного цис-транс изомеризацией пептидной связи 42Thr-43Pro.
Lc-LTP2 эффективно связывает одну молекулу липида. Скорость реакции химического обмена Lc-LTP2/(Lc-LTP2/липид) составила 5 с-1, что говорит о высоком энергетическом барьере взаимодействия Lc-LTP2/липид. Взаимодействие с молекулой липида существенно стабилизирует структуру Lc-LTP2 с сохранением одной конформации. При связывании Lc-LTP2 с липидом сильнее всего изменяется структура С-концевой петли и α-спиралей S1-S3, формирующих «канал связывания» (рис. 3). Вторичная структура Lc-LTP2 при связывании с липидом практически не меняется. Существенные изменения вторичной структуры наблюдались только в петле S2-S3 (остатки 39-43), а также в начале спирали S1 удлинившейся на1 виток с N-конца.
6. Структурно-динамические модели белков высокой точности, верифицированные при помощи расширенного массива данных ЯМР-спектроскопии.
Основная цель проекта состояла в разработке алгоритма построения структурно-динамической модели белков высокой точности за счет совместного использования расширенного набора данных гетероядерной спектроскопии ЯМР и молекулярно-динамических траекторий. На данном этапе получена структурно-динамическая модель нейротоксина II. Для определения структурной составляющей модели была рассчитана структура 15N-,13C-меченного аналога NTII в растворе с помощью методов гетероядерной ЯМР-спектроскопии. При получении структуры были использованы современные методики нелинейного сэмплирования, криогенно охлаждаемые датчики, а также прямые экспериментальные данные о замыкании 15N-Н•••O=13C' водородных связей в молекуле белка. Полученный набор структурных данных ЯМР был интерпретирован в соответствии с экспериментальными данными о подвижности основной цепи (Т1, Т2 и гетероядерный ЯЭО), и данными о конформационном многообразии укладки основной и боковых цепей (на основе спин-спиновых констант 3JHN-Ha и 3JHa-H). Также с помощью оригинальной методики МД-проверки была обнаружена и скорректирована ошибочная интерпретация части ЯЭО кросс-пиков, не приводивших к взаимным разногласиям внутри экспериментального набора данных. Все это позволило получить структуру нейротоксина II в растворе высокой точности. Для определения динамической составляющей модели были рассчитаны МД-траектории белка с явно заданным растворителем в полноатомном силовом поле AMBER99sbILDN общей длиной 1 мкс. МД-траектории были верифицированы путем сравнения величин Т1, Т2, гетероядерного ЯЭО, а также спин-спиновых констант 3JHN-Ha и 3JHа-H, полученных экспериментально и рассчитанных из МД-траекторий. Получившиеся при сравнении высокие коэффициенты корреляции позволяют использовать МД-траектории как высокоточную динамическую составляющую модели.
Лаборатория оптической микроскопии и спектроскопии биомолекул
В исследованиях тирозин киназного рецептора эфринов EphA2 показано, что основные сигнальные события (гомоассоциация, и фосфорилирование) происходят преимущественно на плазматической мембране, а не в эндосомальных компартментах, как предполагалось некоторыми исследователями. Показан импульсный характер активации EphA2 лигандом с достижением максимума через 5 мин и снижением фосфорилирования до исходного уровня в течение 20 мин. Невозможность ре-активации ЕphA2 обеспечивается в значительной степени за счет интернализации рецептора. Показано, что в отсутствии лиганда степень фосфорилирования EphA2 и его локализация зависят от уровня экспрессии рецептора и активности клеточных фосфатаз.
Созданы клеточные линии со стабильной экспрессией химерных рецепторов EphA1-CFP и EphA1-YFP, а также с совместной экспрессией EphA2-CFP и EphA1-YFP, с помощью которых получены предварительные данные о возможности гетеродимеризации рецепторов EphA1 и EphA2 в клетках.
Создано 6 плазмид, содержащих ген EphA2-CFP с точечными заменами в трансмембранном домене рецептора, для изучения роли этого домена в функционировании EphA2 в клетках эукариот.
При изучении механизмов взаимодействия антимикробных пептидов латарцинов Ltc1, Ltc3a и Ltc5 с мембранными и внутриклеточными мишенями установлено, что в субтоксических концентрациях латарцины связываются с мембраной клеток промиелоцитарного лейкоза HL-60 и нормальных лейкоцитов человека и интернализуются без нарушения проницаемости плазмалеммы. Выявлены существенные отличия между латарцинами по локализации в клетках HL-60, что связано с отличиями в их структуре и, предположительно, в механизмах их интернализации.
Методами лазерной сканирующей конфокальной микроскопии (использование маркеров поляризации и проницаемости клеточных мембран, статистический анализ данных сканирующей цитометрии, регистрация индуктивно-резонансного переноса энергии) доказано, что основе бактерицидного эффекта Ltc5 в отношении S.aureus и R.equi лежит механизм необратимой пермеабилизации мембраны бактерий.
Показано, что разработанная нами ранее бактериальная клеточная тест-система обеспечивает направленный поиск лигандов к поровой части вольт-зависимых калиевых каналов Кv1.3 в цельных ядах пауков, скорпионов и жаб, а также в их фракциях на всех стадиях деления и очистки индивидуальных компонентов. (выполнено в сотрудничестве с лабораториями нейрорецепторов и нейрорегуляторов, молекулярной токсинологии и группы нанобиоинженерии ИБХ РАН). Хорошее совпадение измеренных нами констант диссоциации ряда известных лигандов Кv1.3 с опубликованными ранее данными подтверждает возможность высокоэффективного использования бактериальной клеточной тест-системы не только для поиска новых лигандов Кv1.3, но и для оценки их функционального потенциала.
Антимикробные пептиды природного происхождения (из бактерий, грибов, растений и животных): поиск, выделение, структурно-функциональное исследование и изучение взаимодействия с мембранами
Научно-образовательный центр (НОЦ) ИБХ РАН
На основе плазмид pET-31b(+) и pET-32a(+) и фрагментов ДНК, синтезированных с помощью ПЦР, получена конструкция pET-Acip1 для экспрессии рекомбинантного антимикробного пептида из лейкоцитов осетра Acipencer guldenstadti в клетках E. coli в составе гибридного белка, включающего тиоредоксин в качестве белка-носителя. Использование белка-носителя позволяет нейтрализовать токсичность целевого пептида для бактериальной клетки, а также предотвращает его быстрое расщепление внутриклеточными протеазами E. coli. Между последовательностями белка-носителя и целевого пептида был введен метиониновый кодон ATG, что позволило с помощью реакции расщепления гибридного белка бромцианом в кислой среде получить рекомбинантный пептид, идентичный природному. Для предотвращения фрагментации белка-носителя при обработке бромцианом внутренний остаток метионина в положении 37 с помощью направленного мутагенеза был заменен на остаток лейцина. Последовательность, кодирующая антимикробный пептид, была получена методом амплификации соответствующего участка геномной ДНК осетра с использованием ПЦР-праймеров №1 (gcgagatctgatccgatgtctggaaga-ggaaagactgg) и №2 (gcgaattcgcggatccttaatagaccggggctccag-cgc). Для обеспечения возможности металлохелатной очистки гибридного белка в его структуру был введен N-концевой фрагмент из восьми остатков гистидина. Размер плазмиды составил 5912 п.о., размер кодируемого гибридного белка – 175 аминокислотных остатков (18,9 кДа). Конструкция pET-Acip1 предназначена для экспрессии в штамме E. coli BL21(DE3) и аналогичных штаммах, содержащих ген РНК-полимеразы фага T7. Экспрессия протекает под контролем промотора T7lac; индуктором может служить лактоза или ее синтетические аналоги, например, изопропил-β-D-1-тиогалактопиранозид (ИПТГ). Открытая рамка считывания завершается стоп-кодоном TAA, а транскрибируемая область ограничивается терминатором транскрипции фага T7. Плазмида несет ген β-лактамазы, придающий клетке устойчивость к ампициллину (до 500 мкг/мл) и дополнительный ген lac-репрессора. Необходимые нуклеотидные последовательности были получены химико-ферментативным путем с использованием ПЦР, реакций рестрикции и лигирования. Клонирование промежуточных фрагментов ДНК проводили в клетках E. сoli штамма DH-10B. Первичный отбор клонов, содержащих нужную плазмиду, осуществляли методом «ПЦР с клонов». Окончательное строение плазмиды, содержащей требуемый фрагмент, подтверждали определением нуклеотидной последовательности секвенированием по Сэнгеру. Минипрепаративное выделение плазмиды проводили с помощью наборов реактивов и микроколонок Promega и Zymo Research. Для наработки плазмидной ДНК использовали штамм E. coli DH-10B (RecA–).
Плазмидная конструкция pET-Trx-LcLTP3 для экспрессии рекомбинантного липид-транспортирующего белка Lc-LTP3 из чечевицы Lens culinaris была создана на основе BamHI-EcoRI фрагмента плазмиды pET-His8-Trx длиной 5736 п.н. и синтезированного с помощью ПЦР фрагмента ДНК, кодирующего липид-транспортирующий белок. Экпрессирующая плазмида pET-His8-Trx была получена ранее в НОЦ ИБХ путем лигирования BglII-XhoI фрагмента плазмиды pET-31b (Novagen) с фрагментом, содержащим промотор Т7, lac-оператор, сайт инициации трансляции и последовательность, кодирующую N-концевой гистидиновый октамер и тиоредоксин. В составе исходной плазмиды содержались гены устойчивости к ампициллину и белка-репрессора лактозного оперона, а также сайт инициации репликации плазмиды pBR322. Последовательность, кодирующая Lc-LTP3, была получена методом амплификации соответствующего участка кДНК чечевицы с использованием ген-специфичных ПЦР-праймеров, несущих сайты рестрикции в 5’-концевых областях. Размер плазмиды составил 6043 п.н., размер кодируемого гибридного белка – 218 аминокислотных остатков (22,8 кДа). Конструкция pET-Trx-LcLTP3 предназначена для трансформации штаммов E. coli BL21(DE3), способных к индуцибельной экспрессии гена РНК-полимеразы фага T7. Для выделения и очистки суммарной РНК чечевицы использовали набор реактивов «SV Total RNA Isolation System» (Promega). Очищенную суммарную РНК элюировали деионизированной водой, не содержащей нуклеаз. РНК переосаждали 95% этанолом в присутствии подкисленного ацетата натрия (pH 4,5) и перерастворяли в воде. Одноцепочечную кДНК получали с помощью обратной транскриптазы RevertAid (Fermentas), используя для инициации синтеза адаптерный oligo-dT праймер (AAGCAGTGGTATCAACGCAGAGTAC(T)30VN). По окончании реакции объем смеси доводили водой до 200 мкл, затем инактивировали фермент нагреванием (5 мин при 80˚С). Синтез фрагмента ДНК, кодирующего Lc-LTP3, осуществляли с помощью полугнездовой ПЦР с использованием ДНК-полимеразы «Taq Advantage II» (Clontech). Продукты реакции подвергли экстракции: сначала равным объемом смеси фенол-хлороформ (1:1, pH 8,0), а затем хлороформом. Очищенную от белков ДНК осаждали добавлением 95% этанола и перерастворяли в деионизированной воде. После этого проводили рестрикцию фрагмента рестриктазами EcoRI и BglII с образованием липких концов. Продукты реакции разделяли в 1,5% агарозном геле, после чего фрагмент длиной около 300 п.н. очищали с помощью набора «Zymoclean Gel DNA Recovery Kit» (Zymo Research). Фрагмент плазмиды pET-His8-Trx длиной 5736 п.н. был получен путем обработки раствора плазмиды эндонуклеазами рестрикции BamHI и EcoRI. Продукты реакции разделяли в 0,8% агарозном геле и очищали указанным выше способом. Фрагменты векторной ДНК и вставки лигировали по стандартной методике. Лигазную смесь выдерживали в течение 24 ч при температуре 16°С и проводили электротрансформацию клеток E.coli DH-10B. Клеточную суспензию высевали на LB-агар с добавлением 50 мкг/мл ампициллина и инкубировали при 37°С в течение 16-20 ч. Полученные на селективной среде колонии анализировали с помощью ПЦР с ген-специфичными праймерами на вставку и праймерами T7-Forward и T7-Reverse на плазмидный остов. Клоны с плазмидой, содержащей вставку требуемой длины, пересевали в жидкую питательную среду LB с добавлением ампициллина и культивировали в течение 16 ч при 37°С с частотой перемешивания 220 об/мин. Клетки осаждали центрифугированием, после чего проводили выделение плазмидной ДНК с помощью набора «GenElute Plasmid Miniprep Kit» (Sigma) согласно инструкции производителя. Правильность сборки конструкции подтверждали секвенированием плазмидной ДНК с использованием праймеров T7-Forward и T7-Reverse. Секвенирование ДНК проводили с помощью набора реактивов ABI PRISM BigDye Terminator v.3.1 с последующим анализом продуктов реакции на автоматическом секвенаторе ДНК ABI PRISM 3100-Avant (Applied Biosystem).
Для получения рекомбинантного препептида лантибиотика LchA1 была разработана плазмидная конструкция, включающая в себя ген самого препептида, а также ген фермента LchM1, ответственного за образование специфических пострансляционных модификаций в структуре LchA1. В качестве основы для создания экспрессирующей плазмиды была выбрана плазмида pET-His8, полученная в НОЦ ИБХ путем лигирования BglII-XhoI фрагмента плазмиды pET-31b(+) (Novagen) с фрагментом, содержащим промотор фага Т7, lac-оператор, сайт инициации трансляции и последовательность, кодирующую N-концевой гистидиновый октамер. Полинуклеотидная вставка, кодирующая предшественник пептида LсhA1 а также фермент LchM1, получившая название «LchA1-LchM1», была встроена в экспрессирующую плазмиду по сайтам BamHI и XhoI в одной рамке считывания с гистидиновым октамером. Ввиду отсутствия в штамме-продуценте сигнальной пептидазы LchP, в ген гибридного белка был введен участок, кодирующий сайт расщепления фактором Xa – тетрапептид Ile-Glu-Gly-Arg, обеспечивающий возможность отделения октагистидиновой последовательности и сигнального пептида от последовательности зрелого пептида в процессе очистки. Создание генно-инженерной конструкции было осуществлено в несколько этапов. На первом этапе был амплифицирован участок гена lchA1, а в его последовательность введены сайт для расщепления рестриктазой BamHI и участок, кодирующий сайт расщепления фактором Xа. На втором этапе был получен фрагмент, содержащий полную последовательность гена lchA1 и 5’-концевую часть гена lchM1 (1569 п.н.). На третьем этапе была амплифицирована 3’-концевой часть гена lchM1 (1816 п.н.). На завершающем этапе на основе продуктов второго и третьего этапов был синтезирован фрагмент, содержащий полную нуклеотидную последовательность генов lchA1 и lchM1. Полученные на каждом этапе продукты фракционировали в агарозном геле, фрагменты требуемой длины выделяли с помощью набора «Zymoclean Gel DNA Recovery Kit» (Zymo Research). Экспрессирующая плазмида pET-His8 и ампликон «LсhA1-LchM1» были обработаны смесью рестриктаз BamHI и XhoI, после чего фрагменты были разделены методом электрофореза и выделены из агарозного геля. Целевая плазмида pET-His8-LсhA1-LchM была получена в результате лигирования двух указанных фрагментов. Продуктами лигазной реакции методом электропорации были трансформированы клетки E.coli DH-10B, после чего трансформанты были высеяны на чашки Петри с селективной средой. Выросшие колонии анализировали на наличие вставки требуемой длины с помощью ген-специфических праймеров на последовательность генов lchA1 и lchM1. Отобранные клоны подращивали на жидкой среде с ампициллином и выделяли плазмидную ДНК с помощью набора «GenElute Plasmid Miniprep Kit» (Sigma). Нуклеотидные последовательности вставок были просеквенированы по методу Сэнгера с использованием ген-специфических праймеров. Анализ результатов секвенирования конструкции «LchA1-LchM1» и сравнение их с геномной последовательностью штамма B. licheniformis ATCC14580 подтвердили правильность сборки конструкции, а также показали наличие в гене lchM1 семи нуклеотидных замен, которые, по предварительным оценкам, не должны влиять на активность модифицирующего фермента.
Ареницины из целомоцитов морского кольчатого червя Arenicola marina принадлежат к новому структурному семейству минидефенсинов. Arenicola marina относится к классу Polychaeta (многощетинковые) типа Annelida (кольчатые черви). Ареницины вырабатывается целомоцитами - фагоцитирующими клетками целома червя. Каждая из выделенных нами двух изоформ ареницина представляет собой немодифицированную полипептидную цепь, содержащую 21 аминокислотный остаток и стабилизированную одной дисульфидной связью, замыкающей цикл из 18 аминокислотных остатков. Определенная нами полная первичная структура зрелых ареницинов и генов их предшественников позволяет сделать вывод о выявлении нами оригинальных пептидов, не принадлежащих ни к одному из известных ранее классов антимикробных пептидов эндогенного происхождения. Оба пептида обладают антимикробной активностью в отношении грам-положительных и грам-отрицательных бактерий, а также дрожжевых грибков.
Проведен полный анализ флуктуаций проводимости, индуцируемых ареницином-1 и ареницином-2 в бислойных липидных мембранах, отвечающих по своему составу клеточным мембранам грамположительных и грамотрицательных бактерий. Выявлены виды флуктуаций, наиболее характерные для мембран обоих типов, определены их основные характеристики и рассчитаны наиболее вероятные размеры пор и каналов, образующихся в мембране под действием ареницинов. Эти данные, в комбинации с результатами изучения пространственного строения ареницина физико-химическими методами были использованы для построения структурной модели, описывающей молекулярные механизмы взаимодействия ареницинов с мембранами. Согласно этой модели, в основе антимикробной активности ареницинов лежит их способность к образованию тороидальных пор, формирующихся в мембране из двух, трех или четырех аренициновых димеров и липидных молекул.
Исследование терапевтического потенциала аналогов пептида дельта-сна в онкологии
Лаборатория химии пептидов
Осуществлен синтез пептида дельта-сна и нескольких аналогов высокой степени чистоты и в достаточном количестве для проведения экспериментов. Составлен литературный обзор о токсических побочных эффектах цитостатиков при их использовании в экспериментах и в клинике, где наибольшее внимание уделено цисплатину. Составлен подробный протокол проведения анализа модулирующего действия пептидов на фоне введения опытным животным цитостатика в острой дозе. Отобраны физиологические показатели, изменения которых предложено оценивать на основе экспериментальных данных, получаемых для животных контрольной и опытных групп. Определена максимально переносимая доза цисплатина, в которой цитостатик использован при проведении экспериментов.
Проведено изучение антитоксических свойств пептидов при внутрибрюшинном и внутривенном введении на фоне действия цисплатина. Проведенные опыты не выявили существенного антитоксического действия двух изучаемых пептидов семейства ДСИП при анализе некоторых характерных токсических эффектов цисплатина в условиях парентерального и внутривенного введения использованных доз пептидов. Изучаемые пептиды приводили к нормализации количества тромбоцитов и эритроцитов в крови и способствовали повышению репаративных процессов в печени и селезенке.
В модельных опытах по выявлению возможных кардиопротективных свойств пептидов семейства ДСИП в условиях, моделирующих кардиотоксичность цитоксичекого и хирургического лечения в онкологической практике, были получены достоверные данные о существенном кардиопротективном действии исследуемых пептидов.
В целом, проведенные опыты не позволили выявить существенное антитоксическое действие двух изучаемых пептидов семейства ДСИП при анализе ряда токсических эффектов цисплатина в условиях парентерального и внутривенного введения использованных доз пептидов и максимально переносимой дозы цисплатина, действие которой на испытуемых животных оказалось весьма умеренным, что затруднило оценку действия пептидов. В связи с этим представляется целесообразным оптимизировать протокол исследования антитоксического потенциала пептидов по способу введения пептидов и величине их доз и доз цитостатика, а также по спектру анализа вызываемых токсических эффектов. Представляется также продолжить изучение антигипоксических свойств пептидов этой группы в условиях экспериментальной ишемии сердца и мозга.
