Подготовка научных кадров по физико-химической биологии и биотехнологии
| Вид материала | Документы |
- Институт пищевой биотехнологии и геномики Национальной академии наук Украины, 2342.88kb.
- Рабочая программа по дисциплине Аналитическая химия и физико-химические методы анализа, 414.04kb.
- Курсовой или дипломной работы в отделе эволюционной биохимии нии физико-химической, 15.25kb.
- Образовательный стандарт специальность: 170500 [240801] «Машины и аппараты химических, 187.74kb.
- 2005 –№41 Рубрика: Проблемы подготовки, сохранения и развития кадров российской науки, 99kb.
- Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии, 481.05kb.
- Решение этих проблем непосредственно связано с изучением цитоэмбриологических, физиологических, 271.54kb.
- Основанное на научных исследованиях воспроизводство научных и педагогических кадров,, 229.69kb.
- Рабочая программа дисциплины компьютерные моделирующие системы в химической технологии, 239.63kb.
- Вопросы к зачету по курсу "Основы биотехнологии", 27.24kb.
Аспирантура ИБХ
Подготовка научных кадров высшей квалификации
В аспирантуре Института в отчетном 2011 году обучалось 78 аспирантов. До окончания срока отчислены по собственному желанию 5 человек. Окончили аспирантуру в 2011 году 14 человек, из них 4 успешно: досрочно защищены 4 диссертационные работы. Сдали успешно вступительные экзамены и зачислены в аспирантуру на бюджетные места 25 человек.
IX. Сведения о результатах, достигнутых за отчетный период по темам в рамках фундаментальных научных исследований, предусмотренных Планом Института к выполнению в 2011 г. (по направлениям)
Биология развития и эволюция живых систем (42)
Новые белки - регуляторы раннего развития головного мозга позвоночных.
Лаборатория молекулярных основ эмбриогенеза
Впервые выявлена способность секретируемых белков Noggin1 и Noggin2 ингибировать сигнальные каскады Activin/Nodal и Wnt. Ранее была известна только способность белков Noggin подавлять сигнальный каскад BMP. На модели эмбрионов шпорцевой лягушки показано, что необходимым условием развития переднего мозга является подавление белком Noggin2 сразу трех сигнальных каскадов: BMP, Activin/Nodal и Wnt. Ранее нами были идентифицированы два новых гомолога известного эмбрионального индуктора, секретируемого белка Noggin1, – Noggin2 и Noggin4. Было установлено, что Noggin2, экспрессируясь на ранних стадиях развития головного мозга, подавляет функционирование сразу трех сигнальных каскадов, BMP, Activin/Nodal и Wnt, в клетках зачатка переднего мозга. Таким образом, нами, во-первых, были выявлены новые свойства у белков семейства Noggin, а во-вторых, была установлена важная фундаментальная особенность механизма раннего развития мозга позвоночных, заключающаяся в том, что необходимым условием дифференцировки переднего отдела мозга является длительная изоляция его клеток в раннем эмбриогенезе от внешних инструктирующих сигналов, передаваемых тремя типами ростовых факторов: BMP, Activin/Nodal и Wnt.
Изучали влияние ингибирования трансляции мРНК Zyxin на экспрессию некоторых генных мишеней сигнального каскада Sonic hedgehog в клетках зачатка центральной нервной системы эмбриона шпорцевой лягушки. Также проводили эксперименты по выяснению молекулярного механизма ингибирования активности Shh-каскада белком Zyxin. В результате было установлено, что такое ингибирование основано на связывании Zyxin с эффектором Shh каскада – транскрипционным фактором Gli1. Эти данные были объединены с полученными прежде данными в рамках ответа рецензентам ранее подготовленной публикации. Выявление и изучение белков, взаимодействующих с Zyxin важно как для понимания связи процессов морфогенеза и дифференцировки в эмбриональном развитии, так и для возможного использования полученных данных в биомедицинских исследованиях, в связи с известной ролью Zyxin при метастазировании раковых клеток.
В рамках доработки публикации проводился анализ регуляторного каскада, связанного с функционированием малой ГТФазы Ras-dva1 в клетках эктодермы, окружающей головную часть нервной пластинки эмбриона шпорцевой лягушки. В результате были получены важные данные, подтверждающие активацию генов Xagr сигналом на основе фактора Fgf8, передающегося внутрь клетки при посредстве Ras-dva1.
Были начаты эксперименты по анализу экспрессии генов Xagr и Ras-dva при регенерации хвоста и задней конечности у головастиков шпорцевой лягушки. В рамках этих работ начато создание трансгенных линий лягушек, экспрессирующих зеленый и красный флюоресцентные белки под контролем генов Xagr2 и Ras-dva1.Получена линия трансгенных лягушек, экспрессирующая гибридный белок Agr1-TagRFP под контролем промотора Agr1. В дальнейшем мы планируем использовать эмбрионы этой линии для изучения роли Ras-dva1 в секреции белков Agr. Совместно с лабораторией биофотоники (ИБХ РАН) опубликована работа, в которой промотор гена Xagr2 был использован для создания трансгенных головастиков, экспрессирующих белок KillerRed в клетках присоски. В результате с помощью этой линии получены данные, подтверждающие важную роль клеток зачатка присоски в развитии зачатка головного мозга.
Молекулярный дизайн и синтез низкомолекулярных биологически активных соединений и их аналогов
Лаборатория органического синтеза
Продолжен поиск условий абиогенного синтеза аденозина/аденозинмонофосфта Наработаны образцы пяти замещенных аденинов - N1-метиладенина, N6-метиладенина, N1,6-диметиладенина, N9-метиладенина и N6,6-диметиладенина.
Разработка технологий получения трансгенных и нокаутных животных-биомоделей в соответствии с международными требованиями
Питомник лабораторных животных ФИБХ
Получена устойчивая линия нокаутных мышей (кодовое обозначение 6514), которая характеризуется заменой в своем геноме нормального цитохрома С «дикого типа» на мутантный цитохрома С (с инактивированной апоптотической функцией). Полученная модель позволяет изучать физиологические последствия инактивации цитохрома С в различных видах гематопоэтических клеток, поскольку цитохром С в эукариотической клетке, наряду с хорошо известными биохимическими функциями по переносу электронов, необходимыми для процессов клеточного дыхания, служит важным медиатором апоптотического каскада, а нарушения в механизмах апоптоза являются главной причиной развития и устойчивости раковых клеток к используемым на сегодняшний день препаратам.
Проведено успешное размораживание, культивирование и трансплантация доимплантационных эмбрионов линии MRS, хранившихся в криобанке НПП ПЛЖ на протяжении 6 месяцев, с последующим получением нормального приплода.
В криобанк НПП ПЛЖ на длительное хранение заложено 350 эмбрионов генномодифицированной линии мышей 6514, с возможностью проведения контрольного размораживания.
Впервые в России разработана и внедрена модель инфаркта миокарда у мышей, получаемая двумя способами: лигированием нисходящей ветви коронарной артерии и термокоагуляцией небольшого участка миокарда.
Исследование гомеотических генов, влияющих на морфологию соцветия сложноцветных на примере хризантем
Станция искусственного климата «Биотрон»
Высажены в теплицу 20 линий трансгенных растений хризантем с экспрессией гена CDM59,7 линий трансгенных хризантем с экспрессией гена CDM44, 10 линий с экспрессией гена CDM37, 6 линий с экспрессией гена CDM36. Все линии, включая нетрансгенные растения, высажены в 15 кратной повторности.
Отобран растительный материал и выделена ДНК и РНК на различных этапах вегетации и цветения для проведения молекулярно-биологического анализа. В настоящее время проводится анализ сроков цветения и фенотипических изменений трансгенных линий хризантем. Подтверждено опережение закладки бутонов, развития и цветения трансгенных линий хризантем с экспрессией генов ортологов APETALA1 хризантемы CDM111 и подсолнечника НАМ 92 и 75.
Экология организмов и сообществ (43)
Структура низкомолекулярных компонентов природного гуминового комплекса, отвечающих за фотохимическую деградацию поллютантов в окружающей среде и фитогормональную активность
Группа молекулярной экологии ФИБХ
С помощью многократно повторяющейся ультрафильтрации природной гуминовой кислоты (ГК) через мембрану с номинальным размером пор 5 кДа проведено исчерпывающее отделение низкомолекулярной флуоресцирующей фракции ГК от нефлуоресцирующей высокомолекулярной матрицы. Далее с помощью последовательной ультрафильтрации через мембраны 3 кДа и 1 кДа проведено ее разделение на фракции, обогащенные желтым и голубым флюорофором. С помощью высокоэффективной жидкостной хроматографии на колонках с обращенной фазой осуществлена дополнительная очистка флуорофоров и наработаны достаточные количества для их структурного анализа. Проведен структурный анализ полученных флуорофоров с помощью комплекса современных физико-химических методов
Структура и функции биомолекул и надмолекулярных комплексов (46)
Иммуноактивные синтетические фрагменты эндогенных и экзогенных белков для иммунопрофилактики, лечения и диагностики
Лаборатория синтетических вакцин
1.Синтезированы новые пептиды, способные оказывать иммунопротективное действие при экспериментально индуцированной болезни Альцгеймера
2.Осуществлен выбор и наработка противопептидных антител, выявляющих различные структурные формы опухолеассоциированных белков нуклеофозмина и сурвивина. Проведено изучение их диагностического потенциала
С целью повышения иммуногенной и протективной активности синтетического фрагмента (173-193) альфа-7 субъединицы ацетилхолинового рецептора синтезированы производные этого пептида и изучена их способность в свободном неконъюгированном виде стимулировать образование антител и восстанавливать пространственную память животных в животной модели болезни Альцгеймера. Выявлено патентоспособное соединение, проявившее наиболее высокую активность в перечисленных тестах. Анализ сывороток крови детей, перенесших черепно-мозговую травму, показал наличие антител к участку (173-193) альфа-7 субъединицы ацетилхолинового рецептора, уровень которых коррелирует с тяжестью травмы.
Показано, что антитела, полученные на синтетические фрагменты (19-36) и (283-294) нуклеофозмина селективно выявляют мономерные и олигомерные формы нуклеофозмина в различных линиях опухолевых клеток и выявляют нуклеофозмин различной клеточной локализации при цитохимическом анализе разных опухолевых линий клеток. Уникальные свойства антител продемонстрированы при изучении ФГА-стимулированной стимуляции лимфоцитов.
Показано, что антитела, направленные к различным участкам сурвивина, имеют различное сродство к белкам с молекулярными массами 17кД, 38кД и 40 кД, которые могут соответствовать мономеру и гомо- и гетеродимеру сурвивина. С помощью полученных антител проведен сравнительный анализ состояния нуклеофозмина в образцах опухолей молочной железы и мочевого пузыря.
Структура, динамика, механизмы действия и биологическая функция мембранных и мембрано-активных белков и пептидов.
Отдел структурной биологии
Лаборатория биомолекулярной ЯМР спектроскопии
1. Исследование пространственной структуры и внутримолекулярной динамики мембранных и мембрано-активных белков и пептидов в средах, имитирующих биологическую мембрану (мицеллах, бицеллах, нанодисках и липосомах):
- гомо- и гетеродимеры трансмембранных доменов рецепторных протеинкиназ;
ErbB- и FGFR- семейств тирозинкиназ и их патогенных мутантов;
- трансмембранный домен белка амилоидного предшественника APP, ассоциированного с развитием болезни Альцгеймера;
С помощью гетероядерной спектроскопии ЯМР, белковой инженерии, оптической спектроскопии и молекулярного моделирования, проведены исследования пространственной структуры и внутримолекулярной динамики гомодимеров трансмембранных доменов рецепторных тирозинкиназ (РТК) ErbB1, ErbB3, ErbB4, Val659Glu(Gln)-ErbB2 с онкогенной мутацией и FGFR3.
Разработан протокол экспрессии трансмембранного домена рецепторной тирозинкиназы ErbB1tmjm, белка из 54 аминокислотных остатков, несущего на C- конце часть прилегающего к мембране внутриклеточного домена. После оптимизации протокола очистки в течение года было наработано около 10 мг «холодного» белка и около 7 мг 15N-меченого и 7 мг 15N13C-меченого белка. Установлены пространственная структура трансмембранных фрагментов гомодимера ErbB1tm, экспериментально охарактеризована внутримолекулярная динамика исследуемых трансмембранных фрагментов и охарактеризована пространственная укладка его N-концевого фрагмента в пограничной области мембрана/раствор.
Показано на примере димеров ТМ спиралей РТК человека ErbB3 и ErbB4, что выбор мембранной среды не влияет на интерфейс взаимодействия между ТМ α-спиралями, но может локально изменять структуру спиралей и энергетику их взаимодействия. Контактная поверхность между α-спиралями, а также структурные детали взаимодействия практически не зависят от детергента, но существуют различия в кривизне спиралей, а также в термодинамической стабильности димера. Впервые измерены: свободная энергия димеризации, энергия активации димеризации, изменения энтальпии, энтропии и теплоемкости системы при димеризации ТМ α-спиралей. Полученные данные продемонстрировали существенный вклад энтропии системы во взаимодействия пары α-спиралей в мембраноподобных средах.
Разработан протокол экспрессии мутантного трансмембранного домена рецепторной тирозинкиназы ErbB2tm (Val659Glu). После оптимизации протокола очистки в течение года было наработано около 8 мг «холодного» белка и около 15 мг 15N-меченого и 10 мг 15N13C-меченого белка. Начаты структурно-динамические ЯМР-исследования ассоциации ТМ домена ErbB2 с проонкогенной аминокислотной заменой Val659Glu, получена структура мономера Val659Glu-ErbB2tm. В липидном окружении предположительно реализуется димерное состояние пептида Val659Glu-ErbB2tm, в то же время наблюдается локальный конформационный обмен в интерфейсе ассоциации ТМ альфа-спиралей. Определено, что Glu659 находится в липидном окружении и, видимо, участвует в межмономерном взаимодействии, образуя при этом разнообразные водородные связи, что и приводит к локальному конформационному обмену в интерфейсе димеризации (олигомеризации) Val659Glu-ErbB2tm.
Охарактеризованы структурные и динамические особенности димеризации трансмембранных сегментов рецептора фактора роста фибробластов 3 (FGFR3tm) в мембрано-имитирующем окружении. Спираль-спиральная димеризация происходит по гептадному (YA374X2L377X2G380X2FF384X2IL388X2A391X2TL395) мотиву с левозакрученной параллельной упаковкой с углом скрещивания 20° и расстоянием между спиралями ~9А. Центральная область димера характеризуется относительно плотной упаковкой, стабилизированной внутри- и межмолекулярным стекинговым взаимодействием ароматических колец (Y379–FF384–F386), N-концевой фрагмент трансмембранной спирали стабилизируется при формировании димера, что может быть связано с активацией рецептора. Экспериментально установленная конформация левозакрученного гомодимера FGFR3tm подразумевает, что три патогенных аминокислотных замены Tyr373Cys (проонкогенная мутация), Gly380Arg (ахондроплазия) и Ala391Glu (синдром Крузона, проонкогенная мутация) приходятся на димеризационный интерфейс, что указывает на значимый вклад специфического взаимодействия ТМ доменов в передачу сигнала РТК в норме и при патологиях организма.
Для изучения процессинга белка-предшественника амилоида, ассоциированного с болезнью Альцгеймера (ПБА) были созданы три экспрессионные конструкции, несущие гены трансмембранного домена ПБА, укороченного последовательно на 3, 6 и 9 аминокислот с С-конца по сайтам щепления ферментом гамма-сектретазой - APP685-714, APP685-720 и APP685-717. В настоящее время ведутся работы по оптимизации условий экспрессии в E.coli.
Для изучения конформационных изменений трансмембранной спирали белка-предшественника амилоида, ассоциированного с болезнью Альцгеймера (ПБА), сопряженных со связыванием ионов двухвалентных металлов, была создана экспрессионная конструкция, несущая ген APP671-726, имеющий сайт связывания металлов. В настоящее время ведутся работы по оптимизации условий экспрессии в E.coli.
Определена пространственная структура ТМ домена белка- предшественника амилоида APP (amyloid precursor protein) в среде, имитирующей мембранное окружение. Также были охарактеризованы структурно-динамические особенности димеризации ТМ сегментов АРР. Гомодимеризация АРР происходит по спираль-спиральному механизму по классическому гептадному мотиву (L705X2G709X3A713X2V717X2L720) с левозакрученной параллельной упаковкой. Плотная упаковка спиралей в гомодимере обеспечивается гидрофобным взаимодействием боковых групп по принципу «ключ в замок». N-концевой примембранный участок исследуемого пептида имеет повышенную подвижность по сравнению с ТМ сегметом и не образует упорядоченную вторичную структуру.
2. Исследование структуры и динамики вольт-сенсорного домена K+ канала KvAP в мицеллах детергентов с использованием спин-меченых аналогов домена. Исследование топологии комплекса вольт-сенсорный домен KvAP / токсин VSTX1.
Разработка методов применения нанодисков для исследования мембранных белков и мембраноактивных пептидов: исследование механизма взаимодействия VSTX1
с фрагментом мембраны нанодиска и с инкапсулированным в нанодиск вольт-сенсорным доменом KvAP.
KvAP – белок длиной 282 а.к. состоящий из 6 ТМ доменов. Два С-концевых домена S5 и S6 образуют пору канала, домены S1 – S4 являются вольт-сенсорами. Четвертичная структура KvAP представляет собой гомо-тетрамер. ВСД-KvAP представляет собой мономер массой 17 кДа, имеющий в своем составе четыре трансмембранные спирали. Разработан протокол ковалентного присоединения тиол-рективной спиновой метки (MTSL) к боковой цепи цистеина мутантных вариантов вольт-сенсорного домена KvAP. Показана возможность методом спиновых зондов измерять взаимное расположение и подвижность частей молекулы относительно друг друга: были показаны движения N-концевого участка молекулы относительно связки спиралей S1-S2.
Исследовано взаимодействие токсина VSTx1 c нанодисками различного состава и отдельно с их белковым компонентом (MSP). Оценена энергетика связывания токсина как с мембраной нанодиска, так и с белковым компонентом.
3. Изучение пространственной структуры G-Белок-сопряженных рецепторов методом спектроскопии ЯМР.
Получены аффинные сорбенты для изучения функциональной активности и выделения бета-2-адренергического рецептора. Для проведения функциональных тестов бета-2-адренергического рецептора был синтезирован алпренолол-цистаимин - лиганд рецептора, содержащий первичную амино группу. Аффинные сорбенты были получены присоединением алпренолол-цистаимна к карбокси-активированной агарозе и эпокси-сефарозе. Использование алпренолол-цистамина позволяет количественно контролировать присоединение лиганда к сорбенту.
4. Полноразмерные бактериородопсины (БР) из Halobacterium salinarium и Exiguobacterium sibiricum.
Произведен подбор условий для съемки ЯМР спектров высокого разрешения полноразмерного бактериородопсина Halobacterim salinarium. Образец полноразмерного бактериородопсина Halobacterim salinarium при концентрации 15мг/мл в отрицательно заряженных бицеллах DMPG:DHPC (0.4:1), соотношении белок:(липид+детергент) 1:200 и температуре 45°С стабилен в течение трех месяцев, что позволяет снимать ЯМР спектры и производить отнесение сигналов. Были приготовлены образцы бактериородопсина, в одном из которых видны только сигналы NH протонов трансмембранной части белка, в другом сигналы NH протонов, которые свободно обмениваются с водой, что позволило существенно уменьшить перекрытие сигналов в спектрах ЯМР. Произведено отнесение 60% сигналов бактериородопсина (142 из 236 аминокислотных остатков).
Подобраны условия получения 13C-15N-меченого бактериородопсина бактерий E. sibiricum на минимальных питательных средах, где в качестве источника углерода 13С, использовалась только меченая глюкоза. Сравнительно недавно был разработан новый высокочувствительный метод (динамическая поляризация ядер, DPN) ЯМР твердого тела, который в сочетании с вращением под магическим углом позволяет проводить структурные исследования белков. Для использования данного подхода образец должен находиться в среде глицерин:вода, 3:2, и концентрация белка должна составлять сотни мг/мл. В данных условиях был получен образец бактериородопсина психротолерантных бактерий E. sibiricum (ESR) в составе нанодисков различного состава и показано, что структура нанодисков и функциональность белка в этих условиях сохраняются.
5. Исследование структуры мембраноактивных пептидов. Исследование пространственной структуры, динамики и механизма действия антимикробных пептидов животного и растительного происхождения.
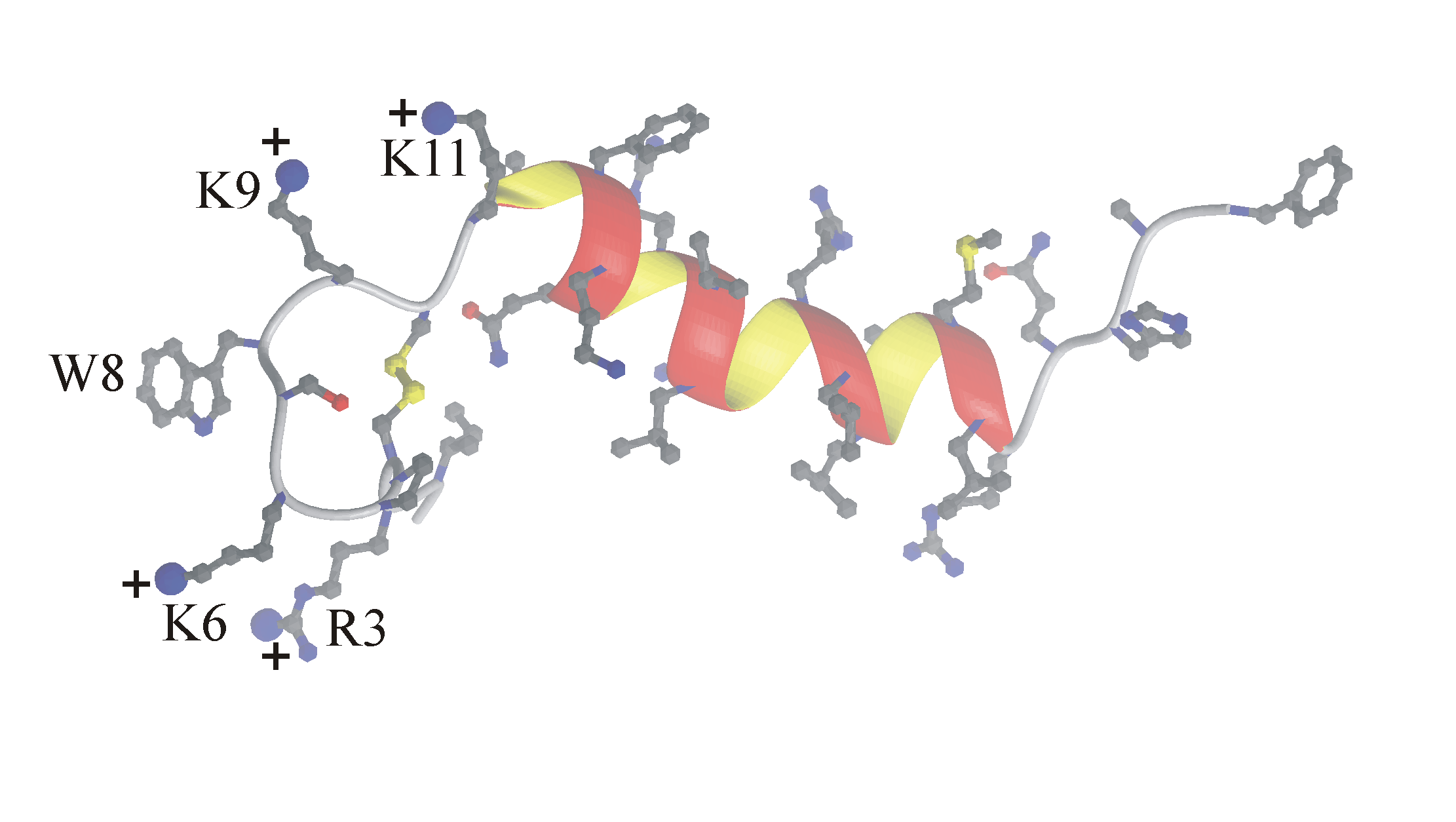 | Рис. 1. Пространственная структура Oxt4a в мицелле ДФХ по данным ЯМР в ленточном представлении. Боковые группы остатков, формирующих кластер положительных зарядов, отмечены знаком "+". |
Получена пространственная структура цитолитического пептида оксиопинина (Oxt4a) (30 а.о.) из яда паука Oxyopes takobius (Oxyopidae). В пептиде имеется одна дисульфидная связь (Cys4-Cys10), что является необычным для цитолитиков, которые либо не содержат их совсем, или их количество превышает 3. В растворе пептид представляет собой неупорядоченную структуру, а в мицелле ДФХ структура пептида состоит из двух частей: N-концевой петли (остатки 1-10), стабилизированной дисульфидной связью, где формируется кластер положительных зарядов, и альфа-спирали (остатки 12-25), соединённых гибким фрагментом (остатки 11-12) (Рис.1). Участки пептида (остатки 1-3, 26-30) разупорядочены. С учётом имеющихся данных об антибактериальной активности пептида сделан вывод о том, что он наиболее активен в отношении грам-отрицательных бактерий. Дестабилизация мембран этих бактерий пептидом Oxt4a происходит по механизму кластеризации заряда, согласно которому пептид создаёт фазовое разделение фосфолипидов, кластеризуя вокруг себя, главным образом, анионные компоненты. На границах областей мембраны с пептидом и без создаются дефекты, через которые протекают токи утечки, рассеивая трансмембранный потенциал. Наличие гибкого линкера пептида необходимо для его проникновения через липосахаридный слой грам-отрицательных бактерий.
Исследование пространственной структуры и динамики дефенсина Lc-def в водном растворе.
Пространственная структура дефенсина в воде представляет собой небольшую глобулу с одним α-спиральным участком (остатки 21-27) и тремя β-тяжами (остатки 2-6, 32-36 и 41-47). Вся структура стабилизирована 4-мя дисульфидными и 16-ю водородными связями между атомами основной цепи. Анализ свойств поверхности дефенсина указывает на отсутствие явно выраженной амфифильности у молекулы пептида, на поверхности не наблюдается протяженных гидрофобных регионов, положительно и отрицательно заряженные остатки распределены на поверхности пептида практически равномерно. Подобные свойства поверхности дефенсина Lc-def указывают на отсутствие у пептида мембранной активности. Тем не менее, небольшой положительный заряд поверхности пептида (общий заряд молекулы +2) может обуславливать слабое сродство молекулы дефенсина к мембранам, содержащим большое количество анионных липидов. Исследование взаимодействия дефенсина Lc-def с липидными везикулами различного состава подтверждает отсутствие выраженной мембранной активности у дефенсина Lc-def. Вероятно, антигрибковая активность этого пептида связана со специфическим взаимодействием пептид/мишень (мишени). При этом возможной мишенью для действия пептида являются специфические компоненты мембраны или клеточной стенки клеток грибов.
Были охарактеризованы, как общая вращательная диффузия молекулы дефенсина в растворе, так и внутримолекулярная динамика основной цепи пептида в двух диапазонах времен – в диапазоне быстрых движений (пико-наносекунды) и в диапазоне медленных конформационных флуктуаций (микро-милисекунды). Дефенсин Lc-def в водном окружении диффундирует изотропно и характерное эффективное время корреляции вращательных движений (τR) составляет около 2.18 нс. Полученное значение соответствует гидродинамическому радиусу 14.0 Å (при 300С) и согласуется с реориентацией мономера пептида в растворе (характерные размеры молекулы аурелина 31×26×22 Å). Остатки Leu6, Phe10, Lys11, Gly12, Arg34, Cys35, Arg36, Asp37, Asp38, Phe39, Trp42 и Cys43 участвуют в процессах конформационного обмена (с характерными временами микросекунды-миллисекунды (значения вклада обменных процессов в скорость R2 релаксации REX >30 Гц). Остатки, участвующие в процессах конформационного обмена, сосредоточены в одном регионе молекулы дефенсина. Этот регион содержит следующие пространственно сближенные участки: петлю, соединяющую первый β-тяж и α-спираль, N-концевой фрагмент α-спирали, а также петлю между вторым и третьим β-тяжами. Следует отметить, что «медленные» обменные процессы в микро-миллисекундном диапазоне времен часто наблюдаются на тех участках поверхности молекул, которые принимают участие в образовании надмолекулярных комплексов. Таким образом, вероятный сайт связывания молекулы дефенсина Lc-def с его мишенью(мишенями) формируется двумя петлевыми участками. Возможно, что наблюдаемые процессы конформационного обмена связаны с динамической изомеризацией двух пептидных связей Gly12-Pro13 и Ile15-Pro16 находящихся в петлевом участке соединяющем первый β-тяж и α-спираль.
-
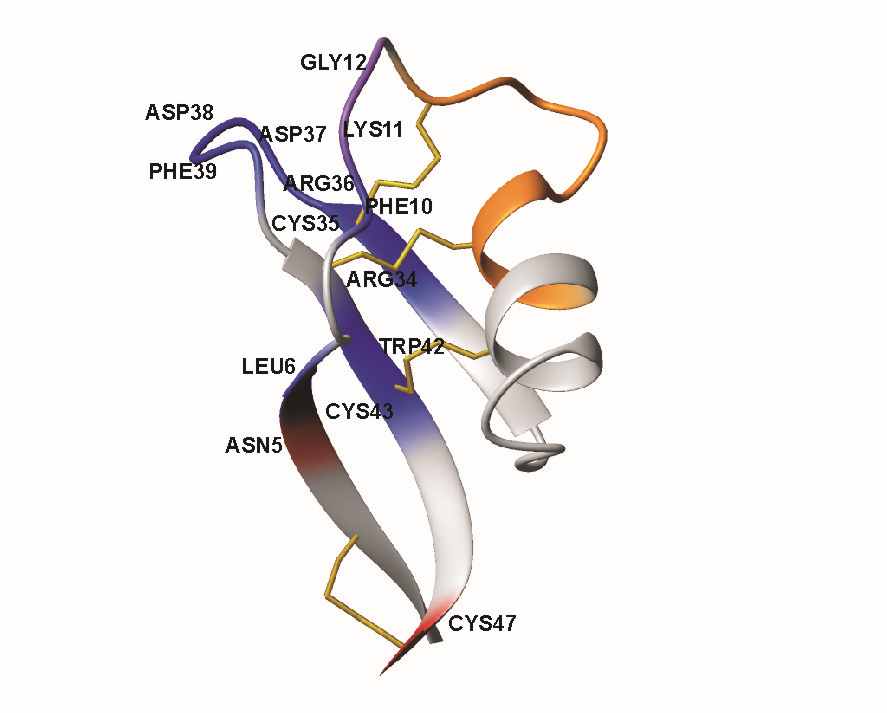
Рис.2. Структура дефенсина Lc-def в ленточном представлении. Красным цветом выделены остатки, совершающие движения в пико-субнаносекундном диапазоне времен, синим – остатки, участвующие в процессах конформационного обмена с характерными временами микросекунды-миллисекунды. Остатки Lys11 и Gly12, для которых характерно и то, и другое, выделены фиолетовым цветом. Оранжевым цветом отмечены остатки, сигналы которых значительно уширены, что не позволяет измерить 15N релаксационные данные. Уширение сигналов этих остатков также свидетельствует о процессах конформационного обмена с характерными временами микросекунды-миллисекунды
