Жизнь Марии Кюри вдохновила многих кинематографистов решение
| Вид материала | Решение |
- Ожизни Марии Склодовской-Кюри написано много замечательных книг, 45.43kb.
- №2: «Мария Склодовская – Кюри», 214.49kb.
- Марии Кюри – Склодовской, 8.44kb.
- Определение точки Кюри ферромагнетика методом Зилова-Ренкина, 39.71kb.
- Пьер Кюри и Мария Склодовская-Кюри, 46.42kb.
- Генеральная Ассамблея ООН объявила Международные годы 2011 года, 167.96kb.
- 2011 год в россии, 309.33kb.
- Сибирский независимый университет, 57.5kb.
- Информационное письмо, 59.81kb.
- Ортопедия, травматология и протезирование» 2009. N«4: 97-100 дискуссии, поиски, гипотезы, 99.12kb.
Фарфоровая химическая посуда
| Название | Применение | *Рисунок | |
| Чашки | Для смешивания, нагревания и выпаривания веществ. При выпаривании растворов сверху над фарфоровой чашкой закрепляют стеклянную воронку, чтобы избежать разбрызгивания кристаллов. | Вещества перемешивают с помощью шпателя или ложки. |  |
| Ступки и пестики | Для перемешивания, измельчения и перетирания твердых веществ. Нагревать нельзя! |  | |
| Шпатели и ложки | Для набирания и перемешивания сыпучих веществ и реактивов. |  | |
| Воронки | Для проведения фильтрования под вакуумом. | | |
| Тигли | Для прокаливания и высушивания осадков и твердых веществ. Этот процесс проводят в тигельных печах или на открытом пламени с использованием металлической сетки. |  | |
| Кружки (с ручками и без ручек) | Для сбора отходов реактивов. Как правило, не нагревают |  | |
Пластмассовая химическая посуда
(нагревать нельзя!)
| Название | Применение | *Рисунок |
| Мензурки |
|  |
| Воронки | Для переливания, смешивания и фильтрования растворов и жидкостей. |  |
| Ложки и совки | Для набирания сыпучих веществ и реактивов. | |
Металлическая химическая посуда
| Название | Применение | *Рисунок |
| Тигли | Для прокаливания и высушивания осадков и твердых веществ. Этот процесс проводят в тигельных печах или на открытом пламени. Перемешивают с помощью шпателя или ложки. |  |
| Ложки (особый вид – ложка для сжигания веществ). | Для набирания, перемешивания и измельчения твердых веществ. |  |
| Шпатели | Для набирания, перемешивания и измельчения твердых веществ. |  |
| Щипцы, пинцеты, корнцанги |
| 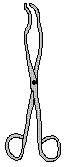  |
Химическое оборудование
Важнейшим химическим оборудованием являются штативы. Они бывают: деревянные, пластмассовые или металлические.
Деревянные и пластмассовые штативы предназначены для закрепления мелкой химической посуды (пробирок, воронок, палочек, шпателей и т.д.). Их также называют стойками или подставками.
Металлические лабораторные штативы предназначены для закрепления химической посуды, оборудования и приборов при выполнении химических экспериментов.
Металлический лабораторный штатив состоит из стержня и подставки, причём стержень должен быть до отказа ввинчен в подставку.
Закрепление на металлическом штативе различных видов химической посуды проводят с помощью деталей:
- зажимов с двумя винтами (муфтами);
- лапок – для закрепления пробирок;
- колбодержателей – для закрепления колб за горло;
- колец различных диаметров – для закрепления колб, стаканов, фарфоровых чашек и тиглей;
- металлических сеток – для закрепления плоскодонной посуды;
- фарфоровых треугольников – для закрепления тиглей.
1
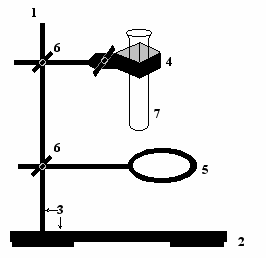 – стержень;
– стержень;2 – подставка;
3 – лабораторный штатив;
4 – лапка;
5 – кольцо;
6 – зажим с двумя винтами;
7 – пробирка: цилиндрическая, безмерная.
Правила закрепления различных видов
химической посуды на металлическом штативе
| Вид посуды | Правила закрепления |
| Пробирки | На стержне штатива закрепляют зажим с двумя винтами. В зажиме закрепляют лапку. В лапке на уровне «двух пальцев» от отверстия (горла) закрепляют пробирку так, чтобы при усилии она вращалась (двигалась). Крепко зажатая пробирка может лопнуть. |
| Колбы | Плоскодонную: на стержне штатива закрепляют два зажима с двумя винтами. В нижнем зажиме закрепляют кольцо соответствующего диаметра, на которое помещают мелкую металлическую сетку. На сетку ставят плоскодонную колбу. В верхнем зажиме закрепляют колбодержатель или кольцо меньшего диаметра для закрепления колбы за горло. |
| Круглодонную: также как и плоскодонную колбу, но без металлической сетки (см. рис.). | |
| Стаканы | На стержне штатива закрепляют зажим с двумя винтами. В зажиме закрепляют кольцо соответствующего диаметра, на которое помещают мелкую металлическую сетку. На сетку ставят стакан. |
| Чашки | На стержне штатива закрепляют зажим с двумя винтами. В зажиме закрепляют кольцо соответствующего диаметра, в которое помещают фарфоровую чашку. |
| Тигли | На стержне штатива закрепляют зажим с двумя винтами. В зажиме закрепляют кольцо соответствующего диаметра или фарфоровый треугольник, в которое помещают фарфоровый или металлический тигель. |
| | |
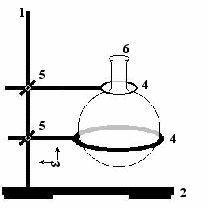
1 – стержень;
2 – подставка;
3 – лабораторный штатив
4 – кольца различных диаметров;
5 – зажим с двумя винтами;
6 – колба: круглодонная, одногорлая, узкогорлая, короткогорлая, безмерная.
Пробиркодержатель
Для нагревания пробирок используют пробиркодержатель, который состоит из трёх частей: деревянной ручки, металлического зажима и «бегунка» (см. рис.).
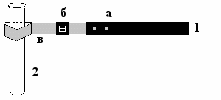
1 – пробиркодержатель:
а – деревянная ручка;
б – бегунок;
в – металлический зажим.
2 – пробирка: цилиндрическая,
безмерная.
Нагревательные приборы
При выполнении лабораторных опытов и практических работ очень часто необходимо нагревать химическую посуду (пробирки, колбы стаканы и т.д.). Для этого используют различные нагревательные приборы, главным из которых является спиртовка. Она состоит из стеклянного резервуара, металлической трубки с диском, фитиля и колпачка. Фитиль изготавливают из «грубой» хлопчатобумажной ткани, а колпачок из термореактивной (т.е. негорючей) пластмассы. Внутрь резервуара наливают этиловый или медицинский спирт (С2Н5ОН – этанол), но не более ⅔ её объёма (см. рис.).
Строение спиртовки:
1 – стеклянный резервуар;
2
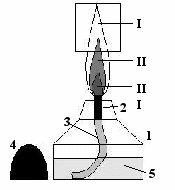 – металлическая трубка с диском;
– металлическая трубка с диском;3 – фитиль из «грубой» хлопчатобумажной ткани;
4 – колпачок;
5 – этиловый спирт (наливается не более ⅔ объема резервуара).
Строение пламени:
І – верхняя зона: невидимая, самая горячая (tº ≈ 550 °C);
ІІ – средняя зона: самая яркая,
горячая (tº ≈ 450-500 °C);
ІІІ – нижняя зона: самая темная, менее горячая (tº ≈ 250-300 °C).
Прямоугольником обозначена зона нагревания предмета.
22. А. химии В. физике.
Н
 обелевские премии присуждаются согласно завещанию Альфреда Бернхарда Нобеля (Швеция), составленному 27 ноября 1895 и предусматривавшему выделение капитала на присуждение пяти премий по направлениям: физика, химия, физиология и медицина, литература и вклад в дело мира во всем мире. Для этой цели в 1900 был создан Фонд Нобеля – частная независимая неправительственная организация с начальным капиталом 33 млн. шведских крон. С 1969 по инициативе Шведского банка присуждаются также премии по экономике (официальное название – премия по экономике памяти Альфреда Нобеля, присваивается решением Шведской королевской академии наук), после чего правление Фонда Нобеля решило более не увеличивать количество номинаций.
обелевские премии присуждаются согласно завещанию Альфреда Бернхарда Нобеля (Швеция), составленному 27 ноября 1895 и предусматривавшему выделение капитала на присуждение пяти премий по направлениям: физика, химия, физиология и медицина, литература и вклад в дело мира во всем мире. Для этой цели в 1900 был создан Фонд Нобеля – частная независимая неправительственная организация с начальным капиталом 33 млн. шведских крон. С 1969 по инициативе Шведского банка присуждаются также премии по экономике (официальное название – премия по экономике памяти Альфреда Нобеля, присваивается решением Шведской королевской академии наук), после чего правление Фонда Нобеля решило более не увеличивать количество номинаций. П
 ервые премии были присуждены 10 декабря 1901 года. С тех пор церемония вручения премий происходит ежегодно 10 декабря в Копенгагене и Осло. Премии по физике, химии, физиологии и медицине, литературе и экономике вручает в Копенгагене в Концертном зале король Швеции, Нобелевская премия мира вручается председателем Норвежского нобелевского комитета в Осло в присутствии короля Норвегии и членов королевской семьи. Премия включает золотую медаль, диплом и денежное вознаграждение. Лауреаты представляют Нобелевские лекции, публикуемые в специальном издании «Нобелевские лауреаты».
ервые премии были присуждены 10 декабря 1901 года. С тех пор церемония вручения премий происходит ежегодно 10 декабря в Копенгагене и Осло. Премии по физике, химии, физиологии и медицине, литературе и экономике вручает в Копенгагене в Концертном зале король Швеции, Нобелевская премия мира вручается председателем Норвежского нобелевского комитета в Осло в присутствии короля Норвегии и членов королевской семьи. Премия включает золотую медаль, диплом и денежное вознаграждение. Лауреаты представляют Нобелевские лекции, публикуемые в специальном издании «Нобелевские лауреаты». 
23. В. Термометр.
Этот прибор термометр.
Термометр (греч. θέρμη — тепло; μετρέω — измеряю) — прибор для измерения температуры воздуха, почвы, воды и так далее. Существует несколько видов термометров:
- жидкостные
- механические
- э
 лектрические
лектрические
- оптические
- газовые
Изобретателем термометра принято считать Галилео Галилея: в его собственных сочинениях нет описания этого прибора, но его ученик, Винченцо Вивиани, засвидетельствовал, что уже в 1597 г. он устроил нечто вроде термобароскопа (термоскоп). Галилей изучал в это время Герона Александрийского, у которого уже описано подобное приспособление, но не для измерения степеней тепла, а для поднятия воды при помощи нагревания.
Термометр Галилея (см. фото) представляет собой запаянный стеклянный цилиндр, наполненный жидкостью, в которой плавают стеклянные сферические сосудики-буйки. К каждому такому сферическому поплавку прикреплена снизу золотистая или серебристая бирка с выбитым на ней значением температуры. В зависимости от размера термометра количество поплавков внутри бывает от 3-х до 11-ти. В настоящее время термометр представляет эстетическую ценность в качестве эффектного предмета интерьера.
В 1657 г. термоскоп Галилея был усовершенствован флорентийскими учеными. Они снабдили прибор шкалой из бусин и откачали воздух из резервуара (шарика) и трубки. Это позволило не только качественно, но и количественно сравнивать температуры тел. Впоследствии термоскоп был изменен: его перевернули шариком вниз, а в трубку вместо воды налили спирт и удалили сосуд. Действие этого прибора основывалось на расширении мер, в качестве «постоянных» точек брали температуры наиболее жаркого летнего и наиболее холодного зимнего дней.
Изобретение термометра также приписывают лорду Бэкону, Роберту Фладду, Санкториусу, Скарпи, Корнелию Дреббелю, Порте и Саломону де Каус, писавшим позднее и частью имевшим личные отношения с Галилеем. Все эти термометры были воздушные и состояли из сосуда с трубкой, содержащего воздух, отделённый от атмосферы столбиком воды, они изменяли свои показания и от изменения температуры, и от изменения атмосферного давления.
Термометры с жидкостью описаны в первый раз в 1667 году «Saggi di naturale esperienze fatte nell’Accademia del Cimento», где о них говорится как о предметах, давно изготовляемых искусными ремесленниками, которых называют «Confia», разогревающими стекло на раздуваемом огне лампы и выделывающими из него удивительные и очень нежные изделия. Сначала эти термометры наполняли водой, и они лопались, когда она замерзала; употреблять для этого винный спирт начали по мысли великого герцога тосканского Фердинанда ІІ. Флорентийские термометры не только изображены в «Saggi», но сохранились в нескольких экземплярах до нашего времени в Галилеевском музее, во Флоренции; их приготовление описывается подробно. Сначала мастер должен был сделать деления на трубке, соображаясь с её относительными размерами и размерами шарика: деления наносились расплавленной эмалью на разогретую на лампе трубку, каждое десятое обозначалось белой точкою, а другие чёрными. Обыкновенно делали 50 делений таким образом, чтобы при таянии снега спирт не опускался ниже 10, а на солнце не поднимался выше 40. Хорошие мастера делали такие термометры настолько удачно, что все они показывали одно и то же значение температуры при одинаковых условиях, однако такого не удавалось достигнуть, если трубку разделяли на 100 или 300 частей, чтобы получить большую точностью. Наполняли термометры посредством подогревания шарика и опускания конца трубки в спирт, заканчивали наполнение при помощи стеклянной воронки с тонко оттянутым концом, свободно входившим в довольно широкую трубку. После регулирования количества жидкости, отверстие трубки запечатывали сургучом, называемым «герметическим». Из этого ясно, что эти термометры были большими и могли служить для определения температуры воздуха, но были ещё неудобны для других, более разнообразных опытов, и градусы разных термометров были не сравнимы между собою.
В
 1702-1703 годах Гильом Амонтон в Париже усовершенствовал воздушный термометр, измеряя не расширение, а увеличение упругости воздуха, приведённого к одному и тому же объёму при разных температурах подливанием ртути в открытое колено; барометрическое давление и его изменения при этом принимались во внимание. Нулём такой шкалы должна была служить «та значительная степень холода», при которой воздух теряет всю свою упругость (то есть современный абсолютный нуль), а второй постоянной точкой — температура кипения воды. Влияние атмосферного давления на температуру кипения ещё не было известно Гильому Амонтону, а воздух в его термометре не был освобождён от водяных газов; поэтому из его данных абсолютный нуль получается при −239,5° по шкале Цельсия. Другой воздушный термометр Амонтона, выполненный очень несовершенно, был независим от изменений атмосферного давления: он представлял сифонный барометр, открытое колено которого было продолжено кверху, снизу наполнено крепким раствором поташа, сверху нефтью и оканчивалось запаянным резервуаром с воздухом.
1702-1703 годах Гильом Амонтон в Париже усовершенствовал воздушный термометр, измеряя не расширение, а увеличение упругости воздуха, приведённого к одному и тому же объёму при разных температурах подливанием ртути в открытое колено; барометрическое давление и его изменения при этом принимались во внимание. Нулём такой шкалы должна была служить «та значительная степень холода», при которой воздух теряет всю свою упругость (то есть современный абсолютный нуль), а второй постоянной точкой — температура кипения воды. Влияние атмосферного давления на температуру кипения ещё не было известно Гильому Амонтону, а воздух в его термометре не был освобождён от водяных газов; поэтому из его данных абсолютный нуль получается при −239,5° по шкале Цельсия. Другой воздушный термометр Амонтона, выполненный очень несовершенно, был независим от изменений атмосферного давления: он представлял сифонный барометр, открытое колено которого было продолжено кверху, снизу наполнено крепким раствором поташа, сверху нефтью и оканчивалось запаянным резервуаром с воздухом.Современную форму термометру придал немецкий Габриель Фаренгейт и описал свой способ приготовления в 1723 году. Первоначально он тоже наполнял свои трубки спиртом и лишь под конец перешёл к ртути. Ноль своей шкалы он поставил при температуре смеси снега с нашатырём или поваренной солью. При температуре «начала замерзания воды» он показывал 32°, а температура тела здорового человека во рту или под мышкой была эквивалентна 96°. Впоследствии он нашёл, что вода кипит при 212° и эта температура была всегда одна и та же при том же стоянии барометра.
Впервые идею использовать в качестве основных точек шкалы термометра точки замерзания и кипения воды использовал Карло Ренальдини 1694 году. Он предложил деление термометра на 12 равных частей.
Окончательно установил обе постоянные точки, тающего льда и кипящей воды, шведский физик Андерс Цельсий в 1742 году, но первоначально он поставил 0° при точке кипения, а 100° при точке замерзания, и принял обратное обозначение лишь по совету астронома Мартина Штремера.
С
 охранившиеся экземпляры термометров Фаренгейта отличаются тщательностью исполнения. Однако более удобной оказалась «перевернутая» шкала, на которой температуры таяния льда обозначили 0 С, а температуру кипения 100 С. Таким термометров впервые пользовались шведские ученые ботаник Карл Линней и астроном Мартин Штремер. Этот термометр получил широкое распространение.
охранившиеся экземпляры термометров Фаренгейта отличаются тщательностью исполнения. Однако более удобной оказалась «перевернутая» шкала, на которой температуры таяния льда обозначили 0 С, а температуру кипения 100 С. Таким термометров впервые пользовались шведские ученые ботаник Карл Линней и астроном Мартин Штремер. Этот термометр получил широкое распространение.Работы Рене Антуан Фершо де Реомюра в 1736 году хотя и привели к установлению 80° шкалы, но были скорее шагом назад против того, что сделал уже Фаренгейт: термометр Реомюра был громадный, неудобный в употреблении, а его способ разделения на градусы был неточным и неудобным.
После Фаренгейта и Реомюра дело изготовления термометров попало в руки ремесленников, так как термометры стали предметом торговли.
В
 1848 г. английский физик Вильям Томсон (лорд Кельвин) доказал возможность создания абсолютной шкалы температур, нуль которой не зависит от свойств воды или вещества, заполняющего термометр. Точкой отсчета в «шкале Кельвина» послужило значение абсолютного нуля: −273,15° С. При этой температуре прекращается тепловое движение молекул. Следовательно, становится невозможным дальнейшее охлаждение тел.
1848 г. английский физик Вильям Томсон (лорд Кельвин) доказал возможность создания абсолютной шкалы температур, нуль которой не зависит от свойств воды или вещества, заполняющего термометр. Точкой отсчета в «шкале Кельвина» послужило значение абсолютного нуля: −273,15° С. При этой температуре прекращается тепловое движение молекул. Следовательно, становится невозможным дальнейшее охлаждение тел.Жидкостные термометры основаны на принципе изменения объёма жидкости, которая залита в термометр (обычно это спирт или ртуть), при изменении температуры окружающей среды.
В связи с ограничением применения ртути во многих областях деятельности ведется поиск альтернативных наполнений для бытовых термометров.
Итак, сегодня в мире приняты три шкалы измерения температуры: Цельсия, Фаренгейта и Кельвина.
С
 егодня, градус Цельсия °C равен одному кельвину K, а нуль шкалы Цельсия установлен таким образом, что температура тройной точки воды равна 0,01 °C. В итоге, шкалы Цельсия и Кельвина сдвинуты на 273,15, а чтобы перейти в шкалу Фаренгейта необходимо отнять 32 и разделить полученное число на 1,8:
егодня, градус Цельсия °C равен одному кельвину K, а нуль шкалы Цельсия установлен таким образом, что температура тройной точки воды равна 0,01 °C. В итоге, шкалы Цельсия и Кельвина сдвинуты на 273,15, а чтобы перейти в шкалу Фаренгейта необходимо отнять 32 и разделить полученное число на 1,8: °C = К − 273,15 =.(F − 32) / 1,8
Переходы из одной шкалы измерения в другую даны в таблице:
| Шкала измерения | Кельвин | Цельсий | Фаренгейт |
| Кельвин (K) | = K | = С + 273,15 | = (F + 459) / 1,8 |
| Цельсий (°C) | = K − 273,15 | = С | = (°F − 32) / 1,8 |
| Фаренгейт (°F) | = K · 1,8 − 459 | = С · 1,8 + 32 | = °F |
Например, если в комнате температура 24 °C, то по шкале Кельвина это 297,15 К, а по шкале Фаренгейта это 75,2 °F.
24. В. Дмитрий Менделеев.
Работая над научным трудом «Основы химии», Д. И. Менделеев открыл 17 февраля (1 марта по новому стилю) 1869 года один из фундаментальных законов природы – периодический закон химических элементов (о предшественниках Д.И. Менделеева см. ответ на вопрос
№ 2 для 3-4 классов).
6 марта 1869 года знаменитый доклад Д. И. Менделеева «Соотношение свойств с атомным весом элементов» был прочтён Н. А. Меншуткиным на заседании Русского химического общества. В том же году это сообщение на немецком языке появилось в журнале «Zeitschrift für Chemie», а в 1871 году в журнале «Annalen der Chemie» была осуществлена развёрнутая публикация Д. И. Менделеева, посвящённая его открытию – «Die periodische Gesetzmässigkeit der Elemente» (Периодическая закономерность химических элементов).
О
 тдельные учёные в ряде стран, особенно в Германии, соавтором открытия считают Лотара Мейрера. Существенное различие этих систем заключается в том, что таблица Л. Мейера – это один из вариантов классификации известных к тому времени химических элементов; выявленная Д. И. Менделеевым периодичность – это система, которая дала понимание закономерности, позволившей определить место в ней элементов, неизвестных в то время, предсказать не только существование, но и дать их характеристики предсказать не только существование, но и дать их характеристики.
тдельные учёные в ряде стран, особенно в Германии, соавтором открытия считают Лотара Мейрера. Существенное различие этих систем заключается в том, что таблица Л. Мейера – это один из вариантов классификации известных к тому времени химических элементов; выявленная Д. И. Менделеевым периодичность – это система, которая дала понимание закономерности, позволившей определить место в ней элементов, неизвестных в то время, предсказать не только существование, но и дать их характеристики предсказать не только существование, но и дать их характеристики.Не давая представления о строении атома, периодический закон, тем не менее, вплотную подводит к этой проблеме, и решение её было найдено, несомненно, благодаря нему – именно этой системой руководствовались исследователи, увязывая факторы, выявленные им с интересовавшими их другими физическими характеристиками. В 1984 году академик В. И. Спицын пишет: «…Первые представления о строении атомов и природе химической валентности, разработанные в начале нашего столетия, основывались на закономерностях свойств элементов, установленных с помощью периодического закона».
Н
 емецкий учёный, главный редактор фундаментального пособия «Анорганикум» — объединённого курса неорганической, физической и аналитической химии, выдержавшего более десяти изданий, академик Л. Кольдиц так истолковывает особенности открытия Д. И. Менделеева, сопоставляя в высшей степени убедительные результаты его труда с работами других исследователей, искавших подобные закономерности: «Никто из учёных, занимавшихся до Менделеева или одновременно с ним исследованиями соотношений между атомными весами и свойствами элементов, не смог сформулировать эту закономерность так ясно, как это сделал он. В частности, это относится к Дж. Ньюлендсу и Л. Мейеру. Предсказание ещё неизвестных элементов, их свойств и свойств их соединений является исключительно заслугой Д. И. Менделеева. …Наилучшим образом он смог применить свой метод горизонтальной, вертикальной и диагональной интерполяции в открытой им периодической системе для предсказания свойств…»
емецкий учёный, главный редактор фундаментального пособия «Анорганикум» — объединённого курса неорганической, физической и аналитической химии, выдержавшего более десяти изданий, академик Л. Кольдиц так истолковывает особенности открытия Д. И. Менделеева, сопоставляя в высшей степени убедительные результаты его труда с работами других исследователей, искавших подобные закономерности: «Никто из учёных, занимавшихся до Менделеева или одновременно с ним исследованиями соотношений между атомными весами и свойствами элементов, не смог сформулировать эту закономерность так ясно, как это сделал он. В частности, это относится к Дж. Ньюлендсу и Л. Мейеру. Предсказание ещё неизвестных элементов, их свойств и свойств их соединений является исключительно заслугой Д. И. Менделеева. …Наилучшим образом он смог применить свой метод горизонтальной, вертикальной и диагональной интерполяции в открытой им периодической системе для предсказания свойств…»Развивая в 1869–1871 годах идеи периодичности, Д. И. Менделеев ввёл понятие о месте элемента в периодической системе как совокупности его свойств в сопоставлении со свойствами других элементов. На этой основе, в частности, опираясь на результаты изучения последовательности изменения стеклообразующих оксидов, исправил значения атомных масс 9 элементов (бериллия, индия, урана, церия и др.).
Предсказал в 1870 году существование, вычислил атомные массы и описал свойства трёх элементов:
«
 экаалюминий» – галлий (открыт в 1875 году французским химиком П.Э.Л. де Буабодраном);
экаалюминий» – галлий (открыт в 1875 году французским химиком П.Э.Л. де Буабодраном);«экабор» – скандий (открыт в 1879 году шведским химиком Л.Ф. Нильсоном);
«экасилиций» – германий (открыт в 1885 году немецким химиком К.А. Винклером ).
Затем предсказал существование ещё шести элементов:
«двителлур» – полоний (открыт в 1898 году польским химиком и физиком М.Складовской-Кюри и её мужем, французским физиком П. Кюри);
«экабарий» – радий (открыт в 1898 году польским химиком и физиком М.Складовской-Кюри, её мужем, французским физиком П. Кюри и французским химиком Ж. Бемоном);
«двимарганец» – рений (открыт в 1925 году, немецкими учеными В. Ноддаком, И. Такке (с 1926
года И. Ноддак) и О. Берг);
«экаиод» – астата (открыт в 1942 – 1943 годах, американским физиком Э. Сегре, Дж. Корсоном, К. Маккензи);
«экамарганц» – технеция (открыт в 1937 году, французским химиком К. Перрье и американским физиком Э. Сегре),
«экацезия» – франция (открыт в 1939 году, французский радиохимик М. Перей).
В 1871 году Менделеев предсказал существование элемента, расположенного между торием и ураном, впоследствии названный в 1900 году протактинием (открыт английским физииком радиохимиком Ф. Содди, Дж. Крэнстон, немецким химиком О. Ганном, австрийским физиком и радиохимиком Л. Мейтнер).
Версия Периодической таблицы, изданная в 1869, предсказывала существование более тяжёлого аналога титана и циркония. Открытие в 1923 году гафния (нидерландский физик
Д. Костер, и венгерский Д. Хевеши) подтвердило первоначальное предположение Менделеева.
25. В. 3.
Карл Линней (Швеция) – естествоиспытатель, врач, систематик (биолог).
Лайнус Карл Полинг (США) – химик, физик и общественный деятель. Дважды лауреат Нобелевской премии (по химии (1954 год) и Премия мира (1962 год)).
Пифагор (Древняя Греция) – философ, математик.
Чарльз Дарвин (Англия) – биолог.
Иван Яковлевич Франко (Украина) – писатель и общественный деятель.
Вольфганг Амадей Моцарт (Австрия) – композитор.
Карл Вильгельм Шееле (Швеция) – химик, фармацевт (аптекарь).
Александр Михайлович Бутлеров (Россия) – химик, пчеловод и общественный деятель.
Теофраст (Древняя Греция) – философ, естествоиспытатель, теоретик музыки.
Исаак Ньютон (Англия) – физик, математик, астроном.
2
 6. Б. С глазами.
6. Б. С глазами.Половину своей жизни Дальтон даже не подозревал, что с его зрением что-то не так. Он занимался оптикой и химией, но обнаружил свой дефект благодаря увлечению ботаникой. То, что он не мог отличить голубой цветок от розового, он объяснял путаницей в классификации цветов, а не недостатками его собственного зрения. Он заметил, что цветок, который днём, при свете солнца, был небесно-голубым (точнее, того цвета, что он считал небесно-голубым), при свете свечи выглядел тёмно-красным. Он обратился к окружающим, но никто такого странного преобразования не видел, за исключением его родного брата. Таким образом, Дальтон догадался не только о том, что с его зрением что-то не так, но и о том, что проблема эта наследуема. В 1794 году, сразу после прибытия в Манчестер, Дальтон был избран членом Манчестерского литературно-философского общества («Лит&Фил») и несколько недель спустя выпустил в свет статью под названием «Необычные случаи цветовосприятия», где объяснял узость цветоощущения некоторых людей обесцвечиванием жидкого вещества глаза. Описав эту болезнь на собственном примере, Дальтон обратил на нее внимание людей, до того момента не осознававших у себя ее наличия. Несмотря на то, что объяснение Дальтона подвергли сомнению ещё при его жизни, тщательность исследований им собственной болезни была настолько беспрецедентной, что термин «дальтонизм» прочно закрепился за этим недугом. В 1995 году были проведены исследования сохранившегося глаза Джона Дальтона, в ходе которых выяснилось, что он страдал редкой формой дальтонизма – дейтеранопией. В этом случае глаз не улавливает свет средних длин волн (в более распространенном варианте болезни – дейтераномалии, глаз просто искажает изображение из-за неправильного цвета пигмента соответствующего участка сетчатки). Кроме фиолетового и голубого цветов он мог нормально распознавать только один – желтый, и так писал об этом: «Та часть картины, которую другие называют красной, мне кажется как будто тенью или просто плохо освещенной. Оранжевый, зеленый и желтый кажутся оттенками одного цвета, от интенсивного до бледно-желтого».
Дальтонизм, цветовая слепота – наследственная, реже приобретённая особенность зрения человека и приматов, выражающаяся в неспособности различать один или несколько цветов. У человека в центральной части сетчатки расположены цветочусвтвительные рецепторы – нервные клетки, которые называются колбочками. Каждый из трёх видов колбочек имеет свой тип цветочувствительного пигмента белкового происхождения. Один тип пигмента чувствителен к красному цвету с максимумом 552—557 нм, другой – к зелёному (максимум около 530 нм), третий – к синему (426 нм). Люди с нормальным цветным зрением имеют в колбочках все три пигмента (красный, зелёный и синий) в необходимом количестве. Их называют трихроматами (от др. греч. χρῶμα — цвет).
Передача дальтонизма по наследству связана с X-хромосомой и практически всегда передаётся от матери-носителя гена к сыну, в результате чего в двадцать раз чаще проявляется у мужчин, имеющих набор половых хромосом XY. У мужчин дефект в единственной X-хромосоме не компенсируется, так как «запасной» X-хромосомы нет. Разной степенью дальтонизма страдают 2–8 % мужчин, и только 0,4 % женщин.
Некоторые виды дальтонизма следует считать не «наследственным заболеванием», а скорее – особенностью зрения. Согласно исследованиям британских учёных, люди, которым трудно различать красные и зелёные цвета, могут различать множество других оттенков. В частности, оттенков цвета хаки, которые кажутся одинаковыми людям с нормальным зрением. Возможно, в прошлом такая особенность давала её носителям эволюционные преимущества, например, помогала находить пищу в сухой траве и листьях.
Причинами появления приобретенных нарушений цветовосприятия являются:
- Возрастные изменения – помутнение хрусталика (катаракта). Снижается и зрение вдаль, и цветовосприятие;
- Нарушение цветового зрения, вызванные приемом различных медикаментов (постоянное или временное);
- Травмы глаза, затрагивающие сетчатку или зрительный нерв.
Клинически различают полную и частичную цветовую слепоту.
Реже всего наблюдается полное отсутствие цветного зрения.
Ч
 астичная цветовая слепота:
астичная цветовая слепота:а) красные рецепторы нарушены — наиболее частый случай:
- дихромия
- протанопия (protanomaly, deuteranomaly)
б) синий и жёлтый участок спектра не воспринимаются
- дихромия – тританопия (tritanopia) – отсутствие цветовых ощущений в сине-фиолетовой области спектра. Встречается крайне редко и практического значения не имеет. При тританопии все цвета спектра представляются оттенками красного или зелёного.
в) дейтеранопия – слепота на зелёный цвет.
г) аномалии по трём цветам (tritanomaly).
Дейтеранопия (от греч. δεύτερος «второй», греч. ἀ(ν)- отриц. частица, греч. ὄψις «зрение») – форма частичной цветовой слепоты, обычно врожденной, которая характеризуется пониженной чувствительности к некоторым цветам, в основном к зеленому. У дейтеранопов отмечается недостаток п
 игмента М-колбочек. Вследствие этого заболевания светло-зеленый цвет воспринимается больным, как темно–красный, фиолетовый – как голубой, пурпурный – как серый. На сегодняшний день данный дефект неизлечим.
игмента М-колбочек. Вследствие этого заболевания светло-зеленый цвет воспринимается больным, как темно–красный, фиолетовый – как голубой, пурпурный – как серый. На сегодняшний день данный дефект неизлечим.Цветовая слепота может ограничить возможности человека при исполнении тех или иных профессиональных навыков. Зрение врачей, водителей, моряков и лётчиков тщательно исследуется, так как от его правильности зависит жизнь многих людей.
Дефект цветового зрения впервые привлёк к себе внимание общественности в 1875 году, когда в Швеции, около города Лагерлунда, произошло крушение поезда, повлёкшее большие жертвы. Оказалось, что машинист не различал красный цвет, а развитие транспорта именно в то время привело к широкому распространению цветовой сигнализации. Эта катастрофа привела к тому, что при приёме на работу в транспортную службу стали в обязательном порядке оценивать цветоощущение.
В Турции и Румынии людям с нарушениями цветоощущения не выдаются водительские права. В России дальтоники при дихромазии могут получить только водительские права категории A или категории B без права работы по найму. В остальных странах Европы ограничений для дальтоников при выдаче водительских удостоверений нет.
27. В. Владимир Вернадский.
Национальная библиотека Украины в Киеве названа в честь выдающегося ученого ХХ века – Владимира Ивановича Вернадского.
В
 ладимир Иванович Вернадский (28 февраля (12 марта) 1863(18630312), Санкт-Петербург – 6 января 1945, Москва) – русский и советский учёный XX века, естествоиспытатель, мыслитель и общественный деятель. Академик Императорской Санкт-Петербургской академии наук, один из основателей и первый президент Украинской академии наук. Создатель многих научных школ. Один из представителей русского космизма; создатель науки биогеохимии. В круг его интересов входили геология и кристаллография, минералогия и геохимия, организаторская деятельность в науке и общественная деятельность, радиогеология и биология, биогеохимия и философия.
ладимир Иванович Вернадский (28 февраля (12 марта) 1863(18630312), Санкт-Петербург – 6 января 1945, Москва) – русский и советский учёный XX века, естествоиспытатель, мыслитель и общественный деятель. Академик Императорской Санкт-Петербургской академии наук, один из основателей и первый президент Украинской академии наук. Создатель многих научных школ. Один из представителей русского космизма; создатель науки биогеохимии. В круг его интересов входили геология и кристаллография, минералогия и геохимия, организаторская деятельность в науке и общественная деятельность, радиогеология и биология, биогеохимия и философия.Владимир Вернадский родился 28 февраля (12 марта) 1863 года в Санкт-Петербурге. В 1868 году из-за неблагоприятного климата семья Вернадских переехала в Харьков – один из ведущих научных и культурных центров Российской империи. В 1873 году Владимир стал первоклассником Харьковской классической гимназии. В 1885 году окончил физико-математический факультет Петербургского университета. В 1890 году — приват-доцент кафедры минералогии Московского университета. В 1897 году защитил докторскую диссертацию в Петербургском университете. В 1898–1911 профессор Московского университета. С 1912 года академик Императорской Санкт-Петербургской академии наук (позже Академия наук СССР).
Научная деятельность В.И. Вернадского оказала огромное влияние на развитие наук о Земле, на становление и рост АН СССР, на мировоззрение многих людей. Начиная с 1908 года, В. И. Вернадский (в то время профессор Московского университета) постоянно проводил огромную работу по организации экспедиций и созданию лабораторной базы по поискам и изучению радиоактивных минералов. Он был одним из первых, кто понял огромную важность изучения радиоактивных процессов для всех сторон жизни общества. Ход исследований радиоактивных месторождений был отражён в «Трудах Радиевой экспедиции Академии наук, в основном это были экспедиции на Урал, в Предуралье, Байкал и Забайкалье, Ферганскую область и Кавказ, но В. И. Вернадский указывал на необходимость подобных исследований в южных регионах в особенности на побережьях Чёрного и Азовского морей. Он считал, что для успешной работы, должны быть организованы постоянные исследовательские станции.
После 1917 года выехал на юг, стал одним из основателей и первым президентом (27 октября 1918 года) Украинской академии наук, состоял профессором и с 1920 по 1921 ректором Таврического университета в Симферополе. В 1921 года вернулся в Петроград, участвовал в создании Радиевого института. В период с 1922 по 1926 год работал за границей в Праге и Париже, читал лекции в Сорбонне, работал в Музее естественной истории и Институте Кюри, где исследовал паризий – вещество, ошибочно принятое за новый радиоактивный элемент. В Париже на французском языке вышел его фундаментальный труд «Геохимия».
В 1915–1930 годах председатель Комиссии по изучению естественных производственных сил России, был одним из создателей плана ГОЭЛРО. Комиссия внесла огромный вклад в геологическое изучение Советского Союза и создание его независимой минерально-сырьевой базы.
По возвращении в 1926 году продолжил творческую самостоятельную работу. Сформулировал концепцию биологической структуры океана. Согласно этой концепции, жизнь в океане сконцентрирована в «плёнках» – географических пограничных слоях различного масштаба. В 1927 году организовал в Академии наук СССР Отдел живого вещества. Однако термин «живое вещество» он употреблял в смысле, отличном от работ О. Б. Лепешинской – как совокупность живых организмов биосферы. Вернадским опубликовано более 700 научных трудов. Основал новую науку – биогеохимию и сделал огромный вклад в геохимию. С 1927 года до самой смерти занимал должность директора Биогеохимической лаборатории при Академии наук СССР. Был учителем целой плеяды советских геохимиков.
Из философского наследия Вернадского наибольшую известность получило учение о ноосфере; он считается одним из основных мыслителей направления, известного как русский космизм.
Летом 1940 года по инициативе Вернадского начались исследования урана на получение ядерной энергии. С началом войны был эвакуирован в Казахстан, где создал свои книги «О состояниях пространства в геологических явлениях Земли. На фоне роста науки XX столетия» и «Химическое строение биосферы Земли и её окружения». В 1943 году Вернадский возвратился из эвакуации и «за многолетние выдающиеся работы в области науки и техники» к 80-летию был удостоен Сталинской премии I степени.
Имя В.И. Вернадского увековечено:
- Институт геохимии и аналитической химии им. В.И. Вернадского РАН.
- Институт общей и неорганической химии им. В.И. Вернадского Национальной академии наук Украины
- Таврический национальный университет им. В.И. Вернадского в Симферополе.
- Подлёдные горы в Восточной Антарктиде.
- Украинская антарктическая станция «Академик Вернадский»
- Национальная библиотека Украины в Киеве
- Банк России выпустил памятную монету «Владимир Иванович Вернадский» к 130-летию со дня рождения в серии «Выдающиеся личности России».
- Станция метро в Москве.
- Улицы и проспекты в ряде городов (Киев, Москва, Симферополь).
Биогеохимия — раздел геохимии; изучает химический состав живого вещества и геохимические процессы, протекающие в биосфере Земли при участии живых организмов; включает также органическую геохимию. Основателем биогеохимии является В.И. Вернадский. Под его руководством была создана первая биогеохимическая лаборатория (ныне институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук).
Биогеохимия является примером междисциплинарной науки. Биогеохимия имеет общие проблемы с биологией, экологией и науками об окружающей среде, с почвоведением и океанологией. Поскольку природный цикл диоксида углерода (углекислого газа) тесно связан с жизнедеятельностью организмов, его изучение имеет прямое отношение к проблематике биогеохимии. Следовательно, биогеохимия связана и с вопросами накопления в атмосфере парниковых газов (к ним относится и диоксид углерода) и проблемами глобального потепления. Роль организмов в формировании газов и всей атмосферы огромна. Ранее ошибочно полагали, что кислород атмосферы образуется при фотосинтезе из углекислого газа. Для поступательного развития науки имело значение открытие того, что кислород атмосферы образуется при фотосинтезе не из углекислого газа, а из воды.
Поскольку многие элементы (например, тяжёлые металлы и мышьяк) обладают токсичностью, то вопросы накопления этих металлов в организмах важны для экотоксикологии. Таким образом, биогеохимия связана с экотоксикологией и вопросами химического загрязнения среды элементами, проявляющими токсичность. Одним из направлений биогеохимии стало изучение изменчивости обмена веществ у животных под влиянием геохимических факторов среды, поэтому биогеохимия тесно связана и с биохимией.
Исследования биогеохимии стали теоретической основой применения микроэлементов в животноводстве и растениеводстве. Интересное направление исследований – установление роли органических веществ в миграции химических элементов. Установлено, что германий связывается c углем; ванадий – с нефтью; бром и йод – с торфом; медь, кобальт, никель, уран – c гумусом. Исследования глобальных циклов элементов продолжают оставаться важной темой биогеохимических исследований. Биогеохимия имеет большое значение для развития биологических наук и экономики, для контроля последствий загрязнения среды.
28. А. Подводный горный хребет. Г. Город в России.
В честь великого русского ученого-энциклопедиста Михаила Васильевича Ломоносова названы.
Географические объекты:
- х
 ребет Ломоносова – подводный хребет в Северном Ледовитом океане, названный в честь М. В. Ломоносова. Хребет пересекает центральную часть океана и простирается примерно на 1800 км от Новосибирских островов до острова Элсмир в Канадском Арктическом архипелаге. Ширина варьируется от 60 до 200 км, высота над дном океана — от 3300 до 3700 м. Минимальная глубина над хребтом 954 м. Склоны относительно крутые, расчленены каньонами и покрыты слоем песчанистого ила. Хребет был открыт в 1948 году советскими высокоширотными экспедициями;
ребет Ломоносова – подводный хребет в Северном Ледовитом океане, названный в честь М. В. Ломоносова. Хребет пересекает центральную часть океана и простирается примерно на 1800 км от Новосибирских островов до острова Элсмир в Канадском Арктическом архипелаге. Ширина варьируется от 60 до 200 км, высота над дном океана — от 3300 до 3700 м. Минимальная глубина над хребтом 954 м. Склоны относительно крутые, расчленены каньонами и покрыты слоем песчанистого ила. Хребет был открыт в 1948 году советскими высокоширотными экспедициями;
- полуостров Ломоносова;
- кратер Ломоносов на Луне.
Населенные пункты, учебные заведения, улицы, площади, станции метро, мосты:
- город Ломоносов в России, муниципальное образование в составе Петродворцового района города федерального значения Санкт-Петербурга (до 1948 года Ораниенбаум, нем. Oranienbaum, фин. Kaarosta, Rampova). Является административным центром Ломоносовского района Ленинградской области, хотя сам в этот район не входит. Расположен на южном берегу Финского залива. Морской порт. Расстояние от основного вокзала Ломоносова (ст. Ораниенбаум) до Балтийского вокзала Санкт-Петербурга – 40 километров. Основан в 1710 году как загородная резиденция А.Д. Меншикова, в 1780 году получил статус города. В городе находится дворцово-парковый ансамбль XVIII века «Ораниенбаум». Награждён орденом Отечественной войны I степени.
- Ломоносово (Денисовка и Мишанинская) – село в Холмогорском районе Архангельской области, на острове Куростров, на реке Северная Двина, родина М. В. Ломоносова;
- Московский государственный университет имени М.В. Ломоносова;
- Московская государственная академия тонкой химической технологии им. М. В. Ломоносова
- Национальный горный университет им. М. В. Ломоносова в Днепропетровске;
- Северный Арктический Федеральный Университет имени М.В. Ломоносова;
- Архангельский театр драмы имени М. В. Ломоносова;
- Музей М.В. Ломоносова Российской Академии Наук;
- площади в Санкт-Петербурге, Северодвинске;
- станция метро Ломоносовская в Санкт-Петербурге;
- Ломоносовский мост в Санкт-Петербурге;
- проспекты в г. Москве, Архангельске, Саратове, Константиновке;
- улицы в 27 городах России, а также в Кишиневе, Риге, Талине;
- улицы (проспекты) в 6 городах Украины: Киеве, Харькове, Донецке, Симферополе, Виннице, Луганске.
