Российская академия наук
| Вид материала | Тезисы |
- Основание Петербургской академии наук, 49.85kb.
- Спонсоры конференции: Фармацевтическая фирма «Санофи-Авентис», 74.5kb.
- Ш. Н. Хазиев (Институт государства и права ран) Российская академия наук и судебная, 297.05kb.
- Научный журнал «Вопросы филологии» Оргкомитет: Сопредседатели, 53.54kb.
- Научный журнал "Вопросы филологии" Оргкомитет: Сопредседатели, 47.73kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- Н. д кондратьева Международный фонд Н. д кондратьева и Российская академия естественных, 13.13kb.
- Российская академия наук отделение общественных наук ран, 74.85kb.
- Высочество Князь Монако Альберт II и другие. Сдоклад, 38.69kb.
- Ипээ ран www sevin ru, 22.27kb.
Муфазалова Р.Р. *, Спивак А.Ю. *, Одиноков В.Н. *
Башкирский государственный университет, г. Уфа, 450074, ул. Заки Валиди, д.32, Veronika1979@yandex.ru, gerchikov@inbox.ru
*Учреждение Российской академии наук Институт нефтехимии и катализа РАН, г. Уфа, 450075, пр. Октября, 141, ink@anrb.ru
Работа посвящена количественному изучению антиокислительного действия конъюгатов бетулоновой и бетулиновой кислот с синтетическими аналогами α-токоферола на модельной реакции инициированного азодиизобутиронитрилом окисления 1,4-диоксана с использованием двух кинетических методов: а) манометрического метода - по поглощению кислорода воздуха; б) метода кинетической спектрофотометрии – по изменению во времени концентрации изучаемых антиоксидантов. Антиокислительная активность этих веществ количественно охарактеризована константой скорости ингибирования
 . Установлено, что антиокислительную эффективность определяет хромановый фрагмент, а введение бетулонового или бетулинового заместителя снижает константу скорости ингибирования.
. Установлено, что антиокислительную эффективность определяет хромановый фрагмент, а введение бетулонового или бетулинового заместителя снижает константу скорости ингибирования.Таблица. Кинетические характеристики производных хромана, бетулиновой и бетулоновой кислот.
| Вещество | СТРУКТУРНАЯ ФОРМУЛА |  •10-4, л/моль•с •10-4, л/моль•с | ТЭ |
| I |  | 2,5 0,3 | 0,2 |
| II |  | 2,5 0,3 | 0,2 |
| III |  | 5,0 0,5 | 0,4 |
| IV |  | 7,5 1,0 | 0,6 |
| V |  | 10,0 2,0 | 0,8 |
| VI (α-токоферол) |  | 12,5 2,0 | 1,0 |
КОМПЛЕМЕНТАРНЫЕ ВЗИМОДЕЙСТВИЯ ЛЕВУГЛАНДИНОВЫХ МЕТАБОЛИТОВ ПОЛИЕНОВЫХ КИСЛОТ И ТОКОФЕРОЛОВ БИОМЕМБРАН
Халиков Р.М.
Башкирский государственный педагогический университет им. М.Акмуллы, г.Уфа; rauf_khalikov@mail.ru
Для подержания динамического равновесия концентрации и регенерации мембранных антиоксидантов интересен подход конструирования циклических аналогов продуктов оксигенирования полиненасыщенных (эйкозаноидных и других остатков полиеновых кислот) фосфолипидов. Биосинтез оксилипинов начинается с гидролитического расщепления фосфолипидов под действием энзимов (фосфолипаз) с образованием свободной арахидоновой (эйкозатетраеновой) кислоты. Окислительная циклизация арахидоновой кислоты протекает по радикальному механизму и осуществляется полиферментным комплексом через интермедиаты PGH2.
Левугландины – производные альтернативной перегруппировки эндопероксида PGH2 продуцируются in vivo по свободнорадикальному механизму. Реакционноспособные молекулы левугландинов и изолевугландинов (γ-кетоальдегиды с простаноидными боковыми цепями) могут повреждать биомембраны. Нами синтезирован циклоаналог стабильного модификанта левугландинов, который рассматривается в качестве структуры для «доставки» лабильных биорегуляторов до рецепторов–мишеней.
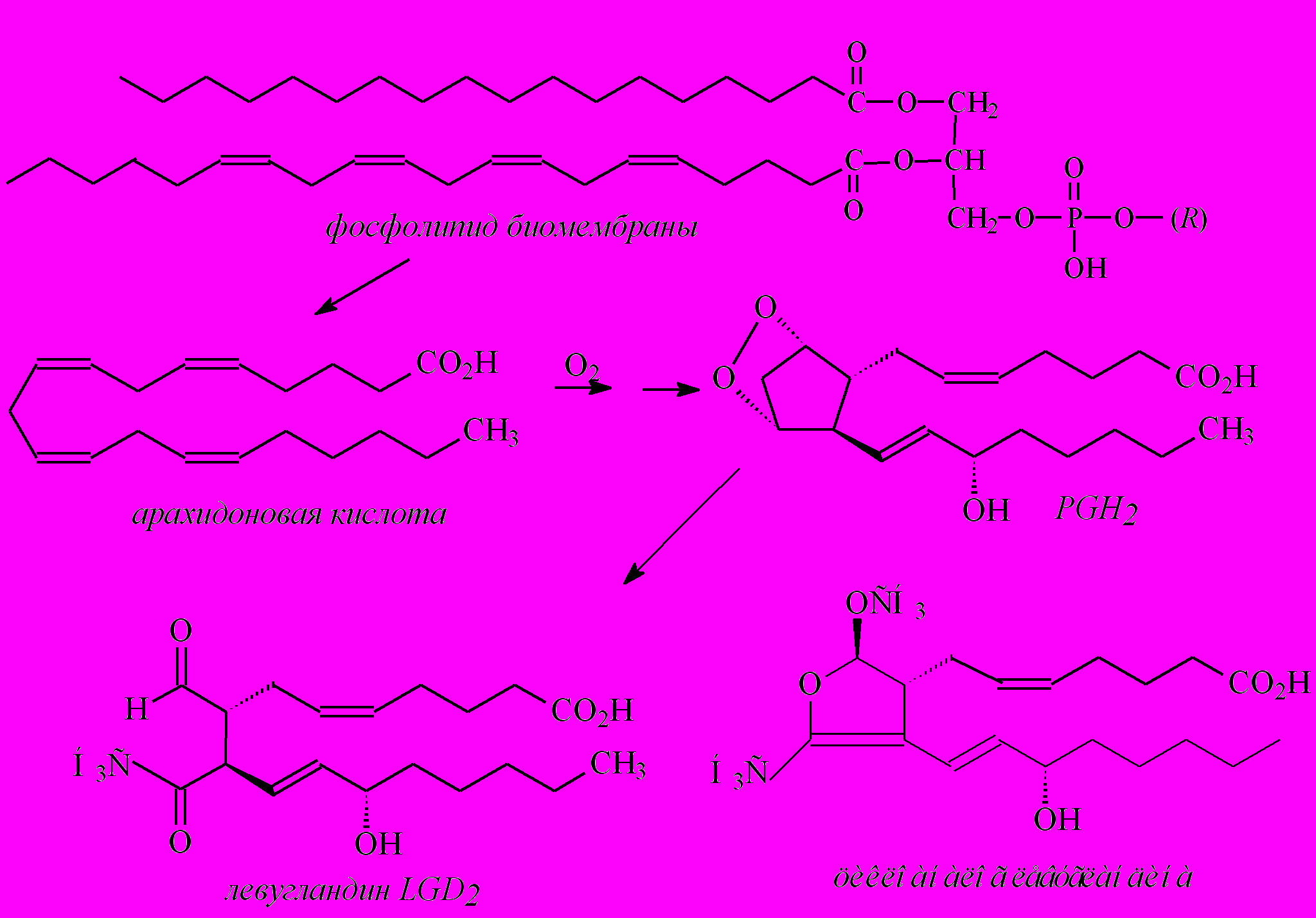
Биогенетически близкие к полиеновым кислотам биологических мембран изопреноиды (витамины группы Е и К, каротиноиды) могут функционировать в качестве эффективных антиоксидантов. Комплементарность структуры молекул позволяет нативным биоантиоксидантам – токоферолам (α–токоферолу) «встраиваться» в наноструктуру биологических мембран. Вероятно, при этом образуются супрамолекулярные комплексы α–токоферола и радикальных интермедиатов метаболизма полиеновых эйкозаноидов, в частности, левугландинов.
Таким образом, за счет взаимного соответствия пространственной структуры биоантиоксиданта и углеводородного фрагмента оксилипинов происходит инактивация свободнорадикального окисления полиеновых липидов и обеспечивается поддержание структурно-функциональной целостности биологических мембран.
НОВЫЕ АНТИОКСИДАНТЫ НА ОСНОВЕ ХИМИЧЕСКОЙ
МОДИФИКАЦИИ СТРУКТУРЫ ТИРОЗОЛА С.
ВЗАИМОСВЯЗЬ СТРОЕНИЯ И АНТИОКСИДАНТНОГО
ДЕЙСТВИЯ
1 СторожокН.М., 1Гуреева Н.В., 1Халитов P.A., 1 СторожокА.С., 2
Крысин А.П.
1ГОУ ВПО «Тюменская государственная медицинская академия»
Росздрава; nadinstor@mail.ru
2Институт органической химии им. Н.Н. Ворожцова СО РАН
Тирозол С 4-(2/-гидроксиэтил)фенол – действующее вещество радиолы розовой - известный тоник и алаптоген. С целью создания эффективных ингибиторов окисления, сохраняющих особенности действия биоантиоксидантов (биоАО), на его основе создано ряд структур, отличающихся между собой количеством фенольных групп, а также степенью экранированности, создаваемой о-трет-бутильным заместителем. Среди исследуемых веществ - производные катехина (о-гидрокситирозол, трет-бутил.-о.-гидрокситирозол, экранированный аналог - 2-трет-бутилтирозол. В работе изучено ингибирующее действие и антирадикальная активность тирозола и химически модифицированных аналогов в сравнении известными синтетическими АО и биоА. Антиоксидантную активность (АОА) индивидуальных соединений тестировали манометрическим методом на модели АИБН-инициированного окисления метилолеата (МО) в хлорбензоле при соотношении с субстратом (1:1), (АИБН) (С=3×10-3 М), Т= 333 К. Константа скорости реакции 7 оценивали хемилюминесцентным методом (ХЛ). Было показано, что тирозол, равно как и его экранированные аналоги проявляет относительно невысокую активность в реакции с пероксильными радикалами (k7=1,0×104 M-1×c-1). Введение в структуру тирозола орто-–ОН-группы приводит к увеличению скорости гибели свободных радикалов в 40 раз. Для гидрокситирозола значение константы составляет k7=4,0×105 M-1×c1. Показано, что гидроксилирование тирозола приводит к увеличению АОА аналога в 1,5 раза. Введение о-трет-бутильного заместителя усиливает ингибирующее действие в 3,5 раза, введение двух заместителей – более чем в 4,0 раза. Максимальный ингибирующий эффект наблюдался у трет-бутил-о.-гидрокситирозола, структурная модификация которого включала одновременно и гидроксилирование, и алкилирование. Действие изученных соединений уступало α-токоферолу и дибунолу. Установлено, что зависимость величины периодов индукции от концентрации исследуемых соединений , как и для большинства биоАО (α-токоферола, ряда каротиноидов, флавоноидов) носит экстремальный характер. Показано, что в результате направленного синтеза получены новые эффективные ингибиторы окисления, сохраняющие особенности действия биоАО.
CОСтояние слизистой оболочки толстого
кишечника крыс под влиянем производного
малеимида цитостатического действия в условиях оксидативного стресса
Харчук И.В., Рыбальченко Т.В., Гебура М.П., Рыбальченко В.К.
Киевский национальный университет имени Тараса Шевченка, 01601, Киев, ул. Володымырська, 64, kharchukirina@ukr.net
Одним из наибольших вызовов современной потивоопухолевой терапии является поиск высокоселективных препаратов, которые угнетают деление и рост злокачественных и не влияют на другие клетки. Новый ингибитор протеинкиназ – производное малеимида 1-(4-Cl-бензил)-3-Cl-4-(CF3-фениламино)-1Н-пирол-2,5-дион (МИ-1) был синтезирован при помощи in silico дизайна как блокатор тирозиновых киназ. В условиях in vitro МИ-1 угнетает пролиферативную активность злокачественных клеток (особенно клеток рака толстого кишечника) и оказывает незначительное влияние на культуры нормальных фибробластов и эндотелиоцитов. Важным показателем целевого действия МИ-1 есть его низкая токсичность по отношению к тканям с высокой пролиферативной активностью в опытах in vivo (слизистая оболочка тонкого кишечника, сперматогенный эпителий), а также по отношению к печени, почкам, поджелудочной железе. Оксидативный стресс может быть как причиной канцерогенеза, так и его сопутствующим состоянием. Поэтому при тестировании новых препаратов важно исследовать их биологические эффекты в условиях нарушения прооксидантно-антиоксидантного равновесия. Целью работы стало исследование структурно-функционального состояния слизистой оболочки толстого кишечника крыс под влиянием МИ-1 в условиях оксидативного стресса. Исследование проведено на 24 белых крысах-самцах весом 180-200 г. Оскидативный стресс молелировали ежедневным внутрибрюшинным введением 0,1 мл СоCl2 в 0,09%-ом NaCl в дозе 15мг/кг на протяжении 10 дней. МИ-1 вводили крысам интрагастрально в 0,1 мл подсолнечного масла ежедневно в дозе 5 мг/кг (1/100 LD50). После стандартной гистологической обработки состояние слизистой кишечника оценивали по результатам морфометрических исследований, которые были проведены при помощи светового микроскопа Olympus BX-41 и програмы Image J.
Оксидативный стресс вызывает дистрофические изменения в слизистой оболочке толстого кишечника, о чём свидетельствует уменьшение толщины слизистого слоя (на 17%) и глубины крипт (на 13%). Уменьшение количества и размеров бокаловидных клеток (на 38%) указывает на уменьшение количества продуцируемой слизи. Об угнетении функциональной и пролиферативной активности епителиоцитов свидетельствует уменьшение высоты клеток и площади их ядер соответственно на 15% и 25%, а также уменьшение митомического индекса на 32%. МИ-1 не вызывает изменений структуры и пролиферативной активности клеток эпителия слизистого слоя толстого кишечника, хотя несколько угнетает слизеобразование за счёт уменьшения размеров бокаловидных клеток на 28%. В условиях оксидативного стресса МИ-1 частично предотвращает неблагоприятное воздействие последнего на морфо-функциональное состояние слизистой оболочки толстого кишечника, оказывает протективное действие по отношению к функциональной активности крипт слизистого слоя и пролиферативной активности клеток эпителия. Однако, при совместном действии МИ-1 и оксидативного стресса истончение слизистого слоя, угнетение функциональной активности эпителиоцитов и уменьшение слизеобразования остаются на уровне индивидуального воздействия оксидативного стресса. Таким образом, производное малеимида с цитостатическими свойствами частично улучшает морфо-функциональное состояние слизистой оболочки толстого кишечника крыс в условиях оксидативного стресса.
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ ПИРИДИЛГИДРАЗОНОВ ПРИ ИНИЦИИРОВАННОМ ОКИСЛЕНИИ ЭТИЛБЕНЗОЛА
Хижан Е.И., Белая Н.И., Моренко В.В.
Донецкий национальный университет, г. Донецк, ул. Университетская, 24, 83001, Украина; (062) 302-07-93; a_khyzhan@telenet.dn.ua
Одним из путей получения новых антиоксидантов и биоантиоксидантов является введение гетероциклов в состав молекулы эффективных ингибиторов - акцепторов пероксирадикалов: фенолов, аминов, фенилгидразонов. Особое внимание в настоящее время уделяют соединениям арилгидразонового ряда, что вызвано их широкими синтетическими возможностями, физиологической активностью, лабильной N-H–связью при более низкой по сравнению с аминами токсичностью. Представителями этого класса соединений являются пиридилгидразоны. Перспективность производных гетероциклических соединений как антиоксидантов с учетом разнообразия их позитивных биологических эффектов связана с возможностью осуществлять торможение по разным механизмам вследствие полифункциональности соединений, то есть выступать ингибиторами комбинированного действия. При этом особую роль имеет медицинский аспект проблемы, поскольку производные N-содержащих гетероциклов являются физиологически активными соединениями, применяемыми в качестве лекарственных средств при антиоксидантной терапии. Так медные комплексы пиридилгидразонов проявляют выраженную противоопухолевую активность.
Целью данной работы стало изучение антиоксидантных свойств пиридилгидразонов гидроксибензальдегидов хемилюминесцентным методом при инициированном азодиизобутиронитрилом окислении этилбензола.
Ранее была исследована антиоксидантная активность арилгидразонов ароматических альдегидов, было определено, что реакционным центром, по которому идет обрыв пероксирадикалов, является NH-группа гидразонового фрагмента молекулы, что обусловлено низкими значениями прочности этой связи. Этот фактор предопределяет очень высокие значения (~106 л/мольс) константы скорости взаимодействия гидразонов с пероксирадикалами этилбензола (k7). Однако при этом повышается реакционная способность соединений и в реакциях непродуктивного расходования с молекулярным кислородом и гидропероксидами, что приводит к снижению стехиометрического коэффициента ингибирования (f≥1). Для предотвращения нежелательных побочных процессов необходима оптимизация прочности NH-связи путем введения гетероатомов в гидразонную часть молекулы, что и реализуется в случае пиридилгидразонов. В данной работе установлено, что антиоксидантная активность исследованных веществ обусловлена их антирадикальной активностью. Для этих веществ k7 и f находятся на уровне таковых значений для стандартного ингибитора – ионола (104 л/мольс и 2, соответственно). Сравнено ингибирующее действие пиридилгидразонов и пиридилгидразина. Высокое значение k7 = (7,7±0,7)·105 л/мольс для пиридилгидразина при f = 0,49 соответствует установленным ранее закономерностям влияния прочности NH-связи на эффективность ингибирующего действия антиоксидантов.
В ряду исследованных соединений наибольшей антиоксидантной активностью обладает 3-пиридилгидразон 3,4-дигидрокси-5-метоксибензальдегида (k7 = (5,6±0,4)·105 л/мольс), что объясняется наличием нескольких реакционных центров в молекуле соединения (гибридный антиоксидант).
Влияние мелатонина на возрастные изменения
активности антиоксидантных ферментов у крыс с различным функциональным состоянием эпифиза
Хижкин Е.А.1, Илюха В.А.1,2, Виноградова И.А.2 Лотош Т.А.2
1 Институт биологии Карельского научного центра РАН, г. Петрозаводск, 185910, ул. Пушкинская, 11, (8142) 573107, hizhkin84@mail.ru
2 Петрозаводский государственный университет, г. Петрозаводск,
пр. Ленина, 33, (8142) 769871
К настоящему времени установлено, что возрастные изменения активности антиоксидантных ферментов (АОФ), участвующих в поддержании на стационарном уровне активных форм кислорода (АФК), протекают неравномерно в различных органах и тканях, из-за неодинаковой выраженности, скорости и направленности. Путем введения в организм дополнительных антиоксидантов, к числу которых относится и основной гормон эпифиза – мелатонин (МТ), можно влиять на активность АОФ. Фактором, регулирующим синтез МТ эпифизом, является свет. Изменение функционального состояния шишковидного тела под влиянием световых режимов приводит либо к снижению синтеза МТ (при постоянном освещении), либо к усилению его выработки (при постоянной темноте).
Целью нашей работы являлось изучение влияния МТ на активность супероксиддисмутазы (СОД) и каталазы в печени, почках и сердце крыс разного возраста (6, 12, 18 и 24 месяца) с измененной постоянным освещением и световой депривацией функциональной активностью эпифиза.
В результате исследования было выявлено органоспецифичное возрастное снижение активности АОФ у крыс, свидетельствующее о старении АОС. Световые режимы, отличающиеся от регулярно чередующегося, модулировали этот процесс. Наиболее выраженными изменения были у животных, содержавшихся при постоянном освещении. Действие МТ в большинстве случаев зависело от световых условий, в которых содержались крысы. Так, введение экзогенного гормона на фоне низкого базального уровня эндогенного МТ (при постоянном освещении) приводило к замедлению процесса старения ферментативного компонента АОС – активность исследованных ферментов приближалась к таковой, наблюдаемой у крыс при регулярно чередующемся освещении. Влияние постоянной темноты оказалось сходным с действием экзогенного МТ и характеризовалось замедлением возрастного снижения активности как СОД, так и каталазы. Данный эффект, вероятно, связан с некоторым усилением синтеза и секреции МТ у крыс постоянно содержавшихся в условиях световой депривации.
Работа выполнена при финансовой поддержке РФФИ (грант № 07-04-00546) и Гранта Президента РФ НШ–3731.2010.4.
РЕАКЦИОННАЯ СПОСОБНОСТЬ ФЕНОЛОВ В МОДЕЛЬНЫХ РЕАКЦИЯХ
Белостоцкая И.С., Бурлакова Е.Б., Мисин В.М., Никифоров Г.А., Храпова Н.Г., Штолько В.Н.
Институт биохимической физики им Н.М. Эмануэля РАН, 119334 Москва, ул. Косыгина, 4; (495)939-74-09; misin@sky.chph.ras.ru
Окисление в жидкой фазе является цепной реакцией с вырожденным разветвлением. Антиоксиданты (АО) уменьшают суммарную скорость окисления (антиоксидантная активность - АОА) как за счет взаимодействия АО с пероксильными радикалами с константой скорости k7 (антирадикальная активность - АРА), так и за счет распада разветвляющих цепь окисления агентов (гидропероксидов) без образования свободных радикалов. Общая АОА зависит не только от k7 , но и от активности образующегося радикала ингибитора, способного участвовать в побочных реакциях, что резко снижает АОА. Для большинства изученных фенолов в среде углеводородов значения констант k7 лежат в интервале 103 106 М –1с –1. Существенное влияние на величину констант k7 оказывают донорно-акцепторные свойства о- и - заместителей и степень пространственного экранирования гидроксильной группы фенолов. В работе приведены значения относительной АОА (ε) и константы k7 для фенолов с различными п – заместителями (табл. 1). Обнаружено, что донорные заместители (-СН3, -СН2NH2, -NHCOCH3) увеличивают величины ε и k7, а акцепторные заместители (-CN, -С6Н5) уменьшают те же величины.
| Табл. 1 R4 – п-заместитель; R2 = R6 = -C(CH3)3 | ||
| R4 | | k7∙10-4 , М-1∙с-1 |
| H | 0,7 | 0,95 |
| CH3 | 1,0 | 2,5 |
| C(CH3)3 | 0,7-0,8 | 1,3 |
| CH2NH2 | 1,8 | 2,5 |
| NHCOCH3 | 2,0 | 8,5 |
| CN | 0,7 | 0,25 |
| C6H5 | 0,75 | 0,04 |
Удаление n-функциональных групп от ароматического ядра на несколько метиленовых мостиков сначала увеличивает константу k7 (при n = 2 значение k7 наибольшие), затем с увеличением числа n значение k7 уменьшается.
Введение алкильных заместителей в о- положения вызывает нарушение компланарности. Нарушение компланарности приводит к некоторому удлинению ОН-связи, к снижению ее прочности и, следовательно, увеличению констант k7 (табл. 2) Однако при введении в молекулу фенола объемных о- заместителей, особенно двух трет-бутильных, наблюдается резкое снижение константы k7, поскольку объемные заместители создают стерические препятствия для реакции фенола с пероксильными радикалами. Во все остальных случаях значение константы k7 значительно выше.
Табл. 2 R4 –
| R4= -NH2 | k7∙ 10-4, М-∙с-1 | R4= -CN | k7∙ 10-4, М-1∙с-1 | R4= -COOH | k7∙ 10-4, М-1∙с-1 | |||
| R2 | R6 | R2 | R6 | R2 | R6 | |||
| CH3 | CH3 | 14,5 | CH3 | CH3 | 5,5 | CH3 | CH3 | 10,6 |
| CH3 | C(CH3)3 | 9,6 | CH3 | C(CH3)3 | 5,3 | CH3 | C(CH3)3 | 7,2 |
| i-C3H7 | i-C3H7 | 12,0 | i-C3H7 | i-C3H7 | 6,2 | i-C3H7 | i-C3H7 | 6,9 |
| C6H5 | C6H5 | 16,5 | C6H5 | C6H5 | 7,4 | C6H5 | C6H5 | 8,5 |
| C(CH3)3 | C(CH3)3 | 2,5 | C(CH3)3 | C(CH3)3 | 0,9 | C(CH3)3 | C(CH3)3 | 1,8 |
Образующиеся из 2,6-ди-трет-бутилфенолов радикалы из-за стерических препятствий не могут вступать в побочные реакции, что приводит к увеличению АОА.
