Российская академия наук
| Вид материала | Тезисы |
- Основание Петербургской академии наук, 49.85kb.
- Спонсоры конференции: Фармацевтическая фирма «Санофи-Авентис», 74.5kb.
- Ш. Н. Хазиев (Институт государства и права ран) Российская академия наук и судебная, 297.05kb.
- Научный журнал «Вопросы филологии» Оргкомитет: Сопредседатели, 53.54kb.
- Научный журнал "Вопросы филологии" Оргкомитет: Сопредседатели, 47.73kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- Н. д кондратьева Международный фонд Н. д кондратьева и Российская академия естественных, 13.13kb.
- Российская академия наук отделение общественных наук ран, 74.85kb.
- Высочество Князь Монако Альберт II и другие. Сдоклад, 38.69kb.
- Ипээ ран www sevin ru, 22.27kb.
Changes of polyphenol metabolism in wine grape
berries induced by postharvest treatments
P. Tonutti
Scuola Superiore SantAnna, Pisa, Italy
e.mail: pietro.tonutti@sssup.it
Postharvest controlled stresses or treatments with specific elicitors can be applied to induce desired physical/chemical changes and/or to positively affect metabolism and phytochemical content. In wine grapes both strategies, individually applied or coupled, can be used to modulate berry composition and, as a consequence, affect wine quality traits. Postharvest berry dehydration is applied for the production of dessert, “passiti”, or reinforced wines and the withering process can be carried out under different environmental conditions that markedly affect the dehydration rates and, as consequence, the berry metabolism. Metabolic and molecular (microarray and RT-PCR) analyses have been performed in wine grape berries subjected to dehydration, at different rates, up to 30% of weight loss. Marked changes in phenol compound biosynthesis (stilbene compounds, in particular) have been detected in the skins where several polyphenol-related genes appeared differentially expressed. When stored in dehydration chambers or tunnels, specific treatments with gaseous elicitors can also be performed. Even though grape berries are classified as non-climacteric fruit, they respond to exogenous ethylene treatments performed in the field (at veraison stage) or after harvest. Postharvest treatment with gaseous ethylene (1000 ppm for 36 h) on red-skinned grapes was effective in inducing changes in skin gene expression, metabolism and composition. These ethylene-induced changes resulted in a modified composition of the wine where polyphenol categories (flavonoids, proanthocyanidins, anthocyanins) markedly increased, aroma compounds (C13, esters and phenols) were higher and the ratio free/glycosylated aroma compounds changed compared with the wine obtained from untreated berries. A marked effect on specific polyphenol categories (flavan-3-ols) has been observed in white-skinned grapes treated for 3 days, after harvest, with high CO2 concentrations (30%). Microarray analyses revealed a number of differentially expressed targets (292) in CO2-treated berries: some of these genes appeared to be involved in hormone metabolism and signalling, in oxidation/reduction reactions, and in senescence-related processes. Taken together, our results demonstrate the great potential for the development and application of postharvest strategies to modulate the composition of the berries and, as a consequence, that of the resulting wines with enhanced antioxidant properties.
ВЛИЯНИЕ МЕКСИДОЛА НА БИОХИМИЧЕСКИЕ СВОЙСТВА ГЛИКОЛИТИЧЕСКИХ ФЕРМЕНТОВ И МИКРОВЯЗКОСТЬ МЕМБРАН В СУБКЛЕТОЧНЫХ ФРАКЦИЯХ КЛЕТОК МОЗГА МЫШЕЙ.
Трещенкова Ю.А., Герасимов Н.Ю., Голощапов А.Н.
Институт биохимической физики им. Н.М. Эмануэля РАН,
Москва, 119334, ул. Косыгина, 4. Тел. (495)939 79-31.
e-mail:tresch@sky.chph.ras.ru
Известно, что мексидол (из класса 3-оксипиридинов) обладает широким спектром действия на метаболические процессы в клетке. Оказывает антиоксидантное, антигипоксическое, мембранопротекторное действие. Повышает устойчивость организма к воздействию различных повреждающих факторов, улучшает энергетический обмен в клетке. В работе изучали действие мексидола на биохимические свойства (Vmax, Km) альдолазы и лактатдегидрогеназы (ЛДГ), микровязкость мембран микросом и синаптосом клеток мозга после воздействия четыреххлористого углерода (CCl4). Мексидол вводили в/м в дозе 100 мг/кг дважды до и после введения в/б CCl4 в масле. Субклеточные фракции (цитоплазму, микросомы, синаптосомы) получали с помощью дифференциального центрифугирования при 100000 g, синаптосомы очищали в градиенте сахарозы. Микровязкость в мембранах изучали методом спиновых зондов с использованием иминоксильного радикала: 2,2,6,6-тетраметил-4-каприлоилоксипиперидин-1-оксил (1) и 5,6-бензо-2,2,6,6-тетраметил-1,2,3,4-тетагидро-карболин-3-оксил (2). Показано, что у интактных мышей мексидол в одинаковой степени уменьшал Vmax / мг белка альдолазы и ЛДГ(на 10-20%) в цитоплазме и увеличивал этот параметр в микросомах. Мексидол влиял на сродство ферментов к их субстратам: пирувату для ЛДГ и фруктозо-1,6-дифосфату для альдолазы (значения Km уменьшались в 1,3-1,5 раза). После введения CCl4 существенно возрастали значения параметров (в 1,7-1,8 раза) альдолазы и Km ЛДГ в цитоплазме. CCl4 практически не оказывал влияние на параметры альдолазы и ЛДГ в микросомах. Мексидол не влиял Vmax / мг белка ферментов, но значительно увеличивал сродство ферментов к их субстратам (значения Km уменьшались) и в большей степени для ЛДГ. У интактных мышей мексидол влиял на микровязкость как в области липидной компоненты для зонда 1 (увеличение), так и в области липид-белковых контактов для зонда 2 (уменьшение) липидного бислоя мембран микросом и синаптосом. CCl4 незначительно уменьшал микровязкость для обоих зондов микросомальных мембран. Действие CCl4 вызывало существенное увеличение (в 1,35 раза) микровязкости (уменьшение текучести) в области липид - белковых контактов (для зонда 2) бислоя мембран синаптосом. Мексидол уменьшал микровязкость (увеличивал текучесть) для зонда 2 липидного бислоя мембран синаптосом. Следует отметить, что Vmax / мг белка ферментов в мембранах микросом имели прямую направленность с изменениями микровязкости для зонда 1 и обратную для зонда 2. Таким образом, обнаружено что мексидол и CCl4 различным образом влияют на метаболизм ферментов и микровязкость мембран субклеточных фракций клеток мозга. В некоторых случаях, особенно синаптосомальных мембран, мексидол защищал от действия CCl4.
КОМПЛЕКСЫ ДИГИДРОКВЕРЦЕТИНА С ЦИНКОМ И ИХ
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ
Трофимова Н.Н., Пономарева Д.С., Остроухова Л.А., Онучина Н.А., Бабкин В.А.
Иркутский институт химии им. А.Е. Фаворского СО РАН, г. Иркутск 664033, г. Иркутск, ул. Фаворского, 1, тел/факс. 3952-511427, natrof@irioch.irk.ru
Дигидрокверцетин (3,5,7,3´,4´-пентагидроксифлаван) является ценным антиоксидантом, который в настоящее время является коммерческим продуктом, производимым в промышленных масштабах из древесины лиственницы сибирской. Области использования этого флавоноида в фармацевтической, пищевой, косметической и других отраслях промышленности непрерывно расширяются.
Цинк является одним из жизненно важных микроэлементов в организме человека. Большая его часть находится в коже, печени, почках, в сетчатке глаза, в предстательной железе. Цинк входит в состав ферментов и комплексов, обеспечивающих важнейшие физиологические функции организма.
Комплексы дигидрокверцетина с цинком показывают в лабораторных условиях повышенную эффективность в защите красных кровяных клеток от окислительной травмы, вызванной воздействием асбеста [1].
Данная работа посвящена изучению комплексообразования дигидрокверцетина (ИНПФ ООО «Химия древесины», г. Иркутск) с солями цинка, установлению их строения и исследованию антиоксидантной активности методом кулонометрии.
Определены условия синтезов, приводящие к образованию моно- и билигандных комплексных соединений с координацией флавоноидного лиганда с ионом цинка по одному из атомов кислорода в положениях 3′, 4′ кольца В.
Исследована антиоксидантная активность комплексов с использованием метода кулонометрии.
Литература:
1. Malesev D., Kuntic V. J.Serb.Chem.Soc., 72(10) 921-939 (2007).
СИнтез и Антиокислительная активность
некоторых сера- и селенсодержащих
аналогов фенозан-кислоты
Трубникова Ю.Н., Гаас Н.А., Ягунов С.Е., Марков А.Ф.,
Кандалинцева Н.В.
НИИ химии антиоксидантов
Новосибирского государственного педагогического университета
630126, г. Новосибирск, ул. Вилюйская, 28, Факс (383)2441856
E-mail: chemistry@ngs.ru
Создание эффективных водорастворимых антиоксидантов является одним из приоритетных направлений современного этапа развития химии фенольных соединений. Результаты многочисленных научных исследований позволяют сделать вывод о перспективности применения таких водорастворимых фенольных антиоксидантов, как фенозан-кислота и её калиевая соль. Вместе с тем известно, что введение бивалентной серы в молекулы алкилфенолов повышает антиоксидантную активность последних и позволяет получать полифункциональные антиоксиданты, обладающие как антирадикальной, так и противопероксидной активностью.
Целью настоящей работы явились синтез и сравнительное исследование противоокислительных свойств сера- и селенсодержащих аналогов фенозан-кислоты – гидроксиарилтиоалкановых и гидроксиарилселеналкановых кислот 1-4:
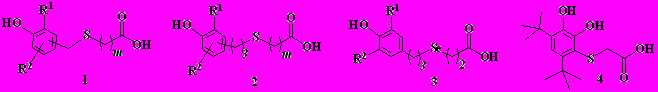
где R, R1= Н, Me, i-Pr, t-Bu, cyclo-C6H11; m=1-4
Соединения 1-4 были получены из фенола, орто-крезола, 2,6- и 2,4-диалкилфенолов, а так же пирокатехина через ряд промежуточных стадий.
Антирадикальную активность синтезированных кислот изучали в модельной реакции инициированного окисления метилолеата в водно-мицеллярном растворе додецилсульфата натрия. Показано, что константы скорости взаимодействия соединений 1, 2 с пероксорадикалами (k7) зависят главным образом от числа и строения орто-алкильных заместителей. Вместе с тем, бензильные производные 1 по величинам k7 несколько уступали своим пропильным гомологам 2.
О противопероксидной активности кислот 1- 4 судили по их влиянию на кинетику разложения гидропероксида кумола (ГПК) в среде уксусной кислоты при 60ºС. Установлено, что соединения 2 и 4 взаимодействуют с ГПК в мольном отношении 1:1 или 1:2, в то же время каждая молекула бензилтиоалкановых и селеналкановых кислот (1 и 3, соответственно) разлагает не менее 10 молекул ГПК. При этом кинетические кривые разложения ГПК под действием соединений 1 имеют выраженный S-образный характер, что свидетельствует об автокаталитическом протекании процесса.
Показано, что соединения 1-4 эффективно ингибируют термическое автоокисление жировой фракции столового маргарина и водной эмульсии метилолеата.
АНТИРАДИКАЛЬНОЕ ДЕЙСТВИЕ ФЕНИЛПРОПАНОИДОВ ИЗ РОДИОЛЫ РОЗОВОЙ НА РАСТИТЕЛЬНЫЕ КЛЕТКИ
Урманцева В.В., Волкова Л.А., Носов А.М.
Институт физиологии растений им.К.А.Тимирязева РАН,127276 Москва, Ботаническая ул., 35, факс (495) 977-80-18,
la-volkova@yandex.ru
Исследовали антиоксидантную (АО) активность фенилпропаноидов (ФП) из экстракта корней родиолы розовой ( Rodiola rosea), в составе которого присутствуют розавин, розаридин, розарин, розин, салидрозид, тирозол и др., полученные из Центра передовых биологических технологий института генетики и физиологии Академии наук Республики Молдова (1).
Антирадикальную активность (АРА) в отношении супероксида и гидроксил-радикала определяли в водной среде в бесклеточной системе. Под действием ФП (100мкМ) наблюдали снижение содержания супероксида более, чем на 90 % по сравнению с контролем, превышая АРА по аскорбиновой кислоте. АРА ФП в отношении гидроксил-радикала определяли по уровню ТБК-активных продуктов (ТБК-АП), образующихся при окислении 2-дезоксирибозы в реакции Фентона. При концентрации ФП 5-10 мкМ уровень ТБК-АП составлял только 30% от контрольного. При увеличении концентрации ФП до 200 мкМ величина ТБК-АП повышалась и составила 70% от контроля. При концентрации 2000 мкМ наблюдалось уже прооксидантное действие - превышение на 45 % от контрольного уровня. Эффективность действия ФП в отношении супероксида более, чем в два раза превосходила таковую в отношении гидроксил-радикала.
Показано, что в нестрессовых условиях уровень ПОЛ под влиянием ФП как в растениях картофеля in vitro, так и в культуре клеток диоскореи, снижался в среднем на 25 % по сравнению с контролем. Известно, что СОД является одним из основных поставщиков пероксида в клетке, дисмутируя супероксид-радикал. Уменьшение количества Н2О2, являющегося субстратом для каталазы и аскорбатпероксидазы, по-видимому, привело к снижению их активности при действии ФП. Гваяколзависимая пероксидаза также практически не изменила свою активность, поскольку ФП в тех количествах, которые проникли в клетки, не конкурировали с более простым фенолом – гваяколом.
У растений картофеля в условиях окислительного стресса, вызванного действием параквата (50 мкМ, 5 мин), ФП (100 мкМ, 30 мин) снизили уровень ПОЛ на 40 %, замедляя темпы пероксидации липидов мембран.
Таким образом, ФП обладают высокой АРА и могут быть эффективны при окислительном стрессе, когда в клетках происходит избыточная генерация АФК. ФП можно рассматривать как ловушки свободных радикалов, защищающих клетки от их повреждающего воздействия.
1.Dascaliuc A. et al. Advanced Biological Technologies and their impact on Economy. Proceeding of the Symposium, Chisinau, 2005, pp. 112-117
ПРОБЛЕМЫ АНТИОКСИДАНТОТЕРАПИИ
Фархутдинов Р.Р.
Башкирский государственный медицинский университет, г. Уфа (450000, г. Уфа, ул. Ленина 3, БГМУ, ЦНИЛ, 8-917-4231364, farkhutdinov@mail.ru )
В последнее время резко возросло внимание к применению антиоксидантов (АО) в медицине, пищевой промышленности и т.д. Многочисленные экспериментальные и клинические наблюдения показали, что как избыточное, так и недостаточное образование свободных радикалов (СР) влияет на течение различных заболеваний. Очень важным, с практической точки зрения, является возможность направленного изменения скорости свободнорадикального окисления (СРО). Поддержание СРО в организме на оптимальном уровне играет существенное значение в оздоровлении лиц, подвергающихся физическим и психоэмоциональным перегрузкам, действию негативных факторов среды, ослабленных и часто болеющих детей, больных с хроническими заболеваниями. Проблемы АО терапии заключаются в необходимости установления единой унифицированной системы количественной и качественной оценки АО активности лекарственных препаратов, биологически активных добавок, пищевых продуктов и т.д., научном обосновании возможностей и целесообразности их использования. Успешность применения АО зависит от наличия доказательств, что вводимый препарат действительно является АО и сохраняет эту активность в организме, выяснения механизма его действия, выявления характера и причин нарушения СРО, контроле состояния процесса окисления в ходе лечения. Необходимы простые и доступные, верифицированные экспресс методы определения АО активности, основанные на доказательной физико-химической базе. Одним из таких является регистрация хемилюминесценции- свечения, возникающего при взаимодействии СР. Другая проблема АО терапии связана с тем, что многие лекарственные препараты, помимо своего прямого фармакологического действия могут тем или иным путем влиять на процессы СРО. Некоторые из них непосредственно взаимодействуют с радикалами и продуктами окисления. Другие проявляют эти свойства лишь при введении в организм, включаясь в метаболизм и превращаясь в активные соединения, или создают благоприятные условия для изменения СРО. Например, меняя количественный и качественный состав окисляющегося субстрата, оказывая влияние на структуру биологических мембран, вызывая появление эндогенных про- или антиоксидантов и т.д. Влияние лекарственных препаратов на СРО может существенно отличаться в норме и при патологии, когда имеют место структурно-функциональные повреждения, нарушается метаболизм, развивается несостоятельность механизмов, поддерживающих скорость окисления на постоянном уровне, которые в норме в значительной степени компенсируют внешние воздействия. Предлагается следующий подход для оценки влияния различных факторов на процессы СРО. На первом этапе изучается действие препарата в простых, модельных системах. Исследуемые вещества добавляются в среды или биологические объекты, в которых инициируется образование активных форм кислорода и реакции перекисного окисления липидов- процессы, наиболее часто встречающиеся в организме. Следующий этап исследования включает введение лекарственного вещества животным, изучение СРО в крови и гомогенатах органов, в которых возможно максимальное действие препарата. Далее оцениваются особенности влияния препаратов на СРО при моделировании в эксперименте на животных патологических процессов. Наконец, в клинических условиях сопоставляется эффективность лечения больных с изменением СРО в крови.
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ ЛАЗОЛВАНА ПРИ
ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ
Фархутдинов У.Р., Петряков В.В., Фархутдинов Р.Р.,
Фархутдинов Ш.У.
Башкирский государственный медицинский университет, Больница 21, г. Уфа, 450000 г. Уфа ул. Ленина д.2 кв.46 тел. 347-272-85-57
babe @ bk.ru
Важное значение в патогенезе заболеваний легких придается процессам свободнорадикального окисления (СРО): продукции активных форм кислорода (АФК) и перекисному окислению липидов. Лекарственные препараты способны изменить интенсивность СРО, тем самым оказывать влияние на течение воспалительного процесса в легких.
Цель: изучить влияние муколитического препарата лазолвана (ЛВ) на продукцию АФК в крови и состояние местного иммунитета у больных с обострением хронической обструктивной болезни легких (ХОБЛ).
Материал и методы: обследованы 52 больных ХОБЛ со среднетяжелым и тяжелым течением заболевания. Продукцию активных форм кислорода (АФК) в крови у больных исследовали методом регистрации спонтанной (СП) и индуцированной (ИН) культурой стафилококка люминолзависимой хемилюминесценции (ХЛ). В бронхоальвеолярной лаважной жидкости (БАЛЖ) больных, полученной при фибробронхоскопии изучали клеточный состав, определяли содержание иммуноглобулинов: S-IgА, IgА и IgG. Были выделены две группы больных. Основную группу составили 25 больных ХОБЛ в лечении которых использовали традиционную терапию (антибиотики, бронхолитики, глюкокортикостероиды) и ингаляции ЛВ через небулайзер 30 мг/ сутки в течении 10 дней. В контрольную группу вошли 27 пациентов у которых использовали традиционную терапию и ингаляции плацебо (физиологический раствор).
Результаты: У больных ХОБЛ показатели СПХЛ и ИНХЛ крови были повышены в 1,3-1,5 раза, что свидетельствовало о повышенной генерации АФК. В БАЛЖ больных, по сравнению со здоровыми, было увеличено общее количество клеток (ОКК) и содержание нейтрофилов (НФ); снижено количество жизнеспособных клеток (ЖСК), альвеолярных макрофагов (АМ)) и содержание S-IgА, IgА, IgG,. При использовании ЛВ у больных ХОБЛ светосумма СПХЛ крови снизилась в 1,3 раза а светосумма ИНХЛ понизилась в 1,4 раза. В процессе лечения в БАЛЖ у этих больных снизилось ОКК (с 1,97±0,31×105г/л до 1,41±0,13×105г/л) и НФ (с 47,89±2,37% до 25,4±1,87%), повысилось количество ЖСК (с 42,4±3,89% до 70,18±3,36%) и АМ (с 47,44±1,62% до 70,2±3,65%); увеличилось содержание S-IgА в 1,9 раза, IgА в 1,5 раза, IgG в 1,3 раза. В контрольной группе больных динамика показателей ХЛ крови и местного иммунитета была не столь выраженной. После лечения, у больных получавших ингаляции ЛВ, по сравнению с контрольной группой были меньше в 1,4-1,5 раза показатели характеризующие интенсивность одышки и кашля, количество выделяемой мокроты и хрипов в легких.
Выводы: муколитический препарат лазолван обладает антиоксидантными свойствами. Применение лазолвана у больных с обострением ХОБЛ подавляет продукцию АФК в крови, улучшает клеточный состав БАЛЖ, стимулирует состояние местного иммунитета, повышает эффективность проводимой терапии.
ВЛИЯНИЕ ИММУНОВЕНИНА НА ГЕНЕРАЦИЮ АКТИВНЫХ ФОРМ КИСЛОРОДА У БОЛЬНЫХ ПНЕВМОНИЕЙ
Фархутдинов У.Р., Мирхайдаров А.М., Фархутдинов Р.Р.,
Утарбаева Г.Х.
Башкирский государственный медицинский университет; Больница 21, г.Уфа, 450000 г.Уфа ул. Ленина д.2 кв.46 тел. 347-373-85-57 babe@ bk.ru
Внебольничная пневмония (ВП) является одной из наиболее актуальных проблем в современной медицине. Важной причиной неблагоприятного течения ВП является нарушение продукции активных форм кислорода (АФК) фагоцитирующими клетками. Повышенная генерация метаболитов кислорода инициирует перекисное окисление липидов, приводит к повреждению биологических мембран. В связи с этим, у больных ВП является целесообразным использование лекарственных средств корригирующих продукцию АФК фагоцитами. Способностью воздействовать на иммунокомпетентные клетки и нормализовать активность фагоцитов обладает иммуноглобулин для внутривенного введения иммуновенин (ФГУП НПО “МИКРОГЕН”, Россия).
Цель: У больных ВП изучить генерацию АФК в крови, оценить эффективность использования иммуновенина в их комплексной терапии.
Материал и методы: У 62 больных ВП. исследовали продукцию АФК в цельной крови методом регистрации спонтанной (СП) и индуцированной (ИН) культурой стафилококка люминолзависимой хемилюминесценции (ХЛ) В сыворотке крови больных определяли содержание маркеров эндотоксикоза- молекул средней массы (МСМ). Были выделены две группы больных ВП. Первую группу составили 30 больных ВП получавшие общепринятую терапию антибактериальными, дезинтоксикационными, муколитическими препаратами. Во вторую группу вошли 32 больных ВП в комплексном лечении которых был использован иммуновенин. Препарат вводили внутривенно по 50 мл трехкратно с интервалом в 2 дня.
Результаты: При госпитализации у больных ВП показатели СПХЛ и ИНХЛ крови были повышены в 1,6- 2,4 раза. В сыворотке крови у больных, по сравнению со здоровыми, было увеличено в 1,3 содержание МСМ. Полученные данные свидетельствовали об избыточной продукции метаболитов кислорода клетками крови, развитии эндотоксикоза. Использование в комплексной терапии больных ВП иммуновенина привело к нормализации показателей ХЛ крови и содержания МСМ в сыворотке крови. После общепринятой терапии у больных ВП показатели ХЛ крови оказались значительно ниже чем у здоровых, что свидетельствовало об истощении микробицидной активности фагоцитирующих клеток. У этих больных сохранялось повышенным содержание МСМ в сыворотке крови. Характер проводимого лечения отразился на клинических симптомах заболевания. После лечения с использованием иммуновенина у больных ВП исчезли хрипы в легких, а кашель, одышка и продукция мокроты отмечались в 2,0 - 2,5 раза реже, чем у пациентов принимавших только общепринятую терапию.
Выводы: У больных ВП выявлена повышенная генерация АФК в крови. Включение иммуновенина в комплексную терапию ВП нормализует продукцию АФК в крови, устраняет проявления эндотоксикоза, улучшает результаты лечения больных.
