Российская академия наук
| Вид материала | Тезисы |
- Основание Петербургской академии наук, 49.85kb.
- Спонсоры конференции: Фармацевтическая фирма «Санофи-Авентис», 74.5kb.
- Ш. Н. Хазиев (Институт государства и права ран) Российская академия наук и судебная, 297.05kb.
- Научный журнал «Вопросы филологии» Оргкомитет: Сопредседатели, 53.54kb.
- Научный журнал "Вопросы филологии" Оргкомитет: Сопредседатели, 47.73kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- Н. д кондратьева Международный фонд Н. д кондратьева и Российская академия естественных, 13.13kb.
- Российская академия наук отделение общественных наук ран, 74.85kb.
- Высочество Князь Монако Альберт II и другие. Сдоклад, 38.69kb.
- Ипээ ран www sevin ru, 22.27kb.
ИССЛЕДОВАНИЕ АНТИРАДИКАЛЬНОЙ АКТИВНОСТИ
БИЛИРУБИНА В МОДЕЛЬНЫХ СИСТЕМАХ
Соломонов А.В., Румянцев Е.В., Антина Е.В.
Ивановский государственный химико-технологический университет, г. Иваново, 153000, пр. Ф. Энгельса, 10, тел. (4932)327256,
E-mail: evr@isuct.ru.
Институт химии растворов Российской академии наук, г. Иваново, 153045, ул. Академическая, 1, тел. (4932)336259,
E-mail: eva@isc-ras.ru
Интерес к исследованию антиоксидантных свойств билирубина вызван его важнейшей ролью в предотвращении свободнорадикальных процессов в сердечной мышце и нервной ткани. Возможно, это открытие может лечь в основу новых методов лечения кардиологических, онкологических и нейродегеративных заболеваний. Однако механизм антиоксидантного действия билирубина до сих пор остается неопределенным. Квантово-химическое моделирование процесса процесса окисления билирубина с применением полуэмпирических методов AM-1 и PM-3 показывает, что образование биливердина и дипирролилметеновых производных энергетически менее выгоден по сравнению процессом последовательного отщепления терминальных пиррольных колец и распада молекулы до монопиррольных продуктов, что согласуется со спектральными данными: в спектрах поглощения ни в одном из случаев не зафиксирован биливердин – продукт, образующийся в результате окисления билирубина по –CH2– мостику, соединяющего два дипирролилметеновых фрагмента, и вероятный механизм окисления пигмента связан с возможностью взаимодействия протонов NH-групп молекул билирубина с пероксильными или гидроксильными радикалами. Ранее было показано, что билирубин составляет конкуренцию одному из самых эффективных антиоксидантов – аскорбиновой кислоте. Поэтому исследования окислительных превращений этих двух соединений при совместном присутствии становятся актуальными. В экспериментах по совместному окислению аскорбиновой кислоты и билирубина не зафиксировано образование радикальной формы аскорбиновой кислоты и дегидроаскорбиновой кислоты. Данные по константам скоростей реакций окисления свидетельствуют о том, что в свободном состоянии аскорбиновая кислота окисляется быстрее билирубина, однако в смеси билирубин предохраняет витамин С от окисления: константа скорости реакции окисления BR возрастает, в то время как константа скорости реакции окисления аскорбиновой кислоты падает по сравнению с окислением их в свободном состоянии.. Окисление билирубина в системе Фентона приводит к значительному росту скорости реакции из-за более высокой реакционной способности OH•-радикалов. Реакционная способность билирубина в составе молекулярного комплекса с альбумином по отношению к радикалам оказывается сниженной за счет эффекта «белковой защиты». Продолжение исследований в данной области может внести существенный вклад в развитие новых методов лечения кардиологических, онкологических и нейродегеративных заболеваний.
Работа выполнена при поддержке гранта Президента РФ для молодых российских ученых – кандидатов наук (проект № МК-313.2009.3), а также АВЦП «Развитие научного потенциала высшей школы (2009-2010 гг.)» (проект № 2.1.1/827).
ИЗМЕНЕНИЕ СОДЕРЖАНИЯ ФЕНОЛОВ И АКТИВНОСТЬ
ФЕНОЛЬНОЙ ПЕРОКСИДАЗЫ В ПРОРОСТКАХ ЯЧМЕНЯ В
УСЛОВИЯХ ПРОГРЕССИРУЮЩЕЙ ПОЧВЕННОЙ ЗАСУХИ
Спивак Е.А.
Институт биофизики и клеточной инженерии НАН Беларуси, г. Минск, ул. Академическая, 27, тел. +375298643414, e-mail spivak_e@inbox.ru
Первичной реакцией растения на абиотический стресс (засуху, низкие и высокие температуры, катионы тяжелых металлов и др.) на клеточном уровне является изменение окислительного потенциала, связанное с избыточной генерацией активных форм кислорода (АФК). В детоксикации АФК в растительной клетке наряду с низкомолекулярными антиоксидантами, такими как аскорбат, глутатион, токоферол, принимают участие фенольные соединения, которые способны непосредственно взаимодействовать с АФК и радикалами жирных кислот. Особый интерес фенолы вызывают как доноры электронов в реакциях с пероксидом водорода (Н2О2), катализируемых пероксидазами, специфичными к фенолам (ФПР). В данной работе исследовали влияние почвенной засухи на содержание водорастворимых фенолов и активность ФПР в растениях ячменя. В опытах использовали 1-ый лист зеленых проростков ячменя (Hordeum vulgare L.) сорта Гонар. Почвенную засуху моделировали в лабораторных условиях. Проростки выращивали в почве в течение 19 сут. Опытные растения не поливали с момента посадки. Сосуды с контрольными растениями взвешивали ежедневно и вес почвы в сосудах при необходимости доводили водой до первоначального значения. Пробы для анализа отбирали через 7, 10, 13, 16 и 19 сут с момента посадки. Установлено, что действие почвенной засухи на проростки сопровождалась интенсификацией окислительных процессов − увеличением общего уровня АФК и накоплением продуктов перекисного окисления липидов. Следует отметить, что содержание Н2О2 в проростках ячменя в условиях засухи было ниже, чем в контроле. Показано, что содержание водорастворимых фенольных соединений в 7-дневных проростках ячменя, выращиваемых в условиях почвенной засухи, было на 20% ниже, а активность ФПР на 60% выше, чем в контроле. По мере старения контрольных проростков ячменя активность ФПР в них увеличивалась и уже на 19 сутки в 5 раз превышала уровень, зарегистрированный в 7-дневных растениях. В опытных проростках ячменя активность ФПР в меньшей степени увеличивалась с возрастом: активность фермента на 19 сут в 2,5 раза превышала уровень, зарегистрированный в варианте 7 суток, и была на 30% ниже, чем в контрольных растениях того же возраста. При этом количество водорастоворимых фенолов в обоих вариантах значительно не изменялось. Активность ФПР в растительной клетке связывают с процессом лигнификации клеточной стенки с участием фенолов. Зарегистрированное нами снижение количества фенольных соединений и увеличение активности фенольной пероксидазы в проростках ячменя при засухе свидетельствует об активации процесса лигнификации клеточной стенки в данных условиях. В условиях засухи процесс лигнификации клеточной стенки активно происходит на ранних этапах действия стрессового фактора, на что указывают более низкая активность ФПР и неизменный уровень фенолов у опытных растений ячменя по сравнению с контрольными при продолжительном действии стрессового фактора.
ПРИРОДНЫЕ АНТИОКСИДАНТЫ В ПРОИЗВОДСТВЕ ЭМУЛЬСИОННЫХ ПРОДУКТОВ
Старовойтова К.В., Трубникова М.А., Савельев И.Д.
ГОУ ВПО «Кемеровский технологический институт пищевой промышленности», г. Кемерово, бульвар Строителей, 47, 64-25-57, office@kemtipp.ru
При разработке эмульсионных продуктов, вырабатываемых с использованием жидких растительных масел и жиров, особое внимание уделяется подбору эффективных композиций антиокислителей, определяющих стабильность жировой фазы продукта в процессе хранения.
В связи с этим разработка новых рецептур эмульсионных продуктов из молочно-растительного сырья с использованием композиционных смесей антиоксидантного назначения на основе природных каротиноидов, токоферолов и фосфолипидов является весьма актуальной.
Природным источником веществ, обладающих, с одной стороны, высокой пищевой и биологической ценностью, с другой антиоксидантным потенциалом является облепиха, содержащая в своём составе многообразный комплекс биологически активных веществ: большую группу витаминов и витаминоподобных соединений, в том числе токоферолы, каротиноиды; органические кислоты, минеральные и другие вещества.
Разработана технология переработки плодов облепихи с получением нескольких видов высокопитательных продуктов. Наряду с облепиховым маслом, порошкообразной биодобавкой, предложено вырабатывать масляно-витаминный продукт «Облепиховый» из высушенной облепиховой мякоти диффузионным методом при нагревании облепиховой мякоти в растительном дезодорированном масле, с последующим отделением жидкой фракции прессованием.
Установлено, что внесение в жировую основу эмульсионных продуктов облепиховой биодобавки «Полис» и масляно-витаминного продукта «Облепиховый» содержащих композиции природных антиокислителей – токоферолов, каротиноидов, повышает антиоксидантный потенциал вырабатываемых продуктов, позволяя увеличить сроки хранения готового продукта.
При разработке новых рецептур спредов и кремов на растительных маслах предлагается использовать в рецептурном составе антиоксидантный комплекс фосфолипидов и красного пальмового масла, содержащий токоферолы и каротиноиды.
Анализируя динамику изменения показателей окислительной порчи в условиях ускоренного окисления жировых фаз с красным пальмовым маслом и фосфолипидами, следует отметить, что накопление первичных продуктов окисления и свободных жирных кислот в жировой фазе без композиции красного пальмового масла и фосфолипидов (перекисное число на 15 сутки хранения составило 15 ммоль акт. кислорода/кг) происходит интенсивней, чем в жировой фазе с красным пальмовым маслом и фосфолипидами (перекисное число на 15 сутки хранения составило 8 ммоль акт. кислорода/кг).
Представленные результаты свидетельствуют о том, что полученные эмульсионные жировые продукты с использованием продуктов переработки облепихи, красного пальмового масла и фосфолипидами обладают антиоксидантными свойствами и способны замедлять процессы окисления ненасыщенных жирных кислот.
Из выше изложенного следует, что природные каротиноиды, токоферолы и фосфолипиды могут быть использованы в качестве компонентов жировых эмульсионных продуктов для повышения антиоксидантного потенциала жировых фаз.
АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ ПЛЮС БИОАНТИОКСИДАНТЫ. ПЕРСПЕКТИВЫ СТАБИЛИЗАЦИИ ОКИСЛЕНИЯ СИСТЕМ С БИОЛОГИЧЕСКИ АКТИВНЫМИ ОЛИГОПЕПТИДАМИ
Сторожок Н.М., Болдырева Ю.В., Галян С.Л., Сокулин Н.В.
ГОУ ВПО Тюменская медицинская академия Росздрава, г. Тюмень, 625023, ул. Одесская, д. 54, 8(3452)207421, Nadinstor@mail.ru
Перспективы пептидной биорегуляции равно как и возможности коррекции здоровья с помощью антиоксидантов (АО) привлекают внимание широкого круга исследователей и врачей. Системное воздействие на организм олигопептидов, применяемых в качестве органоспецифических адаптогенов, сравнивают с АО, полагая, что оба класса соединений действуют однонаправлено, но по разным механизмам: пептиды усиливают синтез АО ферментов, ингибиторы снижают уровень свободных радикалов. Известны также представления о прямом АО действии карнозина и его топохимических аналогов, установленном при Fe2+-аскорбатзависимом окислении. В этих условиях эффективность действия имидазолсодержащих пептидов сравнима с АО.
В настоящей работе исследован характер влияния 11 биологически активных олигопептидов на процесс окисления мицеллярных растворов метилолеата (МО) при разных условиях инициирования, осуществлен поиск способов стабилизации систем с пептидами с использованием ряда биоАО (ά-токоферол, β-каротин), синергистов ингибиторов окисления (аскорбиновая кислота (АК), АО ферментов (каталазы, пероксидазы хрена) и их смесей. Изучали влияние ди-, три- и тетрапептидов: карнозина (β-Аla-His), глутатиона (Gly-Cis-Glu), вилона (Lys-Glu), везугена (Lys-Glu-Asp), пинеалона (Glu-Asp-Arg), хонлутена (Glu-Asp-Gly), овагена (Glu-Asp-Leu), кристагена (Glu-Asp-Pro), эпиталона (Ala-Glu-Asp-Gly), карталакса (Ala-Glu-Asp) при концентрациях (10-2-10-4) М. Пептиды синтезированы в Санкт-Петербургском Институте биорегуляции и геронтологии СЗО РАМН. Окисление мицеллярных растворов МО с 5% ПАВ (додецилсульфатом натрия) осуществляли при 60о С и 40о С при инициировании процесса солями Fe2+ или радикалами, образующимися при термическом разложении азобисизобутиронитрила (АИБН). Установлено, что в условиях инициирования по реакции Фентона все пептиды независимо от особенностей их химического строения существенно ингибируют процесс. Показано, что эффект торможения в указанных условиях обусловлен хелатирующим действием пептидов в отношении катионов металлов-инициаторов. Связывая Fe2+ по типу биуретовой реакции, пептиды уменьшают скорость инициирования и скорость окисления в целом. Было показано, что при АИБН-инициированном окислении большинство пептидов не только не ингибируют процесс, но более чем в 2 раза увеличивают скорость поглощения субстратом кислорода и накопления ROOH. Исключение составляют глутатион и карнозин, образующие, как известно, при окислении S-H-группы и остатка имидазола относительно стабильные радикалы. Таким образом, присутствие пептидов существенно снижает окислительную устойчивость системы. Установлено, что стабилизация окисления при помощи АО (ά-токоферола, β-каротина) малоэффективна, пептиды дозозависимо снижают их действие (до 80%). АК – известный синергист ингибиторов окисления за счет восстановления феноксилов может усилить действие АО, но не более чем на 30% при высоких концентрациях (10-2 М). Показано, что наиболее перспективна стабилизация процесса за счет ферментов и их синергических смесей с ингибитором. Пероксидаза хрена, нерадикальным путем разрушающая ROOH разной природы в сравнимых концентрациях 1,5 раза превосходит действие каталазы, избирательно взаимодействующей с пероксидом водорода.
ИЗМЕНЕНИЕ ЧУВСТВИТЕЛЬНОСТИ МЕХАНОСЕНСОРНЫХ МЕХАНИЗМОВ МЕМБРАН ЭРИТРОЦИТОВ ПОД ДЕЙСТВИЕМ СВОБОДНО-РАДИКАЛЬНОГО ОКИСЛЕНИЯ
Глушков В.С., Глушкова Е.Г., Сторожок С.А., Протасова Н.Л.
ГОУ ВПО Тюменская медицинская академия Росздрава, г. Тюмень, 625023, ул. Одесская, д. 54, 8(3452)207421, storsergey@mail.ru
Механосенсорные механизмы обеспечивают конверсию механических воздействий во внутриклеточные биохимические пути передачи сигнала, изменению разности электрических потенциалов на мембранах клеток и активности систем мембранного транспорта.
Выход АТФ из эритроцитов при сдвиговой деформации играет важную роль в локальной регуляции сосудистого тонуса. Нами были выполнены эксперименты, в которых исследовали изменения динамики выхода АТФ из эритроцитов при их сдвиговой деформации. Результаты исследований свидетельствуют о том, что при возрастании силы сдвига происходит увеличение проницаемости мембран для АТФ.
Также были выполнены эксперименты по модификации липидного бислоя мембран эритроцитов в результате активации свободно-радикального окисления липидов. По мере возрастания уровня пероксидации липидов мембран наблюдалось уменьшение проницаемости их для АТФ, а затем проницаемость снова увеличивалась. Таким образом, зависимость проницаемости мембран клеток крови для АТФ от уровня пероксидации липидов мембран имеет U-образный характер.
Для объяснения выявленной нами зависимости выхода АДФ из клеток крови при деформационном стрессе от глубины свободнорадикального окисления липидов мембран, прежде всего, следует исходить из того, что это определяет характер структурных изменений в мембранах клеток крови.
При небольшой глубине окисления фосфолипидов мембран наблюдается уменьшение выхода АДФ из клеток крови, что может быть обусловлено следующими причинами:
- модификация структуры G-белков в результате свободнорадикального окисления, что влечёт за собой нарушения работы механосенсорного механизма мембран клеток крови, реагирующего на сдвиговую деформацию;
- снижение функциональной активности связанного с ембраной ферментативного комплекса, формирующего ответ клетки на сдвиговую деформацию;
- нарушение работы транспортной системы, обеспечивающей транспорт молекул АТФ, вследствие изменения характера взаимодействия между липидами мембран и молекулами белков Сystic Fibrosis Transmembrane Conductance Regulators (CFTR – относится к суперсемейству АТФ – связующих белков) а также непосредственно окислительной модификации молекул белков CFTR в результате свободнорадикального окисления.
По мере увеличения глубины окисления липидов мембран и накопления гидрофильных продуктов пероксидации липидов возрастает проницаемость мембран клеток крови для воды и полярных молекул
Одновременно проводились эксперименты по коррекции уровня свободно-радикального окисления, с помощью различных антиоксидантов (α-токоферол, СО-3, мексидол). При этом наблюдалось увеличение уровня выхода АТФ из эритроцитов при их сдвиговой деформации.
ВЛИЯНИЕ АНТИОКСИДАНТОВ И ПОЛИЕНОВЫХ
АНТИБИОТИКОВ ( ПА ) НА МЕХАНИЧЕСКИЕ СВОЙСТВА
ЭРИТРОЦИТОВ
Султанова Г.Г.
Институт Ботаники НАН Азербайджанской республики, Баку
Азербайджан,AZ-1073.Баку, Патамдартское шоссе,40 тел+99(412)4314014, sultanqul@mail.ru
Самым показательным методом исследования различных воздействий на эритроциты является гемолиз. В случае ультразвукового гемолиза процесс нарушения целостности клетки происходит под действием акустических микропотоков, что характеризует механическую стойкость мембраны зритроцитов.
Изучено действие на механические свойства эритроцитов следующих препаратов: антиоксиданты гетероциклического ряда – 2-этил – 6-метил – 3-оксипиридин (ОП-1) и 2,6 диметил-3-оксипиридин (ОП-2); и полиеновые антибиотики – амфотерицин В и его производные, леворин и его производные, филипин и нистатин.Использованыэквимолярные концентрации препаратов.Использован кинетический метод ультразвукового гемолиза эритроцитов, метод определения АХЭ-азной активности.
При использовании аппаратов искусственного кровообращения в медицинской практике часто возникает механическое разрушение эритроцитов Механическая травма эритроцитов может быть смоделирована действием ультразвука (УЗ), который, как известно, при определенных условиях вызывает механический гемолиз эритроцитов. Получено что химические соединения из класса 3-оксипиридинов дают защитный эффект в отношении гемолитического действия УЗ.Предположительно,с увеличением интенсивности УЗ, ввиду усиления действия механических факторов, защитный эффект этих соединений может снизиться, что необходимо учитывать при выборе режимов работы апаратов искусственного кровообращения во избежании механической травмы эритроцитов. При этом стабилизация структуры мембраны эритроцитов при действии ОП не сопровождается инактивацией АХЭ-азы, расположенной на наружной поверхности мембраны эритроцитов.
ПА -лекарственные соединения широко применяемые в медицинской практике. Поэтому необходимо разработать эффективные методы оценки их биологического действия на живые структуры .
Установлено, что при комбинированном действии ПА и УЗ наблюдаются изменения механической прочности эритроцитов связанные с нарушением структуры мембраны эритроцитов. При этом ПА могут либо внедряться в липопротеидную структуру эритроцитарной мембраны, либо взаимодействовать с зритроцитами на поверхностных, гидрофобныхучастках мембраны и наконец, могут сами формировать структурные каналы в мембранах эритроцитов, изменяя их ионную проницаемость (по аналогии с бислойными липидными мембранами). Ранее нами было показано, что ПА взаимодействуют с клеткамив только в том случае, когда в мембранах содержатся стерины определенной структуры, в частности эргостерин или холестерин. В мембранах эритроцитов содержится большое количество холестерина и благодаря этой особенности клетки эритроцитов оказываются чувствительными к действию ПА. Таким образом,нами выявлена корреляция во взаимодействии ПА с бислойными и клеточными мембранами, что дает возможность использовать количественные параметры УЗ гемолиза зритроцитов для оценки биологической эффективности антиоксидантов и ПА, что имеет большое практическое значение в связи с использованием изученных препараратов в медицинской практике и для анализа состояния мембран эритроцитов при различных внешних воздействиях.
Синергизм и антагонизм антиоксидантной активности виноградных вин
Султанова Г.Е., Евгеньев М.И., Лапин А.А.*, Герасимов М.К.
ГОУ ВПО Казанский государственный технологический университет, 420015, г. Казань, ул. К. Маркса, 68,тел.: (843) 231-43-81,
е-mail: sultanova_ge@mail.ru.
* ГОУ ВПО Казанский государственный энергетический университет, 420066, г. Казань, ул. Красносельская, 5, тел.: (843) 519-42-67,
е-mail: lapin@iopc.ru
Изучение антиоксидантной активности виноградных вин как источников биологически доступных антиоксидантов в настоящее время не теряет своей актуальности. Особое внимание ученых привлекает возможность обогащения виноградных вин полифенолами на стадии экстракции из виноградной ягоды, но мало изучены их превращения на разных стадиях технологического процесса. Из литературных источников известно, что антиоксиданты в составе вина чаще всего проявляют неаддитивную активность – либо синергизм, либо антагонизм. Однако мало информации, объясняющей данные явления.
Целью наших исследований являлось изучить изменения суммарной антиоксидантной активности (САОА) при технологических обработках и попытаться обосновать происходящие процессы. Анализ изменений САОА на стадии купажирования виноматериалов показал возможность моделирования купажа на основе эффектов синергизма и антагонизма антиоксидантной активности. Для изучения изменений САОА при купажировании были взяты вина: красное полусладкое «Каберне Совиньон» (КВЗ), белое сухое «Шардоне» (Краснодарский край). За основу купажа было взято белое вино, в котором постепенно увеличивали долю красного вина (от 0% до 50%). Таким образом, получили 10 модельных купажей для анализа. Измерение антиоксидантной активности проводили методом кулонометрического титрования электрогенерированным хлором на автоматизированном серийном кулонометре «Эксперт-006-антиоксиданты» ООО «Эконикс-Эксперт» г. Москва по сертифицированной методике. Результаты представлены в виде диаграммы зависимости разности экспериментальной и расчетной суммарной антиоксидантной активности от доли красного вина в купаже (рис. 1).
Рис.1. Приведенные величины суммарной антиоксидантной активности купажей, где САОАexcess = СAOA эксп. – САОА расч.
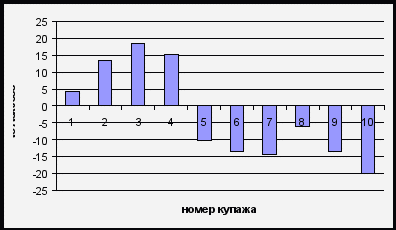
Согласно расчетам максимальный синергизм активности проявил купаж из белого и красного вина в соотношении 10:3 соответственно, наибольший антагонизм проявила смесь вин в соотношении 10:10. Дальнейшие исследования на винных коктейлях и простых антиоксидантах подтвердили наличие эффектов синергизма и антагонизма между системами с различной антиоксидантной активностью.
Таким образом, показана возможность создания напитков с заданной суммарной антиоксидантной активностью.
