Российская академия наук
| Вид материала | Тезисы |
- Основание Петербургской академии наук, 49.85kb.
- Спонсоры конференции: Фармацевтическая фирма «Санофи-Авентис», 74.5kb.
- Ш. Н. Хазиев (Институт государства и права ран) Российская академия наук и судебная, 297.05kb.
- Научный журнал «Вопросы филологии» Оргкомитет: Сопредседатели, 53.54kb.
- Научный журнал "Вопросы филологии" Оргкомитет: Сопредседатели, 47.73kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- Н. д кондратьева Международный фонд Н. д кондратьева и Российская академия естественных, 13.13kb.
- Российская академия наук отделение общественных наук ран, 74.85kb.
- Высочество Князь Монако Альберт II и другие. Сдоклад, 38.69kb.
- Ипээ ран www sevin ru, 22.27kb.
ОКИСЛИТЕЛЬНАЯ ДЕГРАДАЦИЯ ЭРИТРОЦИТОВ,
ИНИЦИИРУЕМАЯ ТРЕТБУТИЛГИДРОПЕРОКСИДОМ
Нешев Н.И., Психа Б.Л., Неганова М.Е.
Институт проблем химической физики РАН, Черноголовка, 142432, Московская обл., Черноголовка, проспект Академика Семенова 1; neshev@icp.ac.ru
В
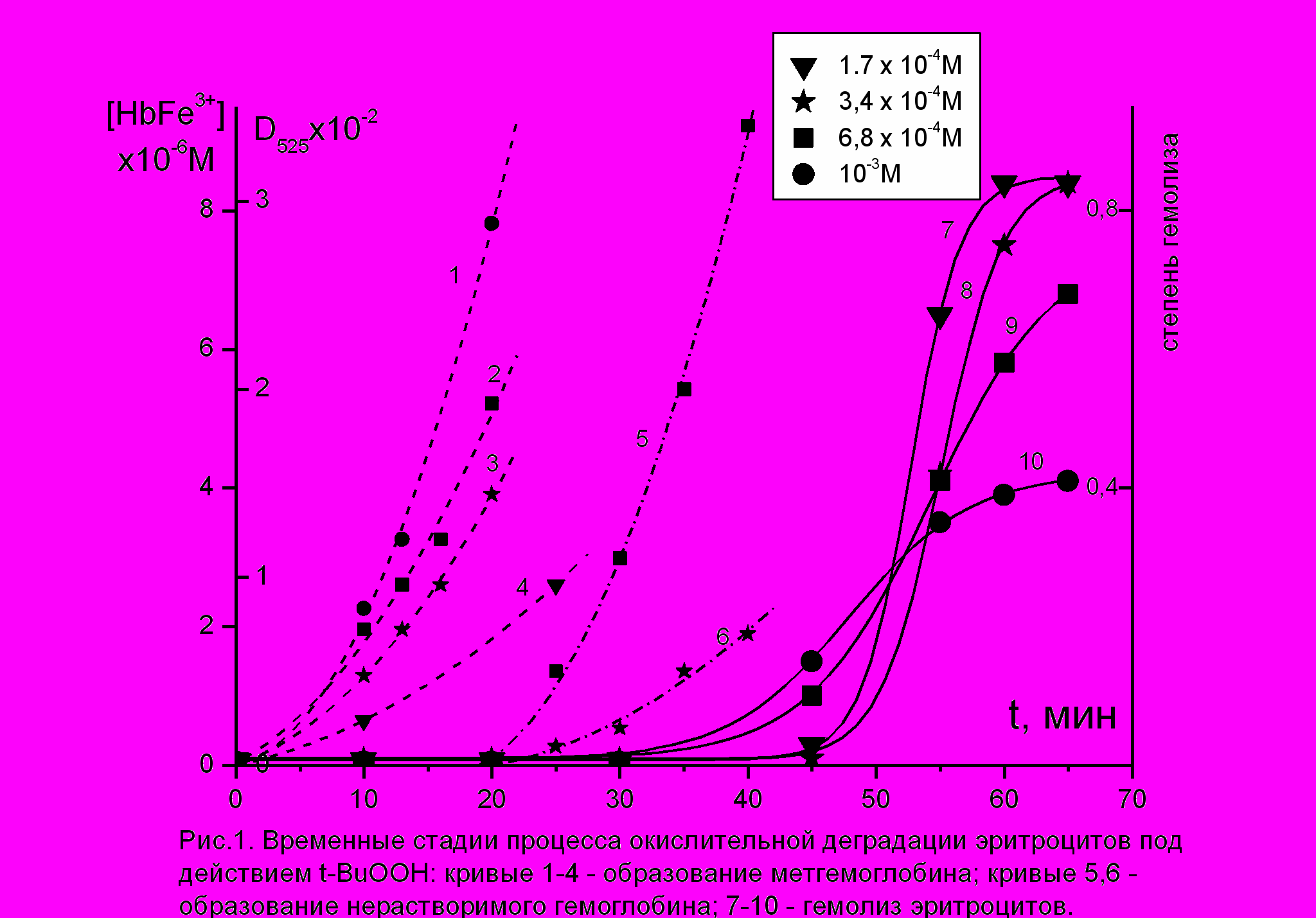 широком диапазоне концентраций третбутилгидропероксида (t-BuOOH) была изучена кинетика гемолиза эритроцитов (рис. 1, кривые 7-10), а также биохимические изменения внутри эритроцитов, происходящие в предгемолитический период: образование метгемоглобина (рис.1, кривые 1-4) и образование нерастворимого ге-
широком диапазоне концентраций третбутилгидропероксида (t-BuOOH) была изучена кинетика гемолиза эритроцитов (рис. 1, кривые 7-10), а также биохимические изменения внутри эритроцитов, происходящие в предгемолитический период: образование метгемоглобина (рис.1, кривые 1-4) и образование нерастворимого ге-моглобина (рис. 1, кривые 5-6). Видно, что все три изученных процесса зависят от концентрации t-BuOOH и характерным образом разнесены во времени.
На основе полученных результатов и литературных данных в работе предложена общая кинетически обусловленная последовательность физико-химических процессов окислительной деградации эритроцитов под действием t-BuOOH.
1. Первичным актом химического взаимодействия t-BuOOH внутри эритроцита является реакция с оксигемоглобином, который, с точки зрения механизма, выступает как реагент Фентона [1]:
HbFe2+∙∙∙∙∙∙O2 + t-BuOOH → HbFe3+ + t-BuO• + OH‾ + O2 (1)
2. По мере накопления метгемоглобина в реакции (1) на первый план выходит взаимодействие t-BuOOH с метгемоглобином с образованием сверхокисленной по железу формы гемоглобина, феррилгемоглобина, несущего неспаренный электрон на белковой глобуле [2]:
HbFe3+ + t-BuOOH → +•HbFe4+═O + t-BuOH (2)
3. С накоплением в системе феррилгемоглобина начинается заключительная стадия деградации гемоглобина, характеризующаяся нарастанием числа внутри- и межмолекулярных ковалентных сшивок, что ведет к потере функциональной активности и снижению растворимости гемоглобина.
4. Образующийся в реакции (1) алкоксильный радикал t-BuO•, благодаря высокой диффузионной подвижности и липофильности является наиболее вероятным кандидатом на роль инициатора пероксидного окисления липидов мембраны, приводящего к нарушению ее барьерных свойств и далее к гемолизу клетки.
Таким образом, радикальные продукты реакций (1) и (2), феррилгемоглобин и t-BuO•, выступают, по-видимому, в качестве независимых индукторов процессов окислительной деградации гемоглобина и пероксидного окисления липидов мембраны.
Литература:
1. S.M.H. Sadrzadeh, E. Graf, S.S. Panter et al. Hemoglobin: A Biologic Fenton Reagent.// J. Biol. Chem. – 1984. – V. 259. – P. 14354 – 14356.
2. D.A. Svistunenko. Reaction of Haem Containing Proteins and Enzymes with Hydroperoxides: The Radical View// BBA. Bioenergetics. - 2005. – V.1707. – P. 127-155.
РОЛЬ ГЛУТАТИОНРЕДУКТАЗЫ В ФОРМИРОВАНИИ
ЗАЩИТНОЙ РЕАКЦИИ ПРИ ИНДУКЦИИ ОКИСЛИТЕЛЬНОГО СТРЕССА В КАЛЛУСАХ ГРЕЧИХИ ТАТАРСКОЙ
Нигматуллина Л.Р., Румянцева Н.И.
Учреждение Российской академии наук Казанский институт биохимии и биофизики Казанского научного центра РАН, 420111,
г. Казань ул., Лобачевского 2/31, e-mail: nigmatullinalili@mail.ru
Одной из главных особенностей клеточных популяций in vitro является их высокая изменчивость, которая приводит к быстрой утрате регенерационного потенциала культивируемых клеток. Генетические аберрации в культуре in vitro могут быть обусловлены мутагенным действием активных форм кислорода (АФК), уровень которых может возрастать при действии определенных стрессоров (неоптимальное сочетание гормонов и наличие прооксидантов в среде культивирования, высокая освещенность и др.). Известно, что способность растений контролировать уровень АФК может в значительной степени коррелировать с их устойчивостью к различным повреждающим факторам. Соответственно, сохранение регенерационной способности клетками растений in vitro во многом зависит от их устойчивости к окислительному стрессу. Глутатионредуктаза (ГР) является одним из наиболее важных ферментов антиоксидантной системы, участвующих в формировании защитной реакции растений в ответ на действие различных стрессоров. Поэтому представляло интерес выяснить различается ли активность ГР в каллусах с различной способностью к морфогенезу и какова ее роль в защите клеток каллусов при индукции окислительного стресса, вызванного неспецифическим прооксидантом – паракватом.
Установлено, что в ходе пассажа в морфогенных каллусах активность ГР достигает больших значений, чем в неморфогенных каллусах. При этом в гормонозависимых и гормононезависимых неморфогенных культурах активность ГР существенно не различалась. Показано, что паракват в концентрации 10 мкМ вызывал значительное снижение жизнеспособности и роста как морфогенных, так и неморфогенных каллусов. При этом наименьшую устойчивость к окислительному стрессу в обоих типах каллусов проявляли активно делящиеся культуры, а наибольшую – культуры на стадии старения. Однако морфогенные каллусы вне зависимости от возраста были более устойчивы к действию параквата по сравнению с неморфогенными каллусами. Показано, что морфогенные каллусы не только сильнее активируют ГР в ответ на окислительный стресс, вызываемый паракватом, но и быстрее осуществляют эту активацию по времени в сравнении с неморфогенным каллусом. Так, культивирование на среде с паракватом уже через 6 ч в 7 раз увеличивало активность ГР в клетках морфогенного каллуса, тогда как в неморфогенных каллусах активность ГР, как в контроле, так и в опыте практически не изменялась и оставалась низкой.
Работа выполнена при финансовой поддержке гранта 09-04-97039 - р_Поволжье_а.
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА
АНТИОКСИДАНТНЫХ СВОЙСТВ ГИДРОКСИБЕНЗОЙНЫХ И ГИДРОКСИКОРИЧНЫХ КИСЛОТ.
Николаев И.В.1, Храмеева Е.Е.2, Степанова Е.В.1, Королева О.В.1
1 Учреждение Российской Академии Наук Институт биохимии им. А.Н. Баха РАН, г. Москва, 119071, Ленинский проспект д.33, стр. 2., тел. 8(495)9544477, ilya_mbf@yahoo.com
2 Факультет биоинженерии и биоинформатики МГУ, г. Москва, 119991,Ленинские горы МГУ 1, стр. 73, ekhrameeva@gmail.com
Введение. Гидроксибензойные (ГБ) и гидроксикоричные (ГК) кислоты являются компонентами системы антиоксидантной защиты растений. Широкое распространение ГБ и ГК кислот в продуктах растительного происхождения обуславливает их важность как пищевых антиоксидантов, необходимых для поддержания антиоксидантного статуса человека и животных. Несмотря на большой массив литературных данных по антиоксидантным свойствам ГБ и ГК кислот остается недостаточно изученным механизм их антиоксидантного действия. Таким образом, целью настоящей работы являлась структурно-функциональная характеристика антиоксидантных свойств ГБ и ГК кислот.
Материалы и методы. Антиоксидантнную емкость (АОЕ) ГБ (п-гидроксибензойная, ванилиновая, сиреневая) и ГК (п-кумаровая, феруловая, синаповая) кислот определяли по отношению к катион-радикалу АБТС с использование тролокса в качестве стандарта. Для дискриминации механизмов донирования атома водорода (ДАВ) и электрона (ДЭ) АОЕ ГБ и ГК кислот определяли в диапазоне рН 3,5-8,0. Квантово-химические расчеты геометрии и электронных дескрипторов ГБ и ГК кислот проводили в вакууме в B3LYP/6-311++G** базисе программы Gaussian 3.0 с учетом энергии нулевых колебаний.
Результаты и обсуждение. ГК кислоты характеризовались в среднем в 1,5 раза более высокими значениями АОЕ по сравнению с соответствующими им ГБ кислотами. При рН 3,5 п-гидроксибензойная и ванилиновая кислоты не проявляли антиоксидантной активности по отношению к катион-радикалу АБТС. АОЕ ГК кислот возрастала с увеличением рН в диапазоне 3,5-8,0 в среднем в 2,8 раза. При этом наиболее выраженный подъем отмечался при рН 3,5-5,0 и 7,0-8,0, что соответствует диапазонам рКа ионогенных групп ГБ и ГК кислот. Выявленная тенденция подтверждается результатами квантово-химических расчетов: депротонирование карбоксильной группы приводит к снижению потенциала ионизации (ПИ) в 2,0-3,3 раза, электроотрицательности () молекулы и разности энергий ВЗМО и НВМО в 1,2-1,5 раза, полярности и энтальпии диссоциации связи в фенольной гидроксильной группе на 8,1-14,2%. При рН 3,5 показана значимая (p<0,05) корреляция АОЕ с ПИ, и разностью энергий ВЗМО и НВМО неионизированных форм ГБ и ГК кислот. При более высоких рН значимых корреляций данных параметров установлено не было, что, по-видимому, обусловлено одновременным присутствием различных форм ГБ и ГК кислот в растворе, наряду с возможным изменением ионизации самого катион-радикала АБТС. Таким образом, с возрастанием рН у ГБ и ГК кислот более эффективно протекает как ДАВ, так и ДЭ. Выраженное снижение ПИ при депротонировании ГБ и ГК кислот свидетельствует о существенной роли механизма ДЭ в реализации их антиоксидантных свойств.
Благодарности. Работа выполнена при финансовой поддержке ГК П211 в рамках федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 г.
ВЛИЯНИЕ КАДМИЯ НА АНТИОКСИДАНТНУЮ СИСТЕМУ
КЛЕТОК ВЫСШИХ РАСТЕНИЙ
Николаева Т.Н., Гончарук Е.А., Загоскина Н.В.
Учреждение Российской академии наук Институт физиологии растений им. К.А. Тимирязева РАН, 127276, г. Москва, ул. Ботаническая, 35, тел. (495)977-94-33, phenolic@ippras.ru
Кадмий является одним из наиболее распространенных поллютантов, для которого характерна высокая подвижность в почвенном растворе и быстрое поступление в растения. Это обычно сопровождается угнетением роста, хлорозом листьев, возникновением мутаций и другими изменениями физиолого-биохимических характеристик клеток и тканей. Кадмий способствует также избыточному образованию активных форм кислорода (АФК) и возникновению окислительного стресса. Для защиты от избытка АФК в клетке существует многокомпонентная антиоксидантная система, включающая высокомолекулярные и низкомолекулярные антиоксиданты. К высокомолекулярным антиоксидантам относится ряд ферментов, среди которых основная роль в элиминации АФК принадлежит супероксиддисмутазе (СОД). Низкомолекулярные антиоксиданты представлены разнообразными веществами, к числу которых относятся и фенольные соединения (ФС).
Целью работы являлось изучение действия кадмия на накопление ФС, активность СОД и интенсивность перекисного окисления липидов (ПОЛ), как одного из наиболее ранних ответов клетки на стрессовое воздействие.
Объектом исследования служили каллусные культуры стебля чайного растения, обладающие специализированным обменом, направленным на синтез разнообразных ФС фенилпропаноидной и флавоноидной природы. Каллусы выращивали в темноте на модифицированной питательной среде Хеллера, содержащей 2,4-Д (5 мг/л) и глюкозу (2,5%). В опытных вариантах к ней добавляли кадмий (в виде соли Cd(NO3)2 в концентрации 6,3х10-5М или 10,6х10-5М). Длительность пассажа составляла 40 дней. Для извлечения ФС каллусную ткань гомогенизировали в 96% этаноле и в этанольных экстрактах определяли их содержание спектрофотометрическим методом с реактивом Фолина-Дениса (длина волны 725 нм). Интенсивность ПОЛ оценивали по реакции с тиобарбитуровой кислотой; уровень СОД - по ингибированию образования формазана.
Реакция каллусных культур чайного растения зависела от концентрации кадмия в питательной среде. Так, при 6,3х10-5М кадмия накопление ФС в каллусах увеличивалось почти в 2 раза по сравнению с контролем, тогда как активность СОД и интенсивность ПОЛ уменьшались (на 25% и 13%, соответственно). При более высокой концентрации кадмия в среде (10,6х10-5М) содержание ФС и уровень интенсивности ПОЛ практически не отличались от таковых в контроле, в то время как активность СОД увеличивалась на 37%.
Все это позволяет предположить, что в зависимости от интенсивности или природы стрессового воздействия, включаются те или иные компоненты антиоксидантной системы защиты. В нашем случае при более низкой концентрации кадмия «запускается» низкомолекулярная компонента, а именно - увеличение синтеза ФС, а при более высокой - высокомолекулярная, когда возрастает активность СОД.
Работа выполнена при частичной поддержке Российского фонда фундаментальных исследований (грант 07-04-00909).
ВЛИЯНИЕ ГИДРАТИРОВАННЫХ ФУЛЛЕРЕНОВ С60 НА
ХЕМИЛЮМИНЕСЦЕНЦИЮ НЕРАЗВЕДЕННОЙ ЦЕЛЬНОЙ КРОВИ ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНЬЮ ЛЕГКИХ ДО И ПОСЛЕ ЛЕЧЕНИЯ ГИПОКСЕНОМ
Новиков К.Н.1, Бердникова Н.Г.2, Новиков А.К.3, Люзина О.Ю.1, Мухитова О.Г.1, До Минь Ха1, Воейков В.Л.1
1Московский государственный университет им. М.В.Ломоносова,
Биологический факультет, г. Москва, Ленинские горы, д.1, стр.1,
тел. 8-495-939-12-68, e-mail: kirniknov@yandex.ru);
2Московская медицинская академия им. И.М.Сеченова, кафедра клинической фармакологии, г. Москва;
3Филиал 1-ого ФГУ «2-ой центральный военный клинический госпиталь им. П.В. Мандрыка» Минобороны РФ, г. Москва
Исследовали статус активных форм кислорода (АФК) в неразведенной крови пациентов с хронической обструктивной болезнью легких (ХОБЛ), подвергавшихся стандартному лечению гипоксеном (антигипоксант и антиоксидант) на фоне комплексной терапии в течение двух месяцев. Изучали действие гидратированных фуллеренов С60 (HyFn) на развитие образования АФК в крови больных ХОБЛ до и после лечения гипоксеном in vitro. HyFn использовали в низких и сверх-низких концентрациях (вплоть до 10-19 М). В крови происходит процесс одноэлектронного восстановления кислорода с образованием энергии электронного возбуждения. Добавление в кровь зондов на образование АФК - люминола (ЛМ) (неспецифический зонд на АФК) и люцигенина (ЛЦ) (специфический зонд на супероксид анионрадикал) активировало хемилюминесценцию (ХЛ) цельной неразведенной крови. Интенсивность ХЛ заметно возрастала после добавления зимозана – индуктора генерации АФК (окислительный взрыв). ХЛ регистрировали с помощью отечественного люминометра «Биотокс 7-А», работающего в режиме счета одиночных фотонов.
У больных ХОБЛ после лечения гипоксеном интенсивность ЛЦ- и ЛМ-зависимой ХЛ при индуцировании зимозаном окислительного взрыва в крови как правило заметно снижалась по сравнению с больными до лечения. Супероксиддисмутазная активность в эритроцитах и содержание малонового диальдегида в плазме крови коррелировали с изменениями ХЛ в цельной крови.
Параметры ХЛ и действие HyFn зависили от функционального состояния крови пациентов. HyFn вызывали нормализацию развития ХЛ в крови пациентов. Используя дискриминантный анализ мы обнаружили наиболее значимые временные точки на кинетических кривых ХЛ, поэтому было возможно классифицировать пациентов на группы (пациенты с ХОБЛ до и после лечения гипоксеном; группа больных с обострением ХОБЛ; кровь пациентов с различной чувствительностью к разным концентрациям HyFn).
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ ПРОИЗВОДНЫХ
ИНДОЛИЗИНО[8,7-b]ИНДОЛА
Нурмаганбетов Ж.С. 1, Шульц Э.Э. 2, Чернов С.В. 2,
Турмухамбетов А.Ж. 1, Исмагулова Н.М. 3, Казанцев А.В.1
Сейтембетов, Т.С. 3, Адекенов С.М. 1
1АО «Международный научно-производственный холдинг «Фитохимия» , Караганда, ул. Газалиева, 4, Казахстан; arglabin@phyto.kz
2Новосибирский институт органической химии СО РАН, 630090,
Новосибирск, пр. Лаврентьева, 9; Россия; schultz@nioch.nsc.ru
3АО «Медицинский университет «Астана», Астана, ул. Бейбитшилик, 49, Казахстан; samankul46@mail.ru
Целый ряд патологических процессов в организме протекает на фоне ярко выраженного оксидантного стресса. С помощью антиоксидантов можно регулировать скорость окислительно-восстановительных процессов в организме.
Синтетические трансформации биоактивных растительных метаболитов – одно из актуальных направлений современной органической и биоорганической химии, связанное с синтезом новых структурных типов биологически активных веществ, перспективных для медицины.
В связи с этим, нами синтезированы соли гарминия 1а,б действием функционально- замещенных фенацилбромидов на гармин. При обработке КОН соединения 1а,б легко циклизуются в производные 11Н-индолизино[8,7-b]индола 2а,б.

Исследование на антиоксидантную активность (АОА) синтезированных производных гармина показало, что соединения 2а, б проявляют выраженный ингибирующий эффект в перекисных процессах, с участием о-фенантролина. Коэффициенты ингибирования веществ составляют 93,91% и 91,76% соответственно. Механизм действия указанных соединений, по-видимому, обусловлен двумя факторами:
- возможностью акцептировать свободные радикалы за счет индольного фрагмента, который может выступать в роли «ловушек» инициаторов свободнорадикальных реакций;
- стабилизирующим эффектом фенильных групп у С-2, пролонгирующих антиоксидантное действие исследованных соединений.
С целью подтверждения полученных данных АОА и механизма ингибирования перекисных процессов нами изучена динамика перекисного окисления желчных липопротеидов путем определения уровня МДА in vitro c помощью ТБК.
Установлено, что соединения 1б и 2б снижает уровень МДА на 17,7% и 10,7% соответственно, что свидетельствует об их АОА.
Безалкогольные растительные напитки как
источники фенольных антиоксидантов в питании человека
Няхина Е.А., Шушкова И.Г., Зайцев В.Г.
Волгоградский государственный медицинский университет, г. Волгоград, 400131, г. Волгоград, пл. Павших Борцов,1;
(8442)385363; zhufa@rambler.ru
Диетические фенолы являются перспективными антиоксидантами, благодаря своим антирадикальным и восстанавливающим свойствам in vitro и in vivo. Ежедневное потребление безалкогольных растительных напитков, богатых полифенолами, снижает риск развития хронических сердечно-сосудистых, нейродегенеративных и опухолевых заболеваний. Несмотря на большое количество исследований, отсутствие общепринятого набора методов для определения антиоксидантных свойств и содержания фенолов в растительных извлечениях и биологических жидкостях, а также недостаточное количество данных о действии безалкогольных растительных напитков в условиях привычной диетической схемы затрудняет оценку их применимости как источников естественных антиоксидантов.
В рамках данного исследования был предложен набор методов для определения фенольных антиоксидантов в безалкогольных растительных напитках и моче с использованием единого эталонного вещества – галловой кислоты. В ряде безалкогольных напитков растительного происхождения оценивались антиоксидантная, антирадикальная и восстанавливающая активность, содержание общих фенолов, флавоноидов и дубильных веществ. Были исследованы черный и зеленый чай, кофе, какао и мате. Наибольшие значения антиоксидантной активности определялись в черном чае, а содержания общих фенолов – в кофе. Были отобраны напитки с наибольшими показателями для изучения их влияния на содержание фенольных антиоксидантов в моче. В моче обследуемых определялись следующие показатели, выраженные в пересчете на креатинин: антиоксидантная, антирадикальная и восстанавливающая активность, содержание общих фенолов и мочевой кислоты. Для перечисленных показателей предварительно были установлены региональные референтные границы с использованием образцов мочи 53 обследуемых. Для оценки влияния безалкогольных растительных напитков на содержание антиоксидантов в моче каждому обследуемому предлагался на выбор один из напитков, отобранных на предыдущем этапе исследования. Испытания проводили без предшествующих диетических ограничений. Образцы мочи обследуемых собирали до и в течение трех часов после потребления напитков. Было показано, что достоверные различия между значениями показателей в моче до и после приема напитков наиболее выражены при потреблении мате, кофе и какао. Антиоксидантная активность увеличивалась у большинства добровольцев после приема какао и мате; значения антирадикальной активности возрастали у большинства обследуемых после потребления растворимого кофе. Какао, мате и растворимый кофе вызывали повышение содержания общих фенолов в моче у каждого добровольца. Возрастание восстанавливающей активности было отмечено у всех восьми испытуемых при потреблении мате. В группах обследуемых наблюдалась большая вариация по абсолютным и относительным значениям величин в моче, собранной до и в течение трех часов после потребления напитков. Сравнение исходных значений показателей в моче с их изменением, обусловленным приемом безалкогольных растительных напитков показало наличие сильной отрицательной связи для трех показателей после приема растворимого кофе и для двух показателей после потребления мате. По-видимому, для данных напитков существует наименьшее число дополнительных неизвестных факторов, влияющих на значения показателей в моче. Кофе и мате можно предложить как одни из наиболее перспективных источников фенольных антиоксидантов в питании человека.
