Автореферат диссертации на соискание ученой степени
| Вид материала | Автореферат диссертации |
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- Автореферат диссертации на соискание ученой степени, 267.76kb.
- Акинфиев Сергей Николаевич автореферат диссертации, 1335.17kb.
- L. в экосистемах баренцева моря >03. 02. 04 зоология 03. 02. 08 экология Автореферат, 302.63kb.
- Автореферат диссертации на соискание ученой степени, 645.65kb.
- Автореферат диссертации на соискание ученой степени, 678.39kb.
- Автореферат диссертации на соискание ученой степени, 331.91kb.
- Автореферат диссертации на соискание ученой степени, 298.92kb.
- Автореферат диссертации на соискание ученой степени, 500.38kb.
Таблица 2. Динамика во времени действия ИФР-1 на активность АЦ в мембранной фракции гладких мышц моллюска.
| Воздействия | Активность АЦ (пкмоль цАМФ/мин/мг белка) | ||
| 2.5 мин | 5 мин | 10 мин | |
| Без ИФР-1 | 110.21±10.8 (100 %) | 125.31±9.3 (100%) | 106.04±6.6 (100%) |
| + ИФР-1 | 259.92±11.4 (269%) | 229.31±5.2 (183%) | 103.81±5.8 (98%) |
Примечание – как в таблице 1.
Таким образом, в мембранных фракциях, выделенных из мышечных тканей исследуемых животных и культуры клеток куриных миобластов, наблюдается закономерность проявления эффекта пептидов в зависимости от времени действия. Инсулин, ИФР-1, ИПП и ЭФР оказывают активирующее действие на АЦ в течение 2,5 и 5 мин с максимальным эффектом через 2.5 мин. АЦ активирующий эффект исследуемых пептидов видоспецифичен. В скелетных мышцах крыс ряд эффективности пептидов по их влиянию на АЦ имеет следующий порядок: инсулин > ИФР-1 > ЭФР > ИПП, а в мышечных тканях моллюска - ИПП > ЭФР > ИФР-1 > инсулин.
 |
| Рис. 3. Концентрация пептидов – 10-8 М Активация АЦ пептидами (в %) по сравнению с базальной активностью фермента, принятой за 100%, приведена в тексте. Различия достоверны (р<0.05). |
Влияние in vivo разных доз инсулина на активность АЦ в тканях позвоночных и беспозвоночных в разные временные сроки.
Обнаружив в опытах in vitro стимулирующее влияние пептидов инсулинового суперсемейства на активность АЦ, мы исследовали влияние инсулина, основного представителя инсулинового суперсемейства, на активность АЦ в разных дозах и при разном времени действия в условиях in vivo. Эксперименты проведены на фракциях мышечных мембран крыс, куриных эмбрионов и моллюсков после введения инсулина (внутрибрюшинно или внутрижелточно) в дозах 0.05 нг/г-10нг/г веса тела (вес крысы или куриного эмбриона, вес моллюска без раковины). Доза, вводимого in vivo инсулина рассчитывалась с учетом концентрации инсулина, используемой в опытах in vitro. Основанием для выбора дозы служили данные литературы и результаты наших опытов in vitro. Было показано, что в скелетных мышцах крыс стимулирующий АЦ эффект инсулина (+222%) выявляется через 5 мин после введения гормона (1 нг/г), а через 15 мин он снижается почти в три раза (67%) (Рис. 4). При более высокой дозе инсулина (10 нг/г), стимулирующий АЦ эффект гормона через 5 мин выражен слабее (+124%), а через 15 мин отсутствовал.
 |
| Рис. 4. Активация АЦ пептидами (в %) по сравнению с базальной активностью АЦ, принятой за 100%, приведена в тексте. Различия достоверны (р<0.05) |
В экспериментах in vivo в мембранных фракциях мышц куриных эмбрионов разного возраста обнаружен АЦ активирующий эффект инсулина. У 10-дневных куриных эмбрионов он выявлялся уже через 5 мин, более четко выражен через 15 мин, а через 30 мин не проявлялся (рис. 5).
 |
| Рис. 5. Различия достоверны (р<0.05) |
У 17-дневных куриных эмбрионов выявлено дозозависимое активирующее действие инсулина на активность АЦ через 5 минут (Рис. 6), которое ослабевает через 15 и 30 мин после введения гормона.
 |
| Рис. 6. Различия достоверны (р<0.05) |
При введении моллюскам инсулина (0.5нг/г и 5.0 нг/г) активность АЦ возрастала через 5 мин после введения гормона на +49% и +381%, соответственно, по сравнению с контролем, принятым за 100%. Через 20 мин влияние гормона (0.5 нг/г) на активность АЦ снижается (+22%) и практически исчезает (+6%) через 40 мин (Рис. 7). При введении инсулина (5 нг/г) моллюскам АЦ стимулирующий эффект гормона через 20 мин составлял +110%, а через 40 мин +50% (рис. 7).
 |
| Рис. 7. Светлые столбики - базальная активность АЦ. Заштрихованные столбики - инсулин-стимулированная активность АЦ при разных дозах гормона. Различия достоверны (р<0.05). |
Из полученных нами данных следует, что отчетливое влияние инсулина на активность АЦ в мышечных мембранах моллюска (Рис. 7) выявляется при более высокой дозе инсулина, чем у млекопитающих и птиц. Это можно объяснить тем, что у моллюска A.cygnea рецепторы к инсулину не обнаружены (Лейбуш, Чистякова, 2003), а эффект инсулина может реализовываться через ИФР-1-подобные рецепторы или рецепторы ИПП моллюска, которые способны опосредовать активирующее влияние инсулина на АЦ (Шпаков и др., 2005).
Следует отметить, что проявление АЦ стимулирующего влияния инсулина и инсулиноподобных пептидов во времени имеет сходство в опытах in vitro и in vivo. АЦ активирующий эффект пептидов отчетливо выявляется при коротких сроках влияния пептида (2,5 и 5 мин) при физиологических концентрациях (10-9-10-8М), с увеличением времени действия эффект пептидов ослабевает или отсутствует.
АЦ активирующий эффект инсулина, ИФР-1 и ИПП при разных концентрациях в условиях in vitro.
Установив оптимальное время действия пептидов инсулинового суперсемейства, при котором происходит активация АЦС (2.5 мин), необходимо было выявить при каких концентрациях АЦ стимулирующий эффект пептидов наиболее выражен. В разных тканях стимулирующий эффект пептидов инсулиновой природы осуществляется через специфичные рецепторы, отличающиеся по сродству к пептиду в гомологичных и негомологичных пептиду тканях.
Проведено исследование влияния инсулина, ИФР-1, ИПП моллюска и ЭФР в течение 2.5 мин при разных концентрациях (10-12-10-6М) в мембранных фракциях крыс, кур, моллюсков, а также во фракции, выделенной из культуры клеток куриных миобластов.
В мембранной фракции скелетных мышц крыс стимулирующий АЦ эффект инсулина, ИФР-1, ИПП обнаруживается при концентрациях - 10-11-10-7М (Рис. 8). Наиболее выраженный АЦ стимулирующий эффект составляет: для инсулина +250% при 10-8М; для ИФР-1 +91% при 10-9М; для ИПП +111% при 10-8М; для ЭФР +190% при
10-10М. (Рис. 8).
Можно отметить, что в диапазоне концентраций 10-10-10-7М наиболее четко выражен активирующий АЦ эффект инсулина, эффекты других исследованных пептидов инсулиновой природы проявлялись слабее. АЦ стимулирующий эффект ЭФР проявлялся при более низких концентрациях (10-11-10-10М).
 |
| Рис. 8. Базальная активность АЦ принята за 100 %. Время действия пептидов 2.5 мин |
Таблица 3. Влияние in vitro разных концентраций инсулина на активность АЦ во фракциях мышечных мембран куриных эмбрионов разного возраста и цыплят.
| Объекты (возраст) | 10-сут Эмбрионы | 13-сут Эмбрионы | 16-сут Эмбрионы | Цыплята 3-сут |
| Воздействия | Активность АЦ (пмоль цАМФ/мин/мг белка) В скобках – Активность АЦ (в %) в присутствии инсулина, по отношению к базальной активности, принятой за 100 %. | |||
| Без Инсулина | 14.021.10 (100 %) | 3.900.45 (100 %) | 2.010.09 (100 %) | 8.520.41 (100 %) |
| +инсулин 10-11 М | 16.341.35 (117 %) | 4.210.34 (108 %) | 4.810.46 (239 %) | 10.110.55 (119 %) |
| + инсулин 10-10 М | 39.141.93 (279 %) | 10.330.89 (265 %) | 5.280.30 (263 %) | 11.240.48 (132 %) |
| + инсулин 10-9 М | 48.252.21 (344 %) | 15.921.24 (408 % ) | 10.240.62 (509 %) | 14.540.82 (171 %) |
| + инсулин 10-8 М | 19.871.44 (142 %) | 9.840.56 (252 %) | 9.920.47 (494 %) | 19.551.13 (238 %) |
| + инсулин 10-7 М | 17.130.98 (122 %) | 4.930.45 (126 %) | 7.510.33 (374 %) | 22.211.37 (261 %) |
| + инсулин 10-6 М | 17.901.12 (128 %) | 5.120.21 (131 %) | 1.950.22 (97 %) | 24.391.62 (286 %) |
Изучение АЦ стимулирующего эффекта пептидов инсулинового суперсемейства и ЭФР в онтогенезе позволило выявить следующие факты. Наиболее выраженный АЦ активирующий эффект инсулина (10-11М-10-6М обнаруживается у куриных эмбрионов (10, 13, 16 суток) и цыплят (3 суток) при концентрации гормона 10-9М, и составляет у 10-суточных эмбрионов +244%, у 13-суточных +308%, у 16-суточных +409% (Таблица 3), а у 3-х суточных цыплят (+186%) при более высокой концентрации 10-6М, что может быть связано с переходом эмбрионов в постэмбриональный период, когда процессы роста и дифференцировки заканчиваются.
Проведенные нами исследования действия инсулина и ИФР-1 на активность АЦ в мембранной фракции, выделенной из культуры клеток куриных миобластов (4-й день развития) показали, что наибольший АЦ стимулирующий эффект инсулина (+352%) выявляется при концентрации 10-9М, а ИФР-1 (+289%) при концентрации 10-10М (данные в диссертации).
В мембранной фракции мышц моллюска АЦ стимулирующий эффект инсулина, ИФР-1, ИПП и ЭФР выявляется при концентрациях - 10-11-10-8М (Рис. 9). Инсулин и ИФР-1 оказывают наиболее выраженное стимулирующее действие на активность АЦ при концентрации 10-8М (+63% и +54%, соответственно), а ИПП и ЭФР при 10-9М (+415% и +223%, соответственно).
 |
| Рис. 9. Базальная активность АЦ принята за 100 %. Время действия пептидов – 2.5 мин. |
Таким образом, определен диапазон концентраций, при которых проявляется АЦ активирующий эффект исследуемых пептидов. Следует отметить видоспецифичность действия пептидов. Действие ИПП, выделенного из висцеральных ганглиев моллюска A.cygnea, является более эффективным в ткани моллюска и менее эффективным в тканях позвоночных.
Участие ц-АМФ-зависимой ФДЭ в механизме действия пептидов инсулинового суперсемейства
Уровень цАМФ в клетке зависит не только от АЦ – фермента, осуществляющего его синтез, но и от фосфодиэстеразы (ФДЭ) - фермента, обеспечивающего его деградацию. Исследована динамика во времени активности примембранной формы цАМФ-ФДЭ во фракции скелетных мышц кур. Эта изоформа ФДЭ локализована на внутренней стороне мембраны и способна активироваться инсулином (Houslay, 1985). Нами показано, что активность примембранной цАМФ-ФДЭ не изменяется через 2.5 и 5.0 мин после действия инсулина, увеличивается на +115% через 10 мин и на +179% через 20 мин, по сравнению с базальной активностью фермента, принятой за 100% (Таблица 4).
Таблица 4. Влияние инсулина (10-8М) на активность примембранной цАМФ-ФДЭ в скелетных мышц кур в зависимости от времени
| Воздействия | Активность цАМФ-ФДЭ (нмоль АМФ/мин/мг белка) | |||
| 2.5 мин | 5.0 мин | 10.0 мин | 20.0 мин | |
| Без инсулина | 3.37±0.5 (100%) | 3.70±0.33 (100%) | 3.56±0.61 (100%) | 3.21±0.28 (100%) |
| + инсулин | 3.06±0.21 (91%) | 4.07±0.18 (110%) | 7.65±0.23 (215%) | 8.95±0.44 (279%) |
Примечание: в скобках представлена активность цАМФ-ФДЭ (в %) в присутствии инсулина и базальная активность фермента, принятая за 100%
При исследовании действия разных концентраций инсулина (10-9М-10-7М) обнаружено, что наиболее выраженное действие гормона (+115%) на активность цАМФ-ФДЭ выявляется через 10 мин при концентрации 10-8М (данные в диссертации).
Соотношение активности систем АЦ-цАМФ и цАМФ-ФДЭ в реализации действия инсулина на клетку является важным моментом в понимании внутриклеточных механизмов функционирования пептидов инсулиновой природы.
При активации АЦ гормонами скорость синтеза цАМФ начинает превышать скорость его деградации. Повышение уровня цАМФ приводит к активации мишени его действия - ПКА. Сродство ПКА к цАМФ в 100-1000 раз больше, чем у ФДЭ. При усилении синтеза цАМФ происходит сначала насыщение цАМФ-регуляторных центров ПКА, и лишь затем гидролиз цАМФ с участием ФДЭ.
Исходя из представленных нами данных, активирующие эффекты инсулина на АЦ и цАМФ-ФДЭ четко разделены во времени. АЦ активирующий эффект инсулина проявляется через 2.5 и 5 мин и отсутствует через 10 мин. Между тем, цАМФ-ФДЭ активируется инсулином только через 10 минут инкубации с гормоном. Таким образом, активация цАМФ-ФДЭ наступает лишь тогда, когда цАМФ как вторичный посредник выполнит свою функцию, достигнет порогового уровня и осуществит свое активирующее действие на ПКА, а затем и на эффекторные системы (Ткачук, 1983), что согласуется с нашими данными о действии инсулина на активность АЦ и цАМФ-ФДЭ и данными литературы.
В связи с этим основное внимание будет уделено исследованию АЦС, участвующей в осуществлении регуляторного действия пептидов инсулинового суперсемейства на клеточные процессы.
Использование анти-инсулиновой сыворотки для доказательства специфичности АЦ стимулирующего эффекта инсулина.
Для доказательства АЦ стимулирующего действие инсулина, а не других пептидных гормонов, не относящихся к гормонам инсулинового суперсемейства, была использована анти-инсулиновая сыворотка (АИС), выработанная в лаборатории на инсулин млекопитающих, которая нейтрализует действие инсулина и, как установлено нами подавляет стимулирующее действие инсулина на АЦ. При добавлении нормальной сыворотки (без инсулина) к фракции скелетных мышц крыс и гладких мышц моллюска, активирующий АЦ эффект инсулина составляет +68% у крыс и +41% у моллюсков. При использовании АИС стимулирующий АЦ эффект инсулина отсутствует у крыс (+7%) и моллюсков (-5%) (Табл. 5).
Полученные данные свидетельствуют о том, что обнаруженное нами активирующее действие инсулина на АЦ в мышечных тканях исследуемых объектов осуществляется именно инсулином и является специфичным при действии этого гормона.
Таблица 5. Нейтрализация АЦ стимулирующего эффекта инсулина в мембранных фракциях скелетных мышц крыс и гладких мышц моллюска в присутствии анти-инсулиновой сыворотки.
| Воздействия | Активность АЦ (пкмоль цАМФ/мин/мг белка) | |
| Нормальная сыворотка | Анти-инсулиновая сыворотка | |
| Гладкие мышцы моллюска Anodonta cygnea | ||
| Без инсулина | 111.186.13 (100%) | 148.294.31 (100%) |
| Инсулин 10-8М | 156.768.54* (141%) | 158.678.16 (107%) |
| Скелетные мышцы крысы | ||
| Без инсулина | 97.344.58 (100%) | 115.826.49 (100%) |
| Инсулин 10-8М | 163.496.17* (168%) | 110.037.12 (95%) |
Примечание: приведены данные из трех независимых экспериментов, повторенных три раза. Значения представлены в виде среднего арифметического с учетом ошибки среднего. Различия достоверны (р< 0.05 (*). В скобках – активность АЦ в %. Базальная активность принята за 100%.
Следующая часть работы посвящена расшифровке структурно-функциональной организации механизма АЦ активирующего действия инсулина и ИФР-1.
В этой части работы мы поэтапно исследовали звенья, которые могут быть вовлечены в реализацию действия инсулиноподобных пептидов, начиная от рецептора и заканчивая эффекторными системами, которые являются конечным звеном реализации сигнала.
Участие рецептора тирозинкиназного типа в реализации АЦ стимулирующего эффекта пептидов инсулинового суперсемейства.
Для доказательства участия рецептора тирозинкиназного типа, характерного для пептидов инсулинового суперсемейства в реализации АЦ стимулирующего эффекта пептидов инсулиновой природы, использовали селективные ингибиторы рецепторных тирозинкиназ – тирфостин 47 и генистеин, которые блокируют тирозинкиназную функцию рецептора инсулина и других пептидов инсулиновой природы. Ингибиторы инкубировали с пробами в течение 15 мин после чего в пробу добавляли пептиды (время действия 2.5 мин) при концентрации, вызывающей максимальный АЦ стимулирующий эффект. Влияние этих ингибиторов на активирующие АЦ эффекты инсулина, ИФР-1, ЭФР и для сравнения на эффект изопротеренола (в случае позвоночных) и серотонина (в случае беспозвоночных), которые также действуют активирующим образом на АЦ, но через рецептор серпантинного типа, изучали in vitro во фракции мембранных препаратов мышечной ткани крыс, культуры куриных миобластов, моллюсков.
У крыс в присутствии тирфостина 47 (1.25-5.0 мкМ) активирующий АЦ эффект пептидов снижался при действии инсулина до 50%, при ИФР-1 до 65 %, при ЭФР до 50 % по отношению к максимальному эффекту пептидов, принятому за 100% (Рис. 10). В присутствии генистеина (1.25-5.0 мкМ) снижение АЦ стимулирующих эффектов всех используемых пептидов у крыс было более выражено. Эффект инсулина снижался до 40%, эффект ИФР-1 до 10 %, эффект ЭФР – до 18 % (рис. 11). В тоже время у крыс стимулирующий эффект изопротеренола на АЦ (10-6М) практически не изменялся в присутствии тирфостина 47 и генистеина (0.5-20.0 мкМ).
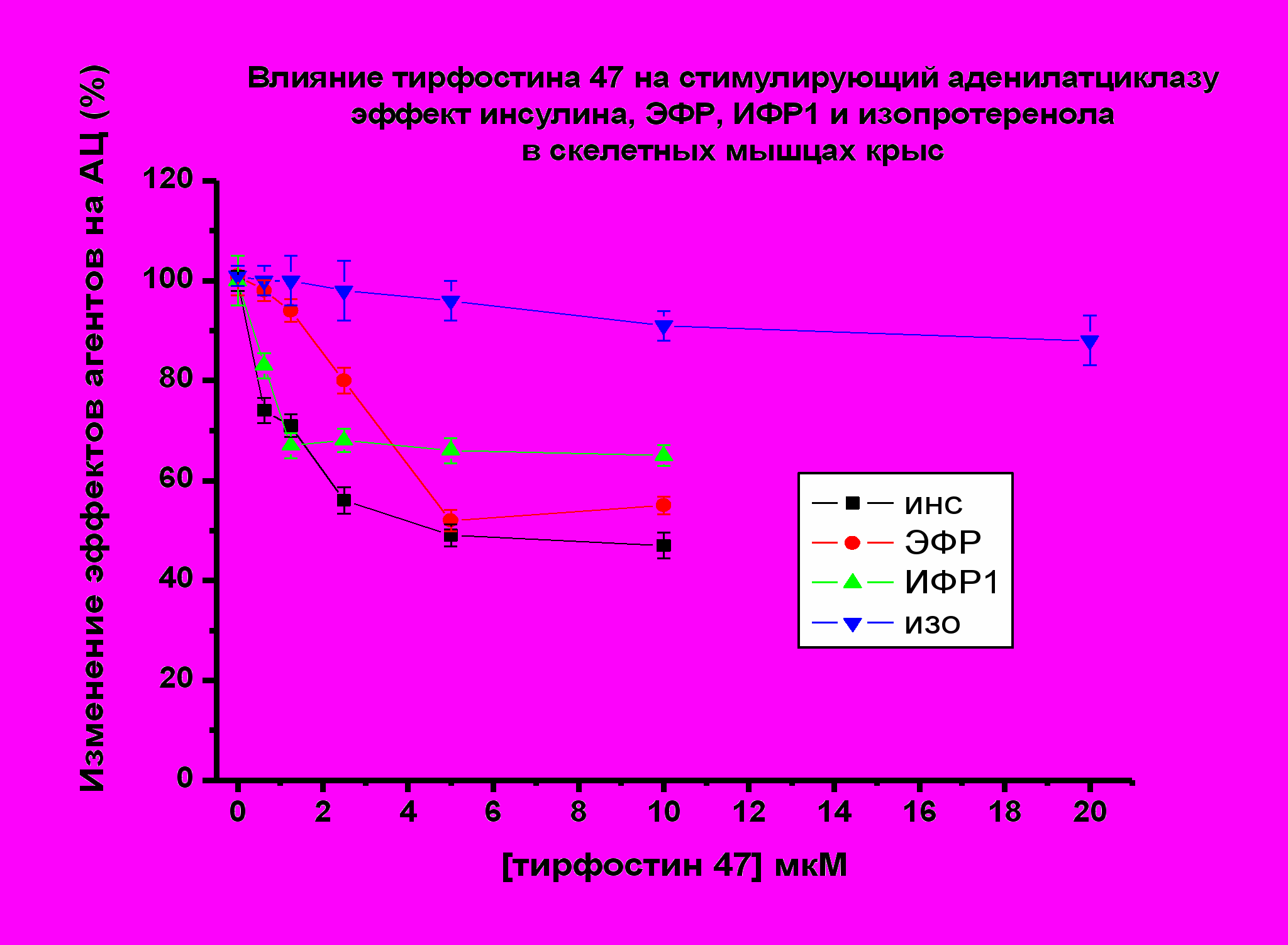 |
| Рис. 10. По оси ординат - снижение стимулирующего эффекта пептидов и изопротеренола на АЦ (принятого за 100 %) в присутствии тирфостина 47. |
 |
| Рис. 11. По оси ординат - снижение стимулирующего эффекта пептидов и изопротеренола на АЦ (принятого за 100 %) в присутствии генистеина. |
В культуре клеток 4-х суточных куриных миобластов тирфостин 47 (Рис. 12) и генистеин (данные представлены в диссертации) ингибировали АЦ активирующий эффект инсулина до 43% и 38%, соответственно. Однако, активирующее действие изопротеренола на АЦ в присутствии ингибиторов тирозинкиназ (тирфостина 47 и генистеина) не изменялось (р < 0.05). Это свидетельствует о том, что классические рецепторы серпантинного типа не участвуют в механизме действия пептидов инсулиновой природы.
 |
| Рис. 12. Ппо оси ординат - снижение стимулирующего эффекта инсулина и изопротеренола на АЦ (принятого за 100 %) в присутствии тирфостина 47. |
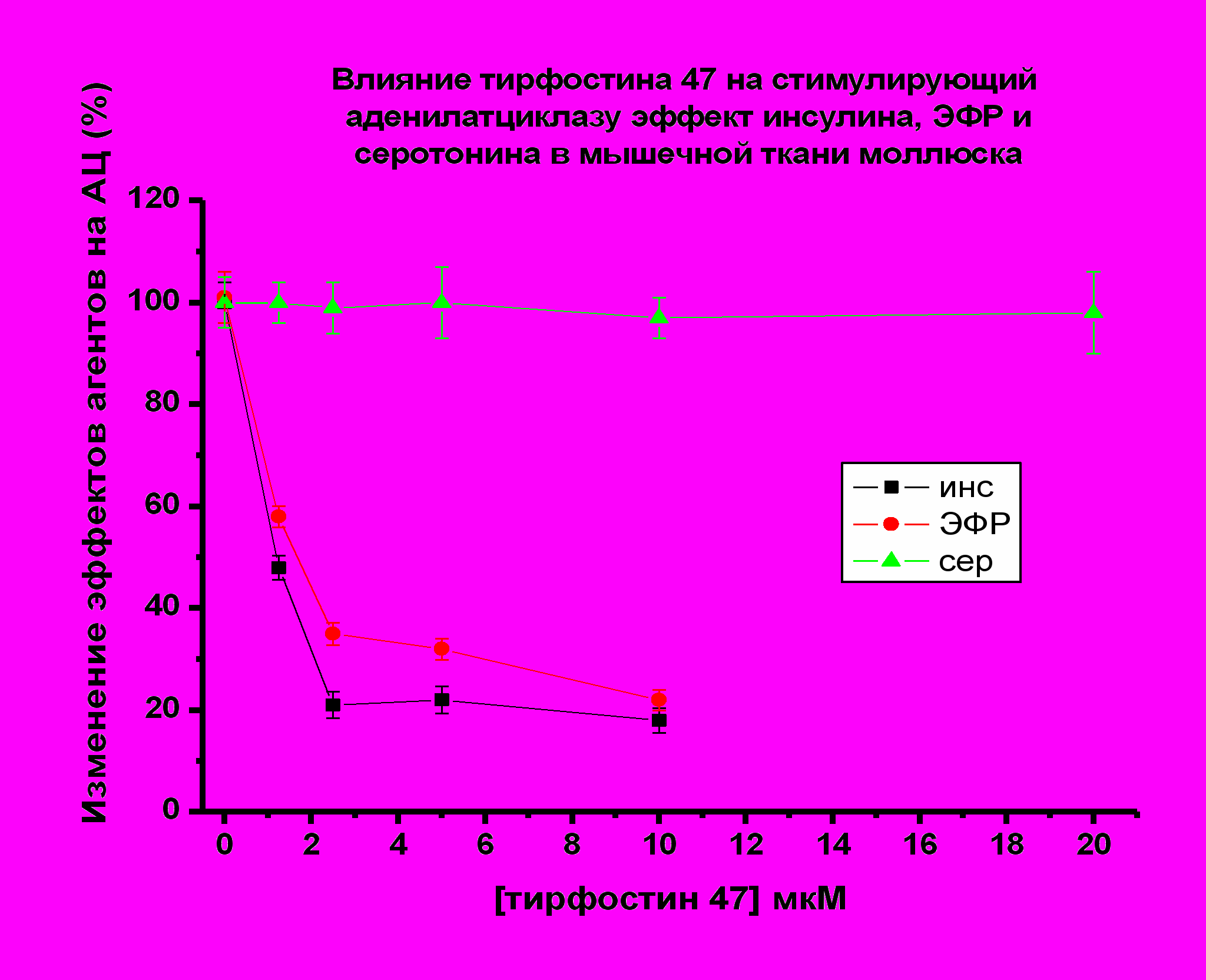 |
| Рис. 13. По оси ординат - снижение стимулирующего эффекта пептидов и серотонина на АЦ (принятого за 100 %) |
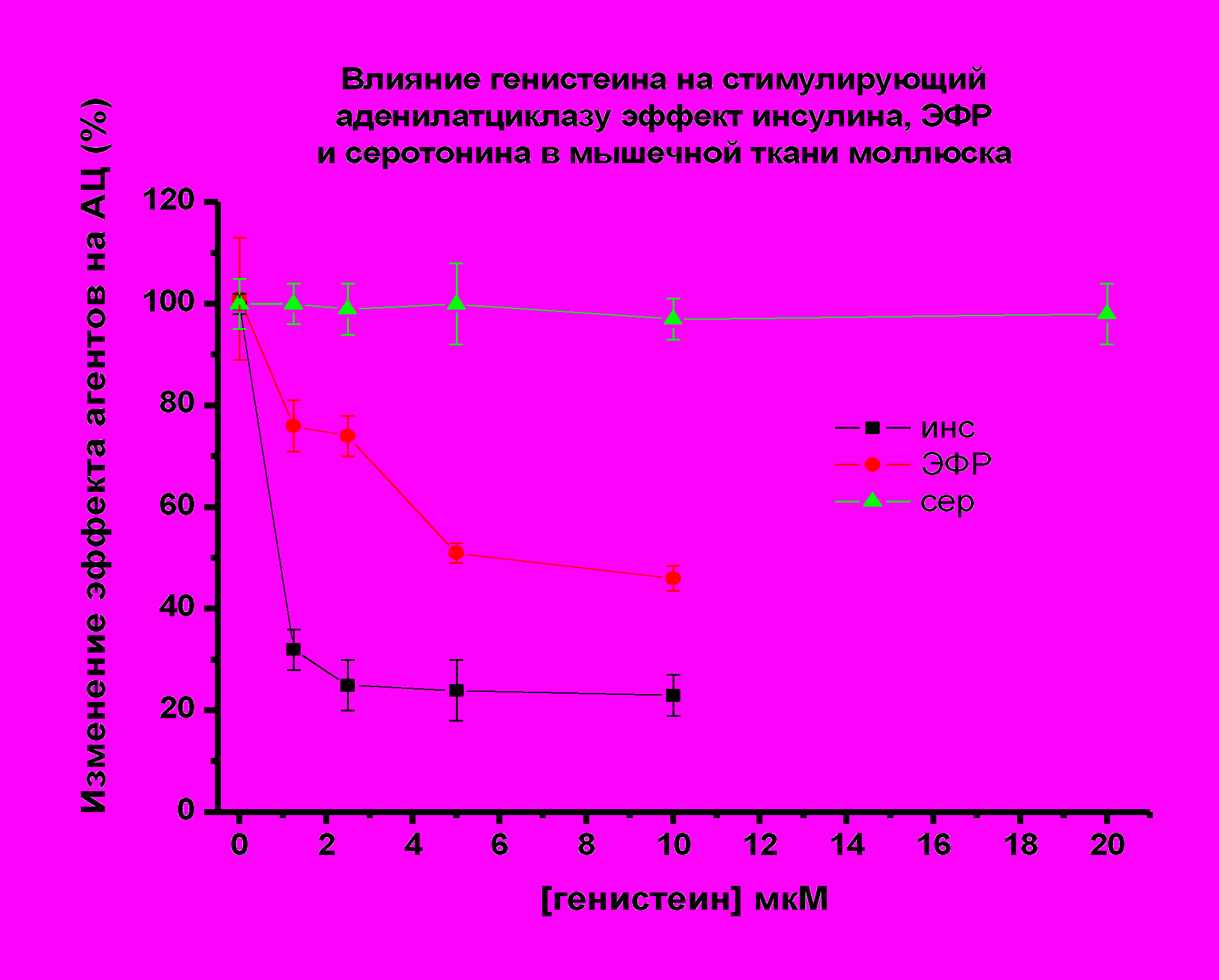 |
| Рис. 14. По оси абсцисс – концентрация генистеина в мкМ; по оси ординат - снижение АЦ стимулирующего эффекта пептидов и серотонина (принятого за 100 %) в присутствии генистеина. |
У моллюсков наиболее выраженное снижение АЦ стимулирующего эффекта пептидов наблюдалось в присутствии тирфостина 47 (2.5 мкМ). Эффект инсулина уменьшался до 20 %, эффект ЭФР до 30-35%. (Рис 13). В присутствии генистеина АЦ стимулирующий эффект пептидов снижался до 25 % в случае инсулина (1.25 мкМ генистеин), и до 50-75% в случае ЭФР (5 мкМ генистеин) (рис. 14).
Необходимо подчеркнуть, что у моллюсков A.cygnea активность АЦ увеличивается не в присутствии изопротеренола, а в присутствии серотонина, реализующего свое действие также через рецепторы серпантинного типа (Pertseva et al., 1992). Исследование действия ингибиторов тирозинкиназ - тирфостина 47 и генистеина (0.5-20.0 мкМ) на стимулирующий АЦ эффект серотонина в мембранной фракции мышечных тканей моллюсков не выявило изменений в действии этого биогенного амина на активность АЦ.
Таким образом, в мембранной фракции крыс, моллюсков и культуры клеток куриных миобластов стимулирующее влияние исследуемых пептидов на АЦ снижалось в присутствии тирфостина 47 и генистеина в диапазоне концентраций - 1.25, 2.5, 5.0, 10, 20 мкМ во всех исследуемых объектах (Рис. 10-14).
Стимулирующее действие изопротеренола (крысы, куры) или серотонина (моллюски) на АЦ, реализуемое через рецепторы серпантинного типа не изменялись в присутствии тирфостина 47 или генистеина в исследуемых объектах (см. Рис. 10-14).
Можно заключить, что в мышечной ткани млекопитающих (крысы), птиц (куры), культуре клеток куриных миобластов и в мышцах моллюсков активирующее действие инсулина, ИФР-1, ЭФР на АЦ осуществляется с участием рецепторов тирозинкиназного типа, специфичных для действия этих пептидов. (Pertseva et al., 1996; Plesneva et al., 2003).
