Федеральное государственное учреждение науки «Государственный научный центр прикладной микробиологии и биотехнологии»
| Вид материала | Автореферат |
- На правах рукописи, 414.66kb.
- Методические указания мук 2870-11, 1885.25kb.
- Работа выполнена в фгу «Государственный научный центр лазерной медицины» Федерального, 275.62kb.
- Г. Москва, Профсоюзная ул., д. 86. Тел. 334-81-86, 181.98kb.
- Проект «Мать и Дитя Федеральное государственное учреждение «Научный центр акушерства,, 1694.96kb.
- Федеральная целевая программа "Культура России (2012 - 2018 годы)" Дата принятия решения, 3977.03kb.
- «Разработка и экспериментальная апробация комплекса средств биологической профилактики, 167.26kb.
- Бно-методический комплекс по дисциплине сд. 03 «Основы микробиологии и биотехнологии», 184.72kb.
- Федеральное агентство воздушного транспорта федеральное государственное образовательное, 204.23kb.
- Шестопалов александр михайлович экологический полиморфизм и территориальная значимость, 601.39kb.
Исследование данных веществ показало их высокую антиоксидантную активность. Установлено, что обработка бактериальных клеток данными антиоксидантами частично предотвращает их элиминацию в мышиных макрофагах.
Глава 3 Бионанотехнологические подходы исследования в микробиологии
3.1 АСМ микроскопия вирусов
Вирусы были выбраны для исследования как наименьшие живые биологические структуры. Существует два метода иммобилизации вирусов: специфическая и неспецифическая. Неспецифический метод заключается в нанесении капли вирусной суспензии на поверхность. Специфический метод основан на предварительной модификации поверхности специфическими антителами. Стандартные методы получения монослоев вирусных антител базируются на ковалентном связывании антител с поверхностью. Хорошо известно, что монослои антител и ферментов могут терять свою активность. Чтобы этого не происходило, используют амфифильные полиэлектролиты и липиды. Был разработан метод с использованием лэнгмюровских пленок антител на амфифильном полиэлектролите для иммобилизации ротавирусов и аденовирусов с последующей визуализацией методом АСМ. Аденовирусы и ротавирусы – важные патогены человека. На рис. 11 представлены АСМ изображения аденовирусов и ротавирусов, полученные с помощью неспецифической иммобилизации.
А Б
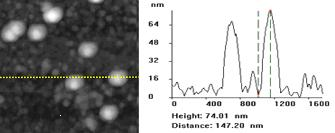
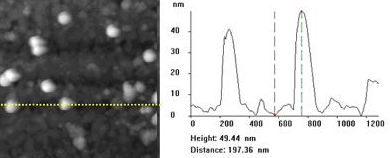
Рисунок 11 - АСМ изображение аденовирусов (А) и ротавирусов (Б) на поверхности. Справа показан вертикальный профиль поверхности
Такие образцы очень нестабильны и быстро разрушаются при хранении. Чтобы повысить специфичность и стабильность иммобилизованных вирусов, использовали антитела для их специфического связывания с поверхностью. Для этого применяли лэнгмюровские пленки антител на амфифильных электролитах – полиэтиленимине и полибензилгистидине. Применение таких электролитов делает возможным предохранение конформации белковой глобулы от действия инактивирующих факторов на границе раздела фаз воздух/вода и приводит к усилению взаимодействий между компонентами лэнгмюровских пленок. Были протестированы различные условия образования монослоев полиэлектролитов. В качестве критерия использовали степень шероховатости получаемых пленок. В случае полибензилгистидина стало возможным получать пленки толщиной 1,5-2 нм и шероховатостью 0,2 нм, что в результате приводит к увеличению аффинности пленок полимер/антитело.
После месяца хранения при +5 °С пленки антител оставались целыми, сохраняя свою иммунную активность. Для определения толщины полученной пленки антител специально разрушали небольшую область ее поверхности. Разница в высоте разрушенного и целого слоев интерпретировалась как толщина пленки, которая составляла 8-12 нм в зависимости от выбранной области и материала субстрата (рис. 12).

Рисунок 12 - Пленка аденовирусных антител на поверхности подложки. Слева (А) показан участок пленки, специально разрушенный для оценки толщины пленки. Справа (В) показана нативная пленка
Используя этот подход, можно получать специфически иммобилизованные аденовирусы и ротавирусы. На рис. 13 представлены АСМ изображения ротавирусов и трехмерное изображение аденовирусов.
А Б


Рисунок 13 - АСМ изображение ротавирусов (А), и трехмерное АСМ изображение аденовирусов (Б), специфически связанных с пленкой соответствующих антител, образованной на амфифильном полимере
3.2 АСМ микроскопия бактерий
Существует множество методов исследования бактерий. Качественную и количественную характеристики бактериальных клеток можно получить методами световой и электронной микроскопии, фотоэлектронной микроскопии Х-лучей, ИК-спектроскопии, измерениями контактного угла и электрофоретической мобильности. Однако многие из этих методов требуют специальной подготовки и условий вакуума во время анализа и не могут быть использованы для нативных исследований. В последние годы в микробиологии открыт новый способ исследования бактерий. АСМ микроскопия обеспечивает получение 3D изображения поверхностных ультраструктур с молекулярным разрешением, в режиме реального времени и физиологических условиях. Поверхность живых бактериальных клеток - это очень сложная гетерогенная структура, содержащая липидные, белковые и углеводные компоненты. Организация некоторых мембранных областей играет важную роль во взаимодействии клеток с поверхностью и между собой. Вместе с тем, несмотря на то, что ультраструктура микробной поверхности изучается методом электронной микроскопии уже более 30 лет, прямой информации о ее строении в нативном состоянии получить таким способом нельзя. Понимание процессов адгезии и агрегации бактериальных клеток требует не только знания физико-химических свойств (гидрофобности и электрических свойств) и химического состава, но также наномеханических свойств и ультраструктуры их поверхности. Уникальная возможность АСМ представлять бактериальный мир в субнанометровом диапазоне и в водном растворе может быть использована для исследования как самих клеток, так и их поверхности в физиологических условиях. АСМ дает изображения бактериальных клеток и их поверхности с высоким разрешением. Эти изображения используются для анализа внешнего вида и свойств поверхности бактерий. АСМ может быть использована для изучения физиологических процессов, таких как клеточный рост и прорастание спор, а также для исследования морфологических изменений живых бактерий под действием антибиотиков. В водных средах микроорганизмы имеют тенденцию образовывать колонии на твердых поверхностях, создавая биопленки. Это вызывает загрязнение трубопроводов, морских сооружений и кораблей. Протекающие при этом коррозиционные процессы также изучаются методами АСМ.
В данной работе мы использовали АСМ для идентификации патогенных бактериальных клеток. Некоторые АСМ изображения получены с использованием неспецифической адсорбции бактерий (рис. 14).


Рисунок 14 - АСМ изображение клеток M. tuberculosis
Для специфической визуализации бактерий был разработан новый подход, основанный на иммобилизации специфических антител непосредственно на твердой подложке через связывание антител стафилококковым белком А. Белок А специфически узнает и связывает Fc-фрагменты антител. Получены изображение слоя белка А (рис. 15) и 3D изображения специфически иммобилизованных бактерий и спор (рис. 16) с использованием слоя белка А для чувствительной иммобилизации специфических антител.

Рисунок 15 - Трехмерное реконструированное АСМ изображение слоя белка А
АСМ очень важна при быстрой и суперчувствительной детекции патогенов. Уникальные возможности АСМ можно использовать в дальнейших исследованиях в нанобиотехнологии не только для детекции бактериальных клеток и вирусов, но и для очень чувствительного определения нанофрагментов этих объектов.


Рисунок 16 - Трехмерное реконструированное изображение клеток (слева) и спор (справа) B. thuringiensis с использованием слоя белка А
3.3 Изучения взаимодействия фаг-бактерия
Был разработан протокол приготовления образцов для визуализации с помощью АСМ взаимодействия бактерий с бактериофагами. Для этого растворы, содержащие живые бактерии E. coli и бактериофаги, специфичные к данному штамму, смешивали и помещали в термостат при 37 °С. Через определенные промежутки времени из термостатируемого раствора извлекали 5-10 мкл смеси для нанесения на слюду и АСМ-мониторинга. Полученные результаты показали эффективность использования АСМ для такого рода систем. На рис. 17 и 18 хорошо видна динамика взаимодействия фаг-бактерия.
А Б

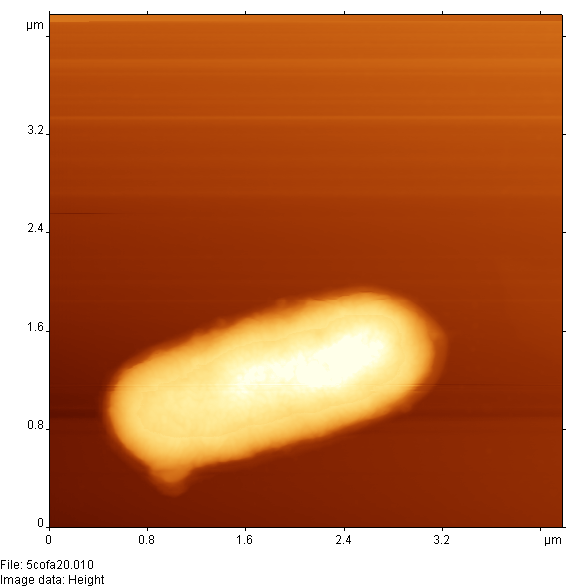
Рисунок 17 - АСМ изображение E.coli при отсутствии фагов (А) и через 15 мин после добавления фагов (Б)
А Б
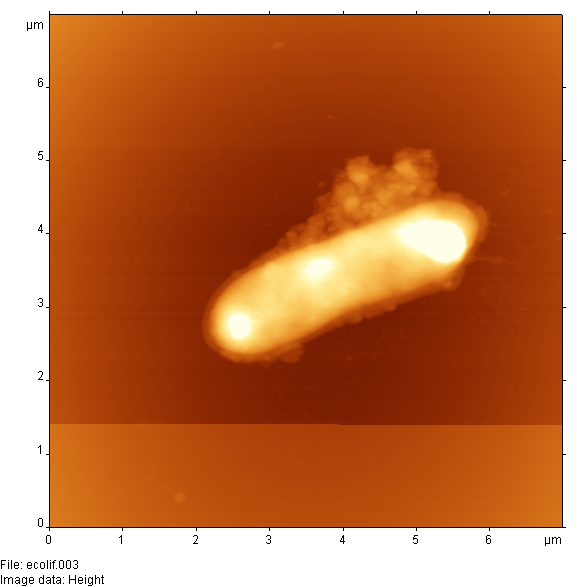

Рисунок 18 - АСМ изображение клетки E. coli после 35 мин (А) и 65 мин (Б) инкубации с фагом
На рис. 17А приведено изображение единичной бактериальной клетки при отсутствии бактериофагов. Через 15 мин после добавления бактериофагов (рис. 17Б) изображение бактериальной клетки изменяется и можно видеть фаговую "шубу" на поверхности бактерии. После 35 мин инкубации бактерий с фагами (рис. 18А) наблюдается выход большого количества фагов из бактериальной клетки в результате ее лизирования. На рис. 18Б изображена бактериальная клетка после фагового лизиса (видны морфологические изменения бактерии и следы выхода бактериофагов). Данная картина является типичной после инкубирования бактерий с бактериофагом более 1 ч.
Кроме этого, были проведены исследования наноструктуры аффинных поверхностей, представляющих собой антитела, закрепленные на латексных и магнитных частицах. Получены изображения высокого разрешения, позволяющие произвести визуальную оценку процесса агглютинации латексных частиц, несущих специфичные антитела, с антигеном и изображения бионанообъектов, отражающие динамику взаимодействия фагов с бактериальной клеткой – мишенью.
3.4 Изучение фрагментов бактериальных клеток
Для изучения специфического связывания фрагментов бактерий с аффинной поверхностью нами была предложена следующая структура этой поверхности: активированная слюда – белок G – антитело. Активированная в тлеющем разряде слюда улучшает адсорбцию на нее белка G, который в свою очередь увеличивает степень адгезии на него антител (в силу их специфического взаимодействия). Толщина слоя белка G возрастает с увеличением его концентрации в растворе, причем оптимальная величина находится в диапазоне 0,1-0,6 мг/мл, при которой толщина слоя составляет до 1,3 нм (рис. 19).
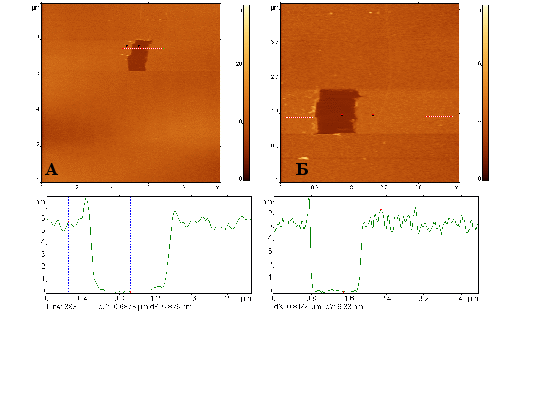
Рисунок 19 - АСМ изображения обработанной в тлеющем разряде (0,2 мА, 60 с) поверхности слюды, (А) экспонированной в растворе (0,1 мг/мл) моноклональных антител к E. coli; (Б) экспонированной последовательно в растворе белка G (0,1 мг/мл), а затем (после промывки) в растворе моноклональных антител к E. coli.
Рис. 21. АСМ изображения обработанной в тлеющем разряде (0,2 мА, 60 сек.) поверхности слюды, (А) экспонированной в растворе (0,1 мг/мл) моноклональных антител к E. coli; (Б) экспонированной последовательно в растворе белка G (0,1 мг/мл), а затем (после промывки) в растворе моноклональных антител к E. coli.
Поверхности, модифицированные «родными» антителами (к E. coli), а также «чужими» антителами (к Salmonella), были изучены как поверхности для связывания с фрагментами клеток E. coli. Из АСМ-изображений, представленных на рис. 20, следует, что количество нанофрагментов, адсорбированных «родными» антителами, в сотни раз больше, чем «чужими». При приготовлении образцов, представленных на рис. 20, время экспозиции поверхности с нанофрагментами составляло 3 мин, а объем раствора с антигеном – 5 мкл. При таких параметрах адсорбции поверхность переставала эффективно адсорбировать антиген с концентрациями 107 клеток/мл и ниже. В связи с этим, параметры адсорбции подбирались таким образом, чтобы позволять детектировать малые концентрации.
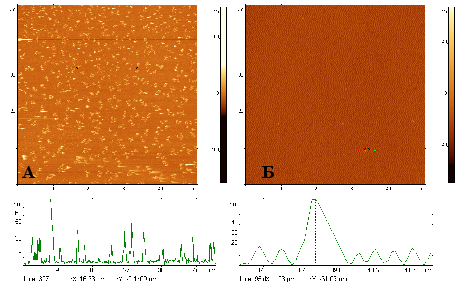
Рисунок 20 - АСМ изображения модифицированных антителами к E. coli (А) и к Salmonella (Б) поверхностей после их экспонирования в растворе, содержащем разрушенные фрагменты клеток E. coli c концентрацией (по целым клеткам) 109 клеток/мл
Для этого уменьшали концентрацию антигена в суспензии, в которую помещали изготовленную поверхность. На рис. 21 показано АСМ изображение поверхности слюды, активированной в тлеющем разряде, модифицированной белком G и антителами к E. coli, экспонированной в течение 10 мин в суспензии фрагментов клеток E. coli, c исходной концентрацией клеток 102 клеток/мл. Как видно из АСМ изображения, на нем присутствуют частицы, которые и являются предположительно фрагментами бактерий. На рис. 21Б и 22В представлены сечения, проведенные по верхней и нижней пунктирным линиям на АСМ изображении. Верхнее сечение демонстрирует профиль бактериального нанофрагмента, а нижнее – глубину белковых слоев
на поверхности слюды (белок G + антитело), целостность которых была нарушена в ходе царапающего эксперимента кантилевером атомно-силового микроскопа.
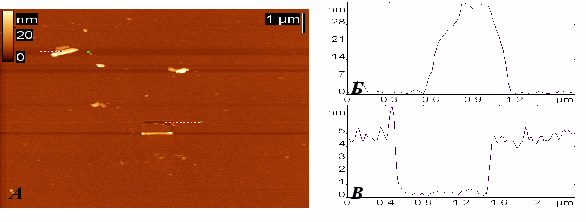
Рисунок 21 - АСМ изображение поверхности слюды, активированной в тлеющем разряде, модифицированной белком G и антителами к E. coli, экспонированной в течение 10 мин в суспензии, содержащей фрагменты клеток E. coli с исходной концентрацией 102 клеток/мл (А); (Б) – сечение, проведенное по верхней пунктирной линии на АСМ изображении, демонстрирующее профиль бактериального фрагмента; (В) – сечение, проведенное по нижней пунктирной линии на АСМ изображении, демонстрирующее результат царапающего эксперимента
При дальнейшем уменьшении концентрации антигена его количество становится настолько маленьким, что вероятность даже специфического связывания очень мала. Поэтому требуется повысить эффективность специфического связывания, понизив при этом эффективность неспецифического. Для решения этой задачи модифицировали методику нанесения следующим образом. Во-первых, связывание антигена с аффинной поверхностью и последующую промывку стали проводить при pH 8,2 и температуре 32 °С, что благоприятствует специфическому связыванию. Во-вторых, промывку проводили погружением подложки в буфер с последующим вращением на шейкере в течение 10 мин, чтобы повысить эффективность очищения от неспецифически связавшегося с поверхностью материала за счет дополнительно возникающих гидродинамических потоков вблизи поверхности.
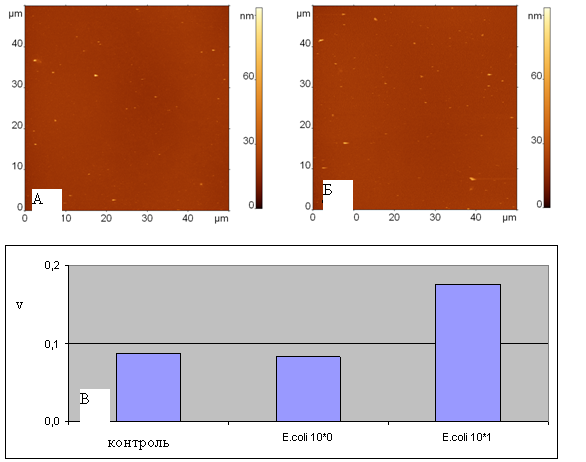
Рисунок 22 - АСМ изображения поверхностей, модифицированных белком G и антителами к E. coli, экспонированных в (А) суспензии, содержащей фрагменты клеток E. coli с концентрацией (по целым клеткам) 100 клеток/мл, (Б) суспензии, содержащей фрагменты клеток E. coli с концентрацией (по целым клеткам) 101 клеток/мл. Все изображения приведены к одному масштабу по высоте. Размеры изображений составляют 50 мкм. (В) – диаграмма значений v для образцов, полученных при экспонировании аффинных к E. coli поверхностей в суспензии E. coli с концентрациями 100 и 101 клеток/мл в сравнении с контрольным изображением
Для того, чтобы оперировать количественными критериями изучаемого взаимодействия, была разработана схема статистического анализа АСМ изображений. Сначала строится гистограмма распределения по высотам всех объектов на контрольном изображении и выбирается такая высота hmin, ниже которой лежит подавляющее большинство объектов. В дальнейшем анализируются лишь объекты, высоты которых превышают hmin. Такое отбрасывание более низких объектов позволит избежать анализа примесей. После этого для анализируемого изображения (с бактериальными фрагментами) строится распределение изображенных на нем объектов с высотами, большими hmin, по объемам и рассчитывается суммарный объем объектов V на АСМ изображении. Затем суммарный объем нормируется на площадь АСМ изображения v=V/S. Таким образом, величина v, имеющая смысл количества присоединившегося к поверхности материала на единицу площади, служит критерием для оценки наличия или отсутствия специфического связывания.
Разработанная методика оценки чувствительности аффинной поверхности была применена к антигену со сверхмалыми концентрациями – 100 и 101 клеток/мл. Соответствующие АСМ изображения приведены на рис. 22А, Б, а значения параметра v – на рис. 22В. Сравнение значений параметра v показывает, что чувствительность к определению малых концентраций становится значительно меньше, а для концентрации 100 клеток/мл значение v практически совпадает с контрольным.
Таким образом, была показана возможность специфической визуализации (идентификации) не только целых бактериальных клеток, но и их фрагментов с помощью АСМ.
Глава 4 Изучение токсичности нанообъектов
Для анализа бактерицидной активности были приготовлены 6 групп образцов с многофункциональными биоактивными наноструктурными покрытиями (МБНП). Их получали путем магнетронного напыления в атмосфере аргона или смеси аргона с азотом.
Грамотрицательные бактерии E. coli X-blue, E. coli 09, S. typhimurium и P. aeruginosa и грамположительные бактерии B. brevis и B. subtilis выращивали на твердой среде LB с 2 % агара в течение ночи в присутствии 6 образцов с МБНП. Не обнаружено разницы в росте бактерий, как в присутствии, так и в отсутствии образцов.
Кроме того, грамотрицательные бактерии E. coli X-blue и P. aeruginosa и грамположительные бактерии B. brevis и B. subtilis выращивали в жидкой среде LB. Исходная концентрация бактерий составляла 106 клеток/мл. Бактериальный рост анализировали по изменению оптической плотности при 625 нм. После 4 ч культивирования в контролях и опытах не было обнаружено разницы в росте. Таким образом, установлено, что образцы с МБНП не обладали бактерицидной активностью при культивировании бактерий как на твердых, так и в жидких питательных средах.
Анализ функциональной активности перитонеальных фагоцитов против клеток Y. pseudotuberculosis проводили в присутствии тех же 6-ти образцов с МБНП. Полученные результаты не выявили статистически достоверной разницы в бактерицидной активности макрофагов в присутствии всех протестированных образцов с МБНП. Это означает, что данные МБНП не изменяют бактериальный статус и системы защиты макроорганизма. Таким образом, данные МБНП могут использоваться для имплантантов, работающих под нагрузкой.
При анализе наноповерхностей титана, модифицированных одной из трех активных добавок - 10CaO + 2KMnO4, или 20%ZrO2 (TiZrCON), или наносеребром, показано, что после первых 3 ч культивирования оптическая плотность уменьшалась в 1,5 раза при инкубации образца с добавлением Ag с клетками E. coli по сравнению с оптической плотностью бактерий при отсутствии образцов в среде культивирования. Для остальных образцов бактерицидный эффект не был обнаружен.
Анализ фагоцитарной активности показал, что в присутствии образца (TiC+10CaO + 2KMnO4) в среде бактерицидная активность макрофагов не изменялась. В присутствии образца (TiC+20%ZrO2 (TiZrCON)) количество живых макрофагов уменьшалось вдвое, при этом оставшиеся (живые) макрофаги обладали нормальной фагоцитарной активностью. В присутствии образца Ag почти все макрофаги были повреждены, а оставшиеся живые макрофаги не обладали фагоцитарной активностью.
Таким образом, с помощью микробиологических приемов можно оценивать токсичность наноматериалов.
ЗАКЛЮЧЕНИЕ
Современные методы анализа и идентификации микроорганизмов направлены на повышение чувствительности и уменьшение времени процедур. С этой точки зрения применение электрооптического и биосенсорного подходов изучения бактерий представляется весьма привлекательным благодаря нативности и чувствительности (для электрооптики), и чувствительности и быстроте (для биосенсоров), а использование бионанотехнологических подходов способствует не только визуализации процессов в нанометровом разрешении, но и увеличению чувствительности определения бактериальных клеток.
Электрооптический метод анализа клеток обеспечивает контроль электрофизических и связанных с ними морфологических и функциональных параметров бактерий. Интерпретация электрофизических параметров клеточных структур, фракционного состава популяции и морфометрии построена на взаимосвязи структуры и функций клетки. Результаты электрооптических исследований взаимодействия микроорганизмов с антителами или с частицами, модифицированными антителами, позволяют оценить возможность совмещения достижений в области иммуноидентификации и электрофизических измерений. Электрооптическое исследование взаимодействия фаг-бактерия также может быть применено для обнаружения и идентификации микроорганизмов. На основании итогов многолетней работы по разработке основ электрооптики микроорганизмов, можно сделать обобщающий вывод о создании теоретической и методической базы для широкого внедрения электрофизического метода анализа клеточных структур и определения гетерогенности клеточных популяций.
Современные методы анализа и идентификации микроорганизмов могут быть чувствительными, недорогими, с хорошими количественными и качественными характеристиками. Однако их применение требует обученного персонала и длительных временных процедур. Биосенсоры представляют собой разумную альтернативу традиционным методам, сокращая процедуру измерения и улучшая ее качество. В данной работе расширена область применения известных биосенсоров и разработаны новые биосенсорные элементы.
В представленной работе предпринята попытка идентификации микроорганизмов путем анализа летучих компонентов (ЛК) бактерий. Принцип определения бактерий основан на анализе воздушного пространства над образцом для определения ЛК компонентов с помощью системы искусственного носа. Разработаны два метода неконтактного определения бактерий. Первый – простой анализатор летучих компонентов (термостатируемый и для постоянного мониторинга) для определения бактерий и грибов по анализу газов над микробными культурами. Второй метод - система искусственного носа на основе оптических волокон высокой плотности, позволяющая определять бактерии. Пористые силиконовые микросферы с флуоресцентным красителем, инкорпорированные в оптоволоконные системы, использовали для оценки изменения их флуоресценции после взаимодействия с ЛК. Анализ достоверности результатов эксперимента показал возможность применения системы искусственного носа на основе оптоволоконной системы для определения бактерий.
Известно, что максимальный выход антибиотика авермиктина наблюдается при полном потреблении глюкозы в среде роста микроорганизма. Биосенсор на глюкозу позволяет оперативно контролировать уровень содержания данного углевода в среде культивирования. Биосенсорная система определения глюкозы на основе фермента глюкозооксидазы и кислородного датчика была успешно применена для оптимизации условий выделения антибиотика авермиктина.
Применение микроорганизмов в качестве узнающего элемента биосенсора широко практикуется при анализе окружающей среды и пищи. Однако микроорганизмы представляют собой сложные полиферментные системы, а наличие сложных метаболических процессов мешает интерпретации сигнала. Поэтому разработка узнающего элемента биосенсора на основе цитоплазматической мембраны микроорганизмов позволяет увеличить специфичность и чувствительность биосенсора. Более того, путем индукции ферментативных комплексов при культивировании можно получить биосенсор на определенный субстрат.
Особенно стоит отметить разработку биосенсора для оценки антиоксидантной активности. Влияние антиоксидантов на выживание бактериальных клеток в настоящее время не изучено. Поэтому разработка такого типа биосенсора является перспективным инструментом оценки антиоксидантной активности соединений для выяснения их роли в процессах переживания микроорганизмов в макрофагах.
Бионанотехнологические подходы в микробиологии – современный тренд в исследовательских направлениях, позволяющий детализировать процессы в микробиологии на нано-уровне. Применение атомно-силовой микроскопии позволило визуализировать такие процессы, как реакция гемагглютинации и взаимодействие фагов с бактериальными клетками. Кроме того, данный подход с использованием антител позволил специфически визуализировать нанофрагменты бактерий. Следует учитывать, что работа в новых областях с применением наноподходов требует хотя бы предварительного изучения возможных рисков при работе с наноматериалами. Предварительные данные показали, что, несмотря на инертность наноповерхностей, в особых случаях мы можем наблюдать токсический и бактерицидный эффект наночастиц.
