Федеральное государственное учреждение науки «Государственный научный центр прикладной микробиологии и биотехнологии»
| Вид материала | Автореферат |
- На правах рукописи, 414.66kb.
- Методические указания мук 2870-11, 1885.25kb.
- Работа выполнена в фгу «Государственный научный центр лазерной медицины» Федерального, 275.62kb.
- Г. Москва, Профсоюзная ул., д. 86. Тел. 334-81-86, 181.98kb.
- Проект «Мать и Дитя Федеральное государственное учреждение «Научный центр акушерства,, 1694.96kb.
- Федеральная целевая программа "Культура России (2012 - 2018 годы)" Дата принятия решения, 3977.03kb.
- «Разработка и экспериментальная апробация комплекса средств биологической профилактики, 167.26kb.
- Бно-методический комплекс по дисциплине сд. 03 «Основы микробиологии и биотехнологии», 184.72kb.
- Федеральное агентство воздушного транспорта федеральное государственное образовательное, 204.23kb.
- Шестопалов александр михайлович экологический полиморфизм и территориальная значимость, 601.39kb.
Небольшое занижение результатов выживаемости бактериальных клеток, получаемое электрооптическим методом, объясняется тем, что данный метод регистрирует как летальные, так и сублетальные повреждения бактерий. Данные повреждения и их репарация детально исследованы при изучении замораживания и оттаивания клеток, а также при их лиофилизации. Оказалось, что при замораживании-оттаивании активность мембраносвязанных оксидазных и дегидрогеназных ферментов, а также содержание цитохромов не меняется. Не наблюдается также структурных перестроек в липидной фазе мембраны и изменений в ее липидном составе. Однако замораживание-оттаивание вызывает повреждение целостности клеточного барьера, с последующим разобщением окислительного фосфорилирования. В ходе восстановительных процессов (репарации) после экстремальных воздействий наблюдается восстановление целостности клеточного барьера, с последующим восстановлением синтеза АТФ в ответ на искусственно созданную протондвижущую силу.
Выбор электрофизических параметров эксперимента определялся тем, чтобы для данного вида микроорганизмов электрооптический сигнал успевал за минимально возможное время достичь максимума при включении поля и вернуться к исходному уровню при его выключении. Измерение поляризационных параметров клеток как функции частоты электрического поля или частотной дисперсии анизотропии поляризуемости (ЧДАП) – позволяет определить физиологическую активность клеток. После оптимизации состава поддерживающей среды и электрофизических параметров электрооптических измерений было изучено влияние реакции антиген-антитело на ЧДАП комплекса микроорганизм – антитело. К суспензии бактерий (E. coli или S. enteritidis) в фосфатно-солевом буфере добавляли раствор антител, специфичных, соответственно, к E. coli или S. enteritidis. Полученную смесь инкубировали 20 мин при 37 °С и легком помешивании. Полученную суспензию помещали в измерительную ячейку электрооптического анализатора. Под действием переменного электрического поля (напряженность Е=100 в/см; время действия t=2 сек.; диапазон частот f=10-30000 кГц) происходили изменения оптических свойств суспензии, которые регистрировали в виде ЧДАП (рис. 1-2). В качестве контроля использовали бактерии, не взаимодействовавшие с антителами.
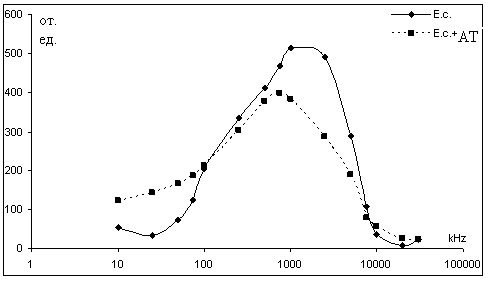
Рисунок 1 - ЧДАП суспензии бактерий E. coli после взаимодействия со специфическими антителами
На основании полученных результатов можно дать некоторую оценку электрофизических и морфометрических параметров полученных комплексов антиген-антитело. Общее снижение амплитуды электрооптического сигнала в присутствии антител может быть следствием образования конгломератов бактериальных клеток. Сдвиг максимума ЧДАП в область низких частот указывает на возможное нарушение целостности бактериальных мембран.
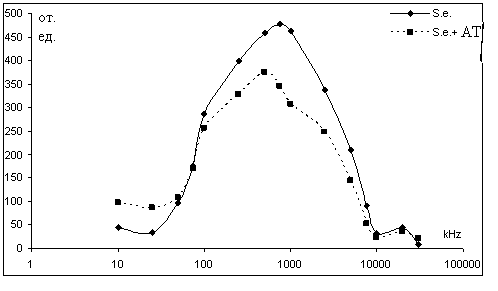
Рисунок 2 - ЧДАП суспензии бактерий S. enteritidis после взаимодействия со специфическими антителами
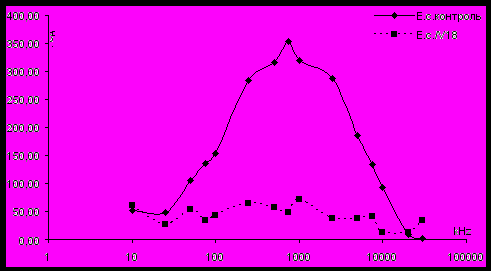
Рисунок 3 - ЧДАП после взаимодействия бактериальной суспензии клеток E.coli 057 c фагом V18/A157
Была изучена возможность использования электрооптического метода для идентификации микроорганизмов путем анализа специфического взаимодействия микробных клеток с бактериофагом. На рис. 3 представлены ЧДАП контрольной суспензии бактерий E. coli и ЧДАП тех же бактерий после 30-минутной инкубации с фагом V18/А157. На рис. 4 показаны ЧДАП контрольной суспензии S. enteriditis и суспензии тех же бактерий после 30-минутной инкубации с фагом 39. Здесь же представлена ЧДАП суспензии бактерий S. enteriditis после 30-минутной инкубации с фагом V18/А157 – специфичным для E. coli, очевидно, невзаимодействующим с бактериями S. enteriditis. Полученные данные подтверждают возможность использования бактериофагов для идентификации микроорганизмов.
Рисунок 4 - ЧДАП после взаимодействия бактериальной суспензии клеток S. enteriditis c фагами V18/A157 и 39
При исследовании взаимодействия клеток B. thuringiensis с фагом Vf, было обнаружено, что если проводить инкубацию бактерий с фагом без аэрации (как в вышеуказанных случаях с E. coli и S. enteriditis), то даже спустя 90 минут не наблюдается существенного изменения ЧДАП (рис. 5).
Однако при инкубации клеток B. thuringiensis с бактериофагом Vf в условиях аэрации результаты получаются сходными с теми, которые были получены при изучении взаимодействия с фагами факультативно анаэробных бактерий E. coli и S. enteriditis (рис. 6). Через 60 мин инкубации бактерий с фагами ЧДАП практически исчезает, что указывает на драматическое нарушение целостности бактериальных оболочек в этих условиях определения.
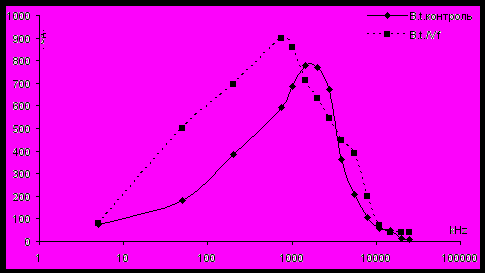
Рисунок 5 - ЧДАП после взаимодействия бактериальной суспензии клеток B. thuringiensis без аэрации c фагом Vf
Рисунок 6 - ЧДАП после взаимодействия бактериальной суспензии клеток B. thuringiensis при аэрации c фагом Vf
Для улучшения измерения ЭОЭ при низкой величине напряженности ориентирующего поля был разработан численный алгоритм определения анизотропии поляризуемости бактериальных клеток, снимающий существенные ограничения на проведение эксперимента.
Глава 2 Биосенсоры
Целью данной части работы является разработка новой генерации биосенсоров на основе системы искусственного носа, ферментов, фагов, бактериальных клеток или их фрагментов для увеличения чувствительности и скорости определения глюкозы, лизина, лактата, а также для определения концентрации бактерий.
2.1 Бесконтактное определение микроорганизмов
Разработан бесконтактный метод определения бактерий с применением системы искусственного носа на основе высокоплотных волоконно-оптических биосенсорных пучков. Принцип определения бактерий основан на анализе воздушного пространства над образцом для определения летучих компонентов (ЛК). Известно, что выделяемые бактериями ЛК определяют специфический запах бактерий, что может служить характерным признаком данной бактерии. Сенсорным элементом являются полистирольные микросферы с флуоресцентным красителем интерколированные в проксимальный конец волоконной системы. ЛК способны влиять на микроокружение микросфер, изменяя флуоресцентные характеристики красителя. Таким образом, анализируя летучие вещества, можно идентифицировать бактерии (рис. 7).
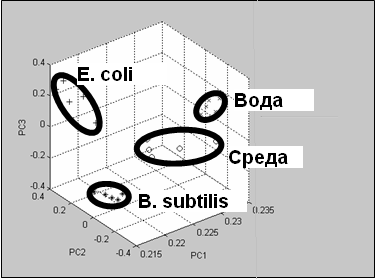
Рисунок 7 - Бесконтактная идентификация бактерий при использовании системы искусственного носа
Развивая данный подход, была показана принципиальная возможность использования простой модификации метода спектрофотометрического анализа для быстрого выявления присутствия микроорганизмов либо по выделению ими ЛК, либо по их поглощению из окружающей среды. Кроме того, данный метод позволяет различить мутанты N. сrassa, дефектные по метаболизму азота, от штамма дикого типа. По-видимому, nit-2 и nit-6 гены гриба связаны с образованием ЛК у этого организма.
2.2 Биосенсор для определения глюкозы
Биосенсоры представляют собой недорогую альтернативу классическому анализу веществ в ходе биотехнологических процессов. Антибиотик авермиктин играет большую роль как в медицине, так и в ветеринарии. Он продуцируется бактериями S. avermitilis в ходе процесса длительного культивирования (72 ч). Характерно, что максимальный выход этого антибиотика наблюдается в короткий промежуток времени при минимальной концентрации глюкозы в среде. Для оптимизации условий выделения антибиотика важно определить минимальную концентрацию глюкозы в среде очень быстро, так как авермиктин быстро распадается при отсутствии глюкозы. Был разработан глюкозный биосенсор для контроля концентрации авермиктина. Для приготовления глюкозного модуля использовали бычий сывороточный альбумин, глюкозооксидазу и глутаровый альдегид. Глюкозный модуль помещали на торец рО2-электрода. Линейный ответ биосенсора наблюдали в диапазоне концентраций глюкозы от 1 до 30 мМ. Данная система очень перспективна для быстрого определения глюкозы в среде культивирования бактерий с целью увеличения выхода антибиотика.
2.3 Разработка бисенсорной системы узнавания на основе бактериальных клеток и их фрагментов с помощью криоиммобилизации
Бактериальные клетки можно рассматривать как систему, содержащую различные ферменты в их естественном окружении, для конструирования биосенсоров. Такая биокаталитическая система на основе бактерий осуществляет ферментативные реакции в оптимальных, естественных условиях, и, как ожидается, будет более стабильной по сравнению с ферментами, полученными путем выделения и очистки. Для создания потенциально новых систем биологического узнавания на основе бактериальных клеток и их фрагментов исследовали три типа бактерий со специфически индуцированными ферментативными системами. Для индукции лактатоксидазной системы культивировали штаммы E. coli и M. luteus в среде, где в качестве источника углерода использовали соли лактата. Клетки A. aceti выращивли в анаэробных условиях для индукции этанолоксидазной системы.
На примере метода криоиммобилизации были отработаны методы иммобилизации бактериальных клеток и их фрагментов. Сущность метода состоит в замораживании микробных клеток в растворе поливинилового спирта, в ходе которого происходит формирование макро- и микроструктуры матрицы криогеля, при этом поликристаллы замороженного растворителя выступают в роли порообразователей. Получаемые гранулы (пленки) обладают, наряду с высокой пластичностью, достаточно высокой механической прочностью. Матрица криогеля, будучи высокопористой структурой, не создает диффузионных затруднений для основной массы соединений.
Установлено, что удельная респираторная активность иммобилизованных клеток и мембран бактерий была постоянной во всех образцах и не зависела от величины навески, а количество потребляемого кислорода в реакционной ячейке зависело от количества иммобилизованного биокатализатора.
2.4 Биосенсоры на основе ЦПМ
Цитоплазматические мембраны (ЦПМ) бактерий представляют собой липидный бислой с инкорпорированными белками. Бактериальные ЦПМ играют важную роль в многочисленных биологических процессах, таких как дыхание и перенос энергии. Способность индукции определенных ферментативных систем в ЦПМ в ходе культивирования бактерий делает мембраны весьма привлекательным инструментом при конструировании биосенсора путем выделения таких мембраносвязанных ферментативных комплексов с последующей иммобилизацией их на твердой подложке с сохранением нативности и биологической активности.
Была изучена возможность модификации поверхностного заряда ЦПМ бактерий для дальнейшего изучения его влияния на чувствительность и стабильность биосенсорного узнающего элемента. Для этого мы использовали модификаторы поверхностного заряда: цетилтриметиламмоний бромид (ЦТАБ) (положительно заряженный) и додецилсульфат натрия (SDS) (отрицательно заряженный). Первоначально было показано, что добавление ЦТАБ в диапазоне концентраций 10–50 мкМ увеличивает потребление кислорода ЦПМ бактерий в присутствии НАДН, отрицательно заряженного субстрата дыхания. Добавление же SDS в диапазоне концентрации 10–50 мкМ в этих же условиях, наоборот, уменьшало потребление кислорода мембранами. По-видимому, данное изменение потребления кислорода ЦПМ и связано с электростатическим взаимодействием заряженного субстрата с заряженной поверхностью бактериальных мембран. Для доказательства наличия зарядовой модификации поверхности мембран мы решили оценить изменения поверхностного заряда с помощью положительно заряженного флуоресцентного зонда disC и отрицательно заряженного флуоресцентного зонда ANS. В качестве модификаторов поверхностного заряда мы использовали ЦТАБ и SDS. Добавление к мембранам положительно заряженного модификатора ЦТАБ увеличивало интенсивность флуоресценции отрицательно заряженного зонда ANS. В свою очередь, добавление отрицательно заряженного модификатора SDS уменьшало интенсивность данного флуоресцентного зонда.
Таким образом, была установлена возможность модификации поверхностного заряда бактериальных ЦПМ с помощью положительно заряженного модификатора ЦТАБ и отрицательно заряженного модификатора SDS. Дальнейшие исследования показали, что поверхностный заряд является барьером проницаемости мембранного аппарата для заряженных субстратов и должен учитываться при конструировании биологической системы узнавания биосенсора.
2.5 Оптоволоконный биосенсор для определения лактата на основе ЦПМ
Лактат является важным метаболитом при анализе пищи, поэтому для его определения создано большое количество биосенсорных измерителей. Данные подходы анализа лактата требуют присутствия НАДН или ДЕАЕ-декстран:лактинола, а также присутствия термостабильной пероксидазы из сои. Нестабильность таких комплексов и необходимость присутствия коэнзимов существенно ограничивают их практическое применение.
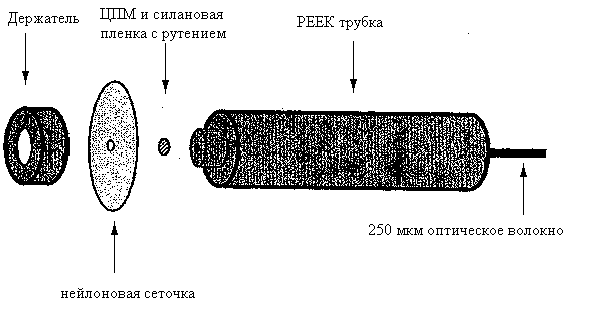
Рисунок 8 - Схема волоконно-оптического биосенсора для определения лактата
В нашей работе описана конструкция волоконно-оптического биосенсора, основанного на новом типе биологического узнающего элемента - бактериальных цитоплазматических мембран (ЦПМ). В качестве вторичного преобразователя использовали волоконно-оптический сенсор для определения кислорода, а в качестве биологического узнающего элемента – ЦПМ. В результате такой комбинации был сконструирован новый тип биосенсора для определения лактата (рис. 8). Его специфичность оценивали по влиянию таких биологически важных соединений как глюкоза, фруктоза и глутаминовая кислота на сигнал прибора.
На рис. 9 видно, что присутствие данных субстратов в концентрации 50 мМ не влияет на определение лактата. Нами было обнаружено, что ковалентное связывание чувствительного к кислороду слоя красителя на поверх-
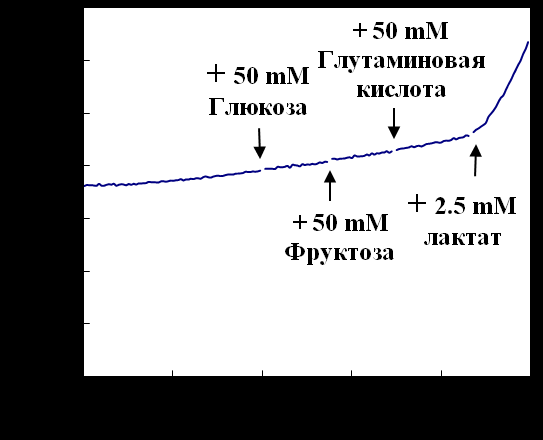
Рисунок 9 - Специфичность лактатного биосенсора к другим субстратам
ность оптического волокна улучшает механическую стабильность сенсора. Другие инструментальные приспособления при конструировании данного сенсора не оказывали значительного влияния на его ответ. Таким образом, была показана способность конструирования биосенсора на основе ЦПМ бактерий. Полученный биосенсор специфически реагирует с лактатом и нечувствителен к наличию в среде измерения таких субстратов как глюкоза, фруктоза и глутаминовая кислота. Уникальная организация ЦПМ совместно с высокой чувствительностью волоконно-оптической системы позволяет применять данные сенсоры как для анализа активных субстратов, так и для косвенного определения бактериальных клеток.
Для определения лактата в молоке был разработан биосенсор на основе бактериальных цитоплазматических мембран (ЦПМ). Нативная организация ферментативных комплексов в липидных бислоях ЦПМ обеспечивала стабильность и высокую чувствительность узнающего элемента биосенсора.
Для подсчета бактериальных клеток в свежем молоке коровы его образцы высевали на плотные питательные среды и подсчитывали колонии после 18 час инкубации. С помощью биосенсора удалось установить корреляцию между концентрацией лактата в молоке и его бактериальной обсемененностью. Концентрация лактата в молоке, равная 5 мМ, соответствует 0,3х106 клеток/мл. После 3 ч инкубации при 37 °С концентрация лактата составляла 10 мМ, а бактерий - 106 клеток/мл; после 6 час инкубации – 20 мМ лактата и 107 клеток/мл. С помощью нашего биосенсора можно определить критическую точку, характеризующую качество молока, которая соответствует концентрации бактерий 106 клеток/мл или 10 мМ лактата.
2.6 Амперометрический биосенсор для определения антиоксидантной активности
На рис. 10 представлена схема определения антиоксидантной активности различных субстратов.
нA 3 4 5 6


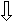
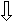


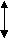
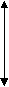
 A
A 
 A’
A’A’’




 1 2
1 2








 1 мин
1 минРисунок 10 - Схема отклика сенсорного электрода на образование супероксида при добавлении антиокисиданта и супероксиддисмутазы. 1 – добавление 100 мM гипоксантина; 2 – добавление ксантиноксидазы, 50 мЕ/мл; 3,4,5 – добавление антиокисиданта; 6 – добавление супероксиддисмутазы, 2 Е/мл. А, А’ и А’’- понижение сигнала при различной концентрации антиокисиданта в среде
Как известно, антиоксиданты предохраняют организмы от вредного воздействия активных форм кислорода. Поэтому использование биосенсорного подхода для регистрации антиокидантных свойств веществ нашло важное применение в медицине и пищевой промышленности. Для определения антиоксидантной активности различных веществ показана высокая эффективность использования супероксидно-специфического амперометрического биосенсора (рис. 10).
Антиоксидантная активность субстратов представлена в табл. 2.
Таблица 2 - Антиоксидантная активность субстратов, где I50 As.ac – концентрация аскорбиновой кислоты, вызывающая 50% ингибирование генерации супероксида, I 50 – концентрация субстрата, вызывающая 50% ингибирование генерации супероксида, E asc,ac – Единицы аскорбиновой кислоты (I 50 As.ac/ I 50)
| Вещество | Сигналэлектрода, нА | I 50 As.ac,мкМ | I 50,нМ | E asc,ac |
| (-) Эпигаллокатехин | 0,8 | 9,0 | 83,7 | 107,5 |
| (+) Катехин | 0,4 | 9,6 | 600,0 | 16,0 |
| (+/-) Катехин | 0,8 | 9,0 | 277,0 | 32,4 |
| Пирогаллол | 0,8 | 9,0 | 262,7 | 34,3 |
| Мирицетин | 0,6 | 7,7 | 454,7 | 17,0 |
| Кверцетин | 0,7 | 4,8 | 2400,0 | 2,0 |
| Танниновые кислоты | 0,8 | 6,6 | 473,0 | 14,0 |
