В. И. Москаленко химия конспект
| Вид материала | Конспект |
- Конспект лекций по курсу «Неорганическая и аналитическая химия», 18.21kb.
- И в свет разрешаю на основании "Единых правил", п 14 Заместитель первого проректора-, 350.14kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Утверждаю, 65.11kb.
- Программа «аналитическая химия» по направлению подготовки 020100 «Химия», 31.74kb.
- Рабочая программа по дисциплине «Спектральные методы анализа» для специальности 020101, 175.88kb.
- «Неорганическая химия», 1345.55kb.
- Рабочая программа по дисциплине «органическая химия» для направления 020100-Химия (цикл, 697.58kb.
Cвойства кремния и его соединений
Кремний можно получить по реакции:
SiO2 + 2Mg Si + 2MgO
Кремний устойчив к кислотам (кроме смеси концентрированных HNO3 и HF), но растворим в щелочах:
Si + 2NaOH + H2O Na2SiO3 + 2H2
Оксид кремния(IV) является кислотным оксидом, но, имея полимерной строение, не растворяется в воде:
SiO2 + H2O
Кремниевая кислота, очень слабая и нерастворимая в воде, может быть получена при действии кислот на ее соли - силикаты:
Na2SiO3 + 2HCl 2NaCl + H2SiO3
Кремниевая кислота при сильном нагревании разлагается на оксид кремния и воду. Силикаты натрия и калия растворимы в воде, силикаты других металлов - нерастворимы.
Свойства соединений олова и свинца
Гидроксиды олова и свинца имеют амфотерные свойства. При этом в степени окисления +2 в гидроксидах преобладают основные свойства, а в степени окисления +4 - кислотные.
SnCl2 + 2NaOH Sn(OH)2 + 2NaCl
Sn(OH)2 + 2HCl SnCl2 + 2H2O
Sn(OH)2 + 2NaOH Na2[Sn(OH)4]
SnCl4 + 4NH4OH H2SnO3 + 4NH4Cl + H2O
H2SnO3 + 2NaOH + H2O Na2[Sn(OH)6]
H2SnO3 + 4HCl SnCl4 + 3H2O
Соединения Sn2+ имеют восстановительные свойства, а соединения Pb4+ - окислительные:
SnCl2 + 2FeCl3 2FeCl2 + SnCl4
PbO2 + 4HCl PbCl2 + Cl2 + 2H2O
12.3. Химия элементов VA группы
Элементы VA группы имеют электронную формулу ns2np3. Азот, фосфор и мышьяк являются неметаллами, висмут и сурьма имеют металлические свойства. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э2О5 имеют кислотные свойства, свойства оксидов Э2О3 : кислотные - для N и P, амфотерные - для As и Sb, основные - для Bi.
Свойства азота и его соединений
Азот находится в природе в свободном состоянии в виде N2 (78% атмосферы). Связанный азот накапливается в растительном и животном мире - в организмах животных, например, от1 до 10% азота. Все важнейшие части клеток построены из белковых веществ. Без белка нет жизни, а без азота нет белка.
В промышленности азот получают сжижением воздуха, при последующем нагревании которого первым испаряется азот (tкип = -195,8оС) и лишь после него - кислород (tкип = -183,0оС).
При обычных температурах азот химически инертен, вследствие большой прочности его двухатомных молекул N2, имеющих тройную связь. Азот используется в промышленности для синтеза аммиака и дальнейшего получения азотных удобрений. Синтез аммиака идет при 320 - 1000 атм., при 500-550оС на железном катализаторе.
N2 + 3H2 2NH3 ; H = -46,36кДж/моль
Соединение азота в степени окисления -3 - аммиак NH3 - является бесцветным газом с резким запахом. Аммиак ядовит, легче воздуха, хорошо растворим в воде (в 1 объеме воды при 20оС растворяется 710 объемов аммиака) с образованием гидроксида аммония, который считается слабым основанием (К = 1,7910-5):
NH3 + H2O NH3H2O
 NH4OH NH4+ + OH-
NH4OH NH4+ + OH- Основные свойства аммиака проявляются и в реакциях с кислотами:
NH3 + НСl NH4Cl
Аммиак имеет восстановительные свойства (азот - в низшей степени окисления), реагируя с кислородом до азота при горении аммиака на воздухе или до NO в присутствии платинового катализатора при 600оС.
4NH3 + 3O2 2N2 + 6H2O
4NH3 + 5O2
 4NO + 6H2O
4NO + 6H2OНаличие у атома азота в молекуле аммиака неподеленной пары электронов обуславливает донорные свойства аммиака, образующего комплексные соединения - аммиакаты:
CuSO4 + 4NH3 [Cu(NH3)4]SO4
Cоли аммония при нагревании разлагаются:
NH4Cl NH3 + HCl
NH4NO2 N2 + 2H2O
NH4NO3 N2O + 2H2O
В последней реакции мы получаем оксид азота (I) - N2O, называемый “веселящим” газом. Это безразличный оксид, разлагающийся при нагревании на азот и кислород. Безразличным оксидом является также и оксид азота(II) - NO, получаемый по следующим реакциям:
N2 + O2 2NO при t>1000oC
3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO + 4H2O
Оксид азота(II) - NO, бесцветный газ, является восстановителем и легко окисляется кислородом, воздуха до оксида азота(IV) - NO2.
2NO + O2 2NO2
Оксида азота(IV) - NO2 - газ бурого цвета, ядовит. При охлаждении димеризуется в бесцветный оксид N2O4. NO2 - сильный окислитель: уголь, сера, фосфор горят в нем, а оксид серы(IV) SO2 окисляется до оксида серы(VI) SO3. Оксида азота(IV) взаимодействует с водой и щелочами, проявляя кислотные свойства. При этом N+4 диспропорционирует на N+5 и N+3:
2NO2 + H2O HNO3 + HNO2
2NO2 + 2NaOH NaNO3 + NaNO2 + H2O
Оксид азота (III) N2O3 существует лишь при низких температурах. При t = 3,5oC кипит и разлагается:
N2O3 NO2 + NO
Этому оксиду соответствует слабая азотистая кислота HNO2 (K=410-4), которая существует лишь в разбавленных растворах и легко разлагается:
2HNO2 NO2 + NO + H2O
Соли азотистой кислоты - нитриты - устойчивы, для них характерны как окислительные, так и восстановительные свойства (азот - в промежуточной степени окисления):
2NaNO2 + 2KI + 2H2SO4 I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
2KMnO4 + 3H2SO4 + 5NaNO2 2MnSO4 + NaNO3 + K2SO4 + 3H2O
Разложение иодида азота(III) происходит с взрывом:
2NI3 N2 + 2I2
Гидратным соединением оксида азота(V) N2O5 является азотная кислота HNO3. Получение азотной кислоты и ее солей основано на синтезе аммиака, его окислении до NO, окислении NО до NO2 и взаимодействии NO2 с водой в присутствии кислорода воздуха:
N2 + 3H2
 2NH3 ;
2NH3 ;4NH3 + 5O2
 4NO + 6H2O
4NO + 6H2O2NO + O2 2NO2
4NO2 + O2 + 2H2O 4HNO3
Азотная кислота - сильная кислота, ее соли хорошо растворимы в воде. Азотная кислота и ее соли - нитраты - являются окислителями (азот - в высшей степени окисления). Концентрированная азотная кислота не реагирует с Au и Pt, пассивирует на холоду Fe, Al, Cr, выделяет NO2 с тяжелыми металлами и N2O - с активными металлами:
Cu + 4HNO3 (конц.) Сu(NO3)2 + 2NO2 + 2H2O
4Ca + 10HNO3 (конц.) 4Сa(NO3)2 + N2O + 5H2O
Разбавленная кислота выделяет NO c тяжелыми металлами и N2 - c активными металлами, очень разбавленная кислота выделяет с активными металлами - NH3 - NH4NO3
3Cu + 8HNO3 (разб.) 3Сu(NO3)2 + 2NO + 4H2O
4Ca + 10HNO3 (оч.разб.) 4Сa(NO3)2 + NH4NO3 + 3H2O
Азотная кислота окисляет при нагревании некоторые неметаллы (S, P, C), при этом концентрированная кислота образует NO2, а разбавленная кислота - NO.
6HNO3 (конц.) + S 6NO2 + H2SO4 + 2H2O
5HNO3 (разб.) + 3P + 2H2O 5NO + 3H3PO4
Нитраты разлагаются при нагревании. Состав продуктов зависит от положения металла соли в ряду напряжений. При разложении нитратов металлов, стоящих в этом ряду левее магния, образуются нитриты и кислород, стоящих от магния до меди - оксиды металлов, оксид азота (IV) и кислород, стоящих после меди - свободные металлы, оксид азота (IV) и кислород:
2KNO3
 2KNO2 + O2
2KNO2 + O22Cu(NO3)2
 2CuO + 4NO2 + O2
2CuO + 4NO2 + O22AgNO3
 2Ag + 2NO2 + O2
2Ag + 2NO2 + O2Соли азотной кислоты (селитры) и соли аммония являются ценными минеральными удобрениями.
Свойства фосфора и его соединений
Фосфор - составная часть растительных и животных белков. У растений фосфор сосредоточен в семенах, у животных - в нервной ткани, мышцах, скелете. Организм человека содержит около 1,5 кг фосфора: 1,4 кг - в костях, 130 г - в мышцах и 13 г в нервной ткани. В природе фосфор находится в связанном виде. Важнейшие минералы: апатит Ca5(PO4)3F и фосфорит Ca3(PO4)2. Фосфор может быть получен нагреванием смеси фосфорита, угля и песка в специальной печи:
Ca3(PO4)2 + 5C + 3SiO2
 2P + 3CaSiO3 + 5CO
2P + 3CaSiO3 + 5COФосфор образует несколько аллотропных модификаций: белый, красный и черный фосфор. Наиболее активен белый фосфор, молекулярная кристаллическая решетка которого построена из тетраэдрических молекул Р4. Фосфор используется при производстве фосфорорганических пестицидов (тиофоса, карбофоса, хлорофоса и др.). Красный фосфор, имеющий атомную решетку, используется в спичечном производстве.
Фосфор в степени окисления -3 образует водородное соединение фосфин PH3, аналогичное аммиаку. Эта степень окисления менее характерна для фосфора, чем для азота. Фосфин - ядовитый газ с чесночным запахом, может быть получен из фосфида цинка действием кислот или воды:
Zn3P2 + 6HCl 2PH3 + 3ZnCl2
Основные свойства фосфина слабее, чем у аммиака:
PH3 + HCl PH4Cl
Соли фосфония в водных растворах неустойчивы:
PH4+ + H2O PH3 + H3O+
Фосфин имеет восстановительные свойства (низшая степень окисления фосфора), горит на воздухе:
2PH3 + 4O2 P2O5 + 3H2O
Фосфид цинка используется в качестве зооцида для борьбы с грызунами.
Оксид фосфора(III) P2O3 (или Р4О6) образуется при окислении фосфора в недостатке кислорода и представляет собой белое кристаллическое вещество, плавящееся при 23,8оС. Этот кислотный оксид взаимодействует с водой, образуя фосфористую кислоту:
Р2О3 + 3Н2О Н3РО3
Фосфористая кислота в водных растворах существует в виде двух равновесных таутомерных формах:

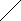
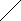
 НO O HO
НO O HO 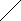

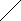
 P
P 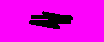 HO P
HO P HO H HO
Под действием щелочей равновесие сдвигается влево, при действии спиртов ROH - вправо. Поэтому фосфористая кислота является слабой двухосновной кислотой, образующей при действии щелочей, например NaOH, кислую соль NaH2PO3 и среднюю соль NaHPO3.
Трех замещенные фосфиты не известны.
Оксид фосфора(V) P2O5 (или P4O10) образуется при горении фосфора на воздухе.
4Р + 5О2 2Р2О5
Твердое кристаллическое вещество Р2О5 гигроскопично и используется как водо-отнимающее средство. При взаимодействии с водой оксид фосфора(V) образует на холоду метафосфорную кислоту НРО3, имеющую полимерное строение, или при нагревании ортофосфорную кислоту Н3РО4.
P2O5 + H2O 2HPO3
P2O5 + 3H2O
 2H3PO4
2H3PO4Осадок метафосфата серебра AgPO3 - белого цвета, осадок ортофосфата серебра Ag3PO4 - желтого цвета. В промышленности фосфорную кислоту получают действием серной кислоты на фосфорит:
Ca3(PO4)2 + 3H2SO4 3CaSO4 + 2H3PO4
Ортофосфорная кислота представляет собой кристаллическое вещество (tпл = 42оС), растворимое в воде. Как трехосновная кислота средней силы диссоциирует ступенчато. Различают средние соли - фосфаты (Na3PO4) и кислые соли - гидрофосфаты (Na2HPO4) и дигидрофосфаты (NaH2PO4). Растворимы в воде фосфаты и гидрофосфаты щелочных металлов и аммония. Все дигидрофосфаты растворимы в воде.
Многие фосфаты используются в качестве удобрений: фосфоритная мука Ca3(PO4)2 и преципитат CaHPO4 (на кислых почвах), суперфосфат Ca(H2PO4)22CaSO4, двойной суперфосфат Ca(H2PO4)2.
12.4. Химия элементов VIA группы
VIA группу образуют четыре неметалла: кислород, сера селен, теллур, называемые халькогенами , и радиоактивный металл полоний. Атомы элементов VIA группы имеют электронную формулу ns2np4. Для них характерны степени окисления -2, 0, +4, +6. У атома кислорода отсутствуют 2d-орбитали, поэтому его валентность равна двум. Наличие d-орбиталей у атомов других элементов позволяет им иметь валентности два, четыре или шесть.
Химия кислорода и его соединений
Кислород - самый распространенный элемент, на его долю приходится 47,2% по массе литосферы и атмосферы вместе взятых. Кислород взаимодействует с большинством химических элементов. Белки, жиры и углеводы являются органическими кислородосодержащими веществами. Как животные, так и растения при дыхании поглощают атмосферный кислород. Теплокровные животные погибают без кислорода в течении нескольких минут. С участием кислорода идет минерализация растительных или животных остатков в почве до NH3, CO2 и H2O. Без аэрации почва не может быть плодородной.
Кислород представляет собой газ без цвета, без вкуса, без запаха. Кислород может быть получен при сжижении и разделении воздуха. В лаборатории кислород получают разложением перманганата калия или разложением хлората калия - бертолетовой соли:
2KMnO4
 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O22KClO3
 2KCl + 3O2
2KCl + 3O2Известны две аллотропические модификации кислорода: кислород О2 и озон О3. Озон может быть получен из кислорода под действием электрического разряда или ультрафиолетового излучения:
3О2
 2О3
2О3Озон - сильный окислитель. его активность обусловлена распадом его молекул с образованием атомарного кислорода, который более активен, чем молекулярный кислород:
О3 О2 + О
Молекулярный кислород (степень окисления равна нулю) является активным окислителем. Кислород в низшей степени окисления -2 ( в оксидах , в воде) окислителем быть не может. В промежуточной степени окисления -1, например, в пероксиде водорода, кислород может иметь как окислительные, так и восстановительные свойства. С сильными окислителями пероксид водорода проявляет восстановительные свойства, окисляясь до кислорода О2.
2KMnO4 + 3H2SO4 + 5H2O2 5O2 + 2MnSO4 + K2SO4 + 8H2O
С сильными восстановителями пероксид водорода проявляет окислительные свойства. Кислород при этом восстанавливается до степени окисления -2.
2KI + H2SO4 + H2O2 I2 + K2SO4 + 2H2O
Пероксид водорода может быть получен действием кислот на пероксиды металлов:
BaO2 + H2SO4 BaSO4 + H2O2
Окислительная активность пероксида водорода, обуславливающая его обеззараживающие свойства, связана с образованием в момент выделения атомарного кислорода:
Н2О2 Н2О + О
Химия серы и ее соединений
В природе сера встречается в самородном состоянии и в виде минералов, таких как пирит FeS2, мирабилит Na2SO410H2O, гипс CaSO42H2O, и др. Сера входит в состав белков растений и животных. При разложении (гниении) мяса, рыбы, яиц выделяется сероводород H2S, имеющий неприятный запах. Соединения, содержащие серу, обуславливают горький вкус лука, чеснока, хрена. Элементарная сера не токсична для человека, но имеет фунгицидные свойства. В промышленности серу получают очисткой, перегонкой самородной серы или при разложении пирита:
FeS2 FeS + S
Чистая сера - хрупкое кристаллическое вещество желтого цвета. Сера имеет несколько аллотропических модификаций: ромбоэдрическую, призматическую, пластическую. Аллотропия серы обусловлена различной структурой кристаллов, построенных из восьмиатомных молекул S8. В расплаве серы существуют молекулы S8, S6, в парах серы - молекулы S6, S4, S2. Сера является типичным неметаллом. Она реагирует с металлами, проявляя окислительные свойства:
Hg + S HgS
Реагируя с более активными неметаллами сера проявляет восстановительные свойства, например, сера горит:
S + O2 SO2
В низшей степени окисления -2 сера образует соединения с водородом - сероводород H2S и с металлами - сульфид натрия Na2S и др.
Сероводород - бесцветный газ с неприятным запахом. В водных растворах (с концентрацией менее 0,1М) ведет себя как слабая двухосновная кислота:
H2S
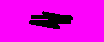 H+ + HS- K1 = 610-8
H+ + HS- K1 = 610-8HS-
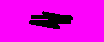 H+ + S2- K2 = 110-15
H+ + S2- K2 = 110-15Сероводород имеет восстановительные свойства. На воздухе горит, окисляясь до оксида серы (IV):
2H2S + 3O2 2SO2 + 2H2O
При недостатке кислорода H2S окисляется до свободной серы:
2H2S + O2 2S + 2H2O
Многие окислители (перманганат калия, дихромат калия, хлор, азотная кислота и др.) окисляют сероводород до свободной серы:
2KMnO4 + 3H2SO4 + 5H2S 2MnSO4 + 5S + K2SO4 + 8H2O
Cульфиды тяжелых металлов малорастворимы в воде и имеют характерные окраски: ZnS - белый, MnS - розовый, CdS - желтый, Sb2S3 - оранжевый, SnS - коричневый, CuS - черный.
В степени окисления +4 сера образует оксид SO2, сернистую кислоту H2SO3, и соответствующие ей соли - сульфиты, например сульфит натрия Na2SO3. Оксид серы (IV) SO2 (сернистый газ) получают в промышленности при горении серы и обжиге пирита:
S + O2 SO2
4FeS2 + 11O2 2Fe2O3 + 8SO2
В лаборатории SO2 получают действием соляной кислоты на сульфит натрия:
Na2SO3 + 2HCl 2NaCl + H2O + SO2
При растворении SO2 в воде образуется слабая двухосновная сернистая кислота H2SO3:
SO2 + H2O H2SO3
H2SO3
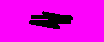 H+ + HSO3- K1 = 210-2
H+ + HSO3- K1 = 210-2HSO3-
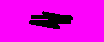 H+ + SO32- K2 = 610-8
H+ + SO32- K2 = 610-8Соединения серы в этой промежуточной степени окисления могут иметь как окислительные, так и восстановительные свойства:
H2SO3 + 2H2S 3S + 3H2O
H2SO3 + Cl2 + H2O H2SO4 + 2HCl
При окислении оксида серы (IV) кислородом в присутствии катализатора (Pt, V2O5 или NO) образуется оксид серы (VI) SO3. Растворение SO3 в воде приводит к образованию серной кислоты H2SO4.
2SO2 + О2 2SO3
SO3 + H2O H2SO4
Серная кислота - тяжелая, бесцветная, маслянистая жидкость. Концентрированная 98% H2SO4 имеет плотность 1,84 г/см3. 100% H2SO4 называется моногидрат. Раствор серного ангидрида SO3 в моногидрате называется олеум H2SO4SO3 = H2S2O7. Серная кислота сильная двухосновная кислота, образующая средние соли - сульфаты (Na2SO4) и кислые соли - гидросульфаты (NaHSO4). Серная кислота энергично реагирует с водой, образуя гидраты. Она поглощает пары воды из воздуха, отнимает воду от углеводов (сахара, клетчатки) обугливая их:
H2SO4 (конц.) + H2O H2SO4H2O + Q
При разбавлении концентрированной серной кислоты нельзя наливать воду в кислоту, можно осторожно наливать кислоту в воду.
Серная кислота является окислителем. Разбавленная серная кислота реагирует с металлами, стоящими в ряду напряжения до водорода, образует соли и вытесняет водород.
Fe + H2SO4 (разб.) FeSO4 + H2
Cu + H2SO4 (разб.)
Концентрированная кислота реагирует с большинством металлов (кроме Pt и Au) с образованием солей и выделением продуктов восстановления S+6: оксида серы (IV) - с тяжелыми металлами, серы - с активными металлами, сероводорода - с щелочными и щелочноземельными металлами. Концентрированная серная кислота на холоду пассивирует железо, алюминий и хром.
Сu + 2H2SO4 (конц.) СuSO4 + SO2 + 2H2O
3Zn + 4H2SO4 (конц.) 3ZnSO4 + S + 4H2O
4Сa + 5H2SO4 (конц.) 4СaSO4 + H2S + 4H2O
Концентрированная серная кислота окисляет и некоторые неметаллы:
2H2SO4 + S 3SO2 + 2H2O
2H2SO4 + C 2SO2 + CO2 + 2H2O
12.5. Химия элементов VIIA группы
Атомы галогенов, образующих VIIA группу, имеют электронную конфигурацию ns2np5. Все галогены являются активными неметаллами, окислителями. Их активность уменьшается в ряду F>Cl>Br>I>At. Характерные степени окисления галогенов: -1, 0, +1, +3, +5, +7. Однако у фтора, наиболее активного неметалла, есть лишь степени окисления -1 и 0. Электронная формула атома водорода 1s1. С галогенами его объединяет способность принимать один электрон и образовывать стабильную электронную оболочку 1s2. Поэтому часто водород располагают вместе с галогенами в VIIA группе.
