Иммунологические аспекты предрака и рака молочной железы
| Вид материала | Документы |
- Иммунодиагностика и иммунотерапия рака молочной железы, 241.98kb.
- Иммунодиагностика и иммунотерапия рака молочной железы, 212.29kb.
- Клинико-морфологические факторы прогноза (на примере рака молочной железы), 79.85kb.
- Локальная, системная и сочетанная лучевая терапия костных метастазов, 150.74kb.
- Некоторые медико-социальные аспекты диагностики и лечения запущенных форм рака молочной, 417.81kb.
- Правила оформления тезисов Тезисы будут воспроизводиться с авторского оригинала без, 37.3kb.
- Программа российской научно-практической конференции с международным участием «современные, 40.31kb.
- Брахитерапия, 18.32kb.
- Роль тиреоидной патологии в развитии дисгормональных заболеваний молочной железы, 224.5kb.
- Рак предстательной железы, 186.21kb.
Классификационные критерии при РМЖ. Определение уровня ОМ стало одним из критериев для установления стадии при РМЖ. Соответственно с установленной стадией изменяется выбор схемы лечения и прогноз. Учёт имуногистохимических данных в TNM-классификации VI пересмотра позволил изменить ряд критериев для установления стадии РМЖ.
Иммуномониторинг (ИМ). При регулярном исследовании ОМ определить прогрессирование болезни можно за 4 – 6 месяцев до регистрации метастазов другими известными диагностическими методами. Показания и ритм исследования ОМ несколько меняются в зависимости от клинического этапа лечения. Наиболее обоснованным и целесообразным является использовнаие ОМ при диспансеризации (III клиническая группа). Согласно рекомендаций экспертов ВОЗ исследование ОМ проводится в первый год наблюдения 1 раз в лесяц, 2-й год – 1 раз в два месяца, 3-й год, и в последующем – 1 раз в три месяца. Бессистемное исследование ОМ, или каких-либо других показателей состояния иммунитета у больной РМЖ срвершенно не имет смысла. При проведении ИМ обязательными являются следующие условия:
- Должен использоваться ОМ, рекомендуемый при РМЖ (табл.2).
- Должен использоваться один и тот же выбранный для проведения иммуномониторинга ОМ, или сочетание ОМ (главный, второстепенный).
- Исследование ОМ должно проводиться в условиях одной лаборатории (обеспечение условий лабораторного стандарта, референсный контроль).
- Должна быть обеспечена связь с клиникой, для применения при необходимости других диагностических методов и/или лечения.
- Показатели ОМ должны фиксироваться в меддокументации больной РМЖ в виде графика иммуномониторинга.
Следует особо отметить, что динамика индивидуальных иммунологичских показателей является более важным критерием, чем факт однократного повышения ОМ. К сожалению, до настоящего времени типичными ошибками являются бессистемное определение ОМ, переход от одного ОМ к другому, попытки принятия клинических решений на основании повышения ОМ при однократном исследовании. Это формирует ятрогению и приводит к клиническим ошибкам. Нет ОМ «хуже» или «лучше». Имеет значение умение правильно пользоваться принципами ИМ.
В настоящее время ИМ позволил существенно изменить принципы диспансеризации в клинической онкологии. От ранее известного подхода «посешение для регистрации уже имеющегося метастаза» диспансеризация перешла на уровень «посещение для определения доклинических предпосылок к возобновлению опухоли». Кроме того, ИМ позволяет перевести ритм диспансеризации больной РМЖ со «среднекалендарного» (посещение через фиксированный промежуток времени) к индивидуальному (время посещения обоснованое личной биологической характеристикой).
С

Больная РМЖ (III клиническая группа
Диспансерный контроль
Известный ранее принцип
Есть метастазы
Нет метастазов
Иммунологические подходы
Специальное лечение
Иммуномониторинг
Стабилизация
Отклонения
Изменение ритма иммуномониторинга
Контроль симультанной патологии (соответственно характеристикам онкомаркера)
Иммунопрофилактика, иммунотерапия (деблокирующая, неспецифическая – специфическая, адоптивная и др.)





Стабилизация иммунологических показателей

Сохранение (нарастание) иммунных девиаций
Дополнительное обследование
Подтверждение продолжения болезни


истемный ИМ также принципиально изменил третичную профилактику (рис. 2).
Рис. 2. Рекомендуемая схема принятия решений при иммуномониторинге.
До настоящего времени неизвестны средства, обладающие «абсолютным» профилактическим эффектом у больных ЗН, что связано с общетеоретическими неясностями этиологии ЗН. Применение ИМ позволяет перейти от уровня возобновления специального лечения при появлении метастазов, именно к уровню профилактики их возникновения через систему комплексной фоновой коррекции канцерогенных условий. Ранее понятие «третичная профилактика» в онкологии имело исключительно теоретическое значение. Вхождение в онкологическую клинику иммунологических методов наполнило это понятие конкретным практическим смыслом.
Прогноз. В настоящее время понятие «прогноз» имеет разные значения. Появились понятия прогноз болезни (истинный прогноз) – прогноз развития опухолевой болезни без лечения, и прогноз лечения – ожидаемый исход при лечении. Иммунодиагностика позволяет биологически контролировать и обосновывать оба вида прогноза у больных РМЖ. Используемые для этого приёмы крайне разнообразные, что зависит от конкретной клинической ситуации. Впервые в истории онкологии методы иммунодиагностики позволили показать в клинике, что в ряде случаев оба вида прогноза могут совпадать. Например, повышение экспрессии онкогенов, определяемое иммуногистохимически (HER-2 new и/или индекс амплификации) свидетельствует о неблагоприятном истинном прогнозе. Эти же показатели свидетельствуют и о неблагоприятном лечебном прогнозе при неадекватном выборе схемы лечения (например, алкилирующие препараты, модуляторы сигнальной трансдукции) и относительном улучшении лечебного прогноза при выборе схемы в соответствии с иммуногистохимическими данными (антрациклинсодержащие схемы, таржетные препараты).
Иммунотерапия.
Класссификация методов иммунотерапии (Гриневич Ю.А. с соавт., 1990)
А. Активная иммунотерапия
I. Специфическая (иммунизация).
1. Неизменёнными аутологичними опухолевыми клетками.
2. Неизменёнными аллогенными клетками опухоли того же гистологического типа.
3. Модифицированными опухолевыми клетками.
4. Растворимыми опухолевыми антигенами.
5. Онкогенными вирусами.
II. Неспецифическая.
1. Вакциной БЦЖ и другими микобактериальными препаратами.
2. Corynebacterium parvum и другими бактериальными препаратами.
3. Полисахаридными адъювантами.
4. Интерфероном и индукторами интерферонообразования.
5. Биологически активными факторами тимуса и индукторами эндогенной тимической сывороточной активности.
6. Левамизолом и другими синтетическими иммуномодуляторами.
7. Другими неспецифическими методами активирования противоопухолевого иммунитета.
Б. Пассивная иммунотерапия.
I. Иммуноглобулинотерапия.
1. Аллогенными или ксеногенными антителами к HLA-антигенам.
2. Аллогенными или ксеногенными противоопухолевыми антиетлами, моноклональными антителами.
3. Конъюгированными с химиопрепаратом или меченными радионуклидом специфическими моноклональными антиетлами против ассоциированных с опухолью антигенов.
II. Адоптивная иммунотерапия.
1. Специфическая:
- трансфузия аутологичных или аллогенных лимфоцитов, специфически сенсибилизированных к ассоциированным с опухолью антигенам;
- трансфузия дендритных клеток, выделенных из крови больного и активированных in vitro опухолевым антигеном в присутствии ростовых факторов;
- введение продуктов экстрагирования специфически сенсибилизированных аллогенных или ксеногенных лимфоцитов (фактора переноса, иммунной РНК).
2. Неспецифическая:
- трансфузия аллогенных несенсибилизированных лейкоцитов и лимфоцитов, трансплантация клеток костного мозга;
- реинфузия аутологичных лимфоцитов, активированных in vitro (ИЛ-2, интерфероном и др.);
- реинфузия аутологичных клеток костного мозга, взятого до лучевой терапии или химиотерапии;
- реинфузия аутологичных клеток костного мозга, взятого до лучевой терапии или химиотерапии, активированных in vitro препаратами тимуса.
Следует подчеркнуть, что несмотря на бурное развитие онкологической иммунологии, предложенная классификация не претерпела принципиальных изменений до настоящего времени. Некоторые рубрикации уточнились и получили дальнейшее развитие, что не изменило принципиальную структуру классификации.
Представить, даже кратко, все разделы лечебной иммунологической классификации в объёме одной лекции практически невозможно. Поэтому остановимся на некоторых подходах, имеющих установленное значение в патогенезе опухолевой болезни, разработанных методах иммунотерапии, доступных клиническому использованию у больных РМЖ.
Деблокирующая терапия. Одной из закономерностей опухолевого роста является повышение в крови онкологических больных циркулирующих иммунных комплексов (ЦИК). Это понятие включает белковые фрагменты, состоящие из экспрессированных онкобелков, а также белков, накапливающихся в организме под влиянием опухолевого эндотоксикоза и лечебного экзотоксикоза. Ведущее значение в патогенезе имеют среднемолекулярные белковые фракции, представленнные белковыми фрагментами с большим количеством свободных радикалов. Свободнорадикальная конфигурация этих белков обеспечивает их высокий патогенетический потенциал. Кроме того, среднемолекулярные белки практически не элиминируются из организма естественными системами самоочищения. Нарастание фракций среднемолекулярных белков сопровождается усилением процессов переокисления. При прогрессировании болезни интенсивно нарастаниет интоксикация. В итоге замыкается порочный круг, когда экзо- и эндотоксикоз способствует повышению уровня ЦИК, которые, в свою очередь, способствуют интоксикации и создают условия для прогрессирования опухоли.
Кроме того, убедительно доказано, что повышение уровня ЦИК соответствует прогрессированию опухоли при РМЖ, степени её злокачественности, и распространённости процесса в организме (опухолевой массой). Повышение уровня ЦИК свидетельтвует об опухолевом рецидиве, даже до клинических проявлений. После хирургического удаления опухоли отмечается снижение ЦИК (уменьшение опухолевой массы). То есть, исследование уровня ЦИК может использоваться как маркер онкологического радикализма и принятия решений о необходимости адъювантной цитостаттической терапии и контроля её эффективности.
Иммунологические методы определения ЦИК хорошо разработаны и известны. При нарастании ЦИК необходимо проведение детоксикации. Трансфузионные растворы в такой ситуации малоэффективы, в лучшем случае дают нестойкий ситуационный результат. Для стабильного снижения ЦИК применяются методы энтеросорбции, гемосорбции, плазмафереза и лимфофереза. Все эти методики также известны, технологии хорошо разработаны и доступны в клинике. Сорбционные методы направленные на снижение уровня ЦИК, обозначаются общим понятием деблокирующая терапия (ДТ). Вместе с тем, эффект от её проведения кратковременный, если она не сочетается с противоопухолевой терапией.
Энтеросорбция. В норме у здорового, взрослого, ничем не болеющего человека за сутки через кишечную трубку фильтруется 8 – 12 литров жидкости (без учёта жидкости пищи), из которых 3 – 4 литра составляют пищевариетльные соки и слюна, а 6 – 8 литров – плазменно-сывороточный состав крови. Создание условий по связыванию токсинов в кишечной трубке позволяет эффективно решать проблемы энтеродетоксикации у онкологических больных.
Гемосорбция. Заключается в фильтрации крови через специальные сорбционные колонки. Неоднократно показано оседание на сорбенте не только неорганических токсинов (продуктов метаболизма цитостатиков), но и среднемолекулярных фракций белков и опухолевых клеток.
П
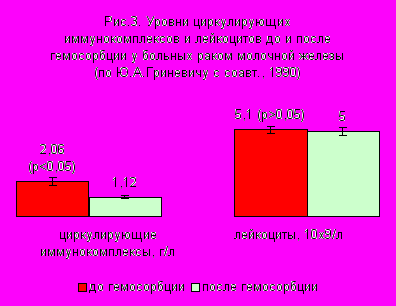 рименение гемосорбции у больных РМЖ приводит к статистически достоверному снижению уровня ЦИК, при этом количество лейкоцитов не снижается (рис. 3). Начиная с 1986 г., метод гемосорбции используется в некоторых онкологических клиниках Украины (Б.Т. Билынский, Львов, А.П. Кабан, Киев).
рименение гемосорбции у больных РМЖ приводит к статистически достоверному снижению уровня ЦИК, при этом количество лейкоцитов не снижается (рис. 3). Начиная с 1986 г., метод гемосорбции используется в некоторых онкологических клиниках Украины (Б.Т. Билынский, Львов, А.П. Кабан, Киев).Плазмаферез. Методика сорбции фракций плазмы. Более эффективна в сравнении с гемосорбцией.
Лимфоферез. Методика сорбции лимфы. Технология заключается в дренировании грудного лимфатического протока и пропускании лимфы через сорбент.
Применение мтодов ДТ позволяет решить комплекс проблем клинической онкологии:
- Восстановить костномозговое кроветворение при лейкопении, анемии, тромбоцитопении развившихся вследствие цитотоксической лекарственной и/или лучевой терапии. Принципиальным отличием ДТ от других методов в таких ситуациях является не заместительный или стимулирующий (в отношении стволовых клеток) эффект, а естественнофизиологический механизм действия. Это крайне важно, так как при курсовом, многоэтапном специальном лечении позволяет получить более стабильный и продолжительный результат, избежать «прессинговых» методов ситуационного решения цитотоксических проблем.
- Подготавливать больных к специальной терапии. Особенна важна ДТ при подготовке к лечению больных с распротранённым опухолевым процессом, при проведении высокодозовой химиотерапии и интенсивной лучевой терапии. Часто эти условия сочетаются (высокая распространённость процесса требует интенсификации лечения). особенно актуально применение ДТ при использовании неоадьювантной терапии, получающей всё большее распространение при лечении больных РМЖ.
- Повышать противоопухолевый эффект. При РМЖ актуальными являются и гемо- и лимфометастазирование. При проведении гемо-, лимфо-, плазмосорбции происходит седиментация опухолевых клеток на сорбенте. Поэтому необходимы разные методики ДТ, в том числе и с применением иммуносорбентов. Выбор методики зависит от клинической ситуации и технических возможностей.
- Повысить эффективность симультанной, комплиментарной и суппортивной терапии. Особенно важной ДТ является для предупреждения осложнений цитостатической терапии.
- Проводить иммунореабилитацию. Этот вариант использовнаия ДТ показан при диспансеризации (III клиническая группа) и в межкурсовых периодах комбинированного лечения.
- Совместно с иммуномониторингом (исследование онкомаркеров) решается серия проблем на всех этапах – от установлениея первичного диагноза и начала лечения до паллиативной терапии. Других подходов, аналогичных по эффективности и спектру показаний ДТ в онкологии нет. В среднем, при использовании ДТ эффективность противоопухолевой терапии может возрастать до 40%.
Применение ДТ безусловно показано больным РМЖ на всех этапах лечения – до начала курса терапии, при проведении терапии (с учётом временных закономерностей фармакодинамики цитостатиков), в межкурсовой период, на этапе диспансеризации (преимущественно энтеросорбция). ДТ выполняется при обязательном мониторировании уровня ЦИК и некоторых других показателей состояния иммунной системы больной РМЖ. Выбор методики ДТ зависит от степени эндотоксикоза, этапа и метода специального лечения, технических возможностей.
К сожалению, несмотря на хорошую изученность, многократно доказанную противоопухолевую эффективность ДТ, практическую доступность иммуномониторинга, как минимум определения ЦИК, методы ДТ в клинике у болных РМЖ используются недостаточно.
Биологичеки активные факторы тимуса (БАФТ). В 1969 г. И. Ройт введены в иммунологическую практику обозначения Т- и В-лимфоциты. Символ Т происходит от «thymus-dependent system» – тимусозависимая система лимфоидных клеток. В вилочковой железе происходит их созревание, генерация (в корковом слое) и последующее поступление в кровь (из мозгового слоя). Символ В происходит от «bursa-dependent system» - бурсазависимая система лимфоидных клеток. Обозначение В связано с первичным выявлением этого типа лимфоцитов в сумке Фабрициуса у птиц. У млекопетающих, в т.ч. у человека продукция В-лимфоцитов происходит во внетимических структурах иммунной системы. Предполагается, что центральным органом для этих лимфоцитов является костный мозг.
По характеру реакций Т и В ситемы обозначаются как «клеточный» и «гуморальный» иммунитет, соответственно. Взаимоотношениям и функционированию этих систем посвящена отдельная специальная лиетратура.
Многочисленные данные свидетельствуют о том, что при раке угнетаются клеточно-опосредованные и не изменяются, или даже усиливаются гуморальные реакции иммунитета. То есть, возникает дисбаланс Т-, В-лимфоцитов и макрофагов, что в клинической практике и характеризуется общим понятием «иммунодепрессия».
У
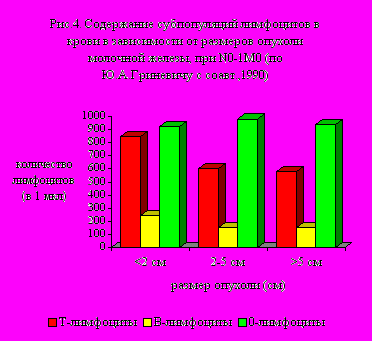 больных РМЖ, по мере увеличения распространения процесса, прогресивно уменьшается количество Т-лимфоцитов, при этом нарастает количество 0 (нулевых)-лимфоцитов (рис. 4).
больных РМЖ, по мере увеличения распространения процесса, прогресивно уменьшается количество Т-лимфоцитов, при этом нарастает количество 0 (нулевых)-лимфоцитов (рис. 4).В настоящее время активно обсуждается значение в патогенезе ПР и РМЖ пролактина. Всё более понятным становится значение внегипофизарного синтеза пролактина, что имеет первостепенное значение в поддержании гомеостаза покоящейся молочной железы. Недавно получены данные о том, что генетическое кодирование пролактина происходит в Т-лимфоцитах. В связи с этим вероятным направлением в терапии ПР и РМЖ может стать коррекция диспролактинемических расстройств, и связанной с этим гиперэстрогенизации опосредованно, наиболее вероятно путём коррекции Т-В-лимфоцитарного дисбаланса. Это принципиально новое направление исследований влияния на эндокринную систему, опосредованно через иммунную систему на уровне генетической кодировки отдельных иммунокомпетентных популяций лимфоцитов. В связи с этим, особое значение имеет коррекция Т-лимфоцитдефицитных состояний при ПР и РМЖ.
К ранним попыткам иммунотерапии онкологических больных при помощи БАФТ относится трансплантация эмбрионального или неонатального тимуса (Г.Я. Свет-Молавский, 1966). Клинический эффект такой трансплантации – замедление опухолевого роста и увеличение выживаемости больных ЗН. К недостаткам такого подхода можно отнести:
- высокий риск развития реакции «трансплантат против хозяина»;
- невозможность дозировки биологической активности;
- повышение риска инфицирования больного, с уже имеющейся иммунной недостаточностью;
- поступление в организм многих биохимических соединений (в т.ч. протеолитических ферментов и нуклеиновых кислот), которые являются токсичными для реципиента (онкологического больного);
- частый тканевой некроз трансплантата (вследствие бедной васкуляризации ткани тимуса).
В
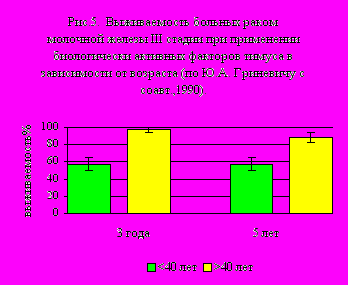 настоящее время направление трансплантации ткани тимуса имеет преимущественн исторический и исследовательский интерес. В клинической практике стандартными подходами является использование экстрагированных препаратов БАФТ, таких как тималин, тактивин, тимозин, тимостимулин, вилозен и ряда других, свободных от недостатков тканевой трансплантации. При использовании этих препаратов, а также синтетичеких аналогов, таких как тимоген, кроме увеличения общей 5-летней выживаемости больных РМЖ при III стадии РМЖ с 51,1%±7,5% (без БАФТ) до 78,6%±8,6% (с БАФТ), особенно важной является динамика улучшения результатов по мере увеличения возраста больных РМЖ (рис. 5).
настоящее время направление трансплантации ткани тимуса имеет преимущественн исторический и исследовательский интерес. В клинической практике стандартными подходами является использование экстрагированных препаратов БАФТ, таких как тималин, тактивин, тимозин, тимостимулин, вилозен и ряда других, свободных от недостатков тканевой трансплантации. При использовании этих препаратов, а также синтетичеких аналогов, таких как тимоген, кроме увеличения общей 5-летней выживаемости больных РМЖ при III стадии РМЖ с 51,1%±7,5% (без БАФТ) до 78,6%±8,6% (с БАФТ), особенно важной является динамика улучшения результатов по мере увеличения возраста больных РМЖ (рис. 5).С учётом общепопуляционных эпидемиологических закономерностей нарастания заболеваемости РМЖ по мере увеличения возраста, а также нарастания частоты сопутствующей патологии у больных старших возрастных групп, эта закономерность иммунотерапии в ряде случаев становится принципиально важной не только с точки зрения улучшения результатов специального лечения, но также вообще возможности его проведения. Дело в том, что 60% женщин, страдающих ПР и РМЖ в возрасте старше 40 лет, имеют сопутствующую полипатологию, что в ряде случаев является ограничением для проведения специального лечения вообще, или в объёме адекватном онкологической ситуации.
При прекращении введений БАФТ, показатели состояния иммунной системы обычно возвращаются к исходным. Поэтому показано проводить иммунотерапию с применением БАФТ пожизненно, в пульсирующем режиме (2-3 мес. – иммунотерапия, 2-3 мес. – перерыв), под контролем показателей иммунограммы соответствующим механизму действия конкретно применяемого препарата. Такое лечение оказывается безальтернативным для болных РМЖ, находящихся в III клинической группе (период диспансерного наблюдения). Второй вариант иммунотерапии БАФТ – в межкурсовой период при адьювантной ПХТ (иммунореабилитация).
