Иммунологические аспекты предрака и рака молочной железы
| Вид материала | Документы |
СодержаниеАдоптивная иммунотерапия (АИТ). Перспективы развития онкологической иммунологии. Иммуногенетические исследования Специфическая противоопухолевая терапия. Иммитаторы опухолевых антигенов. |
- Иммунодиагностика и иммунотерапия рака молочной железы, 241.98kb.
- Иммунодиагностика и иммунотерапия рака молочной железы, 212.29kb.
- Клинико-морфологические факторы прогноза (на примере рака молочной железы), 79.85kb.
- Локальная, системная и сочетанная лучевая терапия костных метастазов, 150.74kb.
- Некоторые медико-социальные аспекты диагностики и лечения запущенных форм рака молочной, 417.81kb.
- Правила оформления тезисов Тезисы будут воспроизводиться с авторского оригинала без, 37.3kb.
- Программа российской научно-практической конференции с международным участием «современные, 40.31kb.
- Брахитерапия, 18.32kb.
- Роль тиреоидной патологии в развитии дисгормональных заболеваний молочной железы, 224.5kb.
- Рак предстательной железы, 186.21kb.
Иммунологические аспекты предрака и рака молочной железы.
Ю.А. Гриневич, И.О. Пономарёв
В 1796 г., Э. Дженнер предложил способ предохранения от оспы, основанный на использовании опыта традиционной (народной) медицины, о приобретении устойчивости части людей к заболеванию оспой, после контакта с больными. В 1881 г. Л. Пастер провёл серию опытов по заражению кур возбудителем куриной холеры, в результате чего птицы приобретали устойчивость к заболеванию этой патологией. Он же сформулировал общие принципы создания вакцин из микробов с ослабленной вирулентностью.
Классический научный подход этих авторов «наблюдение – эксперимент - практика», стал основой для появления принципиально нового научно-практического направления – иммунологии.
Иммунология – наука об иммунитете, т.е. индивидуальной биологической неприкосновенности организма. Иммунитет является основой поддержания гомеостаза – постоянства клеточной массы, структуры и функций организма.
В прошлом приоритетом в развитии иммунологии были исследования и практическое использовнаие их результатов в отношении инфекционных заболеваний, что обосновывалось потребностями практической медицины, в связи с опережающим другие классы болезней уровнями заболеваемости и смертности населения от инфекционной патологии.
Параллельно шло накопление знаний. К середине 60-х годов ХХ столетия окончательно сформировалось понятие «неинфекционная иммунология». Новая парадигма иммунологии обоснована тем, что в начале ХХ века удельный вес «острой» патологии, в т.ч. инфекционной, составлял 90%, а хронической – 10%. К концу ХХ столетия ситуация изменилась на прямо противоположную – 90% всей патологии человека составляет хроническая неинфекционная патология (ХНП).
В структуре ХНП приоритетными являются проблемы, связанные з заболевание населения злокачественными новообразованиями (ЗН). При удельном весе ЗН среди всех болезней человека 17 – 19%, смертность от них занимает 2-е место после сердечно-сосудистой патологии, а по прогнозам к середине ХХ века, может выйти на 1-е место.Это усреднённые данные, но уже сейчас среди женщин трудоспособного возраста смертность от РМЖ опережает смертность от всех других причин, в т.ч. и сердечно-сосудистых заболеваний.
Смертность от ЗН и состояние рождаемости являются основными факторами, определяющими численность населения. Поэтому вопросы, связанные с поражением населения ЗН выходят далеко за рамки узкобиологических и узкомедицинских проблем.
История совершила виток «инфекционной иммунологии» к «неинфекционной иммунологии». Достижения иммунологии позволили решить проблему массовых инфекций. В конце ХХ – начале Ххi века приоритет иммунологии обусловлен проблемой ЗН.
Поэтому в специальной медико-биологической литературе содержится колоссальное количество публикаций на тему «иммунология и рак», число которых в настоящее время уже не поддаётся количественному учёту. По этой же причине иммунология является научно-практической основой современной теоретической, экспериментальной и практической онкологии и определяет развитие всех без исключения медико-биологических направлений при ЗН – от описания процессов геномики и протеомики, до рутинного использования исследования опухолевых маркеров и иммунологических методов терапии (биотерапии) в онкологической клинике.
Междисциплинарная обширность контактов имммунологии с различными «узкими» напрвлениями в ряде случаев затрудняет понимание возможностей и значения иммунологии для онкологии.
Во второй половине ХХ столетия достижения иммунологии послужили основой развития трансплантологии. Принципы, сформулированные в понятиях «иммунодепрессия, «иммунологическая толерантность» позволили преодолеть в клинике конфликт между достаточной хирургической и терапевтической техникой при пересадках тканей и органов и реакциями их отторжения организмом.
Предтечей иммунологического вала в онкологии стали успехи трансплантологии, которые базировались на использовании в практике иммунодепрессивного подхода. При накоплении клинического материала выяснилось, что при подавлении реакций отторжения пересаженных тканей и органов у реципиентов частота злокачественных новообразований возрастает в 35 – 350 раз. У детей с генетически обусловленными иммунодефицитными состояниями частота ЗН возрастает до 1000 раз. Общей закономерностью иммуностатуса онкологических больных также является иммунодепрессия. Поэтому к середине 70-х годов ХХ века сформировалось убеждение о необходимости иммуностимуляции при лечении онкологических больных. Но уже в начале 80-х годов ХХ столетия стало ясно, что применение иммуностимулирующих препаратов в онкологической клинике может приводить и к стимуляции опухолевого роста. Кроме того, описаны случаи, когда эффекты стимуляции приводили к ускорению злокачественной трансформации предопухолевой патологии. Поэтому иммунологические исследования при ЗН начительно разветвились, появилась серия новых подходов, определяемых терминами «иммунокоррекция», «иммуномодуляция», «иммунореабилитация» и другими.
Базовым иммунологическим принципом являются отношения в системе «антиген-антитело». В экспериментальной и клинической онкологии опухоль рассматривается как эндогенный антигенпродуцирующий биологический объект. Исходя из этого на уровне организма должно происходить распознавание опухоли как антигенно чужеродного субстрата. Соответсвенно должна происходить активизация реакций выработки противоопухолевых антител. В реальных условиях этот механизм срабатывает всегда, но процесс «опухолеродный антиген → противоопухолевое антитело → нейтрализация антигена → элиминация из организма» остаётся незавершённым. Сбои в распознавании ассоциированных с опухолью антигенов и приводят к неконтролируемому опухолевому росту. Такую незавершённость реакций противоопухолевой защиты можно объяснить следующим образом.
Каждый организм является генетически детерминированным объектом. Совокупность наследственных признаков передаётся по нисходящей вертикали (из поколения в поколение). Это обеспечивает видовую устойчивость. На уровне отдельного организма стабильност поддерживается иммунной системой. Частично опухолевое носительство запрограммировано генетически. При РМЖ это установленные генетические варианты BRCA-1 (впервые выявлен в 1990г.) и BRCA-2 (впервые выявлен в 1994г.). В настоящее время продолжает изучаться вариант BRCA-3. В различных популяциях женского населения вертикальная передача BRCA-1 регистрируется у 5% - 30%. У части из них в процессе онтогенеза происходит активизация онкогенеза. Поэтому от 5% до 10% вновь возникших случаев РМЖ рассматриваются как «наследственный РМЖ».
В пересчёте на популяцию частота «наследственного РМЖ» составляет 0,00015 - 0,0002. То есть, далеко не все носители генетических опухолевых мутаций фактически заболевают РМЖ. Для того, чтобы «сработала» генетическая вертикаль в индивидуальном варианте, необходим комплекс условий для активизации экспрессии онкогенов. С точки зрения клинической практики процесс онкогнеза можно объяснить снижением иммунологического резерва. В литературе, посвященной ПР и РМЖ содержится большое число сведений о фактрах риска (ФР). Любой экзо- или эндогенный ФР вызывает неспецифическую или специфическую реакцию иммунной системы. Анамнестически накопленные ФР и/или их патогеннный синергизм предъявляет повышенные требования к резервности иммунной системы. Реакции антиген-антитело «не успевают» за развитием патогенетического сценария. Создаются условия для формирования иммунодефицитных состояний. Фазы инициации и промоции канцерогенеза частично выпадают из-под иммунного контроля, и переходят в фазу опухолевого роста, вначале доклинического, затем проявляющегося клинически. Для РМЖ период доклинической недостаточности противоопухолевого иммунитета занимает в среднем 8 – 12 лет, в самых неблагоприятных случаях – около 2-х лет.
То, что потенциально онкогенные участки генетической цепи (наследственные и/или филогенетически мутировавшие) находятся под постоянным иммунологическим надзором, подтверждает факт превышения пограничных значений ряда онкомаркеров не только у больных ЗН, но и при ряде доброкачественных и воспалительных заболеваний, предраковой патологии и у клинически здоровых лиц. То есть, снижение иммунологической резервности под прессингом потенциально канцерогены ФР, приводит к изменению иммунокомпетентности, развитию иммунотолерантности к опухоли, частичной утрате способности формировать специфические иммунологические реакции. Вместе с тем, эти реакции никогда полностью не утрачиваются. Даже в фазе диссеминации опухолевые клетки, попавшие в кровеносное русло, уничтожаются системой противоопухолевой защиты.
Онкомаркеры.
Определение понятия об онкомаркерах связано с выделением в первой трети прошлого века молекулы хорионического гонадотропина (ХГЧ) человека и последующим установлением связи с хориокарциномой (Асхейм и Зондек, 1928). В последующем ХГЧ выявлен и при ряде других ЗН и неопухолевой патологии.
Ещё 15 – 20 лет назад сведения о маркерах опухолевого роста - онкомаркерах (ОМ) имели преимущественно исследовательско-экспериментальный характер. В последнее 10-летие проявлен повышенный интерес к оперделению возможности клинического использования ОМ. Наибольший сектор клинического использования ОМ связан с РМЖ. Используемые в клинической онкологии ОМ подразделяют на следующие классы:
- Гормоны.
- Онкофетальные антигены.
- Рецепторы.
- Ферменты.
- Другие биологически активные соединениясоединения.
Кроме того, ОМ подразделяют на главные, второстепенные и дополнительные.
Следует отметить, что выделенные классы относительно условны, т.к. во всех классах основной является иммунологический принцип: реакция «антиген – антитело», реализуемая in vitro с помощью моноклональных антител.
Исследования возможностей использования ОМ при РМЖ проводятся в следующих направлениях.
1. Выделение опухолеспецифических антгенов и антигенных комплексов, с целью получения специфических моноклональных антител.
2. Дифференцировочные антигены – опухолеассоциированные антигены, зависящие от степени дифференцировки (злокачественности) опухоли МЖ, для выбора индивидуальной тактики лечения и прогноза, связанного с лечением.
3. Белки жидкости кист МЖ – продукты дифференцировки эпителиальных клеток МЖ. Определение этих белков позволяет проводить дифференциальную диагностику между цистоаденопапилломой и цистоаденокарциномой. Белки жидкости кист можно использовать для ранней диагностики рецидивов и метастазов РМЖ, поскольку их содержание зависит от стадии болезни и молекулярной массы белков жидкости кист.
К настоящему времени при ПР и РМЖ установлены иммунологические реакции для ряда ОМ (табл. 1).
| Таблица1. Онкомаркеры, дающие реакцию при предраке и раке молочной железы | ||||
| Онкомаркер | Иммунологический класс | Физиологическая функция | Значения нормы | Пограничные значения |
| Раково-эмбриональный антиген (РЭА)* | Онкофетальный белок | Неизвестна | 0 – 5 нг/мл | 5 – 8 нг/мл |
| Альфафетопротеин (АФП) | Онкофетальный белок | Транспортные функции на ранних сроках развития плода | 0 – 5 МЕ/мл | 5 – 10 МЕ/мл |
| Специфический антиген простаты (ПСА) | Фермент | У мужчин – поддержание вязкости семенной жидкости | 0 – 4 нг/мл | 4 – 10 нг/мл |
| Свободный специфический антиген простаты (сПСА) | Фермент | У мужчин – поддержание вязкости семенной жидкости | >20% | 15 – 20% (< 15 – злокачественные опухоли) |
| Хорионический гонадотропин человека (ХГЧ) | Онкофетальный белок | Иммунотолерантность плода к иммунной системе матери | 0 – 5 МЕ/мл | 5 – 10 МЕ/мл |
| СА 15-3** | Онкофетальный белок | неизвестна | 0 – 22 МЕ/мл | 22 – 30 МЕ/мл |
| СА 125 | Онкофетальный белок | Дискутируется | 0 – 30 МЕ/мл | 30 – 40 МЕ/мл |
| СА 19-9 | Онкофетальный белок | Неизвестна | 0 – 30 МЕ/мл | 30 – 40 МЕ/мл |
| СА 72-4 | Онкофетальный белок | Неизвестна | 0 – 3 нг/мл | 3 – 6 нг/мл |
| СА 50 | Онкофетальный белок | Неизвестна | 0 – 10 МЕ/мл | 10 – 14 МЕ/мл |
| СКА (скавмозный клеточный антиген) | Онкофетальный белок | Дискутируется | 0 – 1,5 нг/мл | 1,5 – 2 нг/мл |
| ТК (тимидмнкмназа) | Фермент | Катализ превращения тимидина в тимидинмонофосфат | 0 – 5 МЕ/мл | 5 – 10 МЕ/мл |
| ТПА** (тканевой полипептидный антиген) | Другие биологически активные соединения | Неизвестна | 0 – 120 МЕ/мл | 120 – 140 МЕ/мл |
| ТПС** (тканевой полипептидный специфический антиген) | Другие биологически активные соединения | Неизвестна | 0 – 85 МЕ/мл | 85 – 95 МЕ/мл |
| ЦИФРА-21 | Другие биологически активные соединения | Неизвестна | 0 – 2,5 нг/мл | 2,5 – 3,5 нг/мл |
| *содержится в жидкости кист молочной железы; **повышение уровня при всех видах дисгормональных дисплазий молочной железы (в т.ч. в жидкости кист МЖ) | ||||
Основной проблемой ОМ является их низкая специфичность. Любой из известных ОМ перекрывает спектр онкологической и неонкологической патологии. Одним из первых ОМ, получивших распространение в практике при РМЖ был МСА. В результате исследований возможностей ОМ при различных локализациях ЗН, выделены ОМ, исследование которых рекомендуется при РМЖ (табл. 2). Овладение методикой исследования ОМ, умение устанавливать показания, правильно интерпретировать получаемые результаты, и принимать на этом основании клинические решния, требует специального обучения онкологов.
| Таблица 2. Рекомендуемые для исследования онкомаркеры при раке молочной железы | ||
| Онкомаркер | Повышение уровня при других злокачественных новообразованиях | Повышение уровня при неопухолевой патологии |
| СА 15-3* | бронхогенная карцинома; рак желудка; рак матки; рак печени; рак поджелудочной железы; рак эндометрия; рак яичников. | беременность (физиологически); бронхопневмония; вич инфекция; гепатит (острый и хронический); доброкачественные заболевания желудочно-кишечного тракта; доброкачественные заболевания молочных желез; пневмония; ревматизм; туберкулёз; хроническая почечная недостаточность; хронический бронхит; цирроз печени. |
| ТПА* | опухоли челюстно-лицевой области; опухоли яичек; рак прямой кишки; рак сигмовидной кишки; рак печени; рак поджелужочной желзы; рак простаты; рак щитовидной желзы; рак лёгких; рак почек; рак яичников. | аутоиммунные заболевания; гепатит; доброкачественные заболевания молочной желзы; доброкачественные заболевания пищеварительного тракта; инфекции дыхательных путей; послеоперационный период; ревматизм; сахарный диабет; цирроз печени. |
| ТК* | злокачественные заболевания крови карциноматоз серозных оболочек рак лёгких рак мочевого пузыря рак простаты рак прямой кишки рак сигмовидной кишки рак яичка | бронхит; вирусная инфекция; воспалительные заболевания пищеварительного тракта; коллагенозы; мегалобластная анемия; пернициозная анемия; пневмония; псориаз; ревматизм; саркоидоз; туберкулёзный плеврит |
| (РЭА)** | рак желудка; рак лёгких; рак матки; рак простаты; рак прямой кишки; рак толстой кишки; рак яичников. | аутоиммунные болезни; болезнь Крона; бронхопневмония; курение; муковисцидоз; туберкулёз; хроническая почечная недостаточность; хронические заболевания печени; хронический бронхит; хронический панкреатит; хронический ревматоидный артрит (в суставной жидкости); язвенный колит. |
| *главный онкомаркер; **второстепенный онкомаркер | ||
Обсуждаются следующие направления использования ОМ: скрининг, диагностика, изменение классификационных критериев при РМЖ, прогноз лечения, иммуномониторинг.
Скрининг. Скрининг – обследование населения для выявления лиц с доклинической фазе заболевания. Теоретически использование ОМ в качестве скринингового теста выглядит весьма привлекательным. Однако, в настоящее время нет практически ни одной иммунологической реакции (в т.ч. и среди практически используемых для ОМ), которая обладала бы качествами Ск теста – нозоспецифичностью, локализационной специфичностью, необходимой для Ск точностью.
Н
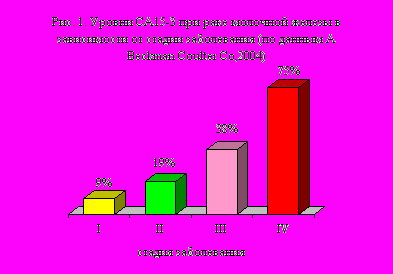 апример, при использовании СА15-3 отмечается корреляция со степенью распространённости процесса (рис 1). Однако, точность крайне низкая – на 1 правильное заключние приходится 66 ложных. Эти характеристики принципиально противоречат основной идее скрининга – выявлению патологии в доклинической стадии или периоде.
апример, при использовании СА15-3 отмечается корреляция со степенью распространённости процесса (рис 1). Однако, точность крайне низкая – на 1 правильное заключние приходится 66 ложных. Эти характеристики принципиально противоречат основной идее скрининга – выявлению патологии в доклинической стадии или периоде.Использование ОМ для скрининга продолжает интенсивно изучаться. Методики для практического иммунологического скрининга в настоящее время всё ещё отсутствуют.
Диагностика.
Рецепторы.
В 1898 г. П. Эрлих предложил гипотезу, известную под названеим «теория боковых цепей». Согласно этой теории, на поверхности клетки существуют особые структуры – рецепторы, которые не создаются вновь под возникающую ситуацию появления антигена, а имеются постоянно. Согласно этой гипотезе, под влиянием антигена рецепторы клеток продуцируют вещества, названные П. Эрлихом антителами. Антиген соединяется с рецепторными структурами и блокирует выработку антител. Избыток антител, продуцируемых клеткой свободно циркулирует в крови.
Приблизительно в одно время с П. Эрлихом, английский хирург J. Beatson, в 1896 г. продемонстрировал на заседании Королевского медицинского общества Англии больную РМЖ, у которой удалось достичь ремиссии при распространённом РМЖ после овариоэктомии. Таким образом, было показано, что некоторая часть женщин при РМЖ чувствительна к гормонотерапии. В дальнейшем это позволило отнести РМЖ в категорию гормонозависимых опухолей.
Много десятилетий теория П. Эрдиха считалась «наивной». В наше время вопросы, связанные с клеточной рецепцией имеют первостепенное значение для определения прогноза и выбора тактики лечения больных РМЖ. Конечно, со времени П. Эрлиха знания о клеточной рецепции претерпели значительные изменения, но общая идея рецепции как основы жизнедеятельности клетки уже не кажется наивной. Антителообразующая же функция принадлежит плазматическим клеткам.
Так история совершила ещё один причудливый виток от иммунологической гипотезы к клинической практике определения рецепторов при РМЖ при помощи иммунологических методик. Трансформация биологических знаний о клеточных рецепторах, привела к появлению совершенно нового разделы морфологии – иммуногистохимии, в основе которой находится всё та же иммунологическая реакция «антиген-антитело». Закономерности окраски препарата при воздействии на него моноклональными антителами позволяют при светооптической микроскопии сделать заключение о наличии или отсутствии рецепторов в опухоли.
Получение информации об особенностях клеточной рецепции позволило получить ответ на кардинальный вопрос об обосновании показаний к выбору терапии (гормональной и цитостатической) при РМЖ.
В настоящее время в рутинной клинической практике используется определение рецепторов эстрогена (РЭ), рецепторов прогестерона (РП) и экспрессии онкогена HER-2new (синонимы: HER-2, c-erbB-2, c- new). Иммуногистохимическое определение спектра этих рецепторов является основой для принятия решений о выборе метода гормонотерапии при РМЖ, в частности о показаниях к назначению модуляторов сигнальной трансдукции (антиэстрогенов или ингибиторов ароматазы). Положительная реакция РЭ и РП является основанием для назначения модуляторов сигнальной трансдукции. Кроме того, повышение РЭ и РП является признаком относительно хорошего истинного прогноза (прогноза без лечения). РЭ негативные опухоли имеют худший истиный прогноз, менее чувствительны к гормонотерапии, их отсутствие является критерием лечебного приоритета по выбору цитостатической терапии. При сочетанном повышении экпрессии РЭ и HER-2new эффективность гормонотерапии снижается, но часто высокая экспрессия HER-2new сочетается с РЭ негативным статусом.
В последние годы появились сведения о значении показателей HER-2new для выбора типа цитостатиков. При повышении экспрессии HER-2new снижается эффективность адьювантной полихимиотерапии с использованием алкилирующих препаратов, эта ситуация свидетельствует в пользу выбора антрациклинсодержащих схем. Продолжается изучение значения экспресии HER-2new для принятия решений по использованию таксанов.
Исследования показаний к объёму лечения, основанные на обследовании ОМ продолжаются в следующих направлениях:
- Полигормонотерапия. Обсуждается совместное использование модуляторов сигнальной трансдукции различного механизма действия(антиэстроген + ингибитор ароматазы).
- Обоснование «линий» терапии (антиэстрогены, ингибиторы ароматазы, прогестерон).
- Применение монохимиотерапии + гормонотерапии. Прогнозируемые преимущества – снижение общей токсичности, без снижения (возможного улучшения) лечебного эффекта.
- Варианты обоснованного отказа от цитотоксической терапии, без ущерба для прогноза лечения (достаточность хирургического лечения / или в комбинации с лучевой терапией).
