И. С. Собенников диагностика рака предстательной железы методические рекомендации
| Вид материала | Методические рекомендации |
- Рак предстательной железы, 186.21kb.
- Брахитерапия, 18.32kb.
- Локальная, системная и сочетанная лучевая терапия костных метастазов, 150.74kb.
- Российско-американской конференции «Актуальные вопросы онкоурологии» с мастер-классом:, 116.71kb.
- Иммунодиагностика и иммунотерапия рака молочной железы, 241.98kb.
- Иммунодиагностика и иммунотерапия рака молочной железы, 212.29kb.
- Возможности уз-диагностики в диагностике рака предстательной железы, 61.85kb.
- Рак пищевода представляет собой наименее исследованную и наиболее агрессивную по течению, 162.36kb.
- Гормонотерапия генерализованного рака предстательной железы, 145.42kb.
- Реферат встатье приводятся результаты клинико-экспериментального научного исследования, 262.05kb.

Б.Н. Жиборев, В.Б. Вижгородский, И.С. Собенников
ДИАГНОСТИКА РАКА
ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Методические рекомендации

Рязань, 2011
Государственное образовательное учреждение высшего профессионального образования «Рязанский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения и социального развития Российской Федерации
Кафедра хирургических болезней с курсом урологии
Уронефрологический центр МУЗ «Городская клиническая больница №11»
Б.Н. Жиборев, В.Б. Вижгородский, И.С. Собенников
ДИАГНОСТИКА РАКА
ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Методические рекомендации
для врачей-урологов, слушателей курсов последипломного обучения по дисциплине «Урология»
Рязань, 2011
УДК 616.65-006.6-07(075.83)
ББК 56.9+55.6
Ж 66
Рецензенты:
Карякин О.Б., д.м.н., проф., зав. отделением лучевого и хирургического лечения урологических заболеваний ФГБУ «Медицинский радиологический научный центр» Минздравсоцразвития России;
Семенов А.В., д.м.н., проф., зав. кафедрой лучевой диагностики и лучевой терапии ГОУ ВПО «Ивановская государственная медицинская академия» Минздравсоцразвития России
Авторы: Жиборев Б.Н., д.м.н., проф. каф. хирургических болезней с курсом урологии РязГМУ; Вижгородский В.Б.,врач-уролог областного уронефрологического центра МУЗ «ГКБ №11»; Собенников И.С.,врач-интерн каф. хирургических болезней с курсом урологии РязГМУ Минздравсоцразвития России
Ж 66 Жиборев Б.Н. Диагностика рака предстательной железы: методические рекомендации / Б.Н. Жиборев, В.Б. Вижгородский,
И.С. Собенников; РязГМУ Минздравсоцразвития России.- Рязань: РИО ГОУ ВПО РязГМУ Минздравсоцразвития России, 2011. – 29 с.
Методические рекомендации для врачей-урологов, слушателей курсов последипломного обучения по дисциплине «Урология» разработаны в соответствии с Государственным стандартом послевузовской профессиональной подготовки специалистов с высшим медицинским образованием по специальности 140040 «Урология».
Предлагаемые методические материалы содержат описание оптимального стандарта диагностики рака простаты, а также рекомендации по тактике лечения данного заболевания с учетом рекомендаций Европейской ассоциации урологов (2010). Авторами разработан оригинальный протокол «Направление на патоморфологическое исследование ткани простаты после пункционной трепанобиопсии». Предлагаемая технология повышает качество получаемой информации о патоморфологических особенностях предстательной железы.
УДК 616.65-006.6-07(075.83)
ББК 56.9+55.6
Табл.: 1; Ил.: 7; Библиогр.: 9
© Жиборев Б.Н., Вижгородский В.Б., Собенников И.С., 2011
© РязГМУ Минздравсоцразвития России, 2011
Содержание
Список условных сокращений ------------------------------------------ 4
Введение --------------------------------------------------------------------- 5
О диагностическом скрининге РПЖ ----------------------------------- 6
Алгоритм диагностики РПЖ --------------------------------------------6
Методы биопсии простаты ------------------------------------------------9
Методика подготовки больного к трансперинеальной биопсии простаты -------------------------------------------------------------------10
Техника выполнения трансперинеальной биопсии простаты --- 11
Комментарии к оценке клеточной дифференцировки опухоли
предстательной железы --------------------------------------------------15
Показания к повторной биопсии простаты --------------------------18
Приложение А. Схема для взятия ткани простаты на патоморфологическое исследование ----------------------------------21
Приложение Б. Протокол «Направление на патоморфологическое исследование ткани простаты после пункционной трепанобиопсии» --------------------------------------------------------- 22
Приложение В. Международная клиническая классификация рака предстательной железы по системе TNM --------------------------- 24
Контрольные вопросы -------------------------------------------------- 26
Список литературы -----------------------------------------------------27
Список условных сокращений
ASAP – атипическая малая ацинарная пролиферация
CSAP – криохирургическая деструкция предстательной железы
EAU – Европейская Ассоциация урологов
HIFU – высокоинтенсивный сфокусированный ультразвук
БПЖ – биопсия предстательной железы
КОЕ – колониеобразующая единица
НПВП – нестероидные противовоспалительные препараты
ПИН – простатическая интраэпителиальная неоплазия
ПРИ – пальцевое ректальное исследование
ПСА – простатспецифический антиген
РПЖ –рак предстательной железы
ТРУЗИ – трансректальное ультразвуковое исследование
ВВЕДЕНИЕ
Рак предстательной железы (РПЖ) – одно из наиболее распространенных в урологической практике злокачественных заболеваний мужчин среднего и пожилого возраста. По данным Европейской ассоциации урологов (EAU) рак простаты занимает второе место среди причин смертности мужчин от злокачественных новообразований.
В России в последнее десятилетие РПЖ по величине прироста занял второе место (31,4%) после меланомы кожи (35%) и в значительной мере превзошел показатели прироста таких злокачественных новообразований как рак легких и рак желудка (соответственно 5% и 10,2%).
Известно, что результаты лечения РПЖ зависят от стадии опухолевого процесса, возраста больного и наличия у него сопутствующих заболеваний.
Для местнораспространенного РПЖ (те случаи, когда опухоль не выходит за пределы капсулы предстательной железы), существуют три лечебных подхода: хирургический метод, лучевое воздействие на опухоль в разных вариантах и наблюдение или отсроченное медикаментозное лечение (Матвеев В.Б., 2004).
На ранних стадиях заболевания (РПЖ Т1 – Т2) хирургический метод позволяет добиться высоких результатов. Но хирургический метод, в частности, радикальная простатэктомия, в прогностическом отношении высоко эффективен у соматически компенсированных больных возрастной категории до 70 лет в стадии Т1 – Т2N0M0. Больным старше 70 лет радикальная операция, как правило, не рекомендуется.
Анализ онкологической заболеваемости указывает на то, что в Российской Федерации почти у 70% больных РПЖ впервые диагностируется в III – IV стадии, нередко с признаками распространенного метастатического процесса. Безусловно, распознавание болезни в поздних стадиях течения патологического процесса снижает возможности эффективного лечения. Следовательно, ранняя диагностика рака простаты является весьма актуальной клинической проблемой.
О ДИАГНОСТИЧЕСКОМ СКРИНИНГЕ РПЖ
В последние годы в странах Европейского научного медицинского сообщества и в нашей стране широко применяется диагностический скрининг для выявления РПЖ на ранних стадиях. Под скринингом в данном контексте понимают обследование «асимптомных» мужчин из группы риска по РПЖ. Цель скрининга – выявление больных с ранними стадиями рака простаты, которым показано радикальное лечение.
Важное место в скрининге уделяется определению в крови уровня общего простатспецифического антигена (ПСА). Эта калликреинподобная сериновая протеаза продуцируется эпителиальными клетками предстательной железы. Особо подчеркнем, что простатический специфический антиген, является органоспецифическим маркером, а не раковоспецифическим. Строгих рекомендаций по поводу верхних границ референсных значений ПСА Европейская ассоциация урологов не дает, полагая, что уровень ПСА – непрерывный параметр: чем выше его значение у больного, тем более вероятно наличие у него РПЖ. Принято считать оптимальным порог нормы общего ПСА = 4,0 нг/мл. В последнее время широко обсуждается необходимость снижения верхней границы нормы общего ПСА до 2,5 – 3,5 нг/мл, особенно для пациентов молодого и среднего возраста.
АЛГОРИТМ ДИАГНОСТИКИ РПЖ
Располагая аналитическими материалами по диагностике и лечению более 1200 больных РПЖ, а также основываясь на накопленном многолетнем опыте работы нашей урологической клиники, мы рекомендуем ориентироваться в практической работе на алгоритм диагностики РПЖ, который в последние годы неоднократно обсуждался в специальной литературе. Он признается рядом исследователей как оптимальный рекомендуемый стандарт диагностики РПЖ. Порядок обследования больного в обсуждаемом алгоритме ориентирован на распространенные методы лабораторной и инструментальной клинической диагностики.
Методика обследования больных с предполагаемым диагнозом РПЖ должна выполняется в определенной последовательности, начиная с первой из приведенных ниже позиций:
- Определение уровня ПСА в плазме крови (общий, свободный, соотношение фракций).
- Пальцевое ректальное исследование простаты (ПРИ).
- Трансректальное ультразвуковое исследование предстательной железы (ТРУЗИ)
- Биопсия предстательной железы (по показаниям).
При направлении пациента на биопсию предстательной железы рекомендуется придерживаться следующих показаний:
- уровень общего ПСА у больного превышает 4 нг/мл. Следует помнить о том, что данный показатель в случае превышения контрольного значения требует обязательного подтверждения. Для этого рекомендуется с интервалом в 2 недели вновь, повторно, определить у пациента содержание общего ПСА в плазме крови при соблюдении всех стандартных условий, в той же лаборатории, на том же аппарате, используя тот же метод определения.
Абсолютными показаниями к биопсии простаты следует считать:
- наличие суспициозных (подозрительных на онкозаболевание) участков в ткани простаты, выявленных при ПРИ;
- Наличие гипоэхогенных участков в ткани простаты, определяемых при ультразвуковом трансректальном исследовании (как показано на клинических примерах №1 и №2, см. ниже) или при сочетании клинически значимых находок при ПРИ с соответствующими данными ультрасонографии.
Клинический пример №1. Больной Н., 65 лет с диагнозом: локализованный рак предстательной железы (Т1). При ТРУЗИ в поперечной плоскости выявляется небольшое гипоэхогенное объемное образование (М) в центральной зоне простаты (рис.1). Сагиттальный ультразвуковой срез через левый семенной пузырек демонстрирует четко очерченный гипоэхогенный очаг (М), лежащий кпереди от шейки семенного пузырька (V), М - опухоль, TZ - переходная зона, V - семенной пузырек (рис. 2,3).
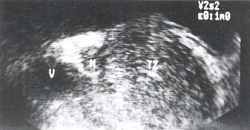
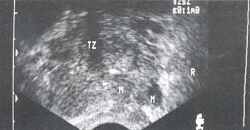 Рис.1 Рис.2
Рис.1 Рис.2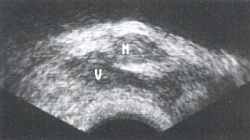
Рис.3
Клинический пример №2. Больной П., 60 лет, с диагнозом: рак предстательной железы Т3. Поперечный ультразвуковой срез показывает нарушение целостности капсулы из-за пенетрации опухоли. М - опухоль, стрелками показано разрушение целостности капсулы предстательной железы (рис.4).
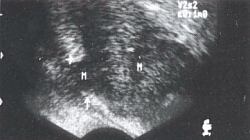
Рис.4
Рекомендуется у пациентов старческого возраста показания к биопсии простаты соизмерять с периодом ожидаемой продолжительности жизни, а также оценивать их общесоматический статус, который часто бывает отягощен тяжелыми интеркурентными заболеваниями. Результаты биопсии простаты в подобных случаях могут представлять ценность для уточнения клинического статуса больного при неясном диагнозе.
МЕТОДЫ БИОПСИИ ПРОСТАТЫ
В зависимости от доступа и методики выполнения различают следующие наиболее распространенные виды биопсии предстательной железы (БПЖ):
- Трансректальная БПЖ.
При этой методике биопсийная игла вводится в простату через стенку прямой кишки под контролем ультрасонографии с помощью ректального датчика. Осуществляется забор биологического материала для гистологического исследования из нескольких зон предстательной железы.
- Промежностная БПЖ.
Данная методика проводится трансперинеальным доступом, транскутанно, через область ограниченную мошонкой и анусом. Диагностическая манипуляция проводится также под контролем ТРУЗИ.
- Трансуретральная БПЖ.
Методика трансуретральной биопсии проводится с применением уретроскопа. Эта манипуляция требует выполнения уретроскопии и может быть единственно возможным вариантом взятия биопсийного материала в ряде клинических ситуаций (например, у больных после экстирпации прямой кишки).
Промежностная БПЖ успешно применяется в ряде клиник и является методом выбора для диагностики РПЖ. В числе ее достоинств следует отметить низкий процент инфекционно-воспалительных осложнений, которые возникают после вышеприведенных инвазивных диагностических манипуляций. В методике промежностной БПЖ сочетаются лучшие топографо-анатомические условия с техникой взятия оптимального массива ткани простаты и семенных пузырьков для патоморфологического исследования.
МЕТОДИКА ПОДГОТОВКИ БОЛЬНОГО К ТРАНСПЕРИНЕАЛЬНОЙ БИОПСИИ ПРОСТАТЫ
В нашей клинике для диагностики локализованного РПЖ уже более 15 лет выполняется мультифокальная трансперинеальная пункционная биопсия предстательной железы. Освоен и внедрен в практику метод трепанобиопсии простаты промежностным доступом из 10 точек под контролем ТРУЗИ.
Для подготовки пациента к мультифокальной трансперинеальной биопсии мы рекомендуем выполнять следующие положения:
- За 3-5 дней до планируемой биопсии простаты пациенту рекомендуется отказаться от приема аспирина и содержащих ацетилсалициловую кислоту препаратов.
- Следует отменить (если таковые имеются) назначения гепарина, синкумара, неодикумарина и других веществ, влияющих на свертываемость крови. Исключением являются те случаи, когда больному нельзя прекратить прием препарата из-за повышенного риска сердечно-сосудистых осложнений.
- За 3 дня до биопсии рекомендуется прекратить прием нестероидных противовоспалительных препаратов (НПВП).
- Накануне биопсии, вечером, пациенту необходимо выполнить очистительную клизму.
- Утром, в день биопсии, прием пищи рекомендуется ограничить до «легкого завтрака».
- Для создания седативного эффекта и проведения манипуляции пациенту за 30 минут до процедуры назначается прием per os 0,001 мг феназепама, либо другого препарата из группы транквилизаторов.
- С целью профилактики инфекционных осложнений больному следует за 30-60 минут до диагностической манипуляции принять per os антибиотик широкого спектра действия (предпочтительно из группы фторхинолонов, цефалоспоринов III поколения). Выбор антибиотика проводится с учетом посева мочи на КОЕ, либо в режиме эмпирической антибиотикотерапии. Так осуществляется антибиотикопрофилактика инфекционных осложнений мультифокальной биопсии простаты.
В качестве метода обезболивания при биопсии предстательной железы следует отдать предпочтение местной инфильтрационной анестезии. После обсуждения с больным особенностей диагностической процедуры, после получения информированного согласия, врачу необходимо разъяснить больному требования к поведению пациента во время диагностической манипуляции.
ТЕХНИКА ВЫПОЛНЕНИЯ ТРАНСПЕРИНЕАЛЬНОЙ БИОПСИИ ПРОСТАТЫ
Больной располагается в урологическом кресле, в положении «как для цистоскопии», с приподнятыми и разведенными ногами. Мошонка фиксируется рукой больного в направлении «на живот». После обработки рук уролог, с соблюдением правил асептики и антисептики, проводит дважды обработку промежности в области предполагаемой манипуляции растворами типа йодопирон. Область промежности отгораживается стерильным бельем. Больному, после осмотра области ануса, в прямую кишку вводится трансректальный датчик – эхосканер. При сканировании подтверждается соответствующая предшествующему обследованию ультразвуковая картина предстательной железы.
Далее следует выполнить местную анестезию с помощью тонкой длинной иглы. Последняя проводится под контролем ультрасонографии. В качестве анестетика рекомендуется использовать раствор новокаина (Sol. Novocaini 0,5%) в объеме до 50 мл. Раствор анестетика вводится из двух проколов в парапростатическую клетчатку и окружающие ткани. Биопсийную иглу следует направить после прокола кожи промежности в направлении от основания к верхушке простаты, параллельно передней стенке прямой кишки. При продольном ультразвуковом сканировании хорошо видно продвижение биопсийной иглы через мышечную ткань промежности, парапростатическую клетчатку, вплоть до ее попадания в предстательную железу. Проводится забор материала для последующего гистологического исследования. Процедура биопсии завершается наложением асептической повязки.
Материал для гистологического исследования следует брать не менее чем из 10 точек простаты, положение которых рекомендуется сопоставлять со строением предстательной железы.
Точки, рекомендуемые для пункционной биопсии простаты, в совокупности представляют собой определенный технологический стандарт, в котором учтены анатомические особенности строения железы. Учитывается в «стандарте» и частота локализации первичных очагов РПЖ. В частности, учитывается то обстоятельство, что в 70% случаев РПЖ развивается в периферической зоне, в 10-15% случаев – в центральной зоне, в остальных случаях – в переходной зоне. На рис. 5 схематически показано строение предстательной железы на поперечном и сагитальном срезах. Условной штриховкой отмечены клинически важные для проведения пункционной иглы анатомические зоны простаты. Выполнение биопсии по рекомендуемому «стандарту» повышает вероятность выявления опухолевого поражения.
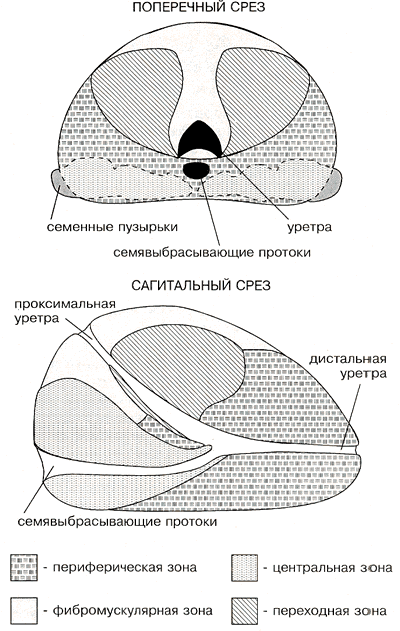
Рис.5. Строение предстательной железы
Фибромускулярная зона: зона, формирующая передний слой железы. Образована мышечными волокнами, которыми представлена 1/3 переднего отдела простаты. В физиологическом плане, равно как и в патологическом, эта зона не играет никакой роли.
Периферическая зона: эта зона формирует задний и нижний отделы предстательной железы. Она богата железами, выводные протоки которых открываются с одной стороны в дистальный отдел уретры, а с другой стороны – в семенной бугорок.
Центральная зона: имеет коническую форму, ее верхушка располагается на семенном бугорке, а ее основание формирует основание предстательной железы. Обычно центральная зона окружает семенные протоки на всем их протяжении. Ее ацинусы сливаются с одной стороны в уретре на уровне семенного бугорка и с другой стороны – в семенных протоках.
Переходная зона: эта зона формируется двумя маленькими дольками с одной стороны и проксимальным отделом уретры с другой стороны. Железы центральной зоны встречаются в строме редко, удалены друг от друга и сливаются в верхней части семенного бугорка. Переходная зона составляет только 5% железистой массы предстательной железы и является местом развития аденомы простаты.
Точки взятия биопсии приведены в прил. А.
Необходимо соблюдать определенный порядок в методике взятия биопсийного биоматериала из вышеописанных анатомических областей простаты.
Каждый столбик биопсийного материала, длина которого должна быть не менее 2 см, следует поместить в отдельный пронумерованный в соответствии с точками забора контейнер, после чего необходимо заполнить направление на патоморфологическое исследование ткани простаты.
В бланке – направлении указываются данные ПРИ, уровня ПСА, результаты предыдущих патоморфологических исследований простаты (если таковые выполнялись). Протокол направления биопсийного материала на патогистологическое исследование мы рекомендуем оформлять согласно прил. Б.
Морфологическое исследование биоптатов должно быть нацелено на решение следующих клинически важных вопросов:
- Имеется ли в предстательной железе опухолевая метаплазия как таковая?
- Если нет, то какие изменения выявлены: железистая гиперплазия, хронический простатит, атипическая малая ацинарная пролиферация (atypical small acinar proliferation — ASAP)?
- Сколько биоптатов содержат карциному, если обнаружен рак простаты?
- Какова степень дифференцировки опухолевой ткани (по шкале Глисона)?
- Есть ли инвазия простатической капсулы, семенных пузырьков (если проводилась биопсия семенных пузырьков)?
6. Какова стадия первичной опухоли по международной клинической классификации рака предстательной железы по системе TNM ? ( прил. В).
Полученная при изучении биопсийного материала информация зависит не только от качества собранного материала, но и от квалификации клинического морфолога. Важно уметь адекватно интерпретировать результаты биопсии простаты, которые имеют, порой, определяющее значение для выбора лечебной тактики и прогноза заболевания у больного РПЖ.
В частности, морфологические данные позволяют выделить группы пациентов, которым не требуется хирургическое вмешательство. Так, пациенты с РПЖ в стадии Т1 - Т2а, у которых ПСА меньше 10 нг/мл, а сумма Глисона не превышает 6 баллов в соответствие с рекомендациями Европейской ассоциации урологов могут подвергаться не только радикальному лечению (радикальной простатэктомии). С учетом клинической ситуации, методом выбора в таких случаях может быть: брахитерапия (контактная лучевая терапия), криохирургическая деструкция предстательной железы (CSAP), HIFU – терапия (использование высокоинтенсивного сфокусированного ультразвука для деструкции опухоли). Методом выбора может быть и тактика активного выжидательного наблюдения.
КОММЕНТАРИИ К ОЦЕНКЕ КЛЕТОЧНОЙ ДИФФЕРЕНЦИРОВКИ ОПУХОЛИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Для определения лечебной тактики и оценки прогноза заболевания необходимо также оценить степень дифференцировки опухоли простаты. Это осуществляется при сопоставлении патоморфологических находок с показателями так называемой шкалы Глисона.
Шкала (или сумма) Глисона позволяет определить степень различия в дифференцировке пораженных опухолью клеток простаты с нормальными неизмененными клетками эпителия предстательной железы. Показатель шкалы позволяет формализовать описательную часть патоморфологического протокола, вводит клиническую стратификацию в представление о больном РПЖ, является стандартом морфологической диагностики РПЖ.
В соответствии со шкалой Глисона принято выделять 5 градаций злокачественности раковоизмененных тканей простаты. Каждая из них определяется в соответствии со степенью их клеточной дифференцировки. Сумма Глисона дает возможность оценить степень агрессивности раковой опухоли: чем выше сумма по шкале Глисона, тем выше потенциал злокачественности опухоли. Основные градации этой шкалы приведены на рис. 6.
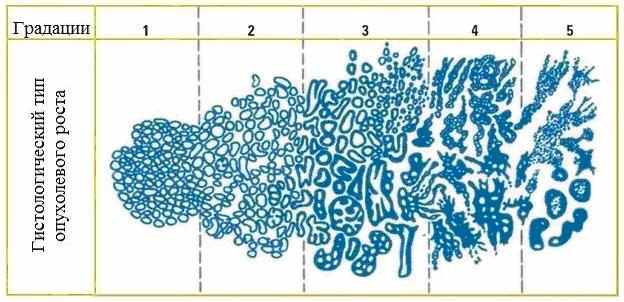
Рис.6. Степень дифференцировки эпителиальных клеток простаты по шкале Глисона.
Величинами 1,2,3,4,5 условно обозначается по шкале Глисона степень градации клеточного роста. Каждая степень градации имеет определенную морфологическую характеристику клеточного роста опухоли.
- градация 1: опухоль состоит из небольших однородных желез с минимальными изменениями клеточных ядер;
- градация 2: опухоль состоит из скоплений желез с хорошо дифференцируемым эпителием, все еще разделенных стромой, но расположенных ближе друг к другу;
- градация 3: опухоль состоит из желез различного размера и строения и как правило, инфильтрирует строму и окружающие ткани;
- градация 4: опухоль состоит из явно атипичных клеток и инфильтрирует окружающие ткани;
- градация 5: опухоль представляет собой слои недифференцированных атипичных клеток.
При исследовании клеток опухоли в биоптатах клинический морфолог в соответствие с методикой оценки градации опухолевого роста проводит сравнение найденных изменений в тканях с образцами шкалы Глисона. Во внимание принимаются два наиболее часто встречающихся в биопсийном материале образца клеточной дифференцировки тканей. Далее их следует титровать по отношению к величинам соответствующих градаций шкалы Глисона. Определенные таким образом величины суммируются, образуя искомую сумму по шкале Глисона. Таким образом, результат может варьировать в разных вариантах и сочетаниях от 2-х баллов (1+1 – высокодифференцированная опухоль) до 10 баллов (5+5 – высокозлокачественная низкодифференцированная опухоль).
Шкала Глисона упрощает оценку степени агрессивности рака простаты. При сумме баллов от 2 до 6 агрессивность рака низкая; 7 баллов – средняя; если сумма баллов варьирует от 8 до 10, то следует определить опухолевый рост как низкодифференцированный, агрессивность опухоли в таком случае – высокая.
Сумма Глисона – важный прогностический фактор для предсказания прогрессирования болезни и риска развития рецидивов после радикальной простатэктомии или лучевой терапии. Представляет определенный интерес для оценки прогноза прогрессии РПЖ после радикальной простатэктомии таблица корреляции показателя Глисона с некоторыми дополнительными морфологическими находками, которые приводятся в «номограмме» (табл. 1).
Таблица 1
Корреляция показателя Глисона с морфологическими находками, выявленными после радикальной простатэктомии
| Выявленная патология | Показатель Глисона | |||
| < 5 | 5 | 7 | 8-10 | |
| Прорастание капсулы простаты | 16% | 24% | 62% | 85% |
| По краям простаты не удаленные раковые клетки | 20% | 29% | 48% | 59% |
| Средний объем удаленной опухоли (см3) | 2.2 | 2.7 | 5.1 | 4.0 |
| Степень инвазии в семенные пузырьки | 1% | 4% | 17% | 48% |
| Метастазы в лимфатических узлах | 1% | 2% | 12% | 24% |
Как видно из табл.1, при показателе Глисона 8-10 все сопоставленные прогностические морфологические факторы развития рецидива после радикального лечения в несколько раз выше (например, факт прорастания капсулы – в 5 раз: от 16% до 85%, средний объем опухоли – в 2 раза: от 2,2 см³ до 4,0 см³ и т.д.).
Таким образом, патолог, изучая полученный препарат ткани простаты и применяя шкалу Глисона, не только качественно оценивает обнаруженное злокачественное поражение, но и дает ему количественное выражение, что представляет несомненный интерес для клиники. Получаемый результат является стандартизированным показателем для оценки риска развития рецидива рака предстательной железы и важен для оценки вероятности местного распространения злокачественной опухоли.
ПОКАЗАНИЯ К ПОВТОРНОЙ БИОПСИИ ПРОСТАТЫ
В ряде случаев при диагностике РПЖ возникает необходимость в повторной биопсии простаты.
Основными показаниями для проведения повторной биопсии простаты следует считать:
- растущий и/или постоянно повышенный уровень общего ПСА в плазме крови;
- подозрительные результаты, полученные при ПРИ простаты;
- атипическая малая ацинарная пролиферация (ASAP), выявленная при первичной биопсии;
- обязательна повторная биопсия простаты при ведении больного в режиме активного выжидательного наблюдения.
Оптимальные временные промежутки выполнения повторной биопсии в литературе строго не определены и во многом зависят от гистологического результата первоначальной биопсии. Рекомендуется при решении вопроса о повторной биопсии оценивать статус больного как реальное подозрение на РПЖ, если:
- выявлен высокий или значительно повышенный уровень свободного ПСА в плазме крови;
- отмечаются подозрительные находки в простате при ПРИ;
- если отягощен семейный анамнез: упоминание о наличии рака простаты у близких родственников .
Следует помнить о том, что чем позже выполняется повторная биопсия простаты, тем выше вероятность морфологического подтверждения РПЖ и вероятность ухудшения течения болезни. Простатическую интраэпителиальную неоплазию (ПИН) высокой степени в настоящее время не считают абсолютным показанием для повторной биопсии простаты.
Третья и последующие биопсии простаты показаны при наличии факторов высокого риска обнаружения РПЖ. Таковыми являются:
- рост уровня общего ПСА в плазме крови;
- снижение соотношения уровней свободный ПСА / общий ПСА ниже 15%;
- скорость прироста общего ПСА повышена ≥ 0,75 нг/мл/год;
- в предшествующих исследованиях выявлена ASAP.
Следует при этом учитывать, что в большинстве случаев решение вопроса о повторной биопсии простаты принимается врачом индивидуально по отношению к каждому конкретному пациенту, с учетом клинической симптоматики и динамики течения заболевания.
Приложение А
Схема для взятия ткани простаты на патоморфологическое исследование:
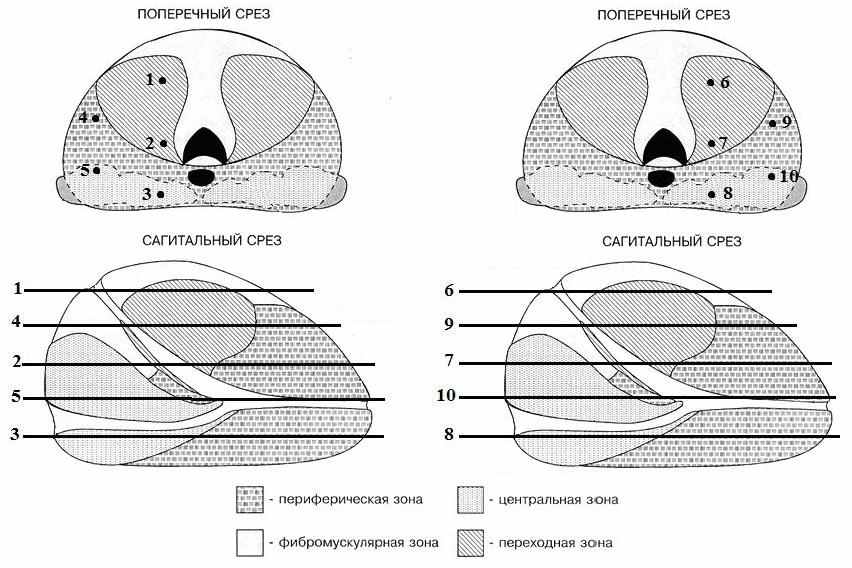
5 столбиков из правой доли и 5 столбиков из левой доли простаты.
Точки 1,6 – столбики биоматериала, полученные при биопсии из данных точек, содержат ткань переходной зоны простаты;
Точки 2,7 – столбики биоматериала, полученные при биопсии из данных точек, содержат ткань переходной, центральной и периферической зон простаты;
Точки 3,8 – столбики биоматериала, полученные при биопсии из данных точек, содержат ткань центральной и периферической зон простаты;
Точки 4,9 – столбики биоматериала, полученные при биопсии из данных точек, содержат ткань переходной и периферической зон простаты;
Точки 5,10 – столбики биоматериала, полученные при биопсии из данных точек, содержат ткань центральной и периферической зон простаты;

Рис.А.1. Схема взятия ткани простаты
на патоморфологическое исследование
Приложение Б
Протокол «Направление на патоморфологическое исследование ткани простаты после пункционной трепанобиопсии»
Ф.И.О. больного ________________________________________________________
Возраст:_________________________________________________
Отделение:______________________________________________
Результаты ПРИ:___________________________________________________
________________________________________________________
Результат исследования ПСА:___________________________________________________
Результаты ТРУЗИ ________________________________________________________
________________________________________________________
Анамнез:________________________________________________
(первичная, повторная. Если повторная – указать результаты предыдущего гистологического исследования)
________________________________________________________________________________________________________________
Схема забора ткани простаты.
Обозначение точек для биоптатов (маркировка), направляемых на гистологическое исследование:
5 столбиков из правой доли и 5 столбиков из левой доли простаты.
Ф
 амилия врача, выполнившего биопсию простаты
амилия врача, выполнившего биопсию простаты ________________
Подпись
________________
Дата
________________
Результаты патоморфологического исследования №___________________________
Ф.И.О. ________________________________________________________
возраст ______________________ отделение _________________
1 образец: ________________________________________________________
2 образец:
________________________________________________________
3 образец: ________________________________________________________
4 образец:
________________________________________________________
5 образец: ________________________________________________________
6 образец: ________________________________________________________
7 образец: ________________________________________________________
8 образец: ________________________________________________________
9 образец: ________________________________________________________
10 образец: ________________________________________________________
Степень дифференцировки по Глиссону: _____________________
Патоморфологический диагноз__________________________________________________
________________________________________________________
Дата исследования: _______________________
Исследование выполнили:
Врач________________________________________________
Лаборант____________________________________________
Приложение В
Международная клиническая классификация рака предстательной железы по системе TNM
Т - первичная опухоль.
- ТХ - недостаточно данных для оценки первичной опухоли.
- Т0 - первичная опухоль не определяется.
- Т1 - опухоль клинически не проявляется, не пальпируется и не визуализируется специальными методами
- Т1а - опухоль случайно обнаруживается при гистологическом исследовании и составляет менее 5% резецированной ткани.
- Т1b - опухоль случайно обнаруживается при гистологическом исследовании и составляет более 5% резецированной ткани.
- Т1с - опухоль диагностируется с помощью игольной биопсии (производимой в связи с высоким уровнем простатспецифического антигена).
- Т1а - опухоль случайно обнаруживается при гистологическом исследовании и составляет менее 5% резецированной ткани.
- Т2 - опухоль ограничена предстательной железой или распространяется в капсулу.
- Т2а - опухоль поражает половину одной доли или меньше.
- Т2b - опухоль поражает более половины одной доли, но не обе доли.
- T2c - опухоль поражает обе доли. Примечание. Опухоль, диагностированная с помощью игольной биопсии в одной или обеих долях, но непальпируемая и невизуализируемая, классифицируется как Т1с.
- Т2а - опухоль поражает половину одной доли или меньше.
- Т3 - опухоль распространяется за пределы капсулы предстательной железы.
- Т3а - опухоль распространяется за пределы капсулы (одно- или двустороннее).
- Т3b - опухоль распространяется на семенной пузырек (и). Примечание. Распространение опухоли на верхушку предстательной железы или в капсулу (но не за ее пределы) предстательной железы классифицируется как Т2, а не Т3.
- Т3а - опухоль распространяется за пределы капсулы (одно- или двустороннее).
- Т4 - несмещаемая опухоль или опухоль, распространяющаяся на соседние структуры (но не на семенные пузырьки): шейку мочевого пузыря, наружный сфинктер, прямую кишку, мышцу, поднимающую задний проход, и/или тазовую стенку.
N - регионарные лимфатические узлы.
Регионарными лимфатическими узлами для предстательной железы являются лимфатические узлы малого таза, расположенные ниже бифуркации общих подвздошных артерий. Категория N не зависит от стороны локализации регионарных метастазов.
NX - недостаточно данных для оценки регионарных лимфатических узлов.
- N0 - метастазы в регионарных лимфатических узлах отсутствуют.
- N1 - имеются метастазы в регионарных лимфатических узлах.
М - отдаленные метастазы.
- МX - определить наличие отдаленных метастазов не представляется возможным.
- М0 - признаки отдаленных метастазов отсутствуют.
- М1 - отдаленные метастазы.
- M1a - поражение нерегионарных лимфоузлов.
- M1b - поражение костей.
- M1c - другие локализации отдаленных метастазов.
Контрольные вопросы
- Каков оптимальный порог нормы общего ПСА?
- Какова последовательность обследования больных с предполагаемым диагнозом РПЖ?
- Каковы абсолютные показания к биопсии предстательной железы?
- Перечислите методы биопсии предстательной железы.
- Какова методика подготовки больного к трансперинеальной биопсии предстательной железы?
- Какова техника выполнения трансперинеальной биопсии предстательной железы?
- Что такое шкала (сумма) Глисона и какова ее диагностическая роль?
- Расскажите о методике вычисления суммы Глисона.
- Перечислите показания к повторной биопсии предстательной железы.
Список литературы
- Клинические рекомендации Европейской Ассоциации Урологов 2010. - М.: АБВ – пресс, 2010.
- Куликов Е.П. Гормонозависимая опухолевая патология / Е.П. Куликов. - Рязань, 2010.
- Матвеев Б.П. Рак предстательной железы / Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев.- М., 2006.
- Пункционная биопсия простаты в диагностике рака предстательной железы / Б.Н. Жиборев [и др.].- Рязань, 2009.
- Пушкарь Д.Ю. Диагностика и лечение локализованного рака предстательной железы / Д.Ю. Пушкарь, П.И. Раснер. - М., 2008.
- Best approach for prostate cancer detection: a prospective study on transperineal versus transrectal six-core prostate biopsy / P. Emiliozzi [et al.] // Urology. - 2003.- Vol.61,№5.- Р. 961-966.
- Clements R. Transrectal ultrasound imaging in the assessment of prostatic disease / R. Clements, G.J. Griffiths, W.B. Peeling // Br.J. Radiol. - 1991.- Vol.64.- Р. 193-200.
- Mc Neal J.E. Regional morphology and pathology of the prostate / J.E. Mc Neal // Amer. J. Clin. Path. - 1968.- Vol.49.- Р.347.
- The prostate cancer intervention versus observation trial: VA/NCI/AHRQ Cooperative studies program #407 (PIVOT): design and baseline results of a randomized controlled trial comparing radical prostatectomy to watchful waiting for men with clinically localized prostate cancer / T.J. Wilt [et al.] // Contemp Clin Trials.- 2009.- Vol.30,№1.- Р. 87.
Протокол «Направление на патоморфологическое исследование ткани простаты после пункционной трепанобиопсии»
Ф.И.О. больного ________________________________________________________
Возраст:_________________________________________________
Отделение:______________________________________________
Результаты ПРИ:___________________________________________________
________________________________________________________
Результат исследования ПСА:___________________________________________________
Результаты ТРУЗИ ________________________________________________________
________________________________________________________
Анамнез:________________________________________________
(первичная, повторная. Если повторная – указать результаты предыдущего гистологического исследования)
________________________________________________________________________________________________________________
Схема забора ткани простаты.
Обозначение точек для биоптатов (маркировка), направляемых на гистологическое исследование:
5 столбиков из правой доли и 5 столбиков из левой доли простаты.
Ф
 амилия врача, выполнившего биопсию простаты
амилия врача, выполнившего биопсию простаты ________________
Подпись
________________
Дата
________________
Результаты патоморфологического исследования №___________________________
Ф.И.О. ________________________________________________________
возраст ______________________ отделение _________________
1 образец: ________________________________________________________
2 образец:
________________________________________________________
3 образец: ________________________________________________________
4 образец:
________________________________________________________
5 образец: ________________________________________________________
6 образец: ________________________________________________________
7 образец: ________________________________________________________
8 образец: ________________________________________________________
9 образец: ________________________________________________________
10 образец: ________________________________________________________
Степень дифференцировки по Глиссону: _____________________
Патоморфологический диагноз__________________________________________________
________________________________________________________
Дата исследования: _______________________
Исследование выполнили:
Врач________________________________________________
Лаборант____________________________________________
