На уроках химии вы познакомились с химическими реакциями, которые ведут к превращениям веществ
| Вид материала | Урок |
СодержаниеМетоды наблюдения и регистрации элементарных частиц. 4. Ядерная энергетика. Из жизни замечательных физиков. Сахаров, андрей дмитриевич |
- Курсовая работа по химии на тему: «управление химическими процессами», 382.99kb.
- Тематика творческих работ слушателей криппо по: химии формирование здорового образа, 1160.03kb.
- Которые проникают друг в друга и при определенных условиях могут превращаться друг, 1375.49kb.
- Которые проникают друг в друга и при определенных условиях могут превращаться друг, 1375.55kb.
- Уроках географии и химии Тема: «Роль табака в экономике и жизни людей. Его химическая, 235.41kb.
- Г. Новосибирск Впроцессе изучения школьниками химии, к сожалению, зачастую химические, 91.53kb.
- Программа Пятой Международной школы по химии Теоретические занятия, 17.81kb.
- План лекций по химии для студентов 1 курса специальности 060201. 65 «Стоматология», 220.47kb.
- Супрамолекулярная химия вопросы к зачету, 29.83kb.
- Темы лекций по аналитической химии: Общие положения и принципы аналитической химии, 23.35kb.
1 2
Ядерные реакции
На уроках химии вы познакомились с химическими реакциями, которые ведут к превращениям веществ. Например, в пробирке, где протекает реакция между цинком и соляной кислотой
Zn + 2HCl > ZnCl2 + H2
молекулы исходных веществ (цинка и соляной кислоты) перестраиваются, образуя два новых вещества (хлорид цинка и водород). Атомы же при химических реакциях не изменяются.
Познакомимся теперь с так называемыми ядерными реакциями, которые ведут к превращениям атомов. Первая ядерная реакция в лабораторных условиях была осуществлена Резерфордом в 1919 году. Она протекала по схеме:
...
Ядро атома азота взаимодействовало с α-частицей. При этом сначала получилось ядро фтора. Это нестабильный, то есть быстро распадающийся промежуточный продукт реакции. В итоге получились ядра кислорода и водорода. Как видите, в ходе этой реакции произошло превращение ядер одних химических элементов в другие. Поэтому такие реакции и называются ядерными реакциями.
Ядерные реакции подчиняются определенным законам. Для их установления найдем суммы массовых и зарядовых чисел до и после реакции:
| | Массовое число | Зарядовое число |
| До реакции | 14 + 4 = 18 | 7 + 2 = 9 |
| После реакции | 17 + 1 = 18 | 8 + 1 = 9 |
Из таблицы видно, что суммы массовых чисел частиц до и после реакции равны. Это равенство справедливо и для зарядовых чисел. Итак, для этой и всех других ядерных реакций выполняются законы сохранения зарядового и массового чисел: суммы зарядовых и массовых чисел частиц до и после ядерной реакции равны.
Большинство ядерных реакций заканчивается после образования новых ядер. Однако существуют также и такие реакции, продуктами которых являются частицы, вызывающие сами реакции. Они называются цепными ядерными реакциями. Примером таких реакций служит реакция деления ядер урана-235. Рассмотрим ее.
Когда в ядро урана попадает нейтрон, оно распадается на два других ядра с образованием нескольких новых нейтронов. То есть причиной распада ядра является нейтрон, и эта же частица является и ее продуктом. Он попадет в другое ядро, и реакция будет продолжаться.
Такая ситуация является идеальной. На самом деле многие образовавшиеся нейтроны быстро покинут зону реакции и не будут захвачены каким-либо другим ядром урана. Кроме того, нейтроны могут поглотиться ядрами атомов примесей. При этом они не будут делиться и, следовательно, не породят новые нейтроны.
| |
Цепная реакция протекает очень быстро, то есть представляет собой взрыв. Для применения в мирных целях необходимо сделать реакцию управляемой, то есть регулировать количество нейтронов, вызывающих деление новых ядер. Такая реакция может протекать лишь в специальном устройстве – ядерном реакторе.
1. Методы наблюдения и регистрации элементарных частиц.
 Физика элементарных частиц – сравнительно молодая область физической науки. Она выделилась из ядерной физики в пятидесятые годы двадцатого века.
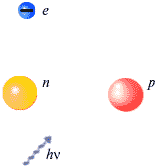
Физика элементарных частиц – сравнительно молодая область физической науки. Она выделилась из ядерной физики в пятидесятые годы двадцатого века.Предположение о дискретности строения вещества появилось еще в античности. Тогда же появился и термин "атом", что в переводе на русский язык означает неделимый. Этот термин сохраняется сегодня в науке чисто традиционно, поскольку современной физике известно множество субатомных (то есть - составляющих атомы) частиц. Некоторые из этих частиц, прежде всего - электрон, протон, нейтрон и фотон, - нам уже знакомы.
 СЦИНТИЛЛЯЦИЯ (от лат. scintillatio — мерцание), кратковременная вспышка люминесценции, возникающая в сцинтилляторах под действием ионизирующих излучений (напр., быстрых электронов).
СЦИНТИЛЛЯЦИЯ (от лат. scintillatio — мерцание), кратковременная вспышка люминесценции, возникающая в сцинтилляторах под действием ионизирующих излучений (напр., быстрых электронов).СЦИНТИЛЛЯЦИОННЫЙ ДЕТЕКТОР (сцинтилляционный спектрометр), прибор для регистрации и
 спектрометрии частиц. Действие основано на возбуждении заряженными частицами в ряде веществ световых вспышек (сцинтилляций), которые регистрируются фотоэлектронными умножителями. Сцинтилляционные детекторы обладают высокой эффективностью регистрации нейтронов и -квантов и быстродействием. Используются в телевизорах (светящийся при работе экран). Э. Резерфорд применил в опытах по рассеянию - частиц.
спектрометрии частиц. Действие основано на возбуждении заряженными частицами в ряде веществ световых вспышек (сцинтилляций), которые регистрируются фотоэлектронными умножителями. Сцинтилляционные детекторы обладают высокой эффективностью регистрации нейтронов и -квантов и быстродействием. Используются в телевизорах (светящийся при работе экран). Э. Резерфорд применил в опытах по рассеянию - частиц. Газоразрядный счетчик Гейгера. Он используется, в основном, для регистрации
Газоразрядный счетчик Гейгера. Он используется, в основном, для регистрации  электронов и -квантов.
электронов и -квантов.  Основа счетчика Гейгера - трубка, заполненная газом и снабженная двумя электродами, на которые подается высокое напряжение. Действие счетчика основано на ударной ионизации. Когда элементарная частица пролетает сквозь счетчик, она ионизирует газ, и ток через счетчик очень резко возрастает. Образующийся при этом на нагрузке импульс напряжения подается к регистрирующему устройству.
Основа счетчика Гейгера - трубка, заполненная газом и снабженная двумя электродами, на которые подается высокое напряжение. Действие счетчика основано на ударной ионизации. Когда элементарная частица пролетает сквозь счетчик, она ионизирует газ, и ток через счетчик очень резко возрастает. Образующийся при этом на нагрузке импульс напряжения подается к регистрирующему устройству.
 Если счетчик Гейгера позволяет лишь фиксировать факт появления частицы, то камера Вильсона и пузырьковая камера дают возможность наблюдать след, который оставляют пролетающие частицы. Камеру Вильсона заполняют парами воды или спирта, а затем создают условия, в
Если счетчик Гейгера позволяет лишь фиксировать факт появления частицы, то камера Вильсона и пузырьковая камера дают возможность наблюдать след, который оставляют пролетающие частицы. Камеру Вильсона заполняют парами воды или спирта, а затем создают условия, в 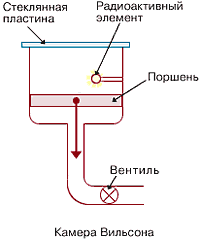 которых пар становится пересыщенным. Для этого резко опускают поршень, вызывая адиабатическое расширение пара. Элементарная частица, пролетая сквозь такую камеру, образует вдоль своей траектории ионы, которые затем выступают как центры конденсации: в них образуются капельки воды. Таким образом, частица оставляет за собой след, или как говорят, трек. Подобный след оставляет высоко летящий в небе самолет. Снимки этих капель и дают информацию о траектории частиц
которых пар становится пересыщенным. Для этого резко опускают поршень, вызывая адиабатическое расширение пара. Элементарная частица, пролетая сквозь такую камеру, образует вдоль своей траектории ионы, которые затем выступают как центры конденсации: в них образуются капельки воды. Таким образом, частица оставляет за собой след, или как говорят, трек. Подобный след оставляет высоко летящий в небе самолет. Снимки этих капель и дают информацию о траектории частиц
Действие пузырьковых камер основано на том, что они заполнены перегретой жидкостью, в которой появляются маленькие пузырьки пара на ионах, возникающих при движении быстрых частиц.

Если фотоэмульсия содержит мельчайшие кристаллы бромистого серебра, то его атомы ионизируются при пролете элементарной частицы. Затем, когда фотопластинку проявляют, происходит химическая реакция
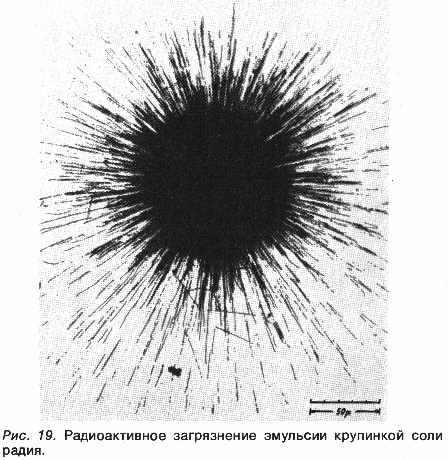 восстановления серебра, и треки частиц становятся видимыми.
восстановления серебра, и треки частиц становятся видимыми.2. Радиоактивность
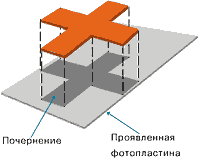
 Изучая действие люминесцирующих веществ на фотопленку, французский физик Антуан Беккерель обнаружил неизвестное излучение. Он проявил фотопластинку, на которой в темноте некоторое время находился медный крест, покрытый солью урана. На фотопластинке получилось изображение в виде отчетливой тени креста. Это означало, что соль урана самопроизвольно излучает. За открытие явления естественной радиоактивности Беккерель в 1903 году был удостоен Нобелевской премии.
Изучая действие люминесцирующих веществ на фотопленку, французский физик Антуан Беккерель обнаружил неизвестное излучение. Он проявил фотопластинку, на которой в темноте некоторое время находился медный крест, покрытый солью урана. На фотопластинке получилось изображение в виде отчетливой тени креста. Это означало, что соль урана самопроизвольно излучает. За открытие явления естественной радиоактивности Беккерель в 1903 году был удостоен Нобелевской премии.РАДИОАКТИВНОСТЬ – это способность некоторых атомных ядер самопроизвольно превращаться в другие ядра, испуская при этом различные частицы: Всякий самопроизвольный радиоактивный распад экзотермичен, то есть происходит с выделением тепла.

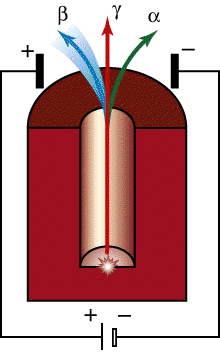 АЛЬФА-ЧАСТИЦА (a-частица)
АЛЬФА-ЧАСТИЦА (a-частица)– ядро атома гелия. Содержит два протона и два нейтрона. Испусканием a-частиц сопровождается одно из радиоактивных превращений (альфа-распад ядер) некоторых химических элементов.
БЕТА-ЧАСТИЦА
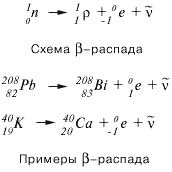 – испускаемый при бета-распаде электрон. Поток бета-частиц является одним из видов радиоактивных излучений с проникающей способностью, большей, чем у альфа-частиц, но меньшей, чем у гамма-излучения.
– испускаемый при бета-распаде электрон. Поток бета-частиц является одним из видов радиоактивных излучений с проникающей способностью, большей, чем у альфа-частиц, но меньшей, чем у гамма-излучения.ГАММА-ИЗЛУЧЕНИЕ (гамма-кванты)
– коротковолновое электромагнитное излучение с длиной волны меньше 2×10–10 м. Из-за малой длины волны волновые свойства гамма-излучения проявляются слабо, и на первый план выступают корпускулярные свойства, в связи с чем его представляют в виде потока гамма-квантов (фотонов).
Время, за которое распадается половина из начального числа радиоактивных атомов, называют периодом полураспада.
За это время активность радиоактивного вещества уменьшается вдвое. Период полураспада, определяется только родом вещества и может принимать разные значения - от нескольких минут до нескольких миллиардов лет.
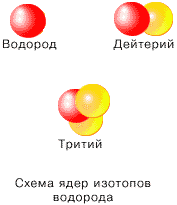
ИЗОТОПЫ
– это разновидности данного химического элемента, различающиеся массовым числом своих ядер. Ядра изотопов одного элемента содержат одинаковое число протонов, но разное число нейтронов. Имея одинаковое строение электронных оболочек, изотопы обладают практически одинаковыми химическими свойствами. Однако по физическим свойствам изотопы могут различаться весьма резко.
Все три составляющие радиоактивного излучения, проходя через среду, взаимодействуют с атомами среды. Результатом этого взаимодействия является возбуждение или даже ионизация атомов среды, что в свою очередь инициирует протекание различных химических реакций. Поэтому радиоактивное излучение обладает химическим действием.
Если же радиоактивному излучению подвергнуть клетки живого организма, то протекание реакций, инициированных радиоактивным излучением, может привести к образованию веществ, губительных для данного организма и в конечном итоге – к разрушению тканей. По этой причине воздействие радиоактивного излучения на живые организмы губительно. Большие дозы излучения могут привести к серьезным заболеваниям или даже к смерти.
3. Ядерные реакции


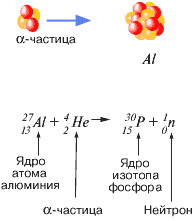
 ЯДЕРНЫЕ РЕАКЦИИ – это превращения атомных ядер в результате взаимодействия друг с другом или какими-либо элементарными частицами. Для осуществления ядерной реакции необходимо, чтобы сталкивающиеся частицы сблизились на расстояние порядка 10–15 м. Ядерные реакции подчиняются законам сохранения энергии, импульса, электрического и барионного зарядов. Ядерные реакции могут протекать как с выделением, так и с поглощением кинетической энергии, причем эта энергия примерно в 106 раз превышает энергию, поглощаемую или выделяемую при химических реакциях.
ЯДЕРНЫЕ РЕАКЦИИ – это превращения атомных ядер в результате взаимодействия друг с другом или какими-либо элементарными частицами. Для осуществления ядерной реакции необходимо, чтобы сталкивающиеся частицы сблизились на расстояние порядка 10–15 м. Ядерные реакции подчиняются законам сохранения энергии, импульса, электрического и барионного зарядов. Ядерные реакции могут протекать как с выделением, так и с поглощением кинетической энергии, причем эта энергия примерно в 106 раз превышает энергию, поглощаемую или выделяемую при химических реакциях.
Открытие нейтрона Д.Чедвиком в 1932 году

В 1932 году немецкий физик В. Гейзенберг и советский физик Д.Д. Иваненко предложили протонно-нейтронную модель атомного ядра. Согласно этой модели, атомные ядра состоят из элементарных частиц – протонов и нейтронов.
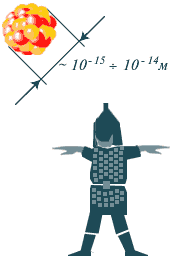 Ядерные силы очень мощные, но очень быстро убывают с увеличением расстояния. Они являются проявлением так называемого сильного взаимодействия. Особенностью ядерных сил является их короткодействующий характер: они проявляются на расстояниях порядка размера самого ядра. Физики в шутку называют ядерные силы "богатырем с короткими руками".
Ядерные силы очень мощные, но очень быстро убывают с увеличением расстояния. Они являются проявлением так называемого сильного взаимодействия. Особенностью ядерных сил является их короткодействующий характер: они проявляются на расстояниях порядка размера самого ядра. Физики в шутку называют ядерные силы "богатырем с короткими руками".Минимальную энергию, необходимую для полного расщепления ядра на отдельные нуклоны, называют энергией связи ядра.
Эта энергия равна разности суммарной энергии свободных нуклонов и полной энергии ядра. Таким образом, суммарная энергия свободных нуклонов больше полной энергии ядра, состоящего из этих нуклонов.
О
 чень точные измерения позволили зафиксировать тот факт, что масса покоя ядра всегда меньше суммы масс покоя составляющих его
чень точные измерения позволили зафиксировать тот факт, что масса покоя ядра всегда меньше суммы масс покоя составляющих его  нуклонов на некоторую величину, называемую дефектом массы.
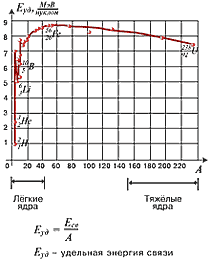
нуклонов на некоторую величину, называемую дефектом массы.Удельная энергия связи характеризует устойчивость ядер. Удельная энергия связи равна отношению энергии связи к массовому числу и характеризует устойчивость ядра. Чем больше удельная энергия связи, тем более устойчивым является ядро. График зависимости удельной энергии связи от количества нуклонов в ядре имеет слабо выраженный максимум в интервале от 50 до 60. Это говорит о том, что ядра со средними значениями массовых чисел, такие как железо, являются самыми устойчивыми. Легкие ядра обладают тенденцией к слиянию, а тяжелые к разделению.
П
 римеры ядерных реакций.
римеры ядерных реакций.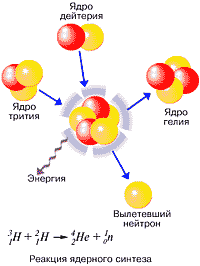



Цепные ядерные реакции.
Термоядерные реакции – это ядерные реакции между легкими атомными ядрами, протекающие при очень высоких температурах (~108 К и выше). При этом вещество находится в состоянии полностью ионизованной плазмы. Необходимость высоких температур объясняется тем, что для слияния ядер в термоядерной реакции необходимо, чтобы они сблизились на очень малое расстояние и попали в сферу действия ядерных сил. Этому сближению препятствуют кулоновские силы отталкивания, действующие между одноименно заряженными ядрами. Чтобы их преодолеть, ядра должны обладать очень большой кинетической энергией. После начала протекания термоядерной реакции вся энергия, потраченная на разогрев смеси, компенсируется энергией, выделяющейся в ходе протекания реакции.
4. Ядерная энергетика.
 Использование ядерной энергии – важная научно-практическая задача. Устройство, позволяющее осуществлять управляемую ядреную реакцию, называют ядерным реактором. Коэффициент размножения нейтронов в реакторе поддерживается равным единице посредством введения или выведения из реактора регулирующих стержней. Эти стержни изготавливают из вещества, хорошо поглощающего нейтроны, - из кадмия, бора или графита.
Использование ядерной энергии – важная научно-практическая задача. Устройство, позволяющее осуществлять управляемую ядреную реакцию, называют ядерным реактором. Коэффициент размножения нейтронов в реакторе поддерживается равным единице посредством введения или выведения из реактора регулирующих стержней. Эти стержни изготавливают из вещества, хорошо поглощающего нейтроны, - из кадмия, бора или графита.Основными элементами ядерного реактора являются:
– ядерное горючее: уран-235, плутоний-239;
– замедлитель нейтронов: тяжелая вода или графит;
– теплоноситель для отвода выделяющейся
 энергии;
энергии;– регулятор скорости ядерной реакции: вещество, поглощающее нейтроны (бор, графит, кадмий).
 Последствия применения ядерного оружия, как и последствия катастроф на ядерных реакторах, не ограничиваются огромными разрушениями. Зная, что период полураспада многих радиоактивных элементов длится многие сотни, тысячи, миллионы и даже миллиарды лет, можно представить себе, насколько долго сохранится радиоактивное загрязнение в районе ядерного взрыва. В случае же массированного применения ядерного оружия все живое на нашей планете может погибнуть.
Последствия применения ядерного оружия, как и последствия катастроф на ядерных реакторах, не ограничиваются огромными разрушениями. Зная, что период полураспада многих радиоактивных элементов длится многие сотни, тысячи, миллионы и даже миллиарды лет, можно представить себе, насколько долго сохранится радиоактивное загрязнение в районе ядерного взрыва. В случае же массированного применения ядерного оружия все живое на нашей планете может погибнуть. 5. Из жизни замечательных физиков.
 РЕЗЕРФОРД Эрнст (1871-1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член-корреспондент РАН (1922) и почетный член АН СССР (1925). Директор Кавендишской лаборатории (с 1919). Открыл (1899) альфа- и бета-лучи и установил их природу. Создал (1903, совместно с Ф. Содди) теорию радиоактивности. Предложил (1911) планетарную модель атома. Осуществил (1919) первую искусственную ядерную реакцию. Предсказал (1921) существование нейтрона. Нобелевская премия (1908).
РЕЗЕРФОРД Эрнст (1871-1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член-корреспондент РАН (1922) и почетный член АН СССР (1925). Директор Кавендишской лаборатории (с 1919). Открыл (1899) альфа- и бета-лучи и установил их природу. Создал (1903, совместно с Ф. Содди) теорию радиоактивности. Предложил (1911) планетарную модель атома. Осуществил (1919) первую искусственную ядерную реакцию. Предсказал (1921) существование нейтрона. Нобелевская премия (1908).Эрнест Резерфорд родился в Новой Зеландии, в простой шотландской семье. Нам известно, что его дед Джордж Резерфорд жил в Шотландии и был колесным мастером. С детских лет Джордж занимался ремонтом кэбов и крестьянских телег. На Британских островах, как и во всей Европе, эта профессия высоко ценилась. Но, видимо, заработки были все-таки недостаточны, и Джордж решился на рискованный шаг – вместе с семьей отправиться в поисках счастья на далекие, таинственные острова Новой Зеландии.
Уже в раннем детстве Эрнест с особым интересом, свойственным далеко не всем детям, наблюдал за полевыми работами и обработкой льна, которыми занимался его отец. Эрнест мог бы стать хорошим фермером и механиком. Но оказалось, что его ум и способности пригодны для других занятий.
Начальную школу он окончил с рекордным количеством баллов: 580 из 600 возможных. Это позволило Эрнесту получить премию 50 фунтов стерлингов для продолжения образования. Это была немалая сумма.
Следующий этап обучения – колледж в Нельсоне, куда Эрнест был принят в пятый класс. Учителя обратили внимание на его исключительные способности к математике. В школьном дневнике появилась запись: «Очень быстро соображающий и многообещающий математик, легко завоевавший первенство». Но математиком Резерфорд не стал.
Добавим, что Резерфорд в этот период проявлял большой интерес к устройству различных машин и механизмов. Подобно юному Ньютону, он любил разбирать часы; правда, ему не всегда удавалось их вновь собрать и привести в действие. Отец часто брал его с собой на строительство водяных мельниц, которым он как механик руководил, и одаренный юноша с увлечением строил модели этих сооружений.
В Кентерберийском университете Резерфорд участвовал в научных и общественно-политических студенческих дискуссиях – не только по вопросам физики, химии, механики, но также литературы, искусства, древнегреческой мифологии и даже алхимии. В 1891 году в университете образовалось студенческое научное общество. На его собраниях обычно выступали студенты с сообщениями на самые различные темы, после чего происходили дискуссии.
На первом же заседании Резерфорд – тогда студент второго курса – выступил с докладом «Эволюция элементов». Название доклада показалось участникам странным, как, впрочем, и его суть. Резерфорд высказал предположение, что все химические элементы представляют собой сложные системы, состоящие из одних и тех же элементарных частиц. К этому предположению Резерфорд пришел совершенно самостоятельно. В то время атом считался неделимым – в физике господствовала теория Дальтона о неделимости атомов. Гипотеза Проута, согласно которой атомы всех элементов состоят из атомов водорода, к тому времени считалась опровергнутой и потому не включалась в курс обучения. Радиоактивность же – явление, которое могло вызвать сомнение в правильности теории Дальтона о неделимости атомов, – была открыта лишь через пять лет.
Утверждения Резерфорда показались большинству участников собрания лишенными здравого смысла. Некоторые студенты даже выразили свою полную уверенность в абсурдности такого утверждения, правда, никто из этих самоуверенных молодых людей не стал впоследствии известным ученым в области естествознания.
Резерфорд с отличием окончил университет, и тут перед ним возникла серьезная проблема: что делать дальше?
Он становится преподавателем средней школы (хайскул) в Крайстчерче.
Знакомя класс с новыми открытиями по магнетизму и электричеству, Резерфорд так увлекался, что подчас забывал о недостаточной подготовке своих учеников и учениц. В классе возникал страшный шум и беспорядок. Молодой учитель чаще всего не замечал этого. Если же он все-таки обращал внимание на происходящее вокруг, он выставлял из класса самого шумного ученика и требовал, чтобы тот принес журнал, куда он впишет ему единицу за поведение. Но ученики быстро научились злоупотреблять добротой и забывчивостью Резерфорда. Они поняли, что как только учитель вновь обратится к теме урока, можно будет свободно вернуться в класс без журнала и избежать наказания.
Трудно сказать, как сложилась бы дальнейшая жизнь Резерфорда, если бы не одно событие, происшедшее через несколько месяцев после начала его учительской карьеры. Как-то он копал картошку в огороде. Это занятие было прервано приходом матери, сообщившей радостную весть: ему присуждена «стипендия 1851 года».
Услышав о стипендии, Резерфорд бросил лопату и, рассмеявшись, воскликнул: «Это последняя картошка, которую я выкапываю».
Стипендия присуждалась самым талантливым выпускникам провинциальных английских университетов. Она была учреждена в 1851 году из части доходов Всемирной выставки в Лондоне, размещенной в построенном для нее Хрустальном дворце (впоследствии уничтоженном пожаром). Стипендия представляла значительную по тем временам сумму и позволяла стипендиату проходить стажировку в течение 2...3 лет в одном или нескольких лучших университетах метрополии.
Провинциальный юноша с университетским дипломом приехал по железной дороге из Лондона в Кембридж и отыскал здание Кевендишской лаборатории на улице Фрискул лэйн (где она находится и ныне). Резерфорд не был уверен, что директор этой знаменитой лаборатории прославленный ученый Джозеф Томсон согласится взять его к себе. Однако опасения рассеяла первая же встреча с Томсоном, который поразил молодого человека своей сердечностью, учтивостью и ученостью. Томсон очень внимательно выслушал Резерфорда и сказал, что ему нужны молодые сотрудники, особенно теперь, когда он приступает к серии новых экспериментов. Он планировал «мощное наступление» на малоисследованные проблемы. К ним Томсон относил, например, электрические разряды в газах, люминесценцию, рентгеновские лучи, только что открытые Конрадом Вильгельмом Рентгеном в провинциальном Вюрцбургском университете.
Почти одновременно с Резерфордом Томсон принял в Кевендишскую лабораторию Джона Мак-Леннана, Таунсенда и Поля Ланжевена – будущего учителя Фредерика Жолио-Кюри.
Забегая вперед, скажем, что Резерфорд долго работал в одной комнате с Ланжевеном и они стали друзьями на всю жизнь.
Резерфорд рассказал Томсону о своих опытах с электромагнитными волнами, проведенных в Кентерберийском университете, и о построенном им приемнике, который он показывал Брэггу. Томсон предложил продолжить эти опыты. Резерфорд тотчас же приступил к экспериментам по распространению электромагнитных волн, используя свой приемник и другую изготовленную им самим, как это было принято в Кевендишской лаборатории, аппаратуру. В 1896 году Резерфорду удалось установить радиосвязь на расстоянии около 3 километров. Это было невиданно. Томсон остался вполне доволен своим практикантом.
Впоследствии Томсон говорил, что профессор Резерфорд никогда не получал похвалы, которую он мог бы получить за свои работы по радиотелеграфии, выполненные в 1895 году в Кембридже. «Его успехи были так велики, что я с тех пор почувствовал себя виновным в том, что убедил его посвятить себя новой области физики, возникшей после открытия рентгеновских лучей».
Резерфорд начал исследования рентгеновских лучей с проверки своего предположения о связи между рентгеновскими и беккерелиевыми лучами. Эта мысль пришла в голову Резерфорду по очень простой причине: и те и другие «лучи» производили ионизацию воздуха.
Целый год работы показал, что сходства между рентгеновскими и беккерелиевыми лучами не существует. Резерфорд опроверг предположение Беккереля о том, что «урановое излучение» обнаруживает свойства света: на самом деле оно не подчинялось законам световой оптики.
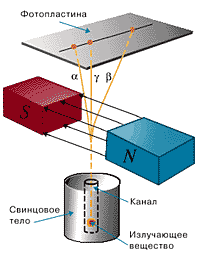
Но наиболее важным результатом Резерфорда было открытие альфа-частиц в составе излучения, испускаемого ураном. Резерфорд поместил урановый источник в сильное магнитное поле и разделил излучение на три различных его вида. Иными словами, он открыл тогда состав радиоактивности: альфа- и бета-частицы и гамма-излучение – то, что сегодня знает каждый школьник.
Получив альфа-частицы, Резерфорд тотчас же сделал гениальное заключение, что именно они представляют собой мощный инструмент для проникновения в глубь атома. Как подтвердилось позднее, это было абсолютно правильно. В последующих работах Резерфорд широко использовал альфа-частицы в качестве снарядов, проникающих в сердце атома – атомное ядро.
Открытие альфа-частиц триумфально завершает трехлетний период работы Резерфорда в Кевендишской лаборатории под руководством Джозефа Томсона.
Выполненные в это время молодым ученым экспериментальные исследования радиоактивности урана и тория принесли ему довольно широкую известность в научных кругах Европы и Америки. В 1898 году он получил приглашение занять должность профессора Мак-Гиллского университета в Монреале – тогда лучшем высшем учебном заведении Канады.
В рекомендации, отправленной Дж. Томсоном по почте в Монреаль, было сказано: «У меня никогда не было молодого ученого с таким энтузиазмом и способностями к оригинальным исследованиям, как г-н Резерфорд, и я уверен, что, если он будет избран, он создаст выдающуюся школу физики в Монреале... Я считал бы счастливым то учреждение, которое закрепило бы за собой Резерфорда в качестве профессора физики».
Приехав в Канаду, Резерфорд сразу же приступил к исследованиям радиоактивности, начатым в Англии. Интуитивно он был убежден в их исключительной важности.
Резерфорд открыл эманацию тория и доказал, что этот радиоактивный газ, выделяющийся из тория, представляет собой химический элемент, отличающийся от самого тория. Позднее он определил атомный вес эманации и показал, что она представляет собой благородный газ нулевой группы периодической системы Менделеева. Статья Резерфорда об эманации тория была напечатана в Англии в феврале 1900 года. В том же году он уехал в отпуск в Новую Зеландию.
Итак, работы с торием позволили Резерфорду и Содди первыми объяснить механизм радиоактивного распада.
Радиоактивный процесс нерегулируемый, ничто не может влиять на его ход. Содди писал в начале века: «...все могучие средства современной лаборатории – крайние пределы тепла, холода, давлений, энергичные химические реактивы, действие могучих взрывчатых веществ и самые сильные электрические разряды – не оказывают влияния на радиоактивность радия или на скорость его распада даже в самой ничтожной степени. Он черпает свои запасы энергии из неизвестного до наших дней источника и подчиняется еще не открытым законам. Есть что-то возвышенное в его отчужденности от окружающей среды и в его индифферентности к ней. Он как будто ведет свою родословную от миров, лежащих вне нас, питаемый тем же неугасимым огнем, движимый тем же лежащим вне нашего контроля механизмом, который поддерживает свет солнца в небесах в бесконечные периоды».
После эманации тория Резерфорд открыл эманацию радия. Ученому было ясно, что радий, испуская альфа-частицы, превращается в новое активное вещество, подобное эманации тория. Открытие эманации радия – радона, который Резерфорд с помощью компрессора «ожижил», доказав этим, что радон – газ, окончательно подтверждало его теорию радиоактивного распада.
Резерфорд своими работами создал Мак-Гпллскому университету известность во всем мире; провинциальное учебное заведение превратилось в крупнейший в то время мировой центр изучения радиоактивности. Однако самому Резерфорду казалось, что здесь его работы продвигаются недостаточно быстро отчасти из-за того, что круг его сотрудников сравнительно узок. Ему хотелось привлечь к своим исследованиям одаренных молодых ученых, окончивших лучшие европейские университеты: Кембриджский, Геттингенский, Сорбонну и другие. В те времена Канада казалась европейцам очень далекой страной. Трудно было уговорить молодого ученого отправиться туда для многолетней работы. Резерфорда не удовлетворяло такое положение. Еще в 1901 году он писал в Кембридж Дж. Томсону:
В 1907 году Резерфорд с женой и шестилетней дочерью Эйлин-Мери переезжает из Канады в Англию. К этому времени он уже был не только членом Лондонского Королевского общества, но и лауреатом медали Румфорда, присуждаемой за выдающиеся научные заслуги.
В Манчестерской лаборатории Резерфорд приступил к широким опытам по исследованию альфа-частиц методом подсчета их с помощью сцинтилляционного счетчика. Опыты начались в 1908 году после того, как Венская академия наук прислала 400 миллиграммов радия (через 20 лет Кембриджский университет заплатил за этот радий 3000 фунтов стерлингов). В этих утомительных и долгих опытах Резерфорду помогал Гейгер.
Нобелевская премия была вручена Резерфорду 10 декабря. В тот же вечер в зале Стокгольмской городской ратуши состоялся банкет, на который было приглашено 800 гостей; здесь присутствовала и королевская семья. Отвечая на приветствия, Резерфорд шутливо сказал: «Я имел дело со многими разнообразными превращениями с разными периодами, но самым быстрым из всех оказалось мое собственное превращение в один момент из физика в химика».
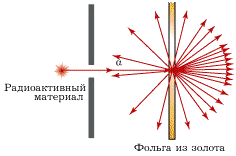
Теперь Резерфорд вместе с Гейгером и Марсденом приступил к задуманной им новой серии экспериментов. Результаты произвели переворот в физике. Это была наиболее драматическая глава в науке нашего времени. Резерфорд открыл атомное ядро и тем самым основал новую исключительно важную науку – ядерную физику.
Что это были за эксперименты? Резерфорд и Гейгер на первых порах продолжили наблюдение сцинтилляций, вызываемых альфа-частицами при ударе о люминесцентный экран из сернистого цинка. Прежде всего опыты привели Резерфорда к заключению, что каждая вспышка (сцинтилляция) вызывается одной альфа-частицей. Таким образом оправдалось предположение, выдвинутое им в книге «Радиоактивные вещества и их излучение», изданной еще во время пребывания его в Канаде. Резерфорд писал тогда, что наблюдение сцинтилляций на экране из сернистого цинка представляет собой очень удобный способ счета частиц, если каждая частица вызывает вспышку. Следовательно, если каждая вспышка вызвана одной альфа-частицей, то перед физиками открывается возможность наблюдать за поведением отдельных атомов.
Резерфорд и Гейгер визуально подсчитали, что в продолжение секунды из излучателя в одну тысячную грамма радия вылетает 130 тысяч альфа-частиц. Точность подсчета была безукоризненна. Оба ученых, к которым присоединился позднее Марсден, по многу часов проводили в затемненной лаборатории за утомительным счетом сцинтилляций. Гейгер рассказывал, что ему одному пришлось подсчитать в общей сложности миллион альфа-частиц.
Открытие атомного ядра явилось важнейшим, принципиально новым моментом, меняющим прежние представления о строении атома. На этой основе родилась наука, значение которой теперь всем известно.
Остановимся на некоторых подробностях. Вот как Резерфорд представлял себе атом. Атом в нормальном, неионизованном состоянии нейтрален, так как в целом он содержит столько же положительного электричества (заряд ядра), сколько и отрицательного (заряд электронов). Атом имеет z электронов, каждый с зарядом e. Следовательно, ядро атома должно иметь заряд +ze. Атомы элементов должны отличаться друг от друга количеством электронов, или, что то же самое, целым числом z единичных зарядов ядра. Число z, характеризующее химический элемент, было названо атомным номером. Позднее было подмечено, что это число оказалось порядковым номером элемента в периодической системе.
В ядре сосредоточена вся масса атома. Это центральная область системы с трудно представляемым радиусом 10–12...10–13 сантиметра. Электроны же очень легкие частицы, масса которых в 1836 раз меньше массы протона – ядра атома водорода с наименьшим атомным номером z = 1. Заряд протона равен заряду электрона, но имеет противоположный знак.
За водородом в периодической системе расположен благородный газ гелий. Заряд ядра гелия в 2 раза больше заряда протона z = 2. Заряд и масса ядра возрастают вместе с атомным номером элемента. Например, элемент уран с атомным номером 92 имеет ядро с электрическим зарядом в 92 раза большим, чем заряд ядра водорода – протона. Атомный вес урана близок к 238.
Модель Резерфорда довольно хорошо объясняла структуру сложной системы атома. Но в ней имелись серьезные противоречия, которые Резерфорд хотя и хорошо понимал, объяснить не мог. Тогда ведь еще не было квантовой механики. Без нее многие противоречия не могли быть разрешены. Кроме того, не был открыт нейтрон, оказавшийся важным связующим звеном для объяснения структуры атома и происходящих в нем процессов.

