Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
ВЫСШИЕ УРОВНИ ОРГАНИЗАЦИИ ХРОМТИНА И РЕГУЛЯЦИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ГЕНОМА
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
Наблюдения за живыми клетками в процессе индукции тепловым шоком показали, что наиболее часто происходит образование новых кластеров по сонседству с трансгеном или увеличение размеров предсуществующих соседних кластеров, однако в некоторых случаях происходило также и перемещение трансгенов по направлению к кластеру, причем это перемещение иногда осущенствлялось на довольно значительные расстояния. При этом низкая частота нанблюдавшихся перемещений трансгена по направлению к кластеру ИХГ может быть следствием фотоингибирования (Chuang et al, 2006). Действительно, в тех
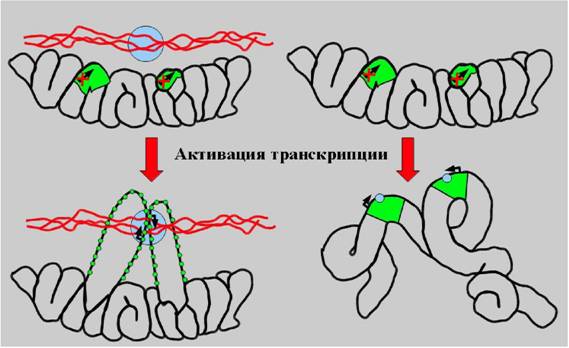
Рис. 10. Модель структурных преобразований высших уровней компактизации хроматина при активации транскрипции. Слева Ч классическая схема, постулирующая полную деконденсацию транскрибирующегося локуса (зеленый) и его взаимодействие с транскрипционными комплексами (синий), фиксированными на ядерном матриксе, справа Ч модель активации транскрипции в контексте высших уровней организации хроматина.
23
случаях, когда мы наблюдали такое перемещение, оно происходило в самом нанчале периода наблюдений, т.е. до достижения ингибирующего порога. Харакнтерно, что локусы, меченые GFP, оставались на поверхности и не погружались в глубину кластера.
Экспериментальная модель, использованная в данных экспериментах, дала возможность проанализировать локальную динамику транскрибирующихнся локусов. Мы использовали прижизненные наблюдения для визуализации пондвижности индивидуальных GFP-позитивных точек, принадлежащих к одному хромосомному субрегиону, относительно друг друга. Была обнаружена сходная быстрая, но ограниченная подвижность трансгенов в секундной временной шкале. Поскольку множественные точки, соответствующие колинеарно интенгрированным копиям ВАС, двигались друг относительно друга, в то же время сохраняя свою колинеарность, очевидно, что наблюдаемая подвижность не явнляется следствием перемещения всего хромосомного субрегиона или целого ядерного субдомена, а отражает локальную подвижность или конформационные изменения хромосомных доменов размером в несколько сотен тпн относительно фланкирующих цис-последовательностей. Поскольку практически все копии трансгена демонстрируют транскрипционную активность и GFP-позитивные точки в составе DHFR ВАС трансгенного локуса колокализуются или контактинруют с сайтами расположения транскриптов, а ген DHFR транскрибируется полностью за 10 мин, наши наблюдения не соответствует предсказаниям моденлям, согласно которым транскрипция происходит на статичном ядерном матрик-се или на транскрипционных фабриках, заякореных на ригидном ядерном скенлете. По-видимому, транскрипционная машин ер ия совершает подобные движения вместе с транскрибирующимся хроматином, и любые локальные взаимодействия с неподвижными ядерными структрами являются весьма динамичными, если вообще такие взаимодействия и такие статичные структуры существуют в живой клетке (рис.10).
В целом, полученные данные демонстрируют тесную связь между декон-денсацией высших уровней организации хроматина эухроматических районов хромосом и актвацией транскрипции с базального до активированного уровня. Деконденсация, однако, не является абсолютно необходимой для транскрипции, тогда как транскрипция сама по себе, или по крайней мере компоненты транснкрипционной машинерии, могут быть необходимыми факторами деконденса-ции. Таким образом, функциональная роль высших уровне организации хромантина может состоять в обеспечении тонкой настройки системы транскрипции посредством контроля крупномасштабной деконденсации хроматиновых локунсов и/или ассоциации с ядерными субдоменами (такими, как кластеры ИХГ).
24
3.5. Высшие уровни упаковки хроматина, выявляемые в ходе естественной компактизации хромосом в митозе.
Ядра клеток, находящихся в фазе G2, демонстрируют практически равнонмерное распределение хроматина в объеме ядра с элементами фибриллярных структур с размерами, находящимися за пределами разрешающей способности светового микроскопа. Просвечивающая электронная микроскопия ядер в G2-фазе выявляет эти фибриллярные элементы (хромонемы) более четко. Толщина хромонем в этих ядрах составляет около 80 нм. Реконструкция по серийным ультратонким срезам толщиной 30-40 нм показывает, что эти обособленные финбриллярные элементы могут быть прослежены на протяжение 0.5-1 мкм. Ананлиз проекций нескольких ультратонких срезов общей толщиной около 0.5 мкм выявил многочисленные участки, в которых хромонемные фибриллы неплотно упакованы в линейные структуры толщиной 0.2-0.4 мкм или более крупные агрегаты.
Первые видимые признаки конденсации состоят в индивидуализации и пространственном разобщении этих локальных агрегатов хроматина. При этом становятся более четко видны индивидуальные хроматиды, визуализуемые как линейные структуры. Характерным признаком ранней стадии профазной коннденсации является общий коллапс хроматина по направлению к ядерной перинферии и появление значительных зон внутри ядра, свободных от хроматина. Дальнейшая компактизация приводит к формированию легко различимых компактных хромосом, в составе которых еще можно различить хромонемные элементы толщиной около 80 нм (рис. 11). Однако в целом упаковка хроматина остается гетерогенной, и индивидуальные хромосомы, а также разделенные сенстринские хроматиды, невозможно проследить на большом расстоянии.
Клетки в ранней профазе составляют 10 и 35% через 7 и 13 часов после выхода из блока на границе G1/S, тогда как число клеток с типичной интерфазной структурой хроматина снижается с 85% до 50%.
Переход от ранней к средней профазе соответствует формированию четко различимых хромосом, которые можно проследить как индивидуальные линейнные структуры с равномерной упаковкой а протяжение нескольких мкм (рис.11). На стадии средней профазы хромосомы тесно контактируют с ядерной оболочкой. Толщина хромосом на этой стадии составляет 0.4-0.5 мкм, что несколько меньше чем у более рыхло упакованных хромосом в ранней профазе. Во многих районах хромосом на светооптическом уровне можно различить сенстринские хроматиды, однако выявление сестринских хроматид на ультратоннких срезах более затруднительно. Ультраструктурный анализ также выявил в составе конденсирующихся хромосом фибриллы хроматина толщиной около 100 нм, особенно на трехмерных реконструкциях протяженных серий (67 срензов по 80 нм каждый), где можно наблюдать сегменты таких фибрилл в обланстях с относительно более низкой степени компактизации.
25
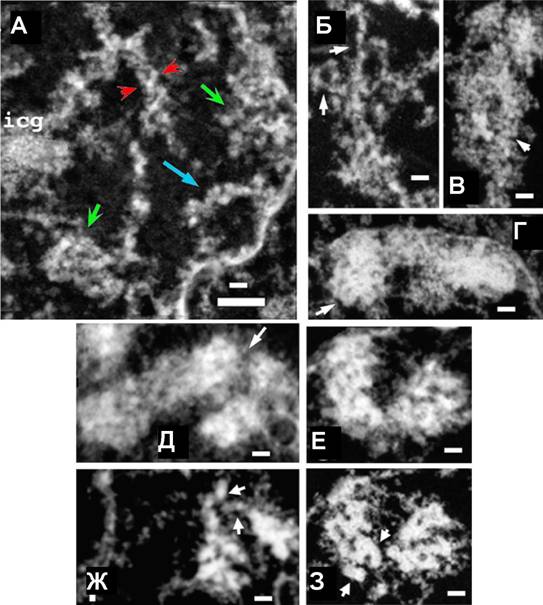
Рис 11. Хромонемные элементы выявляются на всех этапах профазной компактизации. (А) Фаза G2. Компьютерная проекция 5 ультратонких срезов толщиной 35 нм (общая толщина 175 нм. Стрелки указывают на крупные домены конденсированного хроматина, маленькие стрелки Ч на распрямленные хромонемные фибриллы. В некоторых случаях в составе структурных элементов толщиной 200 нм видны рыхло уложенные хромонемы (стрелки). (Б-Г) Ранняя профаза. Формирующиеся хроматиды состоят из хромонемных элементов (стрелки). (Д-3) Средняя профаза. Компьютерная проекция 11 срезов толщиной 80 нм каждый (Д) и индивидуальный срез (Е) показывают отдельные хромонемные элементы (стрелки). На проекции трех ультратонких срезов (Ж) и отдельном срезе (3) видны упакованные 100-130 нм хромонемы в составе 200-250 нм хроматиды. Масштаб: 0.5 мкм (длинный) и 0.2 мкм (короткий отрезок).
26
Поздняя профаза характеризуется увеличением диаметра хромосом примерно вдвое (до 0.8-1 мкм). Сестринские хроматиды на этой стадии все еще находятся в плотном контакте, однако их удается различить, когда хроматиды лежат в плоскости среза. Плечи хроматид однородны по толщине, поперечные сечения хромосом также выглядят равномерно конденсированными, однако на периферии хромосом, а также на тангентальных срезах, четко выявляются элементы высших уровней упаковки толщиной 100-130 нм. Средний диаметр хроматиды составляет 0.4 мкм, что примерно в два раза меньше, чем в метафазе (0.6-0.8 мкм), тогда как в средней профазе толщина хроматид составляет примерно 0.2-0.3 мкм.
Описанные выше ранние этапы конденсации хромосом хорошо соответнствуют модели иерархической упаковки хромосомы, согласно которой хромати-новые фибриллы толщиной 30 нм укладываются в фибриллярные структуры высшего порядка. Последние, в свою очередь, компактизуются с образованием митотических хромосом.
Таким образом, в профазе митоза наблюдается 3 процесса: (1) формированние хромонем; (2) частичная сегрегация сестринских хроматид и (3) укорочение и утолщение хромосом (описываемые как компактизация или конденсация). При этом образование метафазной хромосомы сопровождается формированием как минимум двух помежуточных уровней компактизации: 200-250 нм и 400 нм фибриллы.
Вопрос о молекулярном механизме конденсации остается открытым. Отнсутствие высокой степени упорядоченности в структурной организации хронмосом на ранних стадиях компактизации неизбежно требует, чтобы в основе процесса компактизации лежали несимметричные молекулярные механизмы, возможно, обеспечиваемые участием негистоновых белков. По данным литерантуры, наиболее вероятными кандидатами на роль архитектурных компонентов являются мажорные негистоновые белки хромосом: конденсины и топоизомера-за П. В то же время, следует учитывать и важнейшую регуляторную роль двухнвалентных катионов (в частности, ионов Са++), влияние которых на структур хроматина in vitro детально документирована, хотя механизмы их действия in vivo остаются невыясненными.
3.6.аа Роль ионов Са в стабилизации высших уровней компактинзации ДНК.
Нами была разработана экспериментальная модель, позволяющая контронлировать реконструкцию хромосом in vivo при помощи физиологических коннцентраций ионов Са. В основе данной модели лежит предположение, что обранботка живых клеток низкими концентрациями глутарового альдегида (0.001%) приводит к тому, что клетки теряют способность к восстановлению нормальной концентрации Са, сниженной в результате гипотонического воздействия. Понскольку вхождение Са в клетку регулируется трансметилированием фосфати-
27
|
дилэтаноламина в цитоплаз-
матическом листке плазматин
ческой мембраны (Godeau et
al., 1985), модификация фос-
фатидилэтаноламина глюта-
ральдегидом предотвращает
этот процесс и сопровождаюн
щую его активацию быстрых
Са-каналов. Анализ реакции
хромосом на гипотоническое
воздействие в условиях модин
фикации мембран, а также хан
рактер структурных перен
строек,аа индуцированных
восстановлением физиологин
ческих концентраций Са++
при помощи селективных
ионофороваа (например
А23187), таким образом, мон
жет дать информацию о роли
внутриклеточного Са в стабин
лизации их структуры.
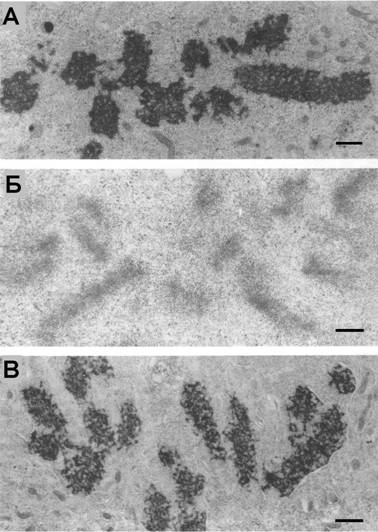
Рис. 12. Ультраструктура митотических хромосом в живых клетках СПЭВ после гипотонического воздействия. (А) контроль, (Б) 5 мин, (В) 30 мин. Масштаб: 0.5 мкм |
Через 5 мин после начанла инкубации клеток в гипо-тоничной среде (30% раствонра Хэнкса) хромосомы на све-тооптическом уровне выгляндят сильно деконденсирован-ными, но по мере адаптации клеток наблюдается рекон-денсация хромосом и через 20-30 мин после начала воз-
действия хромосомы выглядят достаточно плотными и мало отличаются по морфологии от контроля. Однако гипотоническое воздействие оказывает дезорнганизующее влияние на митотический аппарат в целом, что выражается в разнрушении микротрубочек веретена деления. Вследствие этого наблюдается раснпад метафазной пластинки и случайное распределение хромосом по клетке. Перенос адаптированных к гипотоническим условиям клеток в нормальную среду культивирования приводит к их резкому сжатию. Таким образом, гипото-ничная среда после адаптации становится для клеток нормотоничной, а норнмальная среда культивирования Ч гипертоничной.
28
 На ультраструктурном
На ультраструктурном
уровне, деконденсация
хромосом выражается в
практически полному
разворачиванию всех
высших уровней компак-
тизации ДНК. Хромосон
мы представлены только
рыхло упакованными фин
бриллами толщиной 10
нм. В процессе адаптации
к гипотоническому шоку
общая плотность упаковн
ки хроматиновых фин
брилл в митотических
хромосомах возрастает,
что сопровождается
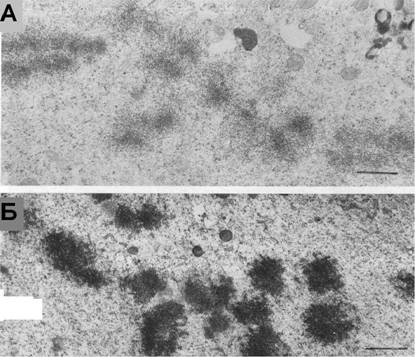
Рис. 13. |
В присутствии 0.001% глуарового альдегида реконденсация хромосома блокируется ы хроматина а через 20 (А).а Приа добавленииа Са-ионофора А23187 зо мин после начала ги происходит быстрое восстановление компактной структуры хромосом (Б). |
укладкой нуклеосомных фибрилл в 30-нм фибрил-
потонического шока нан
блюдается восстановле-
--------------------------------------------------------------------- ание фибрилл высшего пон
рядка Ч хромонем диаметром около 100 нм (рис.12).
Модификация клеточной мембраны глутаральдегидом не изменяет пернвичную реакцию клеток на гипотонический шок. В первые 5 мин воздействия клетки сильно набухают, а митотические хромосомы деконденсируются и знанчительно теряют свою плотность. Главные различия между контрольными и обнработанными глютаровым альдегидом клетками наблюдаются на стадии адапнтации. Через 15-30 мин гипотонического воздействия восстановления структунры хромосом в последних не происходит, и хромосомы остаются деконденси-рованными. Однако перенос клеток, обработанных глутаровым альдегидом, в нормотоническую среду приводит к их быстрому сжатию, что говорит об акнтивной адаптации клеточной мембраны к гипотонии и нормальном функционинровании систем транспорта ионов в целом.
Восстановление структуры хромосом в клетках, обработанных глутаронвым альдегидом, можно стимулировать обработкой кальциевым ионофором А23187. При добавлении ионофора в концентрации 1 мкМ через 15-20 мин понсле начала действия гипотонического шока происходит быстрая реконденсация хромосом и восстановление структуры хромонемных элементов, что указывает на возможную роль ионов Са в формировании и поддержании структуры выснших уровней организации хромосом in vivo. Отсюда также следует, что гипото-
29
ническое воздействие на живые клетки должно приводить к изменениям внунтриклеточной концентрации Са, и эти изменения должны коррелировать с изнменениями структурного состояния хромосом. Измерения внутриклеточной концентрации Са++ при помощи красителя Fura-2 показало, что снижение осмолярности среды сопровождается резким падением концентрации свободнонго Са, однако затем по мере адаптации уровень Са возвращается на исходный уровень в течение 5-10 мин. В присутствие глютарового альдегида подобного восстановления не наблюдалось, и пониженная концентрация Са сохранялась в течение по крайней мере 20 мин. Добавление ионофора А23187 приводило к резкому повышению концентрации Са до уровня, превышающего исходный, что коррелирует с быстрой реконденсацией хромосом.
Можно предложить по крайней мере два объяснения тому факту, что в живых клетках физиологических концентраций Са достаточно для поддержанния хроматина в конденсированном состоянии. Во-первых, в живых клетках эффект Са может быть опосредован специфическими Са-связывающими струкнтурными белками хроматина, которые непрочно связаны с хроматином и легко экстрагируются в процессе выделения хромосом и ядер. Во-вторых, действие Са может быть основано на его участии в регуляции энзиматических систем, например, протеинкиназ, фосфорилирующих гистоны. Однако, вне зависимости от того, каков механизм действия Са, важным является то, что высшие уровни организации хроматина, образующиеся в результате действия ионофора А23187, полостью соответствуют структурным элементам хроматина, наблюданемым in situ. Это свидетельствует в пользу адекватности используемых условий для стабилизации хроматина in vitro и правомерности экстраполяции данных ультраструктурного анализа изолированных хромосом и ядер на нативную органнизацию хроматина in vivo.
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА