Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
ВЫСШИЕ УРОВНИ ОРГАНИЗАЦИИ ХРОМТИНА И РЕГУЛЯЦИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ГЕНОМА
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
Прижизненные наблюдения проводились в проточной камере FCS2 (Bioptechs, США) на автоматизарованном инвертированном микроскопе Axiovert 100М (Zeiss, Германия) под контролем программы ISee (Innovision) (Carpenter et al, 2004).
8
3. РЕЗУЛЬТАТЫ.
3.1.аа Структурныеаа мотивыаа высшегоаа порядк ваа организации факультативного гетерохроматина
|
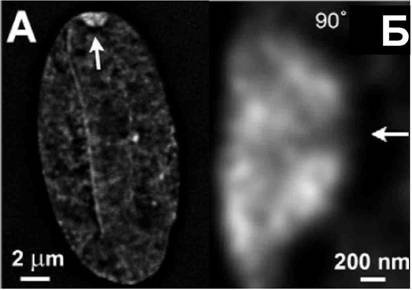
Рис. 1: Оптический срез живой клетки, экспрессирующей гистон H2B-GFP, после деконволюции. В составе тельца Барра выявляются субструктуры размеров 200-400 нм. |
Неактивная Х-хромосома (Xi), являющаюся классическим примером фан
культативного гетерохроматина, в интерфазном ядре представлена в виде
гетеропикнического тельца Барра. В первичных человеческих фибробластах
WI-38 (XX) доля клеток с тельцами Барра, детектируемого как единственная
компактная ядерная структура, ярко окрашиваемая красителем ДАЛИ или антин
телами против p-3mK27. Доля клеток с четко выявляемым тельцем Барра
была максимальной в конфлюэнтной культуре через 10 дней после пересева и
достигала 85% (95% при применении алгоритмов деконволюции). Размеры Xi в
таких клетках составляли 2.7 мкм2 против 3.4 мкм2 в клетках, находившихся в
логрифмической фазе роста. Для оптимизации протоколов пробоподготовки для
иммуноэлектронной микроскопии с целью максимальной сохранности натив-
ной структуры Xi и получения удовлетворитель-ного контраста хроматина,
хроматин в клетках WI-38 метили при помощи экспрессии GFP-pB и сравнин
вали конформацию Xi in
vivo и после пермеабили-
зации и фиксации клеток
в различных условиях.
Флуоресцентная микрон
скопия высокого
разрешения с примененин
ем деконволюции
показала, что в живых
клетках тельце Барра имен
ет фибриллярную
структуру с толщиной
фибрилл от 200 до 400
нм. Сравнительный анан
лиз показал,аа что
наибольшей сохранности
этих структурных элеменн
тов можно достичь при
пермеабилизации в буфе-
ре А с дополнительной
фото стабилизацией с использованием в качестве сенсибилизатора бромистого
этидия. Ультраструктурный анализ клеток, фиксированных 2% глутаральдеги-
дом, и клеток, пермеабилизованных после фото стабилизации, показал наличие
в ядрах четко различимых компактных хроматиновых доменов, по размерам,
структуре и содержанию p-3mK27 соответствующих тельцам Барра (рис.2).
9
Анализ серийных срезов показал, что факультативный гетерохроматин Xi не является сплошной массой хроматина, а представляет собой аггломерат плотнноа упакованныха хроматиновыхаа фибрилла высшегоаа порядка,аа отличающихся
|
существенно большим диаметром в сравнении с фибриллами хромантина в других районах ядра. В составе Xi вынявлялись
пространственно обонсобленные
хроматиновые фирил-лы толщиной от 30 до 400 нм, с 50-400 нм промежутками между ними (рис.2).
Прямое сравнение
организации факультан
тивногоаа и
конститутивного хрон
матина мы провели на
модели эмбриональных
фибробластов мыши
(МЭФ XX). которые
содержат крупные легн
ко идентифицируемые
хромоцентры, образон
ванные слиянием
прицентромерного хрон
матина нескольких
хромосом. Тельца Барн
ра в МЭФ
идентифицировали по
иммуноокрашиванию
p-3mK27. Анализ
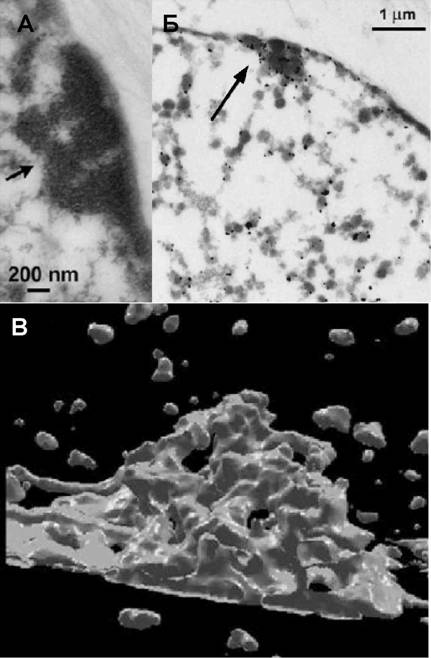
Рис. 2. А) Ультраструктура тельца Барра после полных серий ультра-
фотостабилизации и пермеабилизации в тонких срезов ядер
полиаминовом буфере. Б) Идентификация Xiпоказал, что
(стрелка) при помощи иммуноэлектронной ультраструктура телец
микроскопии с антителами против НЗ-ЗтК27, В) Барра в МЭФ очень по-
Компъютерная модель тельца Барра, построенная хожа на таковую
на основе серийных ультратонких срезов. клеток человека. В них
выявлялись относи-
10
тельно рыхло упакованные гетерохроматиновые фибриллярные домены, что резко отличало Xi от хромоцентров, обладающих более плотной и гомогенной текстурой. Мы не выявили видимых хроматиновых субструктур высшего понрядка в составе хромоцентров, что можно объяснить либо чрезвычайно высокой плотностью упаковки хроматина в них, либо уникальными особенностями их организации, обусловленными низкой сложностью содержащийся в них ДНК и отсутствием необходимых cis-элементов, участвующих в организации хроматинна на высших уровнях компактизации.
Для более детального анализа пространственной организации хроматина в составе Xi, была проведена реконструкция нескольких телец Барра по серийнным ультратонким срезам толщиной 40 нм. Оказалось, что наиболее часто встречающийся структурный мотив в тельцах Барра представляет собой сегменнты фибрилл толщиной около 200 нм. Такие фибриллы примерно в 2 раза больше по толщине, чем типичные для окружающего хроматина хромонемы диаметром около 100 нм. Эти элементы высших уровней организации хроматинна в Xi упакованы достаточно рыхло, в результате чего между ними образуются свободные от хроматина пространства размером до 400 нм, которые сообщаютнся с районами ядерных пор и окружающей нуклеоплазмой. На компьютерных ЗБ-моделях тельца Барра, созданных при помощи сегментации интерполиронванных серий ультратонких срезов по электронной плотности, пористая структура Xi и формирующие ее фибриллы хроматина высшего порядка проявнляются наиболее отчетливо (рис.2).
При помощи флуоресцентной ЗО-микроскопии с использованием антител против нуклеопоринов, а также на сериях ультратонких срезов было обнаруженно, что во всех исследованных клетках Xi контактирует с ядерной оболочкой. В тех случаях, когда Xi занимал центральное положение в ядре (6 случаев из 23), этот контакт осуществлялся через глубокие инвагинации ядерной оболочки или тонкие хроматиновые фибриллы, вытягивавшиеся из компактной хромосомной территории Xi. По-видимому, подобная связь с оболочкой характерна для любонго типа гетерохроматина, поскольку аналогичное расположение было выявлено и для всех хромоцентров фибробластах мыши, исследованных при помощи электронномикроскопического ЗО-анализа.
Таким образом, полученные нами данные выявляют неоднородность в структуре хроматина и свидетельствуют о существенных локальных отличиях в компактизации хроматинового материала Xi. При этом именно формирование хроматиновых фибрилл высшего порядка в процессе образования факультативнного гетерохроматина может являться одним из механизмов инактивации генов в Х-хромосоме.
11
3.2.аа Динамика структурной организации хроматина в процессе репликации.
Для специфического мечения сайтов репликации и пострепликативной организации хроматина с сохранением максимальной нативности хроматина мы использовали два экспериментальных подхода. Сайты, где происходит синтез ДНК мы визуализовли при помощи экспрессии в клетках культуры тканей хинмерного белка EGFP-PCNA. Для анализа взаимного расположения и динамики новореплицированного хроматина относительно репликативных фокусов мы использовали мечение ДНК EdU, что позволило нам сохранить интактную структуру хроматина и таким образом существенно повысить разрешение ми-кроскокпического анализа. После импульсного мечения EdU (5 мин) клетки отнмывали свежей средой и фиксировали немедленно или инкубировали в среде, содержащей 1 мМ тимидина в течение 20, 30 или 120 мин. При импульсном ме-чении наблюдалась полная колокализация сайтов включения EdU и PCNA-no-зитивных фокусов, которые представляли округлые или эллипсовидные струкнтуры размером 0.2-0.3 мкм. В ряде случаев близко расположенные индивидунальные репликативные фокусы сливались в более крупные агрегаты. При этом репликативные фокусы представляют собой сегменты фибриллярных хромати-новых структур высшего порядка и чаще всего полностью совпадают с ними по диаметру. Важно отметить, что интенсивность флуоресценции ДАЛИ непосреднственно в местах расположения репликативных фокусов оказывалась несколько ниже, чем в соседних хроматиновых доменах с теми же линейными параметранми, что мы интерпретировали как результат частичной деконденсацией хромантина в реплицирующихся сегментах хромонемы.
Одновременно с удалением реплицированного хроматина от сайтов ренпликации во многих случаях наблюдаются изменения в структурной организанции реплицированных локусов. Через 20 мин после мечения он принимает бонлее вытянутую конфигурацию. Иногда можно наблюдать достаточно протяженнные сегменты фибрилл высшего порядка, гомогенно меченые по всей длине. Можно предположить, что наблюдаемые в экспериментах с отложенной меткой изменения конфигурации меченых сайтов отражают пост-репликативную перенстройку высших уровней организации хроматина.
Увеличение интервала между введением метки и фиксацией вплоть до 2 часов сопровождается дальнейшей сегрегацией и снижением коэффициента ко-локализации между GFP-PCNA и EdU, меченым А1еха-594. В этих случаях финбриллярная структура реплицированных сегментов хроматина становится еще более выраженной (рис.3).
Для исследования динамики высших уровней компактизации хроматина в процессе репликации на ультраструктурном уровне были использованы мо-ноклональные антитела против EGFP и вторичные антитела, ковалентно связаннных с 1.4 нм наночастицами золота. Для увеличения контраста с целью адекватнной визуализации высших уровней организации хроматина, иммуномечение, а
12
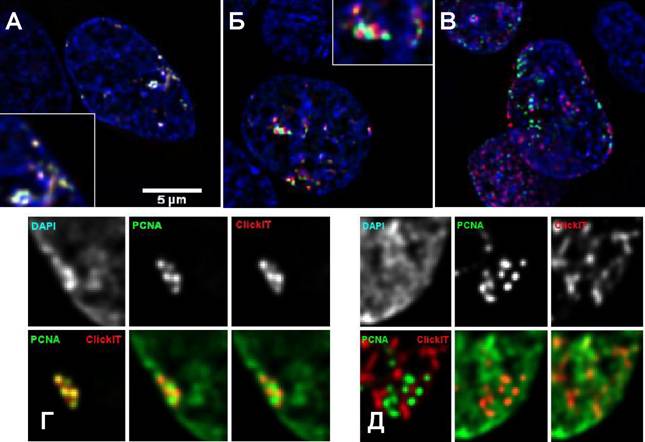
Рис.3. Колокализация новосинтезированной ДНК (красный) и PCNA-позитивных репликативных фокусов (зеленый) в поздней S-фазе (А) при импульсном (5 мин) мечении EdU. Через 20 мин (Б) и 2 часа (И) после мечения наблюдается сегрегация новосинтезированной ДНК и сайтов репликации. ДАПИ (синий). (Г-Д) Пост-реплкативная реорганизация хроматина. (Г) При импульсном мечении локусы новореплицированного хроматина имеют компактную округлую форму, а через 2 часа после репликации реорганизуются в сегменты фибриллярных структур высшего порядка (Д).
также Ag-амплификация сигнала проводились перед заключением препаратов в смолу. В этих условиях репликативные сайты часто представляют собой меченные сегменты хроматиновых фибрилл высшего порядка диаметром около 200 нм. Хроматин в их составе обладает меньшей электронной плотностью по сравнению с окружающими немечеными (нереплицирующимися) доменами, что может быть связано с частичной локальной деконденсацией реплицируюнщегося хроматина, однако тотального разворачивания хроматиновых доменов высшего порядка и появления протяженных нуклеосомных фибрилл в зоне ренпликации не наблюдается. При этом метка располагается преимущественно на поверхности этих доменов, что может быть связано как с расположением ДНК-полимераз на периферии конденсированного хроматина (Jaunin et al, 2000), так и с ограниченной диффузией антител в области плотной упаковки ДНК. Чтобы
13
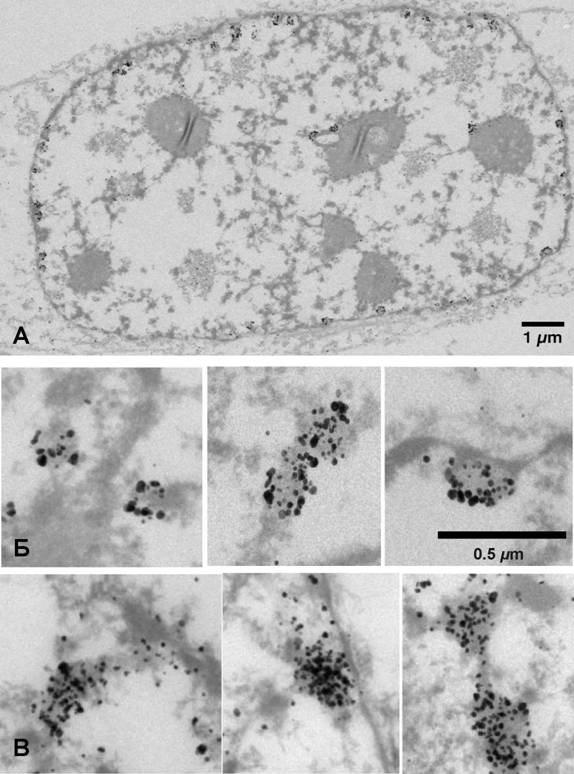
Рис.4. Иммуноокрашивание репликативных сайтов в ядре клетки СНО, экспрессирующей EGFP-PCNA. (А-Б) При окрашивании фиксированных клеток метка располагается преимущественно на периферии репликацтивных сайтов. (В) При микроинъекции антител, меченых 1.4-ни частицами золота PCNA-GFP выявляется во всем объеме реплицирующихся хроматиновых доменов.
14
исключить влияние высокой степени конденсации хроматина на проникновение антител, был использован разработанный нами метод in-vivo иммуномечения, основанный на микроинъекции анти-GFP-Nanogold. На ультратонких срезах инъецированных клеток, находящихся в поздней S-фазе (как зафиксированных непосредственно 2.5% глутаральдегидом на буфере Зеренсена, так и предваринтельно пермеабилизованных в конденсирующем буфере) наблюдается интеннсивное мечение дискретных ядерных доменов размером 200-350 нм, располаганющихся на ядерной периферии или вокруг ядрышка. Важно отметить, что при in-vivo мечении частицы серебра распределялись практически равномерно в объеме меченого домена. Мы не наблюдали компактных агрегатов PCNA, окрунженных немеченным хроматином. Это отчетливо видно как на ультратонких срезах, так и на стереоизображениях срезов толщиной 600 нм, включающих ценлые репликативные фокусы. Таким образом, наши наблюдения не укладываютнся в рамки модели репликативных фабрик - белковых комплексов, содержанщих множество ДНК-полимераз, и окруженных хроматином, протягивающимся через фиксированные ДНК-полимеразы в ходе репликации.
3.3. Особенности структурной организации рано- и поздно-реплицирующихся доменов хроматина в составе митотиче-ских хромосом.
Для исследования структуры высших уровней организации митотиче-ских хромосом мы использовали разработанный нами метод повторяющегося гипотонического шока живых клеток с целью индукции деконденсации хронмосом. Гипотоническое воздействие на митотические клетки выявляет поперечнную дифференцированность хромосом (Howell, Hsu, 1979), а последующий вознврат в нормотонические условия позволяет клеткам адаптироваться и возобнонвить движение по клеточному циклу. Повторный краткий гипотонический шок, воздействующий на клетки, достигшие митоза, выявляет в митотических хронмосомах продольную неоднородность, соответствующую классическим G-бэн-дам. Короткие сроки инкубации в гипотонических растворах оказались пермиссивными и при возврате в нормотоническую среду через час после начанла гипотонического шока клетки успешно адаптировались и возобновляли двинжение по клеточному циклу. Митотическая активность восстанавливалась через 3 часа, хотя митотический индекс снижался до 40% от контроля. Также через 30 мин востанавливался синтез ДНК в клетках, находившихся в S-фазе в монмент гипотонического шока. Более того, по данным прижизненных наблюдений за клетками, эксперссирующими GFP-PCNA, репликация возобновлялась в тех же репликативных сайтах, которые были сформированы до начала гипотониченского воздействия. Анализ динамики клеточного цикла, проведенный при понмощи экспериментов с отложенной меткой, показал, что продолжительность S-
15
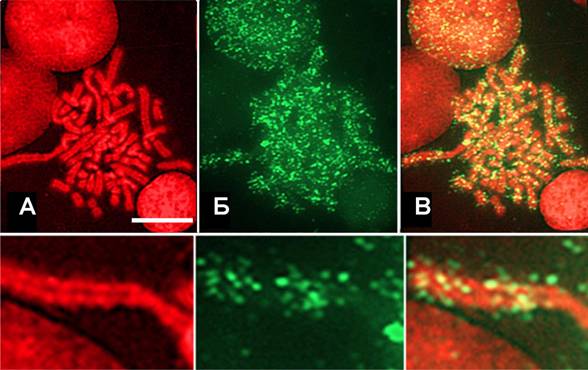
Рис. 5. Репликативные сайты, соответствующие рано реплицирующимся доменам хроматина локализуются преимущественно на периферии хромосом, полученных после двойной гипотонической обработки,. (А) ДНК окрашена бромистым этидием (красный), (Б) места включения БрдУ (зеленый), (В) наложение. Масштаб: 10 мкм.
фазы значительно не изменялась после гипотонического воздействия, однако наблюдалась существенное (примерно на 4 часа) удлинение 02-фазы.
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА