 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Молекулярная биология и физиология запрограммированной смерти дрожжей
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
CFP перемещается в ядро через несколько часов после индукции экспрессии (Рис. 14 а), и это перемещение совпадает с началом ЮЗС-зависимой задержкой роста (данные не приводятся) и накоплением клеток с деградированной ДНК (Рис. 13в). Несмотря на то, что 103Q-CFP не расщепляется в дрожжах (М. Шерман, личное сообщение), его перемещения в ядро не происходит в мутанте с делетированной YCA1 - дрожжевой метакаспазой (Рис. 14 б,в).
15Q103Qа Б
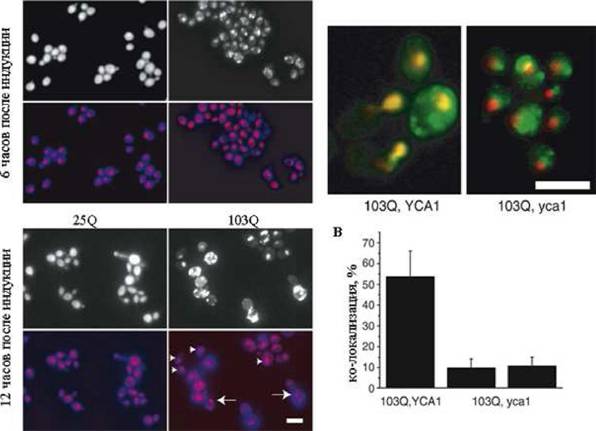
Рис 14. А, Локализация 25Q-CFP и 103Q-CFP в клетках. Черно-белым показан CFP, цветные панели - наложение CFP (синий) и ДНК (красный). Короткие стрелки показывают клетки, в которых CFP практически полностью ко-локализуется с ДНК. Длинная стрелка указывает на клетку с фрагментированным ядром. Б, деления YCA1 предотвращает ко-локализацию 103Q-CFP (зеленый) и ДНК (красный). В, количественный обсчет эффекта (как степени совпадения двух цветовых сигналов), представленного в панели Б. Масштаб - 10 мкМ.
Таким образом, дрожжи являются моделью не только для изучения механизма агрегации, но и для исследования ее пато-физиологических последствий. В дальнейшем мы исходили из следующей гипотезы: если 103Q-CFP инициирует каскад клеточной смерти, то с помощью случайной инактивации генов можно снизить его токсичность. Если это так, то определив инактивированный ген, можно предложить белок-мишень для лечения заболевания. Исходя из этой логики, мы предприняли генетический скрининг, методическиа похожийа на таковыеа по устойчивочтиа ка феромонуа иа амиодарону.а Мы
26
обнаружили, что делеция ASE1 снижает токсичность экспрессии 103Q-CFP (Рис. 15). Asel стабилизирует веретено деления, а также является субстратом поздней формы циклосомы, APC-Cdhl. Циклосома - белковый комплекс, он присоединяет убиквитиновую цепочку к своим субстратам и таким образом направляет их для протеосомальной деградации. В основном этими субстратами являются циклины, ключевые регуляторы клеточного цикла. Мы предположили, что агрегаты 103Q-CFP могут блокировать протеасому, и в этом случае накопление ее циклосомальных субстратов (например, Asel) может определять токсичность 103Q-CFP. Для проверки этого предположения мы нокаутировали несколько циклинов и обнаружили, что делеция CLB2, как и гипер-экспрессия активатора циклосомы Cdhl, полностью устраняла токсичность экспрессии 103Q-CFP (Рис. 15). Интересно, что делеция YCA1 также частично снижала токсичность 103Q-CFP (Рис. 15). Можно предположить, что этот эффект связан с измененной локализацией агрегатов в мутанте (Рис. 14б,в).
Д.
60
СО
о
О I I
Дикийа 103Q тип
Iаа 1
103Qа 103О 103О CDp 103Qа 103Q
УС*1 oselа с1Ь2 CDpаа ус*1
CDp
Рис. 15. Делеции YCA1, ASE1, CLB2, а также гипер-экспрессия Cdhl, снижают токсичность экспрессии 103Q. Показаны выраженные в процентах отношения средних размеров колоний в условиях индукции 103Q-CFP (среда с галактозой, т. к экспрессия 103Q-CFP индуцируется этим сахаром) к таковым в отсутствии экспрессии (среда без галактозы). Это отношения для контрольного штамма превышает 100% - возможно, так как суммарная концентрация углеводов в галактозо-содержащей среде превышает таковую в среде без индуктора экспрессии 103Q-CFP. Все ЮЗС-СРР-экспрессирующие штаммы демонстрируют статистически-достоверное отличие от исходного (2-й столбец), р<0,05.
27
Важно отметить, что при нейродегенеративных заболеваниях, связанных с агрегацией белка (не только болезнь Хантингтона, но и Паркинсона и Альцгеймера) наблюдаются нарушения клеточного цикла в нейронах (см. ссылки в Биохимия, 2009, 74, 231-234). Исходя из вышеизложенного, можно заключить, что накопление субстратов циклосомы -важная составляющая патогенеза ряда нейродегенеративных заболеваний. С целью нахождения потенциальных белков-мишеней для терапии таких заболеваний мы проанализировали литературные данные по субстратам поздней циклосомы в нейронах. Оказалось, что протеолиз ключевого регулятора гликолиза, фосфофруктокиназы 2 (Ффк-2), катализируется APC-Cdhl. В результате гликолиз подавляется, и биоэнергетика нейронов основывается на дыхании. Искусственное подавление APC-Cdhl в культуральных нейронах приводит к переходу на гликолиз и окислительному стрессу (Nature cell biology 2009, JJ_, 747-752). С другой стороны, известно, что при упомянутых выше заболеваниях в нейронах активируют гликолиз, подавляется дыхание и развивается окислительный стресс. Таким образом, ингибирование Ффк-2 кажется перспективной стратегией для борьбы с агрегат-зависимыми нейродегенеративными заболеваниями. В настоящее время мы проводим поиск низкомолекулярных ингибиторов этого фермента.
28
Заключение
В наших исследованиях мы прежде всего показали, что не только обычные стрессы, но и безвредный для других организмов пептид-феромон вызывает смерть дрожжевой клетки, которая сопровождается маркерами апоптоза. При дальнейшем изучении этой модели выяснилось, что важным промежуточным этапом каскада клеточной смерти является повышение концентрации кальция в цитоплазме, которое вызывает ряд изменений в митохондриях. Оказалось, что, несмотря на существенные различия между митохондриями дрожжей и животных, митохондриальные этапы каскадов клеточной смерти во многом совпадают: повышение потенциала на внешней мембране митохондрий вызывает генерацию АФК, которая в свою очередь приводит к фрагментации митохондриального ретикулума. Мы показали, что в дрожжах этот каскад можно прервать как минимум двумя способами. Во-первых, инактивация генов YSP1 и YSP2 не влияет на образование АФК, но предотвращает фрагментацию митохондрий и смерть клеток. Во-вторых, вещества-разобщители предотвращают гиперполяризацию митохондрий и таким образом снижают смертность в исследуемой модели. В дальнейшем мы использовали дрожжи как модель для изучения новых разобщителей. Было показано, что проникающие катионы класса SkQ обладают мягким и митохондриально-направленным протонофорным эффектом, что делает их перспективными для разработки медицинских препаратов на их основе.
Мы также изучали другие модели клеточной смерти дрожжей. Наши экспериментальные данные подтвердили предположение о роли АФК при повреждениях ДНК. При относительно небольших повреждениях клетки генерируют АФК для быстрой мобилизации защитных систем, а при более серьезных повреждениях АФК способствуют клеточной смерти. Исследование модели смерти от белковых агрегатов указывает, что причина их токсичности в перегрузке протеасомы. Важно, что наиболее опасным для клетки последствием этой перегрузки является накопление субстратов циклосомы. Основываясь на этом выводе и на литературных данных, мы предложили новый белок-мишень для лечения нейродегенеративных заболеваний.
29
Выводы
1. Половой феромон способен вызывать физиологическое самоубийство дрожжей.
Количества феромонов, которые вырабатывают дрожжи при спаривании, достаточно для
индукции смертельного каскада.
- Промежуточным этапом этого каскада является повышение кальция в цитозоле, что вызывает гиперполяризацию митохондрий, приводя к генерации активных форм кислорода (АФК). АФК индуцируют фрагментацию митохондрий, которая приводит к смерти клетки.
- Смертельный каскад можно прервать либо на уровне фрагментации митохондрий с помощью делеции генов YSP1 и YSP2, либо на уровне гиперполяризации митохондрий с помощью разобщителей.
- Проникающие липофильные катионы класса SkQ обладают протонофорным эффектом. Этот эффект специфичен для митохондрий. Чем более поляризованной является митохондрия, тем выше разобщающий эффект таких катионов.
- Активные формы кислорода являются защитным фактором при слабом генотоксическом стрессе и повреждающим при относительно сильном стрессе.
- Причина токсичности белковых агрегатов в дрожжевой модели болезни Хантингтона - нарушение клеточного цикла, вызванное накоплением субстратов циклосомы. Ингибирование активности субстратов циклосомы - перспективная стратегия для терапии агрегат-зависимой дегенерации нейронов.
30
Основные публикации
- Kuznetsov, S.A., Rivera, D.T., Severin, F.F., Weiss, D.G., Langford, G.M. Movement of axoplasmic organelles on actin filaments from skeletal muscle. // Cell Motil Cytoskeleton - 1994 -V.28, P.231-242.
- Sorger, P.K., Severin, F.F., Hyman, A.A. Factors required for the binding of reassembled yeast kinetochores to microtubules in vitro. // J Cell Biol - 1994 - V.127, P. 995-1008.
- Severin, F.F., Schuyler, S., Kaplan, K.B., Sorger, P.K., Hyman, A.A.
Interaction of yeast kinetochores with microtubules. // Molecular Biology of the Cell - 1996 -V.7, P. 3289-3289.
4. Blocker, A., Severin, F.F., Habermann, A., Hyman, A.A., Griffiths, G., Burkhardt, J.K.
Microtubule-associated protein-dependent binding of phagosomes to microtubules. //
J Biol Chem-1996- V.271, P.3803-3811.
- Nadezhdina, E.S., Bukharova, T.B., Koretsky, V.V., Potekhina, E.S., Severin, F.F., Shanina, N.A., Solovyanova, O.B., Zinovkina, L.A. Identification of new molecular components of microtubules and centrosomes. // Cell Biol bit - 1997 - V21, P.885-887.
- Blocker, A, Severin, F.F., Burkhardt, J.K., Bingham, J.B., Yu, H., Olivo, J,C.,. Schroer, T.A., Hyman, A. A., Griffiths, G. Molecular requirements for bi-directional movement of phagosomes along microtubules.// J Cell Biol - 1997 - V137, P.113-129.
- Severin, F.F., Sorger, P.K., Hyman, A.A., Kinetochores distinguish GTP from GDP forms of the microtubule lattice. //Nature - 1997 - V.388, P.888-891.
8. Severin, F.F., Shanina, N.A., Shevchenko, A,. Solovyanova, O.B., Koretsky, V.V.,
Nadezhdina, E.S. A major 170 kDa protein associated with bovine adrenal medulla
microtubules: a member of the centrosomin family? // FEBS Lett - 1997 - V.420, P. 125-128.
9. Blocker, A, Griffiths, G, Olivo, J.C., Hyman, A.A, Severin, F.F.
A role for microtubule dynamics in phagosome movement. // J Cell Sci - 1998 - V.lll, P.303-312.
- Muller-Reichert, Т., Chretien, D., Severin, F.F., Hyman, A.A. Structural changes at microtubule ends accompanying GTP hydrolysis: information from a slowly hydrolyzable analogue of GTP, guanylyl (alpha,beta)methylenediphosphonate. // Proc Natl Acad Sci U S A -1998-V.95, P.3661-3666.
- Severin, F.F., Kaplan, K.B., Sorger, PK., Hyman, A.A. In vitro assays for studying Saccharomyces cerevisiae kinetochore activity. // Methods Cell Biol - 1999 - V.61, P. 145-153.
- Biggins, S, Severin, F.F, Bhalla, N., Hyman, A.A., Murray, A.W. Studies on sister chromatid separation and segregation in budding yeast. // Faseb Journal - 1999 - V13, P. A1583-A1583.
31
- Biggins, S., Severin, F.F., Bhalla, N., Hyman, A.A., Murraw, A.W. The conserved protein kinase Ipll regulates kinetochore binding to microtubules in budding yeast. // Genes and Development - 1999 - V13, P.532-544.
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА