Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Молекулярная биология и физиология запрограммированной смерти дрожжей
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
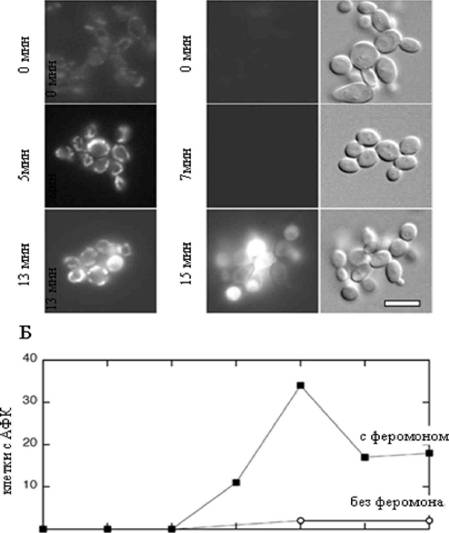
Таким образом, посредством поднятия [Са ] в цитозоле амиодарон активирует дыхание и сопряжение митохондрий. Отражается ли это на уровне мембранного потенциала? Для ответа на этот вопрос мы использовали митотрекер Orange. Этот краситель накапливается в митохондриях в зависимости от величины ?? ? на их внутренней мембране. Как показано на рис. 4 (а), в контрольных клетках окрашивание митохондрий заметно только при увеличенном контрасте микрофотографии. В то же время амиодарон в широком спектре концентраций вызывал заметное увеличение интенсивности окраски (Рис. 46). Важно отметить, что амиодарону требовалось около 5 минут чтобы вызвать такое
12
A
контроль
Ayspl
|
|
феромон
феромон
|
-1Я7 |
г".ва |
||
, |
3D |
амиодарон, мкМ Г с АФКа мертвые |
0^ юнграст^а О
 в
в
Г', 1 СП О |
||||||
< |
-1-А-Н1Й? |
Ч А-йда
Рис. 4. Эффекты феромона и амиодарона на Л? митохондрий опосредованы подъемом [Са]. Для полу-количестве иного определения ?? использовали митотрэкер Orange. А, 01 мг/мл альфа-фактор. Б, цифры под фотографиями указывают концентрацию амиодарона. В, Г, кальциевый ионофор А-23187 вызывает подъем ??, генерацию АФК (В, Г) и смерть клеток (Г). Масштаб - 10 мкМ.
увеличение, в то время как альфа-фактор вызывал подобный эффект (Рис. 4а) не менее чем через 30 минут (данные не приводятся).
13
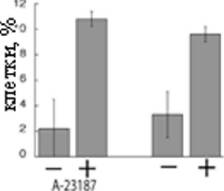
Известно, что аномально высокий ?? митохондрий может вызвать формирование АФК, которые, в свою очередь, являются интермедиатом каскада апоптоза. Чтобы проверить подобное развитие событий в нашей системе мы протестировали кинетику формирования АФК после добавки амиодарона. Аналогично альфа-фактору, амиодарон вызывал резкий подъем скорости окисления pDCF-DA, при этом эффект амиодарона был значительно быстрее эффекта альфа-фактора (Рис. 5а,б). Как и ожидалось, подъем ?? несколько опережал подъем уровня АФК (Рис. 5а). Более того, тот факт, что антиоксиданты (N-ацетилцистеин и альфа-токоферол) в несколько раз повышали выживание после обработки амиодароном, указывает на функциональную роль АФК в каскаде смерти. Достаточен ли вызванный амиодароном подъем [Са ] в цитозоле для инициации клеточной смерти? Как показано на Рис. 4в,г, кальциевый ионофор А23187 также вызывал накопление АФК и клеточную смерть, но эффект амиодарона был сильнее (Рис. 2ж) Возможно, различие вызвано тем, что амиодарон вызывал значительно более быстрый подъем [Саа ] (данные не приводятся).
Чтобы изучить роль ?? на внутренней мембране митохондрий в каскаде клеточной смерти, мы предотвратили его подъем добавкой FCCP. Как и ожидалось, подъем ?? и АФК были заингибированы. Что существенно, FCCP повышал в несколько раз выживание клеток (Рис. 2в). Следовательно, подъем ?? - не побочный эффект, а необходимый этап развития каскада. Как оказалось, 0,4 мкМ FCCP было достаточно для этих влияний. Более высокий (6 мкМ) FCCP оказывал негативное влияние на выживание (Рис. 2в), и этот негативный эффект не является специфичным для FCCP, поскольку другой разобщитель (SF6847) в относительно большой концентрации также снижал выживание (данные не приводятся).
Тот факт, что малые концентрации разобщителя снижают АФК, указывает на то, что они образуются в Q-цикле. Чтобы это проверить, мы использовали ингибиторы двух стадий Q-цикла. Оказалось, что миксотиазол снижал образование АФК, а антимицин, наоборот, усиливал их генерацию (Рис. 2в). Эти факты полностью соответствуют предположению о Q-цикле (Рис. 2в). Наконец, антиоксиданты N-ацетилцистеин и альфа-токоферол усиливали выживание (Рис. 2в), подтверждая функциональную роль АФК в каскаде смерти.
Фрагментация митохондриальных филаментов часто сопровождает апоптоз клеток животных. Мы также замечали, что в моделях феромон- и амиодарон-зависимой смерти клетки также фрагментируют митохондрии (Рис. 4а,б). Ответом на вопрос, является ли эта фрагментация этапом каскада или побочным явлением, послужил предпринятый нами генетический скрининг. С помощью случайной инактивации генов мы искали
14
|
аа митотрэюера АФКаа фаза |
Оа 30 60аа 90 120аа 150а 180
время (мин)
Рис. 5. Кинетика роста ?? и уровня АФКпод действием алъфа-фактора и амиодарона. А, ?? и АФК после добавки 80 мкМ амиодарона. Б, накопление АФК-содержащих клеток после добавки 0,1 мг/мл альфа-фактора. АФК детектировалисьаа с помощью 50 мкМ p-DCF-DA Масштаб - 10
МКМ.
делеционных мутантов, устойчивых к губительному действию альфа-фактора. Для этой мы мутировали дрожжи делеционной библиотекой (лаб. М. Снайдера). Потом мутированные клетки обрабатывались высокой дозой альфа-фактора, а после культура высевалась на твердую среду и выжившие мутанты вырастали в колонии. Кроме специфических мутантов по программе смерти, в первичном скрининге мы получали клетки с полностью инактивированным ответом на феромон (стерильные клетки, как мутант ste20), а также клетки с потерянной респираторной функцией митохондрий (петиты). Чтобы исключить последние две категории мы протестировали полученных
15
A
|
li
Yipl-GFP
митотрэир
??????????
АФК
Ayipl, 30 мин йсусЗ. 30 чип + FCCPQ,4MitM 30 ыин дга;13!ттш, 30 ня дакийтип, 2D мни. |


Б днхнн пш, бсздебмм |
ДНККЙТНП. + пмнодерои |
|
Юн |
\ |
#1а * |
ш * |
1 |
*. * а , iаа .1 |
Г '.-. ж |
| |
V-v^ |
^в |
у |
Ayspl, + ?М№>Д4рОН |
дикий тип,
+ амнод&роц MAC
uyspl, 20 мни.
20 млн
+ FCCP0r4MxM
20 мин
-:
дикий тип, ЗОмин
дикий пш, |J мин
К |
дихнн пш.
Ошш
ID' ТО1
флуоресценция
дао;ни тип, 0 мин. Ю" W W"??*
флуорг{цлнцня
Рис. 6. окализация и функция Yspl. А, ко-локализация Yspl-GFP и митотрэкера Orange. Масштаб - 10 мкм. Вверху показана рассчитанная структура Yspl, содержит плекстриновый домен и два транс-мембранных домена. Б, Ysp 1 необходим для фрагментации митохондрий после обработки амиодароном. Изображения получали путем объединения 20 оптических срезов через клетку. Масштаб - 10 мкм. В, Определение ?? и АФК в клетках методом FACS. Амиодарон (80 мкМ) был добавлен в момент времени 0 мин.
мутантов на способность спариваться и на способность роста на несбраживаемом источнике углерода.
В результате мы нашли один ген, YHR155W, делеция которого не снижала концентрацию альфа-фактора, необходимую для индукции шму, и не препятствовала росту на глицерине (данные не показаны). Ген кодирует предположительно трансмембранный белок без выраженных гомологии с генами высших организмов и содержащий плекстриновый домен. Мы назвали белок Yspl (от yeast suicidal protein). С помощью микроскопии клеток, экспрессирующих Yspl слитый с зеленым флуоресцентным белком (GFP-Yspl) мы обнаружили, что конструкция ко-локализуется с митотракером (Рис. 6а), то есть с митохондриями. Как и ожидалось, инактивация YSP1 снижала смертность как в модели
16
феромон-зависимой смерти (данные не приводятся), так и при обработке амиодароном (Рис. 2в)
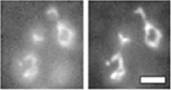
Как показано на рис. 66, амиодарон вызывает полную фрагментацию митохондриальных филаментов, а делеция YSP1 существенно снижает этот эффект. В то же время эта мутация не снизила подъем ?? (Рис. 4а и 6в) и АФК (Рис. 6в), подтверждая, что амиодарон-зависимая генерация АФК как таковая не является летальной, но служит сигнальным этапом каскада смерти.
Поскольку амиодароновая модель клеточной смерти является схожей и одновременно более быстрой и эффективной по сравнению с феромон-зависимой системой, мы предприняли попытку скрининга генов, ответственных за амиодарон-зависимую смерть. Как и в случае с альфа-фактором был произведен случайный мутагенез клеток делеционной библиотекой, после чего мутанты тестировали на устойчивость к амиодарону. Мы ожидали, что устойчивость может возникать как от инактивации непосредственной программы смерти, так и от гипер-стабилизации гомеостаза кальция. Чтобы исключить мутантов второго типа, выжившие клетки тестировали на способность накапливать митотрэкер Orange в митохондриях после обработки амиодароном. Иными словами, искали мутантов, похожих по фенотипу на Ayspl.
В результате было обнаружено, что инактивация гена YDR326c приводила к существенному (в 5 раз) увеличению выживания после обработки амиодароном (Рис. 76), и при этом не предотвращала генерацию АФК (Рис. 7 а). Как и в случае с YSP1, делеция YDR326C существенно ингибировала амиодарон-зависимую фрагментацию митохондрий (Рис. 7в). Поскольку ген YDR326c к тому моменту был неохарактеризован, мы назвали его YSP2 (по аналогии с YSP1). Подобно YSP1, YSP2 не имеет выраженных гомологии среди генов высших организмов и предположительно кодирует продукт с транснмембранным доменом.
Интересно, что в этом скрининге мы также выделили мутантов с делецией YSP1 (данные не приводятся), что еще раз указывает на сходство феромонового и амиодаронового каскадов смерти. Суммируя данные по этим двум каскадам, можно их объединить в одной схеме (Рис. 8). Схема предполагает, что феромон гипер-активирует МАР-киназный путь (этапы 2-4), что приводит к повышению концентрации кальция, достаточному для инициации митохондриальных изменений (этапы 5-9), приводящих в итоге к клеточной смерти.
17

контраа ?????а unmalаа Дугр2
Рис. 7. окализация и функция Ysp2. А, в контроле после добавки амиодарона АФК окрашивают всю клетку, а в Aysp2 АФК - в структурах, морфологически похожих на митохондрии. Б, деления YSP2 повышает устойчивость и предотвращает фрагментацию митохондрий (В) после обработки амиодароном. Г, Снижение рН в среде вызывает образование АФК только в присутствии ацетата. Как и в панели А, заметна У8Р2-зависимое различие в локализации АФК. Г, делеция YSP2 повышает устойчивость к ацетату, рН=3. Масштаб - 5 мкм.
Используется ли рассмотренный выше каскад в других сценариях физиологического самоубийства дрожжей? Классическая экспериментальная система для изучения смерти дрожжей - хронологическое старение, т. е. старение в стационарной культуре. Этот вид смерти можно считать активным. Действительно, дрожжи, помещенные в воду, не теряют жизнеспособности в течении года, а дрожжи в стандартной питательной среде (YPD) умирают через 2-3 недели после достижения стационарной плотности. Большой объем публикаций указывает, что основная причина смерти в стационаре - закисление среды из-за накопления уксусной кислоты. Кроме того, известно, что уксусная кислота вызывает появление маркеров апоптоза и смерть дрожжей (см. работы и обзоры Ф. Мадео [Madeo]). Исходя из этих предпосылок, мы протестировали роль белка Ysp2 в ацетат-зависимой смерти дрожжей. Оказалось, что делеция YSP2 не снижает АФК, индуцированные уксусной кислотой (Рис. 7г), и в то же время (как и делеция гомолога про-апоптозной протеазы, гена NMA111) в несколько раз увеличивает выживание (Рис. 7д).
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА