 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Молекулярная биология и физиология запрограммированной смерти дрожжей
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
Исходя из этих предпосылок, мы решили проверить, вызывает ли альфа-фактор запрограммированную смерть дрожжевых клеток. В большинстве сценариев апоптической смерти генерация клетками АФК - это один из основных этапов каскада. Для детекции АФК использовался pDCF-DA, это вещество становится флуоресцентным после окисления АФК. Оказалось, что после 90 мин. инкубации а-клеток с альфа-фактором примерно треть клеток становятся флуоресцентными, в то время как клетки без альфа-фактора и клетки альфа-типа с альфа-фактором не флюоресцируют (Рис. 1а). Следовательно, альфа-фактор может вызывать генерацию АФК клетками а-типа. Мы оттитровали концентрацию альфа фактора и выяснили, что для индукции АФК необходимо примерно в 10 раз более высокая концентрация, чем для формирования шму -морфолгического маркера половой дифференцировки (данные не приводятся). Еще одним признаком апоптоза является деградация ядерной ДНК. Мы протестировали количество ДНК в клетке с помощью проточной флуоцитометрии (FACS). Оказалось, что высокая концентрация альфа-фактора вызывает накопление клеток с меньшим количеством ДНК чем в нормальных клетках в фазе G1 (Рис. 16), что является маркером деградации. С помощью окрашивания витальным красителем Флоксином Б мы также
7
установили, что такая обработка феромоном приводит к смерти примерно 30% клеток (Рис. 1в)
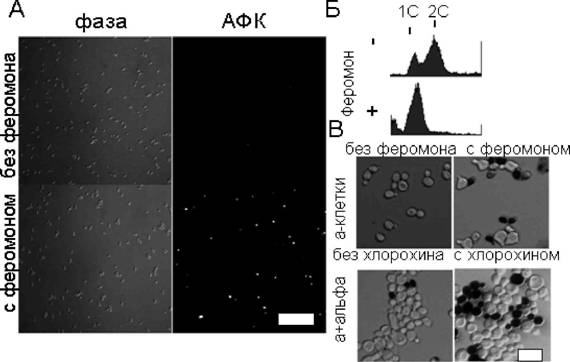
Рис.1. Альфа-фактор вызывает запрограммированную клеточную смерть. Клетки выращивались в жидкой YPD до плотности 10 /мл. Концентрация альфа-фактора - 0,1 мг/мл. А, детекция АФК с помощью красителя pDCF-DA (10 мкМ). Масштаб - 50 мкм Б, Определение содержания ДНК в клетах методом цитофлуориметрии. В, окраска мертвых клеток Флоксином Б (0,4 мг/мл, 5 мин. инкубации с последующим фотографированием). Масштаб - 10 мкм.
Для исследования пути развития этого каскада клеточной смерти мы прежде всего протестировали роль киназы Ste20. Эта киназа активирует ????-киназную часть каскада феромонового ответа. Оказалось, что делеция STE20 предотвращает генерацию АФК и смерть клеток (Табл. 1). Надо отметить, что МАП-киназный каскад играет ключевую роль в апоптозе животных клеток. Таким образом, прослеживается параллель между каскадами клеточной смерти у дрожжей и высших организмов. Активация Ste20 индуцирует экспрессию ряда белков. Чтобы проверить является ли эта индукция необходимой для активации каскада клеточного самоубийства мы проверили эффект ингибирования синтеза белка. Оказалось, что циклогексемид предотвращает генерацию АФК и смерть клеток (Табл. 1). Последующие этапы апоптоза у клеток высших эукариот обычно опосредованы митохондриями. Оказалось, что потеря клетками дрожжей также митохондриальной ДНК полностью ингибирует феромон-зависимую смерть (Табл. 1), и при этом не влияет на образование шму (данные не показаны). Интересно, что клетки без функционального цитохрома ц (делеция гем-лиазы) генерировали АФК но не умирали в ответ на альфа-фактор (Табл. 1).
8
Это показывает, что АФК в данном процессе (как и в апоптозе у животных) выполняют сигнальную функцию, а именно опосредуют выход цитохрома ц из митохондрий. Может ли феромон-зависимая смерть произойти в естественных условиях или является артефактом добавки неестественно большого количества феромона? Для проверки мы смешали клетки противоположных типов спаривания и покрасили смесь Флоксином Б. Примерно 1% клеток оказался Флоксин-содержащим (Рис. 1в). Такой низкий процент показал достаточно малую вероятность смерти при естественном спаривании, и это было вполне ожидаемым результатом. Следующим этапом мы повторили этот опыт в присутствии хлорохина - агента, не влияющего на вегетативный рост (Табл. 1) но ингибирующего последний этап слияния клеток, а именно гидролиз клеточных стенок. Оказалось, что примерно треть клеток в этом случае окрашивалось Флоксином Б (Рис. 1в). Таким образом, локальная концентрация феромонов в агглютинатах клеток при спаривании достаточно высока чтобы активировать каскад смерти, но слияние клеток предотвращает его развитие. Важно отметить, что хлорохин не влиял на смерть клеток а-типа по действием альфа-фактора (Табл. 1).
Таким образом, наши данные указывают, что смерть при спаривании является естественной частью процесса полового размножения дрожжей. Поскольку у дрожжей нет комплекса АПАФ, неожиданной кажется роль цитохрома ц в этом процессе. В настоящее время мы ищем белки, взаимодействующие с цитохромом ц в каскаде дрожжевой смерти.
2. Исследование роли митохондрий в феромон-зависимом каскаде смерти
9
Приведенные выше данные указывают на ключевую роль митохондрий в смерти дрожжей при спаривании. В то же время использованная модель не вполне удобна для детального
 1
1
о 5а 20а во Амиодарон, мкМ
альфа-фактор
 30-
30-
I-
-й ш I-Сг.
? о
Контр, NAC TOKQyspl
??
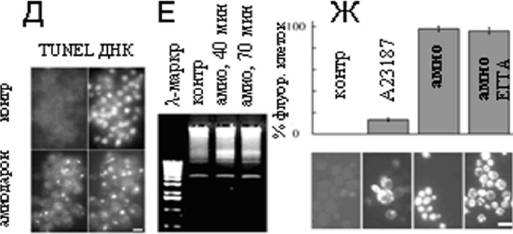
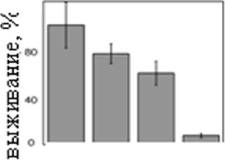
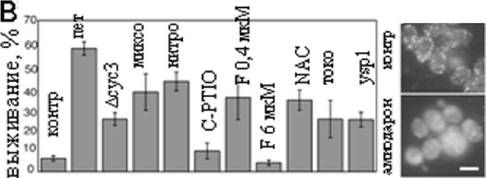
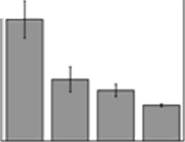
Рис. 2. Маркеры апоптоза и другие общие черты феромон- и амиодарон-заеисимого каскада. А, амиодарон снижает количество колониия-образующих еде ниц в культуре. Б. альфа-фактор в концентрации 0,1 мг/мл обладает схожим с амиодароном эффектом. В, в пробы добавили 80 мкМ амиодарона. Другие добавки: 2 мкМ миксотиазола (миксо), 3 мМ нитропруссид натрия (нитро), 1 мМ фенил-тетраметилимидазол оксид (С-РТЮ), FCCP (F), 30 мМ NAC, 20 мкМ альфа-токоферол (токо). Г, выход цитохрома ц из митохондрий после 30 минут обработки 80 мкМ амиодароном. Клетки фиксировались 4% формальдегидом и окрашивались антителами к цитохрому ц. Фрагментация митохондрий в контроле - артефакт фиксации. Д, Е, детекция фрагментации ДНК послеаа обработкиа амиодарономаа методамиа TUNELаа иа электрофореза.аа Ж,аа амиодарон,аа какаа и
10
кальциевый ионофор, вызывает подъем [Са ] в цитоплазме. Эффект амиодарона сильнее как показывает процент и показательные фотографии Fluo-3/АМ-положительных клеток.
изучения этой роли. Действительно, каскад смерти зависит от синтеза белка de novo, что затрудняет анализ быстрой кинетики митохондриальных изменений. Поэтому мы начали поиск способ активировать каскад феромон-зависимой смерти после (downstream of)
9+
активации синтеза специфических белков. Известно, что подъем [Са ] в цитоплазме является промежуточным этапом ответа на феромон. Более того, по литературным данным даже малые концентрации альфа-фактора токсичны для клеток с мутациями по кальмодулину. Исходя из этого, мы проверили кальциевые ионофоры и амиодарон (фармакологический агент, вызывающий вход кальция в цитоплазму дрожжевой клетки) в качестве индукторов клеточной смерти. Эффект от добавки амиодарона был качественно похож на эффект ионофоров, но развивался быстрее (даннные не приводятся), поэтому большинство экспериментов проводилось с использованием амиодарона. Прежде всего, мы повторили данные лаборатории Корчезне (Courchesne) о токсичности амиодарона (Рис. 2а). Данные, приведенные на Рис. 2 (б,в) показывают практически большое сходство между феромон- и амиодарон-зависимыми смертями. В обоих случаях выживание стимулировалось инактивацией митохондриальной ДНК (Рис. 2в, столбик пет), делецией фермента, ответственного за присоединение гема к цитохрому ц (Рис. 2в, сусЗ), добавкой ингибиторов дыхания (миксотиазол или KCN), добавкой небольших концентраций разобщителя FCCP, антиоксидантов или делецией гена YSP1 (см. далее).
9+
Мутации по Са -кальмодулиновой системе способствовали смерти клеток под действием обоих индукторов. Мы также показали что, подобно феромону, амиодарон вызывает появление маркеров апоптоза в клетках: а именно выход цитохрома ц и фрагментацию ДНК (Рис. 2г,д,е). Мы также подтвердили, что амиодарон вызывает подъем концентрации
9+
Са в цитозоле (Рис. 2ж).
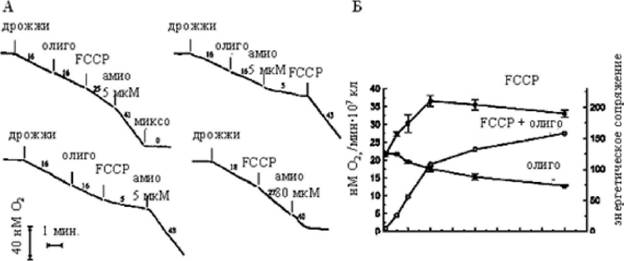
Поскольку дыхательная цепь митохондрий явно вовлечена в амиодарон-зависимую смерть (данные по миксотиазолу и KCN), мы решили проверить эффект амиодарона на дыхание. Оказалось, что дыхание клеток выращенных на сбраживаемом субстрате относительно слабое, не снижается добавкой ингибитора АТФ-синтазы олигомицина и лишь кратковременно стимулируется разобщителем (FCCP, 1 мкМ). Важно отметить, что в животных клетках такие дозы разобщителя существенно стимулируют скорость дыхания - поскольку разность потенциалов противодействует работе дыхательной помпы. Значительно более высокие концентрации FCCP (ЮмкМ) вызывали стабильную стимуляцию дыхания. Добавка низких концентраций амиодарона ингибировала дыхание в присутствииаа олигомицин иаа стимулировал дыханиеаа н фонеаа низкойаа (1 мкМ)
11
концентрации FCCP (Рис. За). Высокие концентрации амиодарона (вызывающие смерть клеток) вызывали временную стимуляцию дыхание с последующим сильным ингибированием (Рис. За,б). Наши данные указывают, что низкие концентрации амиодарона усиливают энергетическое сопряжение и максимальную скорость дыхания. Возможно, эти эффекты опосредованы подъемом концентрации кальция в цитозоле. Что касается энергетического сопряжения, то, в дрожжах отсутствует классическая Са -зависимая транзиторнаяаа пора (типичная для клеток животных, данные лаборатории Р.А.
9+
Звягильской), и при этом подъем [С ] в цитозоле снижает неселетивную прводимость
9+
митохондриальной мембраны (лаб. С. Урибе [Uribe]). Ключевую роль [Са ] подтверждает и тот факт, что амиодарон не действовал на изолированыые митохондрии (данные не приводятся).
 ва ш <баа маа 2Sаа Маа 36аа 44
ва ш <баа маа 2Sаа Маа 36аа 44
амиодарон, ыкЫ
Рис.3 Эффект амиодарона на дыхание клеток дрожжей. 0,6 107 клеток/мл; олигомицин (олиго), 10 мкг/мл; FCCP, 1 мкМ; амиодарон (амио); 7 мкМ миксотиазол (миксо).
9+
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА