Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Молекулярная биология и физиология запрограммированной смерти дрожжей
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
18
|
||
(1) I |
||
рецептор |
амиодарон |
|
(2)аа j |
(1а) |
|
* |
1 |
|
????20 |
подъем [Са] |
|
**-.^ |
в цитоплазме |
|
(3) |
""'-*. |
№)/> |
синтез белка |
||
? |
||
циклогекс |
И МИД |
подъем скорости дыхания и уровня сопряжения
низкий FCCP
МИВДОТНЭЗОЛ
MAC, токо ферол
Дуф 1 = Aysp2 |
Yspl, Увр2-заБиси1яая фрагментация митохондрий
{Щ
падение ??, выход цитохрома ц
у.
(Ю) смерть клетки
Рис. 8. Гипотетическая схема каскадов феромон- и амиодарон-заеисимой смертей. Пояснения -в тексте.
Где пересекаются пути амиодарон- и ацетат-зависимой смертей? Наши данные указывают, что закисление цитоплазмы причиной токсичности ацетата. Известно, что ацетат может уравновешивать рН по разные стороны липидной мембраны пересекая ее в протонированной форме и диссоциируя протон в более щелочном компартменте. Другие способы снижения рН в цитозоле (с помощью пропионата или комбинации НС1-нигерицин) также приводили к АФК- и Узр2-зависимой смерти дрожжей (данные не приводятся). Простейшим объяснением этого факта является то, что при низких значениях рН супероксид, основной АФК производимый в митохондриях, протонируется и становится значительно более реакционно-способным.
Итак, с одной стороны, по литературным данным кальциевый гомеостаз никак не связан с устойчивостью дрожжей к ацетату. С другой стороны, и амиодароновый и ацетатный каскады смерти зависят от АФК и Ysp2. Исходя из этой логики, можно предположить, что эти пути сливаются на уровне АФК (Рис. 8).
3. Мягкое энергетическое разобщение дрожжей
Как следует из предыдущего раздела, мягкое разобщение, т. е. контролируемое снижение уровня мембранного потенциала на внутренней мембране митохондрий, может повысить выживание дрожжей после стресса. Позитивный эффект мягкого разобщения распространяется и на высшие организмы. Поскольку увеличение проводимости внутренней митохондриальной мембраны приводит к холостому сжиганию калорий, оно может служить заменой ограничению по калориям, а также быть полезным при
19
гипотермии. Подобно случаю с дрожжами, мягкое разобщение может снизить уровень АФК в клетках высших эукариот и таким образом противостоять процессам старения и канцерогенеза. Действительно, в лаборатории В.П. Скулачева было показано, что при гиперполяризации митохондрий небольшое (10%) снижение ?? вызывает 10-кратное снижение продукции АФК. Проблема заключается в том, что при передозировке разобщителя уровень ?? может упасть ниже критического для генерации АТФ с очевидными токсическими последствиями (см. ссылки в PNAS 2010, 107, 663-668). Поэтому была поставлена задача найти вещество, которое избирательно снижает ?? в митохондриях с высоким потенциалом. Мы обратились к липофильным проникающим катионов. Эти вещества (например, тэтрафенилфосфоний) способны проходить через бислойную мембрану поскольку их положительный заряд де-локализован по всей молекуле. Так как митохондрия - единственная отрицательно-заряженная органелла в клетке, то такие катионы избирательно накапливаются в митохондриях. До начала экспериментов у нас были предварительные данные о возможной разобщающей активности таких катионов (не приводятся). В рамках биомедицинского проекта Ионы Скулачева разобщающая активность проникающих катионов SkQl и С12-ТРР (Рис..) была подтверждена методом динамического моделироваия, а также экспериментально на моделях бислойной мембраны, липосом и митохондрий in vitro (PNAS 2010, 107, 663-668). Поскольку эти липофильные катионы специфически накапливаются в митохондриях, можно было ожидать, что их протонофорное действие (в отличие от стандартных разобщителей) будет также митохондриально-направленным. Для проверки этого предположения мы использовали измерение дыхания дрожжей внейтральной и кислой культуральных средах. Прежде всего, мы убедились, что закисление цитоплазмы существенно тормозит скорость дыхания (данные не приводятся). Таким образом, в кислой (но не в нейтральной) среде увеличение тока протонов через цитоплазматическую мембрану является ингибитором дыхания. В то же время увеличение проводимости внутренней мембраны митохондрий - стимулятор дыхания (см. раздел по амиодарону). Как показано на рис. 9а, при рН = 3.0 (в отличии от рН = 5.5) в среде анионный разобщитель FCCP стимулировал дыхание только в очень узком диапазоне концентраций. Катионный разобщитель С12-ТРР проявлял стимулирующие свойства в более широком окне концентраций, и график зависимости не имел колокообразной формы как в случае с FCCP (Рис. 96). Таким образом, С12-ТРР является митохондриально-направленным протонофором.
Более широкий, чем у FCCP диапазон стимулирующих концентраций С12-ТРР также указывает на потенциал-зависимость его действия. Чтобы подтвердить, что высоко-
20
|
-
= 1
1 с
so ?*
Ын
10 1* 1 с
и
1 С
4
;ж-..
Pi
#J
DO
aа 1
V
tCа 41
[FCCP],MKM
1*.
pHJlа 13
N |
-А 1
pM 10аа M
DO
Itаа Itаа аа )]
I .
0аа 2аа 4аа ?аа ?а It 11а U ?а tl ?
IG^tppi.mkM
Рис. 9. Стимуляция дыхания клеток дрожжей добавками FCCP и С12-ТРР. Инкубационная среда: 50 мМ фосфат калия указанных значений рН (доводили Н3Р04), 0,5% глюкоза.
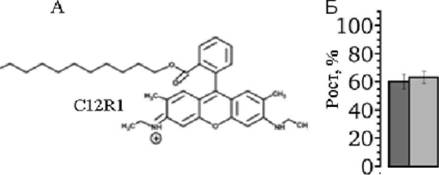
энергизованные митохондрии наиболее подвержены действию новых разобщителей, мы сравнили их действие на обычные клетки и на клетки petite. Поскольку в случае petite ?? митохондрий поддерживается не за счет дыхания а вследствии работы протонной АТФ-азы, его уровень значительно ниже такового в контрольных клетках. Следовательно, можно было ожидать, что превращение в petite вызовет устойчивость к катионам-разобщителям. Для проверки этого предположения мы использовали новую модификацию проникающего катиона - C12R1 (Рис. 10а). Дело в том, что разобщающее действие С12-ТРР происходит за счет симпорта этого иона с де-протонированной формой свободной жирной кислоты (PNAS 2010, 107, 663-668). Разобщитель C12R1 содержит протонируемую аминогруппу, и вследствии этого может оказывать протонофорное действие и в отсутствии свободных жирных кислот (J Biol Chem. 2011, 286, 17831-17840). Возможно, именно из-за этого различия C12R1 менее опасен при передозировке. В частности, C12R1, в отличие от своего непротонируемого аналога C12R4, не вызывает набухания митохондрий (J Bioenerg Biomembr. 2011, 43,175-180) - потому что не так сильно в них накапливается.
Для сравнения действий C12R1 и анионного разобщителя (динитрофенола, DNP) мы прежде всего подобрали их концентрации, которые в одинаковой степени снижали скорость роста контрольных клеток (grande) на среде с глицерином (Рис. 106). Несбраживаемый субстрат был выбран для того, чтобы дыхание митохондрий было максимально активно. Когда эти же концентрации были протестированы на клетках petite, оказалось, что DNP был более токсичен, чем на grande. В отличие от DNP, выбранная концентрация C12R1 совершенно не влияла на скорость роста petite-формы дрожжей (Рис. 106). Таким образом, мы подтвердили, что действие in vivo нового класса разобщителей положительно зависит от величины мембранного потенциала митохондрий.
21
n--- 0 001
 0< Q0OO1
0< Q0OO1
ж СД1 D DNP
П
глнцерйл гпюк^а глюк^а Grandeа Grandeаа petite
Рис. 10. А. Структура протонируемого разобщителя C12R1. Б, дрожжи форм Grande и Petite растили в присутствии C12R1 (10 мкМ) или DNP (0,5 мМ). 100% скорости роста - рост без добавок. Отклонения - стандартная ошибка среднего.
4. Защитное и повреждающее действие АФК при генотоксическом стрессе
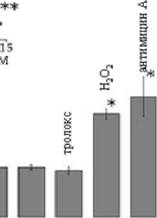
Известно, что АФК участвуют не только в каскаде клеточной смерти, но и в сигнальных путях, не связанных со смертью. Более того, иногда АФК выполняют защитную роль. Так, в определенных случаях в ответ на ухудшение условий клетка вырабатывает количество АФК достаточное для индукции анти-оксидантных систем и таким образом готовится к более сильным стрессам. Рассматривая популяцию дрожжевых клеток, логично ожидать, что относительно небольшой стресс будет индуцировать защитные АФК, а высокий уровень стресса (достаточный для массированного повреждения генома клетки) вызовет АФК-индукторы каскада смерти. Чтобы проверить эту гипотезу мы обратились к модели генотоксического стресса. Группой Доетча (Doetsch) было показано, что в ответ на повреждение ДНК метилметансульфонатом (ММС) дрожжи генерируют АФК. Мы проверили эффект анти- и про-оксидантов на выживание дрожжей после обработки различными дозами ММС. Оказалось, что менадион увеличил выживание дрожжей обработанных низкими концентрациями ММС, но его эффект был противоположным в случае высоких концентраций (Рис. 11а). Более того, антиоксидант ионол способствовал выживанию клеток после высоких доз ММС (Рис. 11а). Чтобы убедится, что эти эффекты не являются специфическими для менадиона и ионола, мы протестировали другие анти- (альфа-токоферол, тролокс) и про-оксиданты (перекись водорода, антимицин). Оказалось, что после обработки низкой дозой ММС про-оксиданты, в отличие от анти-ксидантов, увеличивали выживание (Рис. 116). Мы также показали, что высокая концентрация С12-ТРР (10 мкМ) действует как мягкий прооксидант (Рис. Иг), и при этом защищает дрожжи от низких доз ММС (Рис. 11в). Интересно, что вещество с локализованным положительным зарядом (СТАВ) обладало схожим с С12-ТРР но менее эффективным действием, a SDS (липофильный анион с локализованным
22
|
|
** |

50а 100 200
токоферол мкМ
Рис. 11. Про-оксиданты защищают от токсичности ММС. А, эффекты менадиона (5 мкМ, точечная линия) и ионола (100 мкМ, пунктирная линия) и спиртового контроля (сплошная линия) на выживание дрожжей после обработки указанными концентрациями ММС. Б, процент выживших клеток после обработки 5 мкМ ММС в присутствии различных про- и антиоксидантов: Тролокс, 100 мкМ; перекись водорода (0,3 мМ); антимицин А, (2 мкг,мл). *р<0,01, *р<0,005 в соответствии с t-тестом по сравнению с контролем. В, выживание после обработки 5 мкМ ММС. С12ТРР, СТАВ - 10 мкМ, токоферол - 50 мкМ. Г, окраска клеток p-DCF-DA после добавки контрольного растворителя (а), 10 мкМ С12-ТРР (б), 10 мкМ СТАВ (в), 35 мкМ SDS (г). Д, во сколько раз увеличили продукцию Н202 добавки, представленные в панели Г. Измерение методом Amlex Red/HRP. Е, морфология митохондрий необработанных клеток, а также клеток с 10 мкМ С12-ТРР, 10 мкМ С12-ТРР в присутствии 10 мкМ токоферола, и с10 мкМ СТАВ. Масштаб - 5 мкм. *р<0,01 в соответствии с t-тестом по сравнению с контролем.
зарядом) был неактивен в нашей системе(Рис. 11в,г,д). Впоследствии мы выяснили, что про-оксидантный эффект С12-ТРР связан с набуханием митохондри, которое вызвано накоплением в них С12-ТРР ((Рис. Не, а также J Bioenerg Biomembr. 2011, 43,175-180).
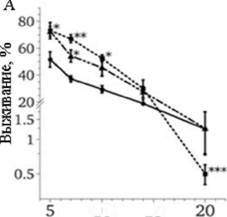
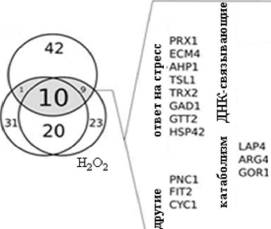
Как АФК защищают от низких доз мутагена? Во-первых, мы показали что эффект есть и на клетках, синхронизованных в клеточном цикле (Рис. 12а) . Следовательно, АФК не связан с обогащением культуру клетками содержащими двойной набор хромосом, которые более устойчивы к повреждениям ДНК. С другой стороны, защитный эффект исчезал при добавке ингибитора транскрипции актиномицина Д (Рис. 126). Таким образом, наиболее вероятно, что АФК активируют транскрипцию ферментов-репараз ДНК. Для проверки этой гипотезы мы сравнили опубликованные данные по глобальным изменениям в профилях экспрессии генов после окислительного и генотоксического стрессов. Оказалось, что транскрипционные ответы на эти стрессы во многом совпадают,
23
|
|
|
IviMC |
DDR48 SFG1 MSC1 |
менадиФН |
 жГ
жГ
-С
40j 35 30 25 20 15 10 5 О1
П
10 15
ММС, мкМ
[
I
J
X
lЧI
и
-*-
TFS1
YNL1J4C
YMR173W-A
Рис. 12. Защитное действие про-оксидантое опосредовано их эффектом на экспрессию генов. А, эффекты менадиона (5 мкМ, точечная линия), С12-ТРР (ЮмкМ, точечно-пунктирная линия) и спиртового контроля (сплошная линия) на выживание синхронизованных нокодазолом (10 мк.мл) дрожжей после обработки указанными концентрациями ММС. *Р<0.05, **Р<0.005, ***Р=0.053. Б, выживание дрожжей, обработанных 5 мкМ ММС, в присутствии указанных добавок. Концентрации: С12-ТРР, 10 мкМ; менадион, 5 мкМ; актиномицин, 10 мкг/мл. *Р<0.01 по сравнению с соответствующей пробой без актиномицина. В, 1% (62) генов с максимальным увеличением экспрессии были выбраны для анализа совпадений. Их названия и функциональные категории (в соответствии с SGD) представлены в правой панели.
совпадения включают ряд ДНК-связывающих белков (Рис. 12в), что подтверждает наше предположение. Важно отметить, что ответ на окислительный стресс развивается быстрее, чем на генотоксический (данные не приводятся). Это объясняет, почему клетки используют АФК для мобилизации защиты от мутаций. Суммируя вышеизложенное, объяснение роли АФК в ответе на повреждения ДНК укладывается в простой алгоритм: малое повреждение - малые АФК - транскрипция защитных белков; большое повреждение - высокие АФК - активация митохондриального этапа каскада клеточной смерти.
24
5. Полиглутаминовые агрегаты белков и субстраты циклосомы
В этой части работы мы использовали дрожжевой каскад клеточной смерти для моделирования и исследования последствий образования полиглутамин-зависимых агрегатов белков в клетке. Агрегация белков с полиглутамин-богатыми фрагментами вызывает ряд нейродегенеративных заболеваний. Так, например, болезнь Хантингтона индуцируется тем, что мутация приводит к удлинению полиглутамин-богатого фрагмента белка хантинтитина, и белок начинает агрегировать. Дрожжи широко используются как модель для изучения молекулярных механизмов подобной агрегации. Типичный подход таков: дрожжи трансформируют плазмидой для экспрессии полиглутамин-богатого фрагмента мутированного белка хантингтина слитого с флуоресцентным белком. После индукции экспрессии этого химерного белка, например, 103Q-CFP (Q - остаток глутамина в полипептиде, CFP - циановый флуоресцентный белок), анализируется степень его агрегации, размер агрегатов и т.п.
Aа CFPАФКаа Б В
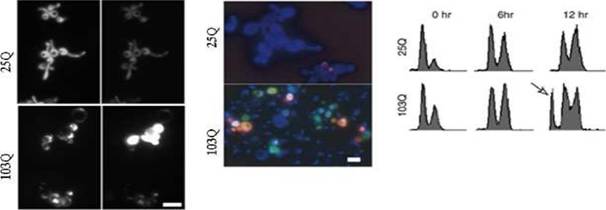
Рис. 13. A, 103Q-CFP (но не 25Q-CFP) вызывает рост АФК (окраска 50 мкМ p-DCF-DA). Б, . CFP- синий цвет, иодид пропидия (окраска на мертвые клетки) - красный, FITC-VAD-fmk (детекция каспазной активности) - зеленый. В, 12 часов экспрессии приводят к появлению заметной пропорции клеток с деградированной ДНК (количественный анализ ДНК методом FACS, пик показан стрелкой).
Мы решили исследовать физиологические последствия агрегации, а именно проверить, не вызывает экспрессия 103Q-CFP в дрожжах последствий, похожих на дегенрацию нейронов при болезни Хантингтона. Оказалось, что, подобно больным нейронам, 103Q-CFP вызывает появление маркеров апоптоза в дрожжах: повышение митохондриальных АФК, активацию каспазной активности и фрагментацию ядерной ДНК (Рис. 13). Неожиданно, сходство обнаружилось и в локализации полиглутаминов. Нормальный хантингтин локализован в цитоплазме, а удлинение полиглутаминового фрагмента приводит к каспазо-зависимуму расщеплению белка и накоплению его в ядре. Оказалось, что и в дрожжах фрагмент нормальной длины (25Q-CFP) локализован в цитозоле, a 103Q-
25
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА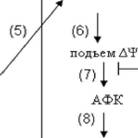 феромон
феромон