Что такое химия окружающей среды
| Вид материала | Документы |
- Утверждаю, 117.11kb.
- Рабочая программа элективного курса «Химия и охрана окружающей среды», 82.96kb.
- Программа дисциплины «Химия атмосферы», 98.37kb.
- Рабочая программа дисциплины «химический анализ объектов окружающей среды» Направление, 311.39kb.
- Программа учебной дисциплины «Химия окружающей среды» для специальности 150109 «Металлургия, 177.15kb.
- Учебно-методический комплекс по дисциплине специальность 032300. 00 (050101)- химия, 764.83kb.
- Программа дисциплины Экологическая биохимия Новосибирск, 167.12kb.
- Программа дисциплины Микроорганизмы и окружающая среда Новосибирск, 114.75kb.
- Тема : «Загрязнение и охрана окружающей среды», 38.66kb.
- Программа дисциплины «Токсикология» составлена в соответствии с требованиями (вузовский, 147.22kb.
НА + Н2О A –+ H3O+
к –та 1 осн.2 осн. 1 к –та 2
Чтобы рассчитать рН в растворе слабой кислоты, нужно воспользоваться формулой:
рН = 0,5* (pKa + С)
где С — молярная концентрация кислоты.
Слабые основания (а именно такие основания и присутствуют в природных водах) реагируют с водой с образованием иона ОН–, причем, как и в случае слабых кислот равновесие соответствующей реакции смещено влево:
В+ + Н2О Б НВ + ОН–
Чтобы рассчитать рН в растворе слабого основания, нужно воспользоваться формулой
рН = 14 – 0,5 –(рКb + C),
где С— молярная концентрация основания.
Многие частицы (например, ион НСО3–) могут вести себя и как кислоты, и как основания:
НСО3– + Н2О Н3О+ + СО32–
к –та1 осн.2 к –та 2 осн. 1
НСО3– + Н2О ОН– + Н2О + СО2.
осн.1 к –та2 осн.2 к –та1
Чтобы узнать, как будет вести себя такая частица, нужно сравнить ее константу кислотности и константу основности. В данном случае:
pКa(НСО3– ) = 10,35, а
pКb(НСО3– ) = 14 –6,35 = 7,65. рКa>рКb,
следовательно Кa<Кb, то есть константа основности больше константы кислотности. Это значит, что гидрокарбонат–ион при реакции с водой будет вести себя как основание, то есть в водном растворе гидрокарбонатов среда будет основной, и его рН нужно рассчитывать как рН раствора основания.
рН – буферные системы
В природных водах, как правило, присутствуют одновременно кислоты и сопряженные им основания. Например, в большинстве водоемов одновременно растворен углекислый газ и сопряженное ему основание гидрокарбонат–ион. Такие системы способны поддерживать более или менее постоянное значение рН при внесении в них как сильных кислот (кислот, более сильных, чем растворенная кислота), так и сильных оснований (оснований, более сильных, чем растворенное основание) и называются рН –буферными системами.
Механизм буферного действия рН–буферной системы достаточно прост: она реагирует как с сильными кислотами, так и с сильными основаниями, превращая их в слабые. Например:
НСО3– + Н3O+ = 2Н2О + СО2;
Н2О + СО2 + В– = НСО3– + НВ.
Наличие в природных водах буферных систем — одно из важнейших условий существования жизни. Если бы буферных систем не было, продукты жизнедеятельности организмов легко превратили бы все природные воды в разбавленные кислоты. При различных рН кислота (основание) распределяется между протонированной (кислотной) и депротонированной (основной) формами. Чтобы рассчитать соотношение протонированной и депротонированной формы, можно воспользоваться уравнением:
lg([HA]/[A–]) = pKa –PH,
где рКа — отрицательный логарифм константы кислотности.
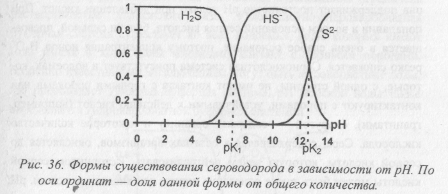
Как пример, на рисунке приведено распределение сероводорода по формам в зависимости от рН.
Добавление в буферную систему с определенным рН небольших количеств кислоты или основания приводит к распределению кислоты (основания) между протонированной и депротонированной формами. Для грубых оценок можно принять, что при рН<рKa преобладает кислота (протонированная форма), а при рН>рKa — сопряженное ей основание (депротонированная форма). Как видно из примера на рисунке, если сероводород (pKa (H2S)=7, pKa (HS–) = 12,3) попадает в буферную среду с рН<7, то он существует преимущественно в форме H2S, при 7<рН<12,3 — в форме HS–, при рН>12,3 — в форме S2–.
рН – буферная емкость любого раствора (в том числе и природной воды) ограничена: как только прореагирует все растворенное основание или растворенная кислота, рН уже не будет удерживаться. Отсюда вывод: чтобы в водоеме не происходило фатальных изменений, количество кислоты, которое в него попадает, должно быть меньше, чем его буферная емкость (обычно условие еще более жесткое: рН не может меняться более, чем на единицу).
Нужно также заметить, что буферными свойствами обладает не только вода, но и водоем в целом. Причем буферная емкость водоема может быть больше, чем буферная емкость содержащейся в нем воды, поскольку с кислотами и основаниями могут также реагировать вещества, содержащиеся во взвесях, донных отложениях и т.д.
рН природных вод
Существует несколько буферных систем, поддерживающих определенный рН природных вод. Ниже мы разберем наиболее важные.
