Загрязнение биосферы
| Вид материала | Документы |
- Второй Планетарный Конгресс по Правам Биосферы. Институт Галактических Исследований, 301.79kb.
- Поздняковой Анны Александровны Симоненко Сергей Валерьевич реферат, 193.96kb.
- «Химическое загрязнение почв» Общая трудоемкость дисциплины составляет, 25.84kb.
- Мутации. Загрязнение биосферы и здоровье человека, 69.24kb.
- План реферата: Вступление Понятие «биосфера». Организация биосферы. Биосфера и человечество, 692.49kb.
- Реды жизни и загрязнение окружающей среды, 57.15kb.
- Рабочая программа по дисциплине Агроэкологии Направления, 267.02kb.
- Реферат состояние биосферы и здоровья человека, 115.66kb.
- Рабочей программы дисциплины Учение о биосфере (наименование) по направлению подготовки, 17.42kb.
- В. Ф. Панин Конспект лекций по учебной дисциплине " Защита биосферы от энергетических, 990.33kb.
Одним из проявлений трансформации загрязнителей в атмосфере является агрегирование (слипание) мелких частиц, аэрозолей с образованием крупных устойчивых конгломератов. Основная часть пыли техногенного происхождения находится в приземном слое воздуха, рассеиваясь на площади не более 0,4% суши. Количество пыли, оседающей в год на поверхность земли, достигает в крупных городах, промышленных центрах 300 т/км2.
Антропогенные выбросы в атмосфере претерпевают различные химические превращения: фотолиз – фотохимические реакции при облучении солнечным светом; озонолиз – в реакциях с атмосферным озоном; гидролиз – при реакции с атмосферной влагой, паром; окисление – соединение с кислородом. Химические атмосферные процессы с участием различных загрязнителей включают первичные реакции окисления NO, SO2, углеводородов с участием озона, гидроксильных радикалов и вторичные фотохимические ре-
акции образования аэрозолей, кислот, озона.
Схема основных газофазных первичных и вторичных преобразований оксидов азота в нижних слоях атмосферы представлена на рис. 1.
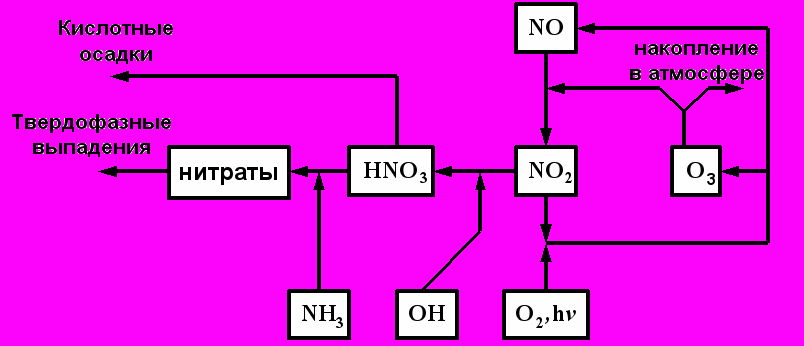
Рис. 1. Схема основных первичных и вторичных преобразований оксидов азота в атмосфере.
Первичная реакция взаимодействия оксида азота с озоном
NO + O3
 NO2 + O2
NO2 + O2 дает толчок к множеству вторичных реакций, в том числе и кругового преобразования с повторным воспроизводством оксида азота и озона:
NO2 + hv + О2
 NO + О3
NO + О3и нитратов – твердых продуктов взаимодействия азотной кислоты с аммиаком NH3 и другими соединениями. Избыточное количество озона, образующееся в каждом цикле преобразования молекулы оксида азота, выводится из цикла, способствуя накоплению озона в атмосфере. Значительную роль в формировании уровня и характера загрязнения воздушного бассейна играет конверсия S02 в атмосфере с образованием аэрозолей: фотохимическое окисление с образованием сульфатных аэрозольных частиц:
2SO2 + O2 + hv
 2SO2
2SO2растворение диоксида серы в каплях атмосферной влаги с образованием сернистой кислоты Н2S0з и окисление сернистой кислоты кислородом, содержащимся в каплях:
2H2SO3 + О2
 2H2SO4
2H2SO4Образующиеся частицы состоят из твердых сульфатов и серной кислоты в виде тумана. Образовавшиеся аэрозоли частично выводятся из атмосферы осадками и туманами, они взаимодействуют с газообразными примесями, подвергаются коагуляции.
В атмосфере при контакте с влагой диоксиды азота и серы образуют соответствующие кислоты. В летний период при интенсивном солнечном облучении скорость превращения диоксида азота в кислоту весьма велика -50% диоксида азота переходит в кислоту. Вследствие высокой растворимости в воде и сорбции на увлажненной поверхности твердых частиц азотная кислота быстро выпадает на землю.
В отличие от оксидов азота, диоксид серы, прежде чем полностью превратится в сульфат-анион, может переноситься с массами воздуха на большие расстояния, ареал рассеивания его значительно больше. Образующиеся кислоты выводятся из атмосферы с осадками – «кислотными» дождями. Кислотность осадков доходит до рН = 1,5. Продукты трансформации диоксида серы в атмосфере в виде осадков выпадают на поверхность литосферы (около 50%), гидросферы (около 30%), поглощаются растениями (около 20%).
