Панасенко Александр Иванович, профессор кафедры органической и биологической химии тгу им. Г. Р. Державина, кандидат химических наук Аннотация Предложенное учебно методическое пособие
| Вид материала | Методическое пособие |
- Г. Р. Державина академия непрерывного образования кузнецов и. А. Основы маркетинга, 857.54kb.
- Протокол №8 от 5 декабря 2008, 329.53kb.
- Г. Р. Державина академия непрерывного образования в. О. Алексеева ораторское искусство, 4496.13kb.
- Методическое пособие к лабораторным работам по физической и коллоидной химии для студентов, 4131.07kb.
- Учебное пособие химическая переработка твердого топлива и перспективы получения жидких, 340.13kb.
- Методическое пособие по неорганическому синтезу подготовлено преподавателем кафедры, 16.91kb.
- Учебно методическое пособие, 771.33kb.
- Автор программы: кандидат философских наук, профессор кафедры общей социологии Филиппов, 178.82kb.
- Учебно-методическое пособие минск 2004 удк 577. 3(075., 636.45kb.
- Самостоятельная работа студентов допущено Редакционно-издательским советом тгу имени, 375.14kb.
Основы биохимии
/Элективный курс профильного обучения. Химия/
Авторы – составители:
Володина Галина Борисовна, доцент кафедры «Природопользование и охрана окружающей среды» ТГТУ,
Крючкова Надежда Николаевна, учитель химии МОУ Кузьминогатьевской СОШ Тамбовского района
Черникова Светлана Вячеславовна, доцент кафедры преподавания дисциплин естественно-математического цикла ТОИПКРО,
Рецензенты:
Селиванова Ольга Владимировна, зав.кафедрой преподавания дисциплин естественно-математического цикла ТОИПКРО
Панасенко Александр Иванович, профессор кафедры органической и биологической химии ТГУ им. Г.Р. Державина, кандидат химических наук
Аннотация
Предложенное учебно - методическое пособие предназначено в помощь учителям химии для проведения элективных курсов профильного обучения на старшей ступени образования. Пособие включает программу элективного курса с методическим и информационным материалом. Информационный материал будет полезен и учащимся при подготовке к ЕГЭ
^ Пояснительная записка
Элективный курс "Основы биохимии" предназначен для учащихся 10-11 классов естественнонаучного профиля. Программа курса составлена на основе концентрического подхода конструирования учебного материала профильной школы. Теоретическая часть закрепляется фактическим материалом, что позволяет усилить дедуктивный подход к изучению биохимии.
Актуальность данного курса состоит в том, что он
-соответствует целям и задачам химико-биологического образования профильного уровня;
-реализует межпредметные связи с экологией, биологией, социологией, математикой и информатикой;
-способствует формированию единой научной картины мира, представлениям о естественном происхождении жизни на Земле;
-развивает экологическую и валеологическую культуру школьников.
Предлагаемая программа позволяет в полной мере использовать в обучении логические операции мышления: анализ и синтез, сравнение и аналогию, систематизацию и обобщение, а также не только вооружает старшеклассников биохимическими знаниями, но и вызывает стремление к применению этих знаний на практике, участию в трудовой деятельности в области диагностической медицины, биотехнологии, рационального питания и экологии.
Целью элективного курса является углубление знаний в области биохимии.
Задачи курса:
- подготовить учащихся к сдаче ЕГЭ по одному из самых сложных разделов химии и биологии "Биохимия";
- сформировать навыки исследовательской деятельности.
Содержание курса рассчитано на 34 часа. Значительное место в содержании курса отводится химическому ученическому эксперименту. Практические работы, исследовательская деятельность позволяют учителю активизировать учебный процесс, а учащимся совершенствовать умения и навыки, необходимые для проведения химического эксперимента, развития логического мышления, организации самостоятельной познавательной деятельности, умения выдвигать гипотезы и приходить к правильным умозаключениям. Теоретические знания и навыки, полученные в ходе исследований, позволят учащимся не только расширить свои знания по разделу биохимии, но и лучше разобраться в процессах, протекающих в организме человека.
При изучении элективного курса «Основы биохимии» отводится достаточное количество часов на решение расчетных задач, ОВР, выполнение тестов.
Программа элективного курса позволяет учащимся осуществлять построение индивидуальной образовательной траектории, преодолевать "школьные границы" и выходить в сферу открытого образования, реализовывать свой познавательный интерес.
В результате изучения курса " Основы биохимии " учащиеся должны
знать:
- сущность биохимии как науки;
- состав органических веществ, их классификацию, изомерию, свойства;
- нахождение в природе и биологическую роль;
- значение в быту, технике, медицине.
уметь:
- самостоятельно отбирать и анализировать информацию;
- представлять информацию в графическом виде;
- оценивать последствия влияния на здоровье человека «факторов риска» нерационального питания, алкоголя, никотина, наркотиков;
- проводить химический эксперимент и грамотно представлять результаты исследования; решать расчетные задачи;
- использовать приобретенные знания и умения в повседневной жизни, в выборе профессии.
Материал данного пособия предназначен для учащихся химических классов средних школ, будет полезен при проведении дополнительных занятий, при подготовке к олимпиадам и единому государственному экзамену.
^ Учебно-тематический план
| № | Название темы | Всего часов | в том числе | ||
| | | | Теоретические | Практические | Семинары |
| | Введение в биохимию | 3 | 1 | 2 | |
| | Жиры. Воски. Поверхностно-активные вещества (ПАВ) | 7 | 2 | 4 | 1 |
| | Углеводы | 7 | | 5 | 2 |
| | Аминокислоты. Белки. | 7 | 2 | 3 | 2 |
| | Гетероциклические соединения. Нуклеиновые кислоты. | 4 | 2 | 2 | |
| | Биологически активные вещества | 4 | | 2 | 2 |
| | ^ Итоговое занятие | 2 | | 2 | |
| | Итого | 34 | 9 | 18 | 7 |
Содержание
Тема 1. Введение в биохимию
Лекция
Сущность биохимии как науки: объекты изучения; методы исследования; задачи; история развития.
Влияние экологических факторов на живые системы.
Работы выдающихся ученых-биохимиков.
Элементный состав живых организмов.
Практическая работа
Определение элементного состава живых организмов.
^ Тема 2. Жиры. Воски. ПАВ.
Лекция
Жиры, их состав, консистенция, свойства, биологическая роль, техническое значение. Воски, их состав, значение в природе, быту, технике.
^ Демонстрационный опыт
Растворимость жиров и масел
Гидролиз жиров и масел
Обнаружение глицерина в жирах
Отношение сливочного, машинного масел и маргарина к бромной воде и раствору перманганата калия.
Семинарское занятие
Вопросы для обсуждения
1. ПАВ, строение молекул
2. Сущность моющего действия, отношение к жесткой воде.
3. Области применения.
4. ПАВ и экология.
Практическое занятие
Исследование строения и свойств жиров. Характерные реакции на жиры.
Исследования свойств образцов растительных и животных жиров, ПАВ.
Решение расчетных задач.
Выполнение тестовых заданий ЕГЭ.
Тема 3 . Углеводы
Семинарское занятие
Вопросы для обсуждения
1. Углеводы - гетерофункциональные соединения.
2. Классификация углеводов.
3. Биологическая роль углеводов, значение в жизни человека, технике.
4. Строение и оптическая изомерия моносахаридов. Их классификация. Формулы Фишера - Xeyoрca. D и L-ряды моносахаридов.
4. Важнейшие представители моноз - пентозы и гексозы, строение молекул, пиранозные и фуранозные циклы.
5. Строение дисахаридов, способы сочленения циклов, свойства. Сахароза, лактоза, мальтоза.
6. Полисахариды. Крахмал, целлюлоза, гликоген, хитин.
7. Сравнительная характеристика крахмала и целлюлозы.
8. Фотосинтез - биохимический процесс.
Практическое занятие
- Определение сахаров в овощах и фруктах.
- Проведение качественных реакций на углеводы.
- Количественное определение углеводов.
- Исследование свойств сахарозы.
- Исследование свойств крахмала.
- Решение расчетных задач.
- Выполнение тестовых заданий ЕГЭ.
Тема 4. Аминокислоты. Белки
Лекция
Пептиды, строение, геометрия пептидной связи, биологическая роль. Белки - природные полимеры, их отличие от пептидов, классификация, строение, формы молекул, свойства, биосинтез, значение.
Семинарское занятие
Вопросы для обсуждения
1. Аминокислоты: классификация, строение, оптическая изомерия.
2. Особенности строения и свойств α-аминокислот.
3. Амфотерность свойств и её причины.
4. Биологическая роль аминокислот.
Практическое занятие
1. Исследование веществ на наличие белков.
2. Растворимость в воде, органических растворителях
3. Осаждение белков нагреванием и химическими агентами
4. Разделение альбуминов и глобулинов яичного белка методом высаливания
5. Характерные реакции белков.
6. Решение расчетных задач.
Тема 5. Гетероциклические соединения. Нуклеиновые кислоты.
Лекция
Гетероциклы, классификация, свойства, значение в природе. Нуклеиновые кислоты: сравнительная характеристика ДНК и РНК. Генная инженерия и биотехнология.
Практическое занятие
Решение расчетных задач.
Выполнение тестовых заданий ЕГЭ
Тема 6. Биологически активные вещества
Семинарское занятие
Вопросы для обсуждения
1. Витамины: история открытия, классификация, действие на организм.
2. Лекарства: история развития химиотерапии, группы лекарств, лекарственные формы, способы применения.
3. Ферменты: биологические катализаторы, особенности их строения и свойств, биологическая роль, значение, применение в промышленности.
4. Гормоны: классификация, отдельные представители, биологическая роль.
Практическое занятие
Исследование строения и свойств БАВ
Итоговое занятие.
Защита проектов, результатов исследовательских и творческих работ.
Литература
1. Буховец С.В. Упражнения по биологической химии. М., Просвещение, 1989.
2. Васильева Н.В. Задачи и упражнения по органической химии. М., Просвещение, 1973.
3. Габриелян О.С. Готовимся к ЕГЭ. М., Дрофа, 2003.
4. Габриелян О.С., Остроумов И.Г. Настольная книга учителя химии. М., Блик, 2001.
5. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. М., Экзамен, 2004.
6. Ленинджер А. Биохимия. М., Мир, 1974.
7. Овчинников Ю.А. Биоорганическая химия. М., Просвещение, 1987.
8. Пичугина Г.В. Химия и повседневная жизнь человека. М., Дрофа, 2004.
9. Проскурин И.К. Биохимия. М. Владос-Пресс, 2004.
10. Северюхина Т.В., Сентемов В.В. Исследование пищевых продуктов//Химия в школе №5, 2000.
11. Смолин А.Н. Практикум по общей биохимии. М., Просвещение, 1989.
12. Сорвачев К.Ф. Биологическая химия., М., Просвещение, 1971.
13. Филиппович Ю.Б. Биохимия белка и нуклеиновых кислот. М., Просвещение, 1978.
14. Филиппович Ю.Б. Упражнения и задачи по биологической химии. М., Просвещение, 1976.
15. Физер Л., Физер М. Органическая химия. М., Химия, 1970. 16.Цветков Л.А. Эксперимент по органической химии. М., Просвещение, 1973.
Теоретический материал и методические рекомендации
к реализации тем элективного курса
Тема 1. Введение в биохимию
Биохимия - наука
На первом занятии необходимо создать обстановку заинтересованности и необходимости в дальнейшем изучении биохимии как науки. В качестве мотивации занятие целесообразно начать эпиграфом - словами К.Э. Циалковского: «Человек на то имеет разум и науку, чтобы обезопасить себя от всякого бедствия».
Изложение теоретического материала в профильной школе осуществляется через лекцию. Лекция дает систематизированные основы научных знаний, концентрирует внимание обучающихся на наиболее сложных, узловых вопросах, стимулирует активную познавательную деятельность при условии правильной ее организации и проведения.
Слабым местом традиционной лекции является пассивность обучающихся при высокой односторонней активности учителя. Для устранения данного противоречия необходимо внедрение проблемных лекций, где используется всесторонний анализ явлений, научный поиск истины, где учитель правильно поставленным проблемным вопросом заставляет слушателей вместе с ним находить ответ.
В ходе проведения лекции встает необходимость обучения учащихся приемам и формам работы с большим объемом информации. Для этого целесообразно использовать технологию графического представления информации, что заставляет обучающегося думать, рассуждать, а не механически записывать огромный и непонятный зачастую для него материал
^ После вводных слов и эпиграфа целесообразно подвести учащихся к восприятию проблемного вопроса: «Люди всегда мечтали, их фантазии превращались в реальность, например, в сказках мы встречаем ковер-самолет, и вот у нас уже появились настоящие самолеты; путешествие на Луну сейчас тоже быль. В фантастических фильмах наших дней мы встречаем искусственных людей. Что это - миф или реальное будущее 21 века? Можно ли синтезировать человека, его органы, и изучение какой науки приблизит нас к этому?»
Биологическая химия (биохимия) – наука о химическом составе и свойствах веществ живых организмов, о превращениях веществ в процессе жизнедеятельности.
Далее рекомендуется учащимся в ходе работы с информационными источниками (учебная и дополнительная литература, электронные учебники, сайты Интернет) заполнить хронологическую таблицу «История развития биохимии».
Хронологическая таблица «История развития биохимии»
| Годы | Ученые | ^ Вклад в развитие биохимии |
| 1452-1519 | Леонардо да Винчи | сравнил питание животных с горением свечи |
| М.В. Ломоносов | заложил основы материалистического взгляда на процессы жизнедеятельности | |
| 1780-1789 | А. Лавуазье | показал, что животные нуждаются в кислороде и что дыхание - это окисление, а также впервые измерил поглощение кислорода человеком |
| 1828 | Ф.Велер | синтезировал первое органическое вещество из неорганических компонентов (мочевину из цианата свинца и аммиака) |
| 1854-1864 | Л.Пастер | доказал, что брожение вызывается микроорганизмами, развеял гипотезу о «самозарождении» |
| 1842 | Н.И Зимин | получил анилин |
| 1845 | М.Бертло Кольбе | синтезировал жир, синтезировал уксусную кислоту |
| 1861 | А.М Бутлеров | получил сахаристое вещество- углевод |
| 1869 | Мишер | открыл ДНК |
| 1893 | Освальд | доказал, что ферменты представляют собой катализаторы |
| 1894 | Э.Фишер | получил пептиподобные вещества и пептиды |
| 1897 | Эйкман | доказал, что заболевание известное под названием «бери-бери», обусловлено нехваткой каких-то веществ в пище, впоследствии названных витаминами |
| 1914 | Кендаль | выделил тироксин |
| 1925-1930 | Левей | расшифровал структуру мононуклеотидов из которых построены НК |
| 1939-1941 | Липман | предположил, что центральную роль в обмене играет АТФ |
| | Л.Полинг и В.Кори | установили структуру белка |
| 1951 | Полинг | пришел к выводу о существовании х-спиралей в биопола |
| 1953 | Уотсон и Крик | предложили модель двойной спирали у молекулы ДНК |
| | А. Кернберг и Э.Чаргафф | открыли генетический код ДНК |
| 1962 | А.Я. Данилевский | основоположник биохимии в России, в Казанском университете была создана первая в мире кафедра медицинской химии |
| | А.И Опарин | автор теории естественного происхождения жизни на земле |
| Конец XX-XXI | генная инженерия, клонирование и т.д. | |
| * | В.Ингерем | синтез гормона инсулина |
Элементный состав живых организмов
После заполнения и обсуждения истории развития биохимии рекомендуется рассмотреть предмет изучения биохимии - элементный состав живых организмов.
Основными типами соединений, входящих в состав живых организмов (рис.1), являются: белки, нуклеиновые кислоты, углеводы, липиды (жиры и жироподобные вещества), вода, минеральные соли.
Рис 1. Химическая организация клетки
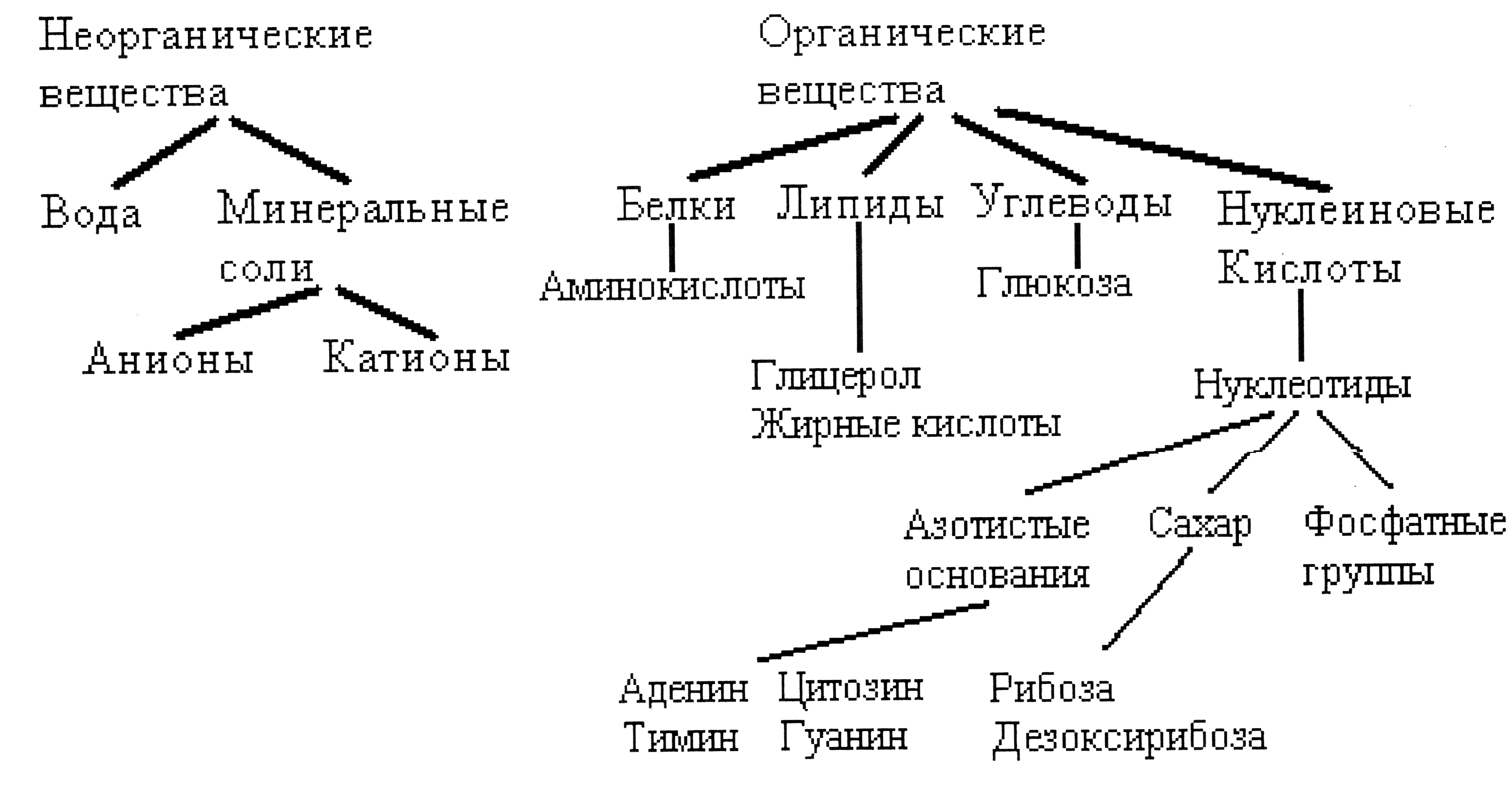
В составе организмов присутствуют карбоновые кислоты, углеводороды, амины, спирты, альдегиды.
Для растительных тканей присущи: эфирные масла, алкалоиды, дубильные вещества.
В отдельные группы выделяют вещества живых тканей организма, присутствующие в небольшом количестве, но играющие главные роли в регуляции обмена веществ: гормоны, ферменты, витамины, антибиотики и т.п. Часто их называют биологически активными соединениями.
Обнаружение и количественное определение отдельных химических соединений в составе живых организмов - сложная и трудоемкая задача. Гораздо легче определить элементный состав органических веществ.
В составе живых организмов присутствуют атомы практически всех элементов периодической системы Д.И.Менделеева. Однако, их содержание существенно отличается от элементного состава земной коры. Так, в земной коре распространены элементы, образующие нерастворимые соединения (Si, Fe, Al). В живых организмах подобные элементы присутствуют в очень малых количествах. Основную массу биосферы составляют элементы, образующие легко растворимые соединения или газы (С, N, P, S). Хорошая растворимость обеспечивает легкость попадание в организм и участия в обменных процессах. Около 98% массы биосферы составляют элементы –биогены (биогенные элементы)- химические элементы, постоянно входящие в состав живых организмов и необходимые для жизнедеятельности (их около 20).
По содержанию элементы, входящие в состав клетки, делятся на три группы:
- макроэлементы – составляют основную массу клетки – 99%. Из них 98% приходится на 4 элемента: С, О, Н и N. Также к этой группе относятся К, Мg, Са, Р, С1, S, Na, Fe.
- микроэлементы – к ним относятся в основном ионы, входящие в состав ферментов, гормонов и др. веществ. Их концентрация от 0,001 до 0,000001 % (В, Сu, Zn. Br, I, Mo и т.д.).
- ультрамикроэлементы – их концентрация не превышает 10-6%, а физиологическая роль не выявлена (Аи, Аg, U, Ra).
Важнейшими из макроэлементов являются:
- Кислород (70% массы живых организмов)
- Углерод (18%)
- Водород (10%)
- Азот, кальций, фосфор, магний, сера, хлор, натрий и др.
Эти элементы присутствуют в клетках всех видов организмов (табл.). Малые размеры атомов указанных элементов способствуют образованию относительно прочных ковалентных связей, которые устойчивы к действию химических, физических и др. факторов. Большое значение имеет и способность к образованию кратных связей, циклов, благодаря чему возникает большое разнообразие соединений с уникальными свойствами. Качественный элементный анализ позволяет определить, из каких элементов построены молекулы данного органического вещества. Наиболее часто в состав органических веществ, помимо углерода и водорода входят кислород, сера, азот, галогены, фосфор.
Таблица. Элементный состав органических веществ (%)
| Элемент | Углеводы | Липиды | Белки |
| Кислород | 49,36 | 17,90 | 22,40 |
| Углерод | 44,44 | 69,05 | 51.30 |
| Водород | 6,18 | 10,05 | 6,90 |
| Фосфор | - | 2,13 | 0,70 |
| Азот | - | 0,61 | 17,80 |
При выполнении элементного анализа органическое соединение разлагают таким образом, чтобы исследуемые элементы перешли в состав неорганических веществ. При этом углерод переходит в оксид углерода (IV), водород – в воду, азот – в цианид-ион, аммиак или молекулярный азот, сера в сульфид. Дальнейшее определение элемента проводят обычными методами аналитической химии.
Практическая работа. Определение элементного состава живых организмов.
Химия - наука экспериментальная. Химический эксперимент позволяет установить законы, разработать теории, является ведущим методом химических исследований, поэтому широко применяется в данном элективном курсе. Кроме того, химический эксперимент оказывает эмоциональные воздействия на учащихся, формирует интерес к науке, развивает наблюдательность, умение анализировать наблюдаемые явления, обобщать и делать выводы.
^ Элективный курс включает два вида школьного эксперимента: демонстрационный и ученический.
Демонстрационный эксперимент должен отвечать следующим требованиям:
- связь опыта с изучаемым материалом, его актуальность;
- соблюдение принципа наглядности, достигаемого применением экранов, подсветок, проецирования на экран и т. д.;
- безопасность эксперимента, достигаемая тщательной подготовкой опытов, соблюдения правил техники безопасности, использованием защитных средств и приспособлений;
- надёжность и воспроизводимость эксперимента;
- продуманное сочетание демонстрации опыта и его объяснения;
- высокая методическая и лабораторно техническая культура демонстрации, служащая примером для учащихся.
Чаще всего демонстрационный опыт проводит учитель, иногда лаборант. Эти опыты достаточно сложны по выполнению, а иногда и опасны, поэтому демонстрирование химических опытов перед классом - большое искусство. Однако некоторые не очень сложные опыты может провести и ученик, с которым учитель заранее отрабатывает технику постановки опыта, и только затем показывают его на занятии. Можно поставить цель, чтобы каждый учащийся за время изучения курса побывал в роли «демонстратора».
^ В ходе ученического эксперимента у школьников формируются экспериментальные умения и навыки, совершенствуются и проверяются знания детей.
Практическое занятие это очень сложная форма занятия, поскольку учителю необходимо наблюдать за каждым учеником и оценивать его экспериментальные умения.
^ Перечень практических работ, планируемых в элективном курсе определяется учебно - материальной базой школьной химической лаборатории и содержанием программы курса.
Требования к ученическому эксперименту.
- цель постановки и содержание опытов должны быть понятны каждому учащемуся.
- обязательное соблюдение всех мер предосторожности при работе с оборудованием и химическими реактивами.
- химические опыты должны быть доступными для восприятия и всегда убедительными, не должны давать повод учащимся для неправильных толкований.
- для оформления полученных результатов в ходе эксперимента данные предпочтительней вносить в специальную таблицу, логичное построение которой экономит время, помогает детям прийти к правильным умозаключениям.
- эксперимент элективного курса не должен повторять программный эксперимент.
Таким образом, школьный эксперимент, запланированный в данном элективном курсе, создаёт условия для личной заинтересованности ученика не только в конечном результате его деятельности, но и в самом процессе его достижения.
^ К проведению практических исследований учитель готовит инструкции по их проведению в виде текста, таблицы, инструктирующей карточки, логико-смысловой модели и др.
Практическая часть
Реактивы (в расчете на одно рабочее место):
- Спирт для спиртовки 30 см3
- Спирт для утилизации натрия 10 см3
- Соляная кислота (1:1) 1 см3
- Азотная кислота 3 см3
- Уксусная кислота 2 см3
- Сульфат меди (безводн.) 2 г
- Оксид меди (II) прокал. 3 г
- Баритовая вода ( или известковая вода) 10 см3
- Сульфат железа (II) (10% раствор) 1 см3
- Раствор молибдата аммония 1 см3
- Водный раствор нитрата серебра 0,5 см3
- Ацетат свинца (капельница)
Посуда и приборы (в расчете на одно рабочее место):
- Пробирки 7
- Спиртовка 1
- Пробка с газоотводной трубкой 1
- Вата
- Пипетка 1
- Капельницы 2
- Медная проволока с петлей на конце 1
- Держатель 1
Опыт 1. Определение углерода и водорода
Определение основано на окислении органического соединения оксидом меди (II) при нагревании. При этом органическое соединение разлагается с выделением оксида углерода (IV) и воды. Оксид углерода открывают с помощью баритовой (известковой) воды, а воду – по образованию кристаллогидрата сульфата меди:
CxH2y + (2x+y)CuO хCO2 + yH2O + (2x+y)Cu;
CO2 + Ba(OH)2 BaCO3
 + H2O ;
+ H2O ;CuSO4 + 5H2O CuSO4 5H2O.
белый голубой
Методика выполнения
В сухую пробирку поместите 23 г прокаленного оксида меди (II) и 0,20,3 г исследуемого органического вещества. В середину пробирки поместите ватный тампон, на который нанесите 1,52 г прокаленного сульфата меди (II). Пробирку закрепите в штативе, закройте пробкой с газоотводной трубкой, конец которой поместите в другую пробирку с баритовой водой. Пробирку с веществом нагрейте на пламени спиртовки. Вместо баритовой воды можно использовать известковую воду Ca(OH)2.
^ Аналитический эффект: баритовая (известковая вода) помутнела, сульфат меди изменил цвет с белого до голубого,.
Опыт 2. Определение галогенов (проба Бейльштейна)
При нагревании с медью органических соединений, содержащих галоген, образуются галогениды меди, окрашивающие пламя в зеленый цвет:
t
CxHyHal + Cu + О2 CuHal2 + CO2 + H2O.
Методика выполнения
Петлю на конце медной проволоки прокалите на пламени спиртовки до исчезновения зеленого окрашивания пламени. После охлаждения нанесите на петлю исследуемое вещество и наблюдайте за цветом пламени.
^ Аналитический эффект – при наличии галогена пламя окрашивается в зеленый цвет.
Опыт 3. Определение серы, азота, хлора и фосфора
Для определения присутствия в исследуемом веществе серы, азота, хлора, фосфора сплавьте его с металлическим натрием (для определения фосфора с пероксидом натрия):
C, N, O, S, Hal NaHal, NaCN, Na2S, NaCNS;
P + Na2O2 Na3PO4.
^ Методика выполнения
Все опыты по сплавлению проводите в защитных очках под руководством преподавателя или лаборанта. В пробирку внесите исследуемое вещество (0,25 г) и примерно такой же кусочек металлического натрия, нагрейте на остром пламени спиртовки до полной минерализации (ОТОРОЖНО, может быть вспышка). Затем пробирку разбейте в чашке с дистиллированной водой, выпарите воду на 1/3, охладите и отфильтруйте через складчатый фильтр. В фильтрате определите элементы.
Опыт 3.1. Определение серы
Серу открывают переводом сульфида натрия в сульфид свинца или по взаимодействию сульфида натрия с пентацианонитрозилферратом (III) натрия:
Na2S + (CH3COO)2Pb PbS + 2CH3COONa;
Na2Fe(CN)5NO + Na2S Na4Fe(CN)5NOS.
Методика выполнения
В пробирку внесите 11,5 см3 фильтрата и подкислите его уксусной кислотой до кислой реакции по лакмусу. Фильтрат разделите на 2 пробирки.
а) К полученному раствору прибавьте 45 капель ацетата свинца.
^ Аналитический эффект: выпадение черно-коричневого осадка ацетата свинца.
б) В пробирку внесите 1 см3 подкисленного фильтрата, прибавьте 23 капли нитропруссида натрия.
Аналитический эффект – красновато-фиолетовое (фиолетовое) окрашивание раствора.
Опыт 3.2. Определение азота
Азот открывают в виде цианид-аниона по образованию берлинской лазури:
^ Методика выполнения
В пробирку налейте 1 см3 фильтрата, прибавьте 0,5 см3 10% водного раствора сульфата железа (II) и нагрейте до кипения. Смесь охладите и по каплям прибавьте соляную кислоту (1:1) до исчезновения темно-серого осадка, затем добавьте 3 капли раствора хлорида железа (III)..
^ Аналитический эффект: окрашивание раствора в сине-зеленый цвет или выпадение хлопьев синего осадка.
Опыт 3.3. Обнаружение хлора
Обнаружение хлора основано на способности катиона серебра образовывать с анионом хлора осадок
Cl- + Ag+ AgCl.
Методика выполнения
В пробирку налейте 2 см3 фильтрата, подкислите азотной кислотой, добавьте 23 капли раствора нитрата серебра.
^ Аналитический эффект: выпадение белого творожистого осадка.
Опыт 3.4. Определение фосфора
Методика выполнения
В пробирку налейте 1 см3 фильтрата, прибавьте несколько капель азотной кислоты до кислой реакции (по лакмусу) и добавьте 1 см3 раствора молибдата аммония. Смесь тщательно перемешайте и нагрейте на пламени спиртовки до кипения.
^ Аналитический эффект: при наличии фосфора появляется ярко-желтая окраска и выпадает желтый осадок: (NH4)3PO4 12MоO3 2H2O.
После завершения рассмотрения каждой темы рекомендуется проводить контроль в форме ответов на вопросы и выполнения тестовых заданий.
Вопросы для самоконтроля
- Перечислите меры техники безопасности, соблюдение которых обязательно при выполнении данной работы.
- С помощью каких химических реакций можно отличить органическое вещество от неорганического?
- Какие экспериментальные данные о веществе необходимы для того, чтобы установить его простейшую формулу, молекулярную формулу?
- Какими методами проводят качественный элементный анализ органических веществ?
- Укажите условия определения элементного состава органических соединений?
- Изложите ход определения элементов в органических соединениях содержащих: углерод, водород, хлор, азот, фосфор.
- Обнаружение каких элементов затрудняет присутствие серы в органическом соединении?
- Что представляет собой количественный элементный анализ?
- Какие макроэлементы содержат аминокислоты, белки, жиры, углеводы, нуклеиновые кислоты?
- При сжигании некоторой массы вещества, в состав которого входит углерод, водород и хлор, было получено 0,44 г оксида углерода (IV) и 0,18 г воды. Из хлора, содержащегося в пробе равной массы, после превращений его в ряде реакций в хлорид-анион было получено 2,86г хлорида серебра. Определите формулу исходного вещества.
^ Тестовые задания
Укажите правильный ответ
- Органические соединения, входящие в состав живых организмов:
а) белки; б) концентрированные кислоты;
в) углеводы; г) пестициды;
д) липиды; е) углеводороды;
з) вода.
Выберите несколько правильных ответов
- Биогенные элементы:
а) С; б) N; в) Ag; г) H;
д) S; е) P; ж) Ca; з) Cl.
- Элементный анализ позволяет определить:
а) качественный состав вещества; б) строение вещества;
в) класс соединения; г) путь поступления в организм;
д) функции в организме.
- Основные вещества метаболических процессов в организме
а) глюкоза; б) уксусная кислота; в) мочевина;
г) серная кислота; д) винная кислота; е) щавелевая кислота;
ж) масляная кислота; з) липиды.
