Роль определения кетонемии в диагностике, самоконтроле и лечении при сахарном диабете
| Вид материала | Документы |
- Программа и Типовой План элективного курса по офтальмологии: "Поражение глаз при сахарном, 37.99kb.
- Рессия и экстернальный локус контроля при сахарном диабете II типа значимо взаимосвязаны, 108.58kb.
- Туристические маршруты, 145.39kb.
- Взаимосвязь вариабельности артериального давления и уровня глюкозы крови при артериальной, 276.43kb.
- Сахарный диабет и беременность, 134.09kb.
- План лечения сахарного диабета Рецепты, полезные при сахарном диабете, 319.06kb.
- Рефератов, историй болезни, литературы, обучающих программ, тестов, 140.38kb.
- Питание при сахарном диабете, 43.84kb.
- Правильное питание при сахарном диабете, 31.2kb.
- Информационно-методический материал для медицинских работников Сахарный диабет серьёзная, 47.48kb.
Опубликовано в журнале:
«Фарматека», 2008, № 17, с. 64-69
Роль определения кетонемии в диагностике, самоконтроле и лечении при сахарном диабете
Е.Е. Петряйкина 1, Е.А. Пронина 1, Т.Д. Михайлова 1, И.Г. Рыбкина 1, Э.Т. Манджиева 2, И.В. Гаряева 2
1Морозовская детская городская клиническая больница ДЗ Москвы
2РГМУ, Москва
Обсуждаются общие проблемы и принципы дифференциальной диагностики сахарного диабета (СД), значение кетоацидоза в его течении. Представлены данные о значении тестирования при различных формах нарушения углеводного обмена. Обосновывается необходимость определения кетонемии на разных этапах ведения диабета. Подчеркивается, что добавление мониторинга кетонемии к таким традиционным маркерам метаболической декомпенсации, как гликемия и кислотно-щелочное состояние крови, при лечении кетоацидоза, обусловленного СД типа 1, способствует более эффективному и быстрому выведению больных из этого состояния, снижая продолжительность и стоимость стационарного лечения.
Драматический рост заболеваемости сахарным диабетом (СД) детей и подростков во всем мире делает актуальной дальнейшую оптимизацию диагностики, самоконтроля пациента и лечения этого тяжелого заболевания. Однако, несмотря на все усилия, прилагаемые клиницистами, фармакологами, пациентами и членами их семей, лишь треть детей и подростков, страдающих СД, достигают целевых значений показателей компенсации заболевания [1].
^ Проблемы и принципы дифференциальной диагностики диабета
Правильная и своевременная диагностика заболевания, оптимальный выбор лечения и объективная оценка необходимости срочной госпитализации не только способствуют профилактике тяжелых форм декомпенсации при СД, но и являются залогом доверия между врачом, пациентом и членами его семьи, будущей комплаентности лечения. Учитывая пандемию ожирения во всем мире, сегодня нельзя утверждать, что наличие гипергликемии у детей и подростков – симптом только СД типа 1 (СД1). У пациентов этой категории можно диагностировать и другие формы СД.
По нашему мнению, лучшей на сегодняшний день классификацией СД является этиологическая классификация Американской диабетологической ассоциации (АДА), отражающая все многообразие форм этого заболевания (American Diabetes Association, 2006):
- Сахарный диабет типа 1.
- Сахарный диабет типа 2.
- Специфические типы:
- генетические дефекты β-клеток;
- генетические дефекты активности инсулина;
- неэндокринные заболевания поджелудочной железы;
- эндокринопатии;
- сахарный диабет, вызванный лекарствами или другими веществами;
- инфекции;
- редкие формы аутоиммунного диабета;
- другие генетические синдромы, связанные с диабетом.
- генетические дефекты β-клеток;
- Гестационный сахарный диабет.
Многие авторы [2, 12] отмечают “промежуточную” форму между СД1 и СД типа 2 (СД2), или “двойной” диабет, говорят о СД1 и СД2 как о разных фазах одного и того же заболевания, отмечая роль ожирения и формирования инсулинорезистентности (ИР) в развитии СД1, апоптоз β-клеток при СД2 (рис. 1)
^ Рис. 1. Формы сахарного диабета
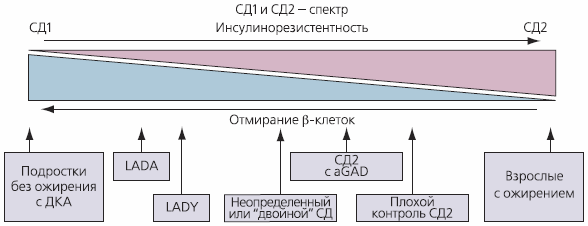
Примечание. Здесь и далее: LADA - медленнопрогрессирующий аутоиммунный СД взрослых; LADY - медленнопрогрессирующий аутоиммунный СД у молодых; aGAD - декарбоксилазаглутаминовой кислоты.
Приведем лишь некоторые факты, свидетельствующие о неоднородности СД:
- Диабетический кетоацидоз (ДКА) встречается при СД2.
- У 42 % афроамериканцев, 4,2 % канадских индейцев, 30 % латиноамериканцев при манифестации СД2 определяется кетоз или классический ДКА, при этом С-пептид в норме или повышен, уровни антител к островковым клеткам и декарбоксилазе глутаминовой кислоты (GAD) в норме.
- У мышей линии NOD без ожирения выявлена ИР до деструкции β-клеток и при отсутствии гипергликемии.
- При формировании деструкции β-клеток имеют значение неиммунологические процессы.
- Повышение заболеваемости СД1 в течение последних 10 лет, особенно у детей до 5 лет, – скорее влияние окружающей среды, чем следствие генетических изменений, произошедших за короткий промежуток времени. Решающей причиной здесь может быть рост индекса массы тела (ИМТ) как фактора формирования ИР [11].
- Повышение заболеваемости и СД1, и СД2 у детей и подростков коррелирует с увеличением распространенности среди них ожирения и малоподвижного образа жизни.
У взрослых пациентов при выявлении нарушения углеводного обмена давно разработан четкий алгоритм действий врача, учитывающий разнообразие форм СД (рис. 2). Этот алгоритм на сегодняшний день может практически без изменений применяться в практике детского эндокринолога. Маркером ургентного состояния в диабетологии может служить гипергликемия при наличии кетонемии (ацетонурии). Именно это состояние требует немедленной госпитализации и начала инсулинотерапии. Гипергликемия без кетонемии, особенно при наличии семейного диабетологического анамнеза и ожирения, неургентна, поэтому пациент может быть обследован в рамках стационарсберегающих технологий в условиях детского окружного эндокринологического отделения для верификации диагноза и подбора терапии. Эта тактика увеличивает доверие между врачом и пациентом, а в дальнейшем – приверженность больного назначениям эндокринолога. Но определение антител к GAD и индекса НОМА как маркера ИР требует времени для проведения дорогостоящих обследований и получения их результатов. Это делает актуальным использование экспресс-тестов на приеме эндокринолога для первичной верификации диагноза и выбора тактики ведения.
^ Рис. 2. Алгоритм диагностики взрослых пациентов с впервые выявленным СД
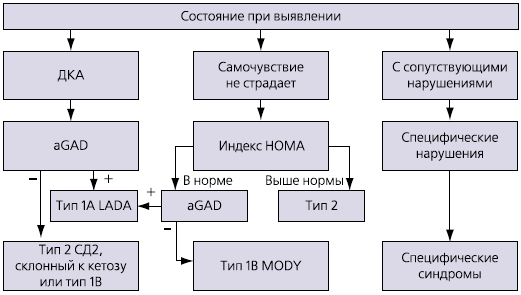
К числу экспресс-тестов, которыми располагает эндокринолог при выявлении нарушения углеводного обмена, относятся:
- глюкометр с возможностью определения β-кетонов (β-гидроксибутирата – β-hydroxybutyrate – β-ОНВ) – в крови (рис. 3);
- глюкометр без возможности определения β-кетонов;
- определение глюкозурии и ацетонурии в моче;
- определение гликированного гемоглобина.
Рис. 3. Глюкометр с возможностью определения β-кетонов Optium Xceed
Дифференциальный диагноз различных форм нарушения углеводного обмена по тестированию кетонов
Положительный кетоновый тест:
- СД типа 1А;
- фульминантный СД типа 1В;
- LADA;
- LADY;
- склонный к кетозу СД2;
- генетические синдромы, связанные с деструкцией β-клеток: синдром Дауна, порфирия, синдром Вольфрама, миотоническая дистрофия, хорея Хантингтона.
Положительный кетоновый тест свидетельствует о дефиците инсулина, при его выявлении необходимы экстренная инсулинотерапия и госпитализация.
Отрицательный кетоновый тест
- СД2, СД типа 1В инсулинрезистентный;
- генетические дефекты функций β-клеток: варианты MODY и мутации митохондриальной ДНК;
- генетически обусловленное нарушение активности инсулина – ИР: лепречаунизм, синдром Рабсона–Менденхолла, СД типа 1А инсулин-резистентный, синдром HAIRAN, липоатрофический диабет;
- заболевания экзокринной части поджелудочной железы: панкреатит, травма/панкреатэктомия, неоплазия, муковисцидоз, гемохроматоз, фиброкалькулезная панкреатопатия;
- эндокринопатии: нарушение функции β-клеток – соматостатинома, смешанный генез – феохромоцитома, альдостеронома, нарушение активности инсулина (ИР) – акромегалия, глюкогонома, болезнь Кушинга, гипертиреоз;
- индуцированная лекарствами и химическими веществами гипергликемия: связанная с нарушением функции β-клеток (пентамидин, такролимус, диазоксид, фенитоин, опиаты; смешанного генеза (циклоспорины, интерферон α, β-адреномиметики); связанная с формированием ИР (никотиновая кислота, глюкокортикоиды, гормоны щитовидной железы, пульстерапия при аутоиммунных заболеваниях);
- генетические синдромы, связанные с ИР: синдром Клайнфельтера, синдром Шеришевского–Тернера, синдром Лоуренса–Муна Бидля, синдром Прадер–Вили;
- гипогликемический синдром в результате доброкачественной гиперплазии β-клеток – некетотическая гипогликемия.
^ Клиническая значимость определения кетонемии
В табл. 1 представлены рекомендации по определению кетонов, предложенные АДА.
Таблица 1. Рекомендации для определения кетонов Американской диабетической ассоциации (2005):
| ^ Кому нужен тест? | Когда? | Частота проведения |
| Больные СД1 | Во время болезни или стресса | Каждые 2–4 часа |
| При постоянном росте гликемии (> 16,7 ммоль/л, возможно, даже > 13,3 ммоль/л) | Пока гликемия не станет < 13,3 ммоль/л | |
| При наличии симптомов ДКА (тошнота, рвота, боль в животе) | До купирования симптомов | |
| Женщины с любым типом СД | Во время беременности | Каждый день |
Определение кетонемии дороже и инвазивнее, чем традиционное определение кетонурии с помощью качественных тест-полосок, но по информативности возможности оптимизации лечения ценность определения кетонов в крови моче, несомненно, выше. В табл. 2 представлены сравнительные возможности тестирования кетонов в крови и в моче.
Таблица 2. Возможности тестирования кетонов в моче и крови
| ^ Измерение β-кетонов в крови | Измерение ацетоацетата или ацетона в моче |
| Бета-кетоны – основной вид кетонов при ДКА | Ацетоацетата или ацетона при ДКА меньше |
| Измерение в крови – точный индикатор количества кетонов в микроциркуляции | Измерение в моче ацетоацетата – косвенный показатель уровня кетонемии |
| Показывает уровень кетонов в крови на данный момент | Отражает уровень кетонов за 2–4 часа до исследования |
| Усовершенствованная технология – малое влияние других веществ в крови на результат | Влияние различных средств на результат исследования |
| Предоставляет точные количественные данные об уровне кетонов | Уровень кетонов оценивается качественно по трем группам: “высокий”, “средний”, “низкий” |
| Результаты не зависят от приема жидкостей | Прием большого количества жидкости дает ложноотрицательный результат, малого количества – ложноположительный |
В настоящее время используются следующие параметры уровня β-кетонов в крови:
- ниже 0,5 ммоль/л – считается нормой;
- 0,5–1,0 ммоль/л – повышенный уровень;
- > 3 ммоль/л – состояние ДКА.
Также велика роль определения β-кетонов при лечении ДКА, т. к. с его помощью осуществляется дифференциальный диагноз между ДКА и гипергликемическим гиперосмолярным некетотическим синдромом (ГГНС; гиперосмолярная кома) и обеспечивается контроль адекватности терапии.
ДКА и ГГНС близки по патогенезу (рис. 4), но существенно различаются по прогнозу. Смертность от ДКА составляет 3,5–5 %, от ГГНС – 15–35 %.
^ Рис. 4. Схема патогенеза ДКА и ГГНС
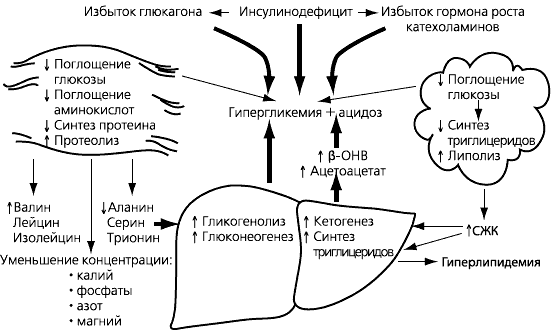
ДКА, особенно в начале, практически не отличается от ГГНС, различия – только метаболические: по уровню кетонемии. В случае ГГНС кетонурия является ложной, присутствуют следы ацетоацетата, которые нельзя дифференцировать от истинного β-ОНВ по визуальной тест-полоске. Только отсутствие гиперкетонемии при выраженной гипергликемии и незначительном ацидозе позволяет заподозрить ГГНС, оптимизировать лечение и в конечном итоге спасти жизнь пациенту.
В оптимизации лечения ДКА роль определения кетонемии также значительна. Нами проведено сравнительное исследование различных протоколов лечения ДКА (рис. 5). В исследование включены 25 детей с впервые выявленным СД1 (17 девочек, 18 мальчиков), которых разделили на две группы: 1-я группа – 13 детей (средний возраст – 11,2 ± 1,2 года), 2-я группа – 12 детей (средний возраст – 9,7 ± 1,5 года). В 1-й группе исследовали b-кетоны крови, во 2-й – ацетон в моче, определение – каждые 3 часа. Показано, что скорость снижения гликемии и увеличения рН достоверно зависит от скорости снижения уровня кетонов крови до нормального значения (ниже 1 нмоль/л). При определении ацетона в моче такой зависимости выявлено не было.
^ Рис. 5. Сравнение двух протоколов лечения ДКА с определением кетонемии и ацетонурии

ДКА был купирован в 1-й группе за 18,7 ± 1,2 часа, во 2-й – за 24,1 ± 1,2 часа (р < 0,05). Можно сделать вывод, что мониторинг кетонемии в капиллярной крови при лечении ДКА (в дополнение к другим показателям) оптимизирует терапию, повышая ее эффективность. Также заслуживают внимания результаты исследования Rizzo Т. и соавт. (1991), в котором рассматривалась взаимосвязь между нарушением метаболизма матери до родов и интеллектом ребенка. В исследование были включены 223 беременные и их единственные дети, причем у 89 женщин имел место прегестационный СД, у 99 – гестационный СД, а у 35 нарушения метаболизма углеводов отсутствовали. Выявлено, что нарушение метаболизма матери во время беременности влияет на психосоциальное развитие детей. Гестационная кетонемия ведет к снижению IQ ребенка, что является основанием для постоянного мониторинга кетоза у женщин как с СД, так и без нарушений углеводного обмена (предотвращение ацетонемии при голодании).
Было проведено рандомизированное клиническое исследование по сравнению эффективности контроля уровня β-ОНВ в крови с контролем кетонурии. В нем доказано, что контроль кетонемии снижает количество госпитализаций у детей, подростков и молодых взрослых с СД1 при присоединении интеркуррентных заболеваний (Laffel L.M. и соавт., 2005). Всего в исследование включены 123 пациента в возрасте от 3 до 22 лет, которые вместе с семьями прошли Школу обучения самоконтролю гликемии, кетонемии и кетонурии при болезни. Больных рандомизировали в 2 группы: у 62 человек определяли кетонемию, у 61 – кетонурию в динамике. Гликемию оценивали более 3 раз в день, кетоны – во время острого заболевания или стресса при гликемии более 13,9 ммоль/л или при присоединении симптомов ДКА: слабости, тошноты, рвоты и др. Учитывали дни болезни, продолжительность гипергликемии и кетоза, госпитализации, необходимость неотложной интенсивной терапии при госпитализации.
Всего зарегистрировано 578 дней болезни за 21 548 дней исследования. В группе кетонемии определение кетонов проводили во время болезни достоверно чаще (276 на 304 эпизода, 90,8 %), чем в группе кетонурии (168 на 274 эпизода, 61,3 %; р < 0,001). Потребность в госпитализациях, в т. ч. с проведением интенсивной терапии, была достоверно ниже в группе кетонемии: 38/100 пациентов против 75/100 пациентов (р = 0,05). Таким образом, у пациентов с СД1 определение кетонемии во время болезни предпочтительнее, чем определение кетонурии.
Включение самоконтроля кетонемии в стандарт ведения пациентов во время острых заболеваний и при появлении симптомов ДКА может снижать количество госпитализаций с проведением интенсивной терапии по сравнению с контролем кетонурии и потенциально удешевляет лечение больных СД1.
При обсуждении необходимости мониторинга кетонемии у пациентов, страдающих СД, обязательно встает вопрос о ценовых параметрах данного варианта оптимизации обследования и лечения. В связи с этим целесообразно привести результаты итальянского исследования по затратной эффективности контроля β-ОНВ в крови у детей с ДКА (Vanelli M. и со-авт., 2003). Лечение было одинаковым у всех пациентов: стандартные низкие дозы инсулина и инфузионный протокол. Участвовавшие в исследовании 33 ребенка были рандомизированы в 2 группы: у 16 пациентов (1-я группа) определялась кетонемия, у 17 больных (2-я группа) – кетонурия. В начале исследования кетонемия определялась каждый час, причем на забор крови не влияла степень дегидратации. Во 2 группе из-за дегидратации образцы мочи для ежечасного мониторинга удавалось собрать лишь у половины пациентов. В 1-й группе ДКА был купирован на 5,8 ± 0,5 часа раньше, чем во 2-й. Была выявлена четкая корреляция между снижением уровней гликемии и β-ОНВ, с одной стороны, и повышением артериального уровня рH, с другой (к = -0,82; р = 0,001). Результаты этого исследования практически совпадают с данными собственного исследования авторов (рис. 5). Однако зарубежные авторы делают более широкий вывод, согласно которому протокол лечения ДКА с использованием мониторинга кетонемии позволяет быстрее переводить пациента из палаты интенсивной терапии в связи с купированием ДКА. Более раннее выведение больных из ургентного состояния сохраняет 22 часа рабочего времени персонала палаты интенсивной терапии и снижает стоимость ведения больных на сумму, большую (2940 евро), чем стоимость мониторинга кетонемии.
Таким образом, добавление мониторинга кетонемии к традиционным маркерам метаболической декомпенсации, таким как гликемия и кислотно-щелочное состояние крови, при лечении ДКА, обусловленного СД1, способствует более эффективному и быстрому выведению больных из этого состояния, снижая продолжительность и стоимость стационарного лечения.
Выводы
- Определение кетонов в крови должно быть обязательно включено в диагностику нарушений углеводного обмена и самоконтроль пациента с СД для своевременной коррекции терапии и профилактики ДКА.
- Определение кетонов в крови должно быть обязательно включено в протокол лечения ДКА в стационаре для своевременной коррекции терапии, диагностики ГГНС и контроля адекватности лечения.
ЛИТЕРАТУРА
1. Rewers M, Pihoker C, Donaghue K, et al. Assessment and monitoring of glycemic control. ISPAD consensus guidelines 2007. Pediatr Diabetes 2007;8:25–29.
2. Donath MY, Ehses JA. Type 1, type 1.5 and type 2 diabetes: NOD the diabetes we thought it was. Proc Natl Acad Sci USA 2006;103:12217–18.
3. Pozzilli P, Buzzetti R. A new expression of diabetes: double diabetes. Trends Endocrinol Metab 2007;18:52–57.
4. Libman IM, Becker DJ. Coexistence of type 1 and type 2 diabetes mellitus: “double” diabetes? Pediatr Diabetes 2003;4:110–13.
5. The DIAMOND project group: incidence and trends of childhood type 1 diabetes worldwide 1990-1999. Diabet Med 2006;23:857–66.
6. Hypponen E, Virtanen SM, Kenward MG, et al. Childhood diabetes in Finland study group. obesity, increased linear growth, and risk of type 1 diabetes in children. Diabetes Care 2000;23:1755–60.
7. Hermann R, Knip M, Veijola R, et al. Temporal changes in the frequencies of HLA genotypes in patients with type 1 diabetes – indication of an increased environmental pressure? Diabetologia 2003;46:420–25.
8. Adeghate E, Schattner P, Dunn E. An update on the etiology and epidemiology of diabetes melli-tus. Ann NY Acad Sci 2006;1084:1–29.
9. Rapaport R, Wallach E, Greig F, et al. Diabetes mellitus: type 1 or type 2? J Pediatr 2001;138:612.
10. Libman IM, Pietropaolo M, Arslanian SA, et al. Changing prevalence of overweight children and adolescents at onset of insulin-treated diabetes. Diabetes Care 2003;26:2954–56.
11. Wilkins TJ. The accelerator hypothesis: weight gain as the missing link between type 1 and type 2 diabetes. Diabetologia 2001;44:914–22.
12. Matarese G, Sanna V, Lechler RI, et al. Leptin accelerates autoimmune diabetes in female NOD mice. Diabetes 2002;51:1356–61.
13. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2006;29(Suppl. 1):S43–48.
14. Rizzo T, Metzger BE, Burns WJ, et al. Correlations between antepartum maternal metabolism and child intelligence. N Engl J Med 1991; 325(13):911–16.
15. Laffel LM, Wentzell K, Loughlin C, et al. Sick day management using blood 3-hydroxybutyrate (3-OHB) compared with urine ketone monitoring reduces hospital visits in young people with T1DM: a randomized clinical trial. Diabet Med 2006;23(3):278–84.
16. Vanelli M, Chiari G, Capuano C. Cost effectiveness of the direct measurement of 3-beta-hydroxybuty-rate in the management of diabetic ketoacidosis in children. Diabetes Care 2003;26(3):959.
