Книга посвящена одному из самых малоизученных, но чрезвычайно важных разделов медицины соединительной ткани и ее основной структурной составляющей коллагену
| Вид материала | Книга |
СодержаниеСтроение молекулы коллагена Биосинтез коллагена Обмен коллагена |
- Эликсир красоты и здоровья, 2843.71kb.
- 1. Общая характеристика системы соединительной ткани, 474.44kb.
- А мышечной ткани, б соединительной ткани, в эпителиальной ткани, 45.82kb.
- Книга английского ученого М. Барбсра посвящена одному из самых скандальных событий, 4957.44kb.
- Экспериментально-клиническое обоснование применения импульсного низкочастотного электромагнитного, 438.35kb.
- Компьютерная программа «Методика диагностики и алгоритмированного выбора терапии Дисплазии, 1454.14kb.
- Гордейчик Алексей Владимирович исследование, 3008.68kb.
- Книга предназначена для научных работников, преподавате, 3085.69kb.
- Инфекционный фактор и показатели липидного спектра у детей с системными заболеваниями, 157.05kb.
- Перечень медицинских услуг при заболеваниях костно-мышечной системы и соединительной, 58.61kb.
2.2. КОЛЛАГЕНОГЕНЕЗ
Представляет собой особый физиологический механизм производства коллагена.
^ Строение молекулы коллагена
Молекула коллагена состоит из трех полипептидных α -цепей, взаимосвивающихся в структуру тройной правозакрученной суперспирали наподобие трехжильной веревки. Каждая из полипептидных α -цепей имеет молекулярную массу 100 000-120 000, содержит в среднем 1200 аминокислот и структурно представляет собой левозакрученную спираль. Следовательно, общая молекулярная масса молекулы коллагена составляет 300 000—360 000. Две цепи обычно идентичны, а третья несколько отличается от первых двух.
Существует 4 вида α -цепей, в зависимости от их сочетания и возникает тот или иной тип коллагена, характерный для разных тканей.
Длина суперспирали варьирует в зависимости от типа коллагена.
У человека преобладает I тип коллагена, из которого состоят преимущественно кости, сосуды и на 80—90% — кожа. Его спираль имеет длину около 300 нм, диаметр 1,5 нм и построена из двух α1-цепей и одной α2-цепи. Остальные 10—15% коллагена кожи составляет его III тип, для которого характерно особенно высокое содержание гидроксипролина, гидроксилизина и сиаловых кислот, придающих ему высокую прочность.
Существует два типа связи между полипептидными цепями. Одна из них латеральная, или боковая, поперечная, в образовании которой принимают участие полисахариды и гексозы. Именно поперечные связи между этими тремя α-цепями и ориентируют последовательно повторяющиеся области в молекуле коллагена, которые под электронным микроскопом определяются как полосы, или первичную исчерченность. Другая межполипептидная связь — «голова в конец» в комбинации с поперечными связями перекрывает 1/4 часть молекулы коллагена, что выглядит уже как ее вторичная более крупная исчерченность, внутри которой определяется первичная.
Молекулярные связи как внутри каждой отдельной α-цепи, так и между цепями обеспечивает стабильность всей спиралевидной молекулы. В тоже время такое спиральное строение дает возможность молекуле коллагена в определенных пределах растягиваться и сжиматься.
^ Биосинтез коллагена
Биосинтез коллагена происходит в коллагенпродуцирующих клеточных элементах — фибробластах и фиброцитах, как внутри-, так и внеклеточно (рис. 5).
Фибробласты — это биосинтетические фабрики, вырабатывающие разнообразные соединения:
- компоненты межклеточного матрикса дермы;
- волокна соединительной ткани: коллаген и эластин;
- ферменты;
- сигнальные молекулы и проч.
Все начинается с образования из ядерной РНК проколлагеновой РНК-матрицы. Затем, с помощью этой матрицы в цитоплазме этих клеток осуществляется синтез полипептидных α-цепей проколлагена с последующей их модификацией под действием специфических энзимов и железа (Fe++), аскорбиновой и α-кетаглутаровой кислот. При этом происходит гидроксилирование аминокислот пролина и лизина.
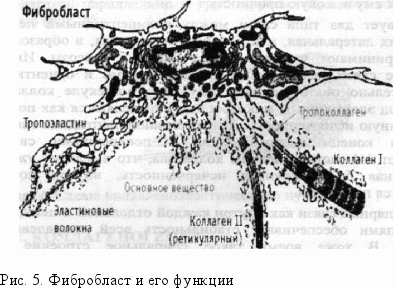
Эта растворимая, промежуточная форма коллагена, состоящая из мономерных молекул, называется еще тропоколлагеном.
Здесь же идет выравнивание цепей, сшивание их по С-концевым пропептидам с образованием дисульфидных мостиков. Потом начинает формироваться спираль, которая как застежка молнии, быстро распространяется на всю цепь до самого N-конца. Наконец, все цепи скручиваются в суперспирали — триплетные молекулы проколлагена и выбрасываются из клетки во внеклеточный матрикс.
После выхода проколлагена на поверхность клеточной мембраны, молекулы проколлагена фиксируются между собой за счет образования между ними дисульфидных мостиков. Параллельно этому, в присутствии медьсодержащего фермента лизилоксидазы, идет процесс окисления некоторых остатков лизина или гидроксилизина до реакционных альдегидов, что и обеспечивает окончательную сборку молекул коллагена и формирование из него субфибрилл и фибрилл. Это сопровождается дальнейшим изменением молекул, определяемым характером поперечных и концевых связей, образующихся за счет остатков лизина. Здесь же готовые элементарные единицы коллагена собираются в полимерные молекулы, а затем в отдельные волокна и пучки.
^ Обмен коллагена
В нормальных условиях жизнедеятельности человека коллаген синтезируется клетками довольно быстро. Однако разрушается он очень медленно. Период его полураспада составляет 50—60 дней. Такое значительное преобладание синтеза коллагена над его деструкцией является важной особенностью обмена данного белка и обусловлено несколькими моментами.
Во-первых, коллаген медленно «зреет», т. е. формируется в полноценные структурные единицы. Причем на процесс созревания влияет биологический возраст человека, с возрастом он созревает еще медленнее.
Во-вторых, значительное накопление «молодого» коллагена в виде тончайших волокон вызвано особой необходимостью и производится, так сказать «на всякий случай». Дело в том, что большое количество коллагеновых волокон может в любое время потребоваться при травматическом повреждении дермы для регенерационных процессов при заживлении ее раневых дефектов.
И, наконец, коллаген, особенно «зрелый», обладает необычайной устойчивостью и практически недоступен действию протеолитических ферментов. Конечно, в организме существуют энзимы, способные деструктурировать коллаген (например, лизосомальные ферменты клеток). Но для того, чтобы они смогли оказать свое разрушающее действие, им, сначала нужно покинуть лизосомы и выйти наружу из клеток (что при полноценной неповрежденной клеточной мембране невозможно), а во-вторых, сам коллаген должен быть денатурирован. Только тогда он теряет свою устойчивость к лизосомальным протеиназам.
Основным ферментом, ответственным за деструкцию коллагена, является коллагеназа, причем она специфична для обоих основных типов коллагена (I и III). Эта интерстициальная коллагеназа обладает поистине безграничными возможностями. Так, она фактически контролирует коллагеногенез во всех органах, и в норме, и при патологии.
Источником коллагеназы в дерме служат все те же фибробласты. Этот фермент отщепляет примерно четверть молекулы коллагена с ее С-конца, поле чего вступают в дело и другие протеазы. Протеолитические ферменты (пепсин, трипсин, папаин) расщепляют лишь растворимые фракции проколлагена. Разрушать коллаген способны лейкоциты, благодаря содержащимся в них коллагеназе и ферментам, гидролизующим мелкие пептиды до аминокислот.
При гидролизе происходит разрыв пептидной связи в спиральной области коллагеновой молекулы. При физиологической температуре частично расщепленные коллагеновые молекулы денатурируют, превращаются в желатин, и становятся доступными субстанциями для других ферментов.
При распаде коллагена высвобождаются отдельные аминокислоты, большая часть которых опять вовлекается в метаболизм.
Однако одна характерная для коллагена аминокислота — гидроксипролин не способна усваиваться повторно и большая ее часть экскретируется с мочой. Это требует ее дополнительного образования.
