Лекции 1-3
| Вид материала | Лекции |
- Критерии оценки качества лекции, 33.79kb.
- Методическая разработка лекции для преподавателя тема лекции, 39.55kb.
- План лекций порядковый номер лекции Наименование лекции Перечень учебных вопросов лекции, 36.49kb.
- Методические рекомендации по подготовке и проведению лекции Лекции, 73.92kb.
- Такие разные лекции, 101.86kb.
- Ю. Б. Гиппенрейтер Введение в общую психологию. Лекции 1,2, 45.86kb.
- Лекция: Историк. Гражданин. Государство. Опыт нациестроительства Мы публикуем расшифровку, 472.92kb.
- План лекции: Что такое «сердечные катастрофы»? Фибрилляция желудочков сердца, 178.21kb.
- В. Ф. Гегель лекции по философии истории перевод А. М. Водена Гегель Г. В. Ф. Лекции, 6268.35kb.
- Ответственность за компьютерные преступления (лекции), 20.89kb.
Лекции 1-3
I. Общие сведения о процессе сульфирования
Сульфированием называют процесс введения в молекулу органического соединения сульфогруппы -SO3H.
Чаще всего под сульфированием понимают замещение атома водорода в органическом соединении сульфогруппой.
Различают С-, N- и О-сульфирование. Последнее называют также сульфатированием.
Субстратом (исходным веществом) при сульфировании служат, главным образом, ароматические и гетероароматические соединения и их производные. Реже используются вещества алифатического и алициклического ряда. Среди них наибольшее значение в синтезе сульфо-БАВ имеют полисахариды и стероиды. В ряде случаев сульфируются сами лекарственные вещества.
Сульфирующими агентами являются концентрированная серная кислота, олеум, хлорсульфоновая кислота, серный ангидрид, его комплексные соединения и некоторые другие вещества.
Сульфогруппа вводиться в молекулу соединения как с целью придания ему новых свойств (снижения токсичности лекарственного препарата, придания ему несколько иной биологической активности, повышения его растворимости в воде, что создает предпосылки для получения инъекционных лекарственных форм), так и с целью дальнейшей замены сульфогруппы на гидроксил, аминогруппу и т.п. Сульфокислоты являются промежуточными веществами в синтезе ряда химфармпрепаратов (диазолин, амидопирин и др.).
Число синтетических сульфокислот очень велико, и они широко используются в практике.
Из природных сульфокислот следует, прежде всего, отметить аминосульфокислоты: таурин и цистеиновую кислоту, которые играют большую роль в процессе всасывания жиров в организме млекопитающих, а также гепарин и хондроитинсульфат
При полном окислении тиоловой группы цистеина последний превращается в цистеиновую кислоту, которая, декарбоксилируясь, превращается в таурин. Таурин образует конъюгат с холевой кислотой, который способствует растворению липидов в воде и делает их доступными для гидролитических ферментов - липаз:
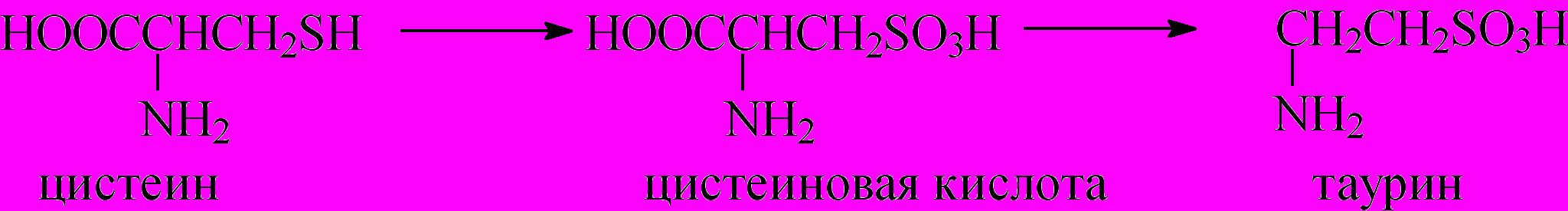
 Гепарин
ГепаринГепарин - специфический гетерополисахарид (молекулярная масса 17000 - 20000), препятствующий свертыванию крови человека и животных. Он содержится в печени, легких, селезенке, щитовидной железе, крови и, вероятно, в других тканях и органах. Гепарин выпускается в качестве лекарственного препарата для регулирования свертываемости крови и лечения ряда других заболеваний.
II. Сульфирование ароматических соединений серной кислотой, олеумом и сульфотриоксидом
Целевым продуктом сульфирования ароматических соединений являются сульфоновые кислоты (сульфокислоты).
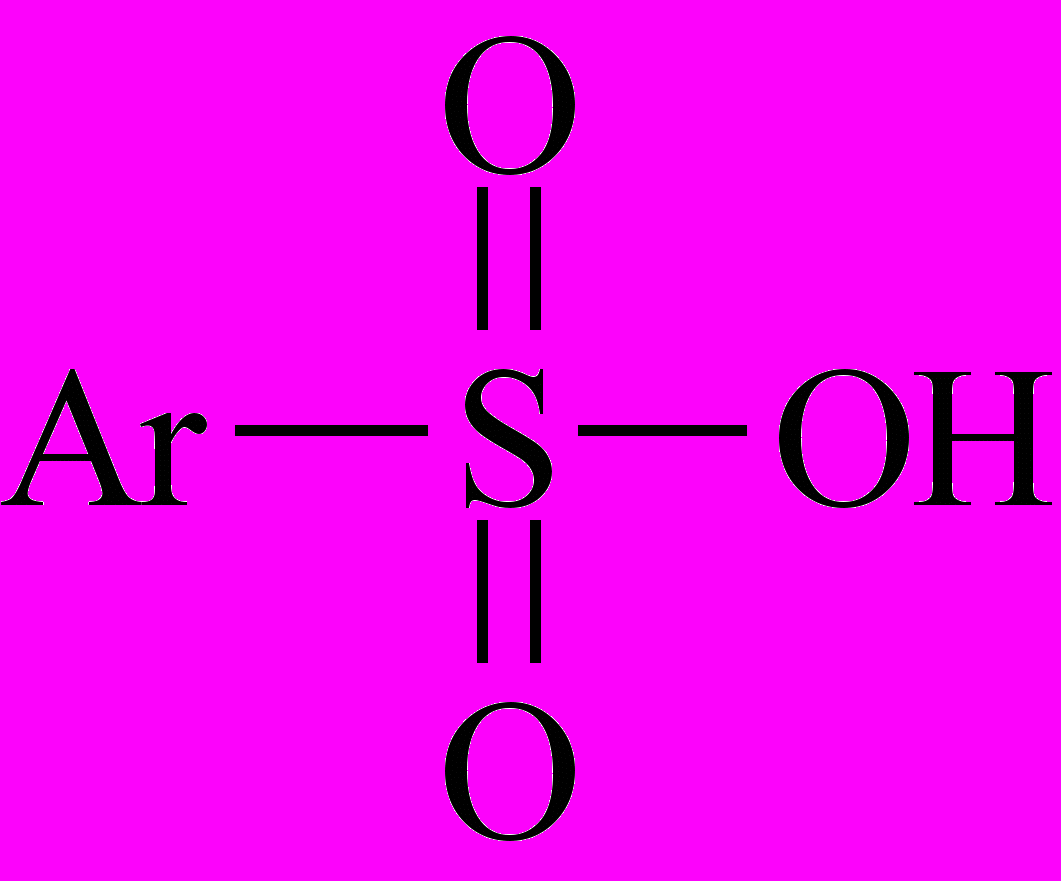
Сульфокислоты (ароматические и алифатические) называют, добавляя к названию основы окончание «сульфокислота» («сульфоновая кислота»). Они, как правило, являются твердыми гигроскопичными кристаллическими веществами, хорошо растворимыми в воде. Ароматические сульфокислоты по силе близки к минеральным. В разбавленных водных растворах они практически полностью диссоциированы.
1.Сульфирующие агенты: строение свойства и область применения
А)Безводная серная кислота плавится при +10,4оС, кипит + 296оС с разложением до образования азеотропной смеси состава 98,3% H2SO4 и 1,7% Н2О. При комнатной температуре представляет собой полимер, образованный за счет водородных связей, молекулы которого при повышении температуры разрушаются:

Жидкая 100%-ая серная кислота является ионизирующим растворителем, однако, ее собственная ионизация незначительная и соответствует уравнению:

Серная кислота смешивается с Н2О и SO3 в любых соотношениях. С водой серная кислота образует гидраты с характерными температурами плавления: H2SO4.Н2О (tпл = +8,5оС), H2SO4.2Н2О (tпл = -39оС), H2SO4.4Н2О (tпл = -28оС). В водных растворах она полностью диссоциирована:

Для промышленного сульфирования серной кислотой чаще всего используют 92-93%-ную серную кислоту (купоросное масло) и 98-100%-ную серную кислоту. Концентрированная H2SO4 является довольно сильным окислителем, особенно при нагревании.
Б)Олеум образуется при растворении SO3 в концентрированной серной кислоте и представляет собой смесь кислот (H2SO4, H2S2O7, H2S3O10, H2S4O13):

серная кислота двухсерная (пиросерная) трисерная кислота H2SO4 кислота H2S2O7 H2S3O10 и т.д.
При концентрации сульфотриоксида 20 – 25% и 60 – 65% олеум представляет собой густую маслянистую, дымящуюся на воздухе жидкость. Пары над олеумом состоят главным образом из SO3, а в парах над серной кислотой SO3 почти нет. При других концентрациях SO3, олеум при комнатной температуре является твердым веществом.
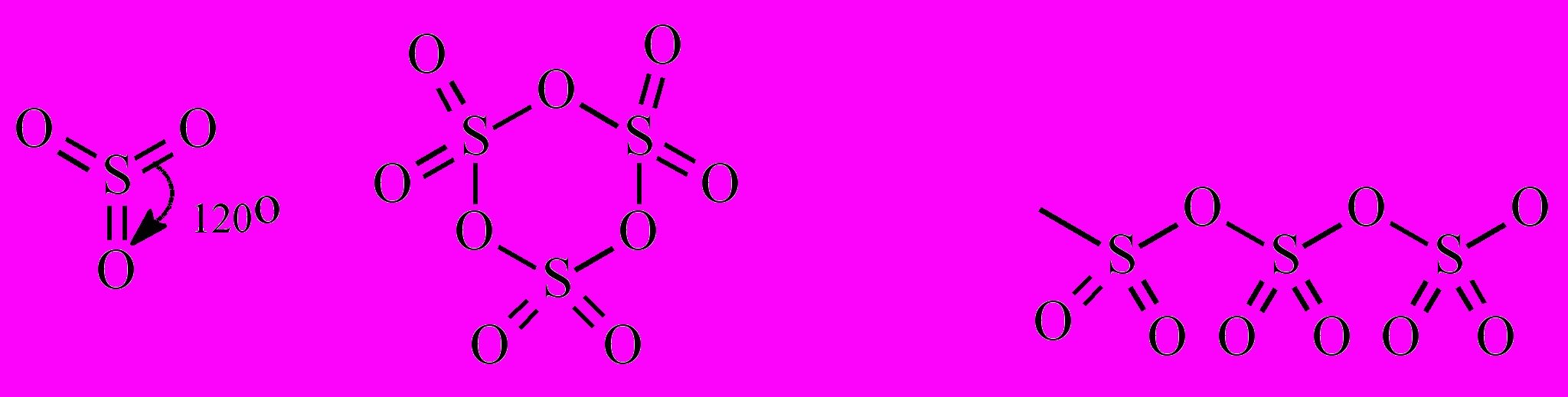
В)Серный ангидрид – это общее название нескольких модификаций триоксида серы. Молекула SO3 существует в виде мономерной, тримерной и полимерной форм:
SO3 мономер (SO3)3 тример (SO3)n полимер
В газовой фазе и в разбавленных неводных растворах триоксид серы находится в мономерной форме. При конденсации паров SO3 образуется летучая бесцветная жидкость (tк=44,8оС), состоящая преимущественно из циклических тримерных молекул (SO3)3. При охлаждении до 16,8оС она затвердевает с образованием прозрачных кристаллов. Эта форма SO3 неустойчива и при хранении или в присутствии следов влаги превращается в устойчивую асбестовидную модификацию - шелковистые, похожие на асбест нити (SO3)n. Полимеризацию SO3 предотвращают введением В2О3, Р2О5 и других ингибиторов этого процесса.
Для сульфирования серный ангидрид получают: а) обжигом пирита и последующим каталитическим окислением SO2 в SO3; б) из баллонов под давлением в жидком стабилизированном виде, поступающих на предприятия со специализированных заводов; в) десорбцией из высокопроцентного олеума при нагревании. Остающаяся после десорбции серного ангидрида 100%-ная серная кислота может быть использована в других производствах. Первый метод применяют на производствах большой мощности, например, заводы по синтезу поверхностно-активных веществ (ПАВ) сульфированием (сульфатированием) первичных спиртов, олефинов, алкилбензолов и т.п. Остальные - на предприятиях с малой мощностью, например, на ХФЗ.
