Предмет: Хімія Мета
| Вид материала | Документы |
- Предмет: Органічна хімія Мета, 369.43kb.
- Робоча програма навчальної дисципліни екоаналітична хімія напряму підготовки 040101, 154.06kb.
- Робоча програма навчальної дисципліни математичне моделювання аналітичних систем напряму, 172.48kb.
- Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених, 622.54kb.
- Структура дисципліни «Біологічна хімія», 150.63kb.
- Робоча програма навчальної дисципліни хемометричні методи аналізу даних напряму підготовки, 113.56kb.
- Паспорт спеціальності 02. 00. 01 неорганічна хімія, 11.45kb.
- Методичні рекомендації щодо вивчення хімії в 2011-2012 н р. На вивчення навчального, 96.27kb.
- Робоча програма педагогічної практики галузі знань 0401. Природничі науки напрямку, 434.43kb.
- Робоча програма навчальної дисципліни актуальні проблеми фізичної хімії (викладається, 140.5kb.
1 2
Опис дисципліни
Предмет: Хімія
Мета: Оволодіння знаннями про властивості, будову, способи
одержання і застосування хімічних елементів та їх
сполук; оволодіння теоретичними основами органічної
хімії, розкриття суті механізмів хімічних процесів, які
протікають у природі, формування навичок виконання
хімічного експерименту як основи екологічного
контролю стану довкілля, створення наукової бази для
вивчення професійно-орієнтованих та спеціальних
дисциплін.
| Курс: перший семестр: перший, другий | Напрям, спеціальність, освітньо-кваліфікаційний рівень | Характеристика навчальної дисципліни |
| Кількість кредитів національних: 4 ECTS 6,0 Модулів: 5 Змістових модулів: 30 Загальна кількість годин: 216 Тижневих годин: І сем. – 5; ІІ сем. - 3 | „Екологія і охорона навколишнього середовища” Шифр та назва спеціальності: 6.040106 – „Екологія, охорона навколишнього середовища та збалансоване природокористування” Освітньо-кваліфікаційний рівень: „Бакалавр” | Нормативна Рік підготовки: 1 Семестр: 1,2 Лекції (теоретична підготовка): 35 год. Лабор.-практичні: 85 год. Самост. робота: 96 год. Вид контролю: І сем.- іспит; ІІ сем.- іспит |
3.1. Мета вивчення дисципліни
Хімія - природнича наука, яка вивчає речовини та процеси їх перетворення.
Хімічний характер процесів в природних об’єктах, організмі рослини і в грунтах обумовлює їх підкорення основним хімічним закономірностям, в життєдіяльності рослин велику роль відіграють ряд біогенних макро- та мікроелементів, як металів, так і неметалів, багато елементів є забруднювачами довкілля..
Завдання прискореного розвитку сільськогосподарського виробництва вимагають його широкої хімізації, що, в свою чергу, вимагає від спеціалістів-екологів знання властивостей використовуваних хімічних речовин, розуміння механізму їх дії в організмі рослини, тварини, в грунті для забезпечення раціонального, економічного та безпечного їх застосування.
Такі напрямки діяльності спеціалістів як контроль за станом грунтів, агрохімічні заходи, заходи по захисту рослин від бур'янів, шкідників та хвороб неможливі без глибокого знання неорганічної хімії та певних навиків виконання аналітичних операцій.
Хімія тісно пов'язані з такими фаховими дисциплінами як біохімія, фізіологія рослин, ґрунтознавство, агрохімія, захист рослин, екологія, агроекологія, екологічна хімія та ін.
Навчальна дисципліна „Хімія” для бакалаврів-екологів є комплексною і включає складові: неорганічну хімію, органічну хімію, біогеохімію. Зміст дисципліни адаптовано до спеціальності; акцентовано увагу на хімічних процесах, що відбуваються в навколишньому середовищі, закономірностях їх перебігу, можливостях впливу на них.
Основною метою вивчення хімії є оволодіння знаннями про властивості, будову, способи одержання і застосування хімічних елементів та їх сполук; оволодіння теоретичними основами органічної хімії, розкриття суті механізмів хімічних процесів, які протікають у природі, формування навичок виконання хімічного експерименту як основи екологічного контролю стану довкілля, створення наукової бази для вивчення професійно-орієнтованих та спеціальних дисциплін.
Основні завдання курсу:
- вивчення основ хімії як складової фундаментальної підготовки фахівців з екології;
- забезпечити спеціалістів-екологів певним мінімумом знань хімії, який дозволяє засвоїти профільні дисципліни та сприяє розумінню хімічних аспектів заходів, націлених на підвищення продуктивності галузей рослинництва;
- виробити у студентів навики експериментальної роботи, уміння поводитися з приладами, грамотно обробляти результати досліджень і самостійно робити відповідні висновки з одержаних дослідних даних;
- розвинути у студентів навички самостійного пошуку, виховати вміння застосовувати одержані знання на практиці:
- забезпечити можливість екологам кваліфіковано давати економічні обґрунтування різних заходів з охорони докілля.
В результаті вивчення хімічних дисциплін студент повинен знати:
- основні закони і концепції хімії;
- сучасні уявлення про будову речовин;
- основні термодинамічні і кінетичні закономірності хімічних процесів;
- природу процесів утворення розчинів та сутність і кількісну характеристикуреакцій, що відбуваються в них (електролітичнадисоціація, гідроліз, окисно-відновні процеси, комплексоутворення);
- властивовті біогенних хімічних елементів, сполук та їх роль у навколишньому природному середовищі;
- особливості будови, властивості органічних сполук та їх роль для живої природи, техніки, суспільства;
- хімічні аспекти стану навколишнього середовища і його охорони від забруднень продуктами життєдіяльності людини;
вміти:
-поянювати і узагальнювати хімічні явища, процеси, реакції, що відбуваються в навколишньому середовищі, або на яких базуються уявлення і ефекти прикладних дисциплін технологічного спрямування;
- виконувати підготовчі і основні операції під час проведення хімічного експерименту;
- користуватися сучасним хімічним обладнанням для досліджень якісного ікількісного складу об’єктів навколишнього природного середовища, а також факторів, що на нього впливають;
- самостійно проводити хімічний експеримент, оформляти його результати у вигляді звіту в лабораторному журналі;
- виконувати розрахунки за рівняннями хімічних реакцій, статистичну і графічну обробку результатів досліджень, вирішувати розрахункові задачі;
- знати і вміти користуватися навчальною, методичною та довідковою літературою з хімії.
Навчальний курс дисципліни „Хімія” проводиться протягом двох семестрів та має такі види робіт:
- аудиторні заняття: 18 лекцій та 43 лабораторно-практичних заняття;
- самостійна робота студентів та поточний контроль: виконання 14 індивідуальних завдань та 8 тестових контрольних робіт;
- рубіжне оцінювання: 6 контрольних робіт, 1 реферат;
- вихідний контроль: іспит – І семестр, іспит – ІІ семестр.
Загальний обсяг годин складає : лекцій – 35 год., лабораторно-практичних занять – 85 год., самостійна позааудиторна робота студентів – 96 год.
Вивчення дисципліни розбито на дві частини: „Неорганічна хімія з основами біогеохімії” і „Органічна хімія” та на 5 змістових модулів:
Модуль 1. Основні закономірності хімічних перетворень.
Модуль 2. Розчини. Окисно-відновні процеси. Комплексні сполуки.
Модуль 3. Хімія елементів. Основи біогеохімії.
Модуль 4. Вуглеводні. Спирти. Карбонільні сполуки.
Модуль 5. Карбонові кислоти. Вуглеводи. Нітрогеновмісні сполуки. Гетероциклічні сполуки.
Розбиття дисципліни за видами робіт на модулі
| № | Види робіт | І модуль | 2 модуль | 3 модуль | 4 модуль | 5 модуль | Всього |
| 1. | Лекції | 3 | 3 | 2 | 5 | 5 | 18 |
| 2. | Лабораторно-практичні заняття | 6 (в т.ч. 1-контр. роб.) | 9 (в т.ч. 2-контр. роб.) | 8 (в т.ч.1- контр. роб.) | 10 (в т.ч.1- контр. роб.) | 10 (в т.ч.1- контр. роб.) | 43 (в т.ч. 6- контр. роб.) |
| 3. | Індивідуальні завдання | 4 | 6 | - | 2 | 2 | 14 |
| 4. | Тестові контрольні роботи | - | - | - | 4 | 4 | 8 |
| 5. | Реферат | - | - | 1 | - | - | 1 |
| 6. | Контрольні роботи | 1 | 2 | 1 | 1 | 1 | 6 |
| | Іспит | - | - | 1 | - | 1 | 2 |
Структура навчальної дисципліни „Хімія”
за модульно-рейтинговою системою
| № залікового кредиту | № і назва модулю | Змістові модулі | Види навчальної діяльності і кількість годин | Форми контролю | |||
| Усього | Лекції | Лаб.-практ. | Самост. робота | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| І – ІІІ - навчальна дисципліна, 6 кредитів | Модуль І. Основні поняття і закони хімії. Основні законо-мірності перебігу хімічних реакцій | 1. Предмет та методи хімії і біогеохімії. Основні стехіометричні закони хімії | 7 | 1 | 2 | 4 | Модульна контрольна робота № 1 |
| 2. Класи неорганічних сполук | 7 | - | 2 | 5 | |||
| 3. Будова атомів хімічних елементів. Періодичний закон і періодична система Д. І. Менделєєва | 8 | 1 | 2 | 5 | |||
| 4. Хімічний зв’язок | 3 | 1 | - | 2 | |||
| 5. Основні закономірності перебігу хімічних реакцій | 13 | 2 | 4 | 7 | |||
| Всього | 38 +2КР | 5 | 10 +2КР | 23 | |||
| Модуль ІІ. Розчини та їх властивості. Окисно-відновні процеси. Комплексні сполуки. | 6. Розчини, загальні поняття, концентра-ція, колегативні властивості | 9 | 1 | 2 | 6 | Контрольні роботи № 2, 3 | |
| 7. Розчини електролітів. Електролітична дисоціація, рН | 9 | 1 | 2 | 6 | |||
| 8. Гідроліз солей. Буферні розчини | 8 | - | 4 | 4 | |||
| 9. Окисно-відновні процеси | 10 | 1 | 2 | 6 | |||
| 10. Метали | 6 | - | 2 | 3 | |||
| 11. Комплексні сполуки | 5 | - | 2 | 2 | |||
| Всього | 47 +4КР | 6 | 14 +4КР | 27 | |||
| МодульІІІ. Хімія елементів. Основи біогеохімії. | 12. Біосфера як вищий ступінь організації природної системи. Хімічні елементи – основа живої та неживої природи. Біогеохімічна міграція сполук. | 2 | 2 | - | - | Модульна контрольна робота № 4. Реферат | |
| 13. Біогеохімічні цикли і фізіологічна роль деяких макро- і мікроелементів. Біогео-хімічне районування | 4 | 2 | - | 2 | |||
| 14. Характеристика хімічного складу природних вод. | 4 | - | 2 | 2 | |||
| 15. Визначення вмісту фосфору у воді фотоелектроколориметричним методом | 4 | - | 2 | 2 | |||
| 16. Визначення вмісту кальцію і магнію у воді комплексонометричним методом | 4 | - | 2 | 2 | |||
| 17. Визначення вмісту загального заліза у питній та природній воді фотометричним методом | 4 | - | 2 | 2 | |||
| 18.Визначення вмісту нітратів у питній та природній воді | 4 | - | 2 | 2 | |||
| 19. Визначення вмісту сухої речовини і золи | 4 | - | 2 | 2 | |||
| 20. Визначення вмісту Hg і Pb у грунті і воді. | 4 | - | 2 | 2 | |||
| Всього | 34 +1КР | 4 | 14 +1КР | 16 | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| І – ІІІ - навчальна дисципліна, 6 кредитів | Модуль ІV. Вуглеводні. Спирти. Карбонільні сполуки. | 21. Предмет, задачі і значення органічної хімії. Теоретичні основи органічної хімії. Алкани. | 9 | 2 | 4 | 3 | Тестові контрольні роботи № 1 – 4, модульна контрольна робота №1 |
| 22. Ненасичені вуглеводні. Алкени. Алкіни. Алкадієни. | 9 | 2 | 4 | 3 | |||
| 23. Ароматичні вуглеводні. Арени. Галогенопохідні вуглеводнів. | 9 | 2 | 4 | 3 | |||
| 24. Спирти. Феноли. | 9 | 2 | 4 | 3 | |||
| 25. Альдегіди і кетони. | 9 | 2 | 4 | 3 | |||
| Всього | 45 | 10 | 20 | 15 | |||
| Модуль V. Карбонові кислоти. Вуглеводи. Нітрогеновмісні сполуки. Гетероциклічні сполуки. | 26. Карбонові кислоти. Жири. | 9 | 2 | 4 | 3 | Тестові контрольні роботи № 5 – 8, модульна контрольна робота №2 | |
| 27. Оксикислоти. Оксокислоти. | 9 | 2 | 4 | 3 | |||
| 28. Вуглеводи. | 9 | 2 | 4 | 3 | |||
| 29. Амінокислоти. Білки. | 9 | 2 | 4 | 3 | |||
| 30. Гетероциклічні сполуки. | 9 | 2 | 4 | 3 | |||
| Всього | 45 | 10 | 20 | 15 | |||
| Разом | 216 | 35 | 85 | 96 | Іспит-І, іспит-ІІ | ||
| IV. Наукова робота | Модуль VI. | Публікації | | | |||
| Участь у конференціях | | | |||||
| Участь в олімпіадах | | | |||||
При вивченні дисципліни передбачається модульно-рейтингова система оцінки знань студентів за 100-бальною шкалою для кожної частини курсу, в основі якої лежать структурно-модульні схеми, наведені нижче.
Структурно-модульна схема з дисципліни „Хімія”
(частина І „Неорганічна хімія з основами біогеохімії”)
| Модуль | К-сть год. | Форма контролю | К-сть заходів | Оцінка за захід | Сума балів | ||||||||
| ЛЗ | ЛПЗ | СР | max | min | max | min | |||||||
| 1 | 5 | 12 в т.ч. ЛР-4, ПЗ-6, КР-2 | 23 | Перевірка ЛЗ | 3 | 1,0 | 0,5 | 3,0 | 1,5 | ||||
| Перевірка ЛР | 2 | 1,8 | 1,1 | 3,6 | 2,2 | ||||||||
| Перевірка ПЗ | 3 | 1,25 | 0,75 | 3,75 | 2,25 | ||||||||
| Перевірка ІЗ | 4 | 2,0 | 1,2 | 8,0 | 4,8 | ||||||||
| Контрольні роботи | 1 | 8 | 5 | 8 | 5 | ||||||||
| | Всього | 26,35 | 15,75 | ||||||||||
| 2 | 6 | 18 в т.ч. ЛР-14, КР-4 | 27 | Перевірка ЛЗ | 3 | 1,0 | 0,5 | 3,0 | 1,5 | ||||
| Перевірка ЛР | 7 | 1,8 | 1,1 | 12,6 | 7,7 | ||||||||
| Перевірка ІЗ | 6 | 2,0 | 1,2 | 12,0 | 7,2 | ||||||||
| Контрольні роботи | 2 | 8 | 5 | 16 | 10 | ||||||||
| | Всього | 43,6 | 26,4 | ||||||||||
| 3 | 4 | 15 в т.ч. ЛР-12, ПЗ-2, КР-1 | 16 | Перевірка ЛЗ | 2 | 1,0 | 0,5 | 2,0 | 1,0 | ||||
| Перевірка ЛР | 6 | 1,8 | 1,1 | 10,8 | 6,6 | ||||||||
| Перевірка ПЗ | 1 | 1,25 | 0,75 | 1,25 | 0,75 | ||||||||
| Реферат | 1 | 8 | 5 | 8 | 5 | ||||||||
| Контрольні роботи | 1 | 8 | 5 | 8 | 5 | ||||||||
| | Всього | 34,0 | 18,35 | ||||||||||
| Разом | |||||||||||||
| | 15 | 45 | 66 | іспит | 100 | 60,5 | |||||||
Розрахунок кількості балів за видами робіт
(частина І „Неорганічна хімія з основами біогеохімії”)
- загальна кількість балів за дисципліну – 100 балів;
- кількість балів на всі лекції – 8 балів;
- кількість балів на всі лабораторно-практичні заняття – 32 бала;
- кількість балів за виконання індивідуальних завдань (поточний контроль)
– 20 бала;
- кількість балів за всі види рубіжного контролю знань – 40 балів
Розрахунок балів для курсу „Неорганічна хімія з основами біогеохімії”
за пропорційною схемою
1. Лекції
8 балів : 8 лекцій = 1,0 бала/лек
Розподіл балів за категоріями діяльності студентів
присутність – 0,5 бала;
акуратність ведення конспекту – 0,5 бала
Всього балів за 1 лекцію 1,0 бала
2. Лабораторно-практичні заняття (23 ЛПЗ - 32 бала,
в т.ч. 4 – контрольні заходи (КР), 4 – семінарські заняття (ПЗ) – 5,0 балів,
15– лабораторні роботи (ЛР) – 27,0 балів)
Семінарські заняття Лабораторні роботи
5,0 балів : 4 ПЗ = 1,25 бала/ПЗ 27,0 бала : 15 ЛР = 1,8 бала/ЛР
Розподіл балів за категоріями діяльності студентів
Семінарські заняття
присутність – 0,25 бала;
готовність до ПЗ – 0,3 бала;
активна робота на ПЗ – до 0,7 бала
Всього балів за 1 ПЗ – 1,25 бала
Лабораторні роботи
Присутність та виконання ЛР – 0,5 бала;
готовність до виконання ЛР – 0,3 бала;
оформлення лабораторного журналу, захист ЛР – до 1,0 бала
Всього балів за 1 ЛР – 1,8 бала
3. Поточний контроль (10 індивідуальних завдань (ІЗ))
20 балів : 10 ІЗ = 2 бала/ІЗ
- виконання завдання на 90-100% - 2,0 бала;
- виконання завдання на 75–89% - 1,6 бала;
- виконання завдання на 60-74% - 1,2 бала;
- виконання завдання на 35-59% - 0,9 бала;
- виконання завдання на 1-34% - 0,5 бала
- несвоєчасна здача ІЗ – - 0,2 бала
4. Рубіжний контроль знань
(4 контрольні роботи (КР), 1 реферат)
40 балів : 5 контр. заходів = 8 балів/КР
Контрольні роботи
- виконання завдання на 90-100% - 8 балів;
- виконання завдання на 75–89% - 7 балів;
- виконання завдання на 60-74% - 5 балів;
- виконання завдання на 35-59% - 3 бала;
- виконання завдання на 1-34% - 1 бала
Реферат
якість виконання – до 4 балів;
публічний захист – до 4 балів.
Структурно-модульна схема з дисципліни „Хімія”
(частина ІІ „Органічна хімія”)
| Модуль | К-сть год. | Форма контролю | К-сть заходів | Оцінка за захід | Сума балів | |||||||
| ЛЗ | ЛПЗ | СР | max | min | max | min | ||||||
| 1 | 10 | 20 в т.ч. КР-2 | 15 | Перевірка ЛЗ | 5 | 0,9 | 0,4 | 4,5 | 2 | |||
| Перевірка ЛПЗ | 9 | 1,5 | 1,0 | 13,5 | 9 | |||||||
| Перевірка ТКР | 4 | 2,5 | 1,5 | 10 | 6 | |||||||
| Перевірка ІЗ | 2 | 4 | 2 | 8,0 | 4 | |||||||
| Контрольна робота МКР-1 | 1 | 14 | 9 | 14 | 9 | |||||||
| | Всього | 50,0 | 30 | |||||||||
| 2 | 10 | 20 в т.ч. КР-2 | 15 | Перевірка ЛЗ | 5 | 0,9 | 0,4 | 4,5 | 2 | |||
| Перевірка ЛПЗ | 9 | 1,5 | 1,0 | 13,5 | 9 | |||||||
| Перевірка ТКР | 4 | 2,5 | 1,5 | 10 | 6 | |||||||
| Перевірка ІЗ | 2 | 4 | 2 | 8 | 4 | |||||||
| Контрольна робота МКР-2 | 1 | 14 | 9 | 14 | 9 | |||||||
| | Всього | 50,0 | 30,0 | |||||||||
| Разом | ||||||||||||
| | 20 | 40 | 30 | іспит | 100 | 60,0 | ||||||
Шкала оцінки знань студентів
| За шкалою ECTS | За національною шкалою | Рейтингова оцінка (абсолютна кількість балів за дисципліну) |
| А | відмінно | 90 ... 100 |
| ВС | добре | 75...89 |
| DE | задовільно | 60…74 |
| FX | незадовільно | < 60 |
Правила зарахування іспиту
1. При умові повного виконання навчального навантаження та отримання за семестр студентом не менше 90 балів у залікову відомість за згодою студента автоматично заноситься оцінка „відмінно”, від 75 до 89 балів – „добре”, від 60 до 74 балів – „задовільно” (у присутності студента).
2. При умові повного виконання навчального навантаження та отримання за семестр студентом менше 60 балів студент попереджується про необхідність складання іспиту в установленому порядку.
3. Студент має право не погодитися на рейтингову оцінку з іспиту і покращити її (не більше, ніж на 1 бал) шляхом складання іспиту в установленому порядку. Якщо при складанні іспиту студент отримав нижчу оцінку, то зараховується більша – рейтингова.
4. Студент має право покращити рейтингову оцінку на протязі модуля шляхом виконання додаткових самостійних завдань підвищеної складності, які розробляються і оцінюються викладачем.
5. Студенти, які не виконали навчальний план (пропуски аудиторних занять, порушення термінів захисту модулів, календарного плану виконання завдань) навіть при наявності необхідної рейтингової оцінки не допускаються до спрощеної форми здачі сесії. Такі студенти здають сесію у встановленому порядку.
3. 2 ЗМICT ДИСЦИПЛІНИ
ЛЕКЦІЇ
Частина І „Неорганічна хімія з основами біогеохімії”
| № теми | Назва теми | Зміст теми | Кільк. годин |
| Модуль 1 | |||
| 1 | Предмет та методи хімії.Біогеохімія як наука про взаємодію між живою і неживою природою | Предмет та методи хімії. Місце хімії серед природничих наук, її роль в вирішенні народногосподарських проблем. Хімія та екологія. Основні стехіометричні закони хімії. Біогеохімія як наука про взаємодію між живою і неживою природою | 1 |
| 2 | Будова атомів хімічних елементів. Періодичний закон та періодична система елементів Д.І.Менделєєва | Ключова роль теорії будови атома в хімії. Теорії будови атома, їх коротка характеристика. Квантово-механічна теорія будови атома: хвильова функція, рівняння Шредінгера, квантові числа, принцип Паулі, електронні та електронно-графічні формули, принципи заповнення орбіталей електронами. Періодичний закон та періодична система елементів Д.І. Менделєєва, сучасне формулювання та трактування періодичного закону, характеристика елементів на основі періодичної системи. Основні фізичні та хімічні властивості елементів та закономірності їх зміни в періодичній системі. | 1 |
| 3 | Хімічний зв’язок | Визначаюча роль хімічного зв'язку в розумінні найважливіших явищ хімії. Причини утворення хімічного зв'язку. Метод валентних зв'язків. Метод молекулярних орбіталей. Типи хімічних зв'язків, їх характеристика. | 1 |
| 4 | Хімічна термодинаміка | Основні поняття хімічної термодинаміки: термодинамічна система. Функції стану, внутрішня енергія, ентальпія, ентропія, вільна енергія Гіббса. Перший та другий закони термодинаміки, критерій довільності перебігу процесів. Поняття про біохімічну термодинаміку. Тепловий ефект реакції. Закон Гесса та наслідки з нього. Використання закону Гесса для розрахунку калорійності продуктів харчування та кормів. | 1 |
| 5 | Хімічна кінетика Хімічна рівновага | Швидкість хімічної реакції та фактори, що на неї впливають. Основний закон хімічної кінетики. Вплив температури на швидкість хімічної реакції, правило Вант-Гоффа. Теорія активації С.Арреніуса. Каталіз. Поняття про ферментативний каталіз, індуктивні та супряжені реакції. Оборотні та практично необоротні хімічні процеси. Хімічна рівновага, константа рівноваги. Зв'язок між Кр та 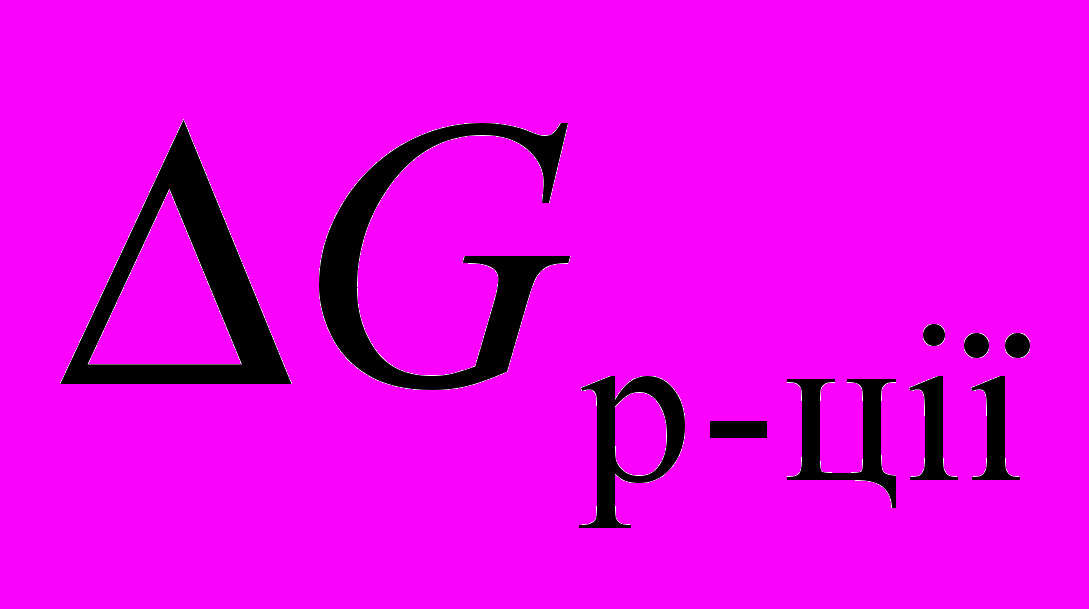 . Зміщення рівноваги, принцип Ле-Шательє. . Зміщення рівноваги, принцип Ле-Шательє. | 1 |
| Модуль 2 | |||
| 6 | Розчини та їх властивості | Розчини, загальні поняття, причини утворення. Концентрація розчинів та способи її вираження. Колігативні властивості розчинів, закони Вант-Гоффа та Рауля. Значення розчинів та їх властивостей в хімії, техніці, живій природі. | 1 |
| 7,8 | Розчини електролітів | Електроліти та неелектроліти. Основні положен-ня теорії електролітичної дисоціації. Константа дисоціації, ступінь дисоціації, закон розведення В.Оствальда. Дисоціація кислот, основ, солей. Електропровідність розчинів електролітів. Особливості розчинів сильних електролітів, теорія Дебая-Хюккеля. Рівновага в системі «розчин-осад», правило добутку розчинності. Вода як слабкий електроліт. Іонний добуток води, рН та рОН, їх значення для життєдіяльності організмів, індикаторні та безіндикаторні способи вимірювання. Гідроліз солей, типи гідролізу, константа та ступінь гідролізу. Сучасні погляди на природу кислот та основ, теорія Бренстеда-Лоурі (протолітична). Буферні розчини, їх класифікація та принцип дії. Буферні системи в живій природі, буферність грунтів. | 1 |
| 9 | Окисно-відновні процеси | Окисно-відновні процеси: основні поняття, класифікація, роль у живій природі. Поняття про електродний потенціал. Стандартний водневий електрод. Стандартний електродний потенціал. Електрохімічний ряд напруг. Напрямок перебігу окисно-відновних реакцій. Рівняння Ернста. Поняття про гальванічні елементи. | 2 |
| 10 | Метали | Метали: поширення у природі, методи добування, фізичні та хімічні властивості металів. Ряд активності металів. Корозія металів та методи захисту від неї. | 1 |
| 11 | Комплексні сполуки | Комплексні сполуки: характер зв'язку, будова, ізомерія, властивості. Координаційна теорія Вернера. Комплексні сполуки у розчинах, константа стійкості та константа нестійкості. Подвійні солі, хелати. Роль комплексних сполук в хімії та біології. | 1 |
| Модуль 3 | |||
| 12 | Біосфера як вищий ступінь організації природної системи. Хімічні елементи – основа живої та неживої природи. Біогеохімічна міграція сполук. | Поняття про природні системи. Система як комплекс компонентів, що знаходяться у взаємодії. Прості та складні системи, їх будова, функціонування та розвиток. Характерні риси всіх природних систем. Саморегуляція, еволюційність та емерджентність природних систем. Біосфера як вища природна система, її основні компоненти. Головна властивість біосфери – виникнення „живої речовини” і підтримка умов її існування. Історія розвитку біосфери. Закон В.І.Вернадського. Межі компонентів біосфери, її мозаїчність. Закономірності процесу розвитку життя на Землі: а) безперервність; б) оновлення форм життя; в) спливання у часі і просторі; г) циклічність. Хімічні елементи як основа живої і неживої природи. Періодична таблиця елементів і „лінія поживних речовин”. Макро- і мікроелементи. Біофільність елементів. Розподіл елементів на органогени і слідові елементи. Коефіцієнт біологічного поглинання (КБП), елементи накопичення і захоплення. Біогенна міграція речовини. Геохімічна міграція речовин. Поняття про великий геологічний кругообіг речовин. Типи міграції речовин. Взаємодія між живою і неживою природою – основа біогенної міграції речовин. Поняття про малий кругообіг хімічних елементів. | 2 |
| 13. | Біогеохімічні цикли і фізіоло-гічна роль деяких макро- і мікро-елементів. Біогеохімічне районування. | Декади В. І. Вернадського. Вміст основних хімічних елементів у воді, земній корі, склад тварин і рослин порівняно з хімічним складом літосфери. Фізіологічне значення і кругообіг основних макроелементів: Карбону, Оксигену, Гідрогену, Нітрогену, Фосфору, Сульфуру, Кальцію, Калію, Магнію, Феруму, Силіцію, Натрію. Фізіологічне значення і кругообіг найважливіших мікроелементів: Мангану, Бору, Купруму, Цинку, Молібдену, Кобальту, Іоду, Флуору, Стронцію і Цезію | 2 |
Всього 15 год.
Викладач Т.В. Марчак
А.П. Маслоїд
ЛАБОРАТОРНІ ЗАНЯТТЯ
Частина І „Неорганічна хімія з основами біогеохімії”
| № заняття | № теми | Зміст заняття | Кільк. годин |
| Модуль1 | |||
| 1 | 1,3 | Загальні правила роботи в хім.лабораторії. Загальні правила роботи в хім. лабораторії. Хімічний посуд, реактиви, правила техніки безпеки. Будова атомів хімічних елементів і періодичний закон Д.І Менделєєва (сем.). | 2 |
| 2 | 2 | Класи неорганічних сполук (сем.). | 2 |
| 3 | 1 | Основні стехіометричні закони хімії (сем.). | 2 |
| 4 | 5 | Визначення ентальпії гідратації безводної солі. | 2 |
| 5 | 5 | Кінетика хімічних реакцій та хімічна рівновага. Вплив концентрації речовини та температури на швидкість реакції. Вплив концентрації речовин на стан хімічної рівноваги. | 2 |
| 6 | 1-5 | Контрольна робота 1. Основні поняття і закони хімії. Будова атомів хімічних елементів і періодичний закон. Закономірності хімічних перетворень | 2 |
| Модуль 2 | |||
| 7 | 6 | Розчини: загальна характеристика, способи вираження концентрації, колігативні властивості (сем., лаб. р.) | 2 |
| 8 | 7 | Електролітична дисоціація, рН. Електроліти та неелектроліти. Зміщення рівноваги дисоціації електролітів. Визначення рН розчинів за допомогою індикаторів. | 2 |
| 9 | 8 | Гідроліз солей. Визначення характеру гідролізу солей. Вплив температури та розведення на гідроліз. Ступінчатий гідроліз. Розчинення речовин у продуктах гідролізу. Необоротний гідроліз. | 2 |
| 10 | 8 | Буферні розчини: одержання, властивості. Буферні системи крові. | 2 |
| 11 | 6 - 8 | Контрольна робота 2. Розчини та їх властивості. | |
| 12 | 9 | Окисно-відновні реакції. Окисні властивості хлорної води. Окисні та відновні властивості сульфітної та нітритної кислот та їх солей, пероксиду гідрогену. Окисні властивості перманганату калію в різних середовищах. Складання рівнянь окисно-відновних реакцій. | 2 |
| 13 | 10 | Загальні властивості металів, їх взаємодія з неметалами, кислотами, лугами, водою. Ряд напруг металів. Корозія при контакті різних металів. Електрохімічна корозія. | 2 |
| 14 | 11 | Комплексні сполуки: добування, властивості, застосування. Різниця між комплексними сполуками та подвійними солями. Хелати.Окисно-відновні властивості комплексних сполук. | 2 |
| 15 | 9 - 11 | Контрольна робота 3. Реакції окиснення-відновлення. Метали. Комплексні сполуки. | 2 |
| Модуль 3 | |||
| 16 | 14 | Характеристика хімічного складу природних вод. | 2 |
| 17 | 15 | Визначення вмісту фосфору у воді фотоелектроколориметричним методом. | 2 |
| 18 | 16 | Визначення вмісту кальцію і магнію у воді комплексонометричним методом. | 2 |
| 19 | 17 | Визначення вмісту загального заліза у питній та природній воді фотометричним методом. | 2 |
| 20 | 18 | Визначення вмісту нітратів у питній та природній воді потенціометричним методом з використанням нітрат-селективного електрода або фотометричним методом із салвциловою кислотою. | 2 |
| 21 | 19 | Визначення вмісту сухої речовини і сухої золи. | 2 |
| 22 | 20 | Визначення Hg і Pb у грунті і воді. | 2 |
| 23 | 16-20 | Контрольна робота 4. Основи біогеохімії. | 1 |
Всього 45 год.
Викладач Т.В. Марчак
А.П.МАслоїд
