Конспект лекций для студентов всех специальностей дневной и заочной формы обучения Челябинск
| Вид материала | Конспект |
СодержаниеМетод электронного баланса. Направление ОВР. |
- Конспект лекций по курсу Начертательная геометрия (для студентов заочной формы обучения, 1032.28kb.
- Краткий конспект лекций Кемерово 2002 удк: 744 (075), 1231.26kb.
- Конспект лекций по курсу "Начертательная геометрия и инженерная графика" Кемерово 2002, 786.75kb.
- Методические указания по подготовке к семинарским занятиям для студентов дневной формы, 1587.03kb.
- Тематический план, рабочая программа и методические рекомендации к семинарским занятиям, 755.58kb.
- Планы семинарских занятий по дисциплине «Экономическая теория» для студентов технических, 527.66kb.
- Конспект лекций для студентов заочной формы обучения по дисциплине " Организация производства", 16.36kb.
- Методические указания для студентов всех специальностей дневной формы обучения Новосибирск, 320.91kb.
- Тематический план, рабочая программа и методические рекомендации к семинарским занятиям, 755.41kb.
- Методические указания к выполнению задания по черчению для студентов всех специальностей, 589.35kb.
Метод электронного баланса. Уравнения ОВР часто имеют сложный характер, их составление, в частности, расстановка стехиометрических коэффициентов, представляет собой при этом трудную задачу. Одним из методов решения этой задачи является метод электронного баланса.
Рассмотрим этот метод на примере восстановления перманганата калия концентрированной соляной кислотой. Эта реакция используется в качестве лабораторного метода получения хлора.
Записываем схему реакции: KMnO4 + HCl = Cl2 + KCl + MnCl2 + H2O.
Определяем СО элементов: K+Mn+7O4-2 + H+Cl- = Cl20 + K+Cl- + MnCl2+ H2+O-2. В ходе взаимодействия только атомы марганца и хлора изменяют степень окисления. При этом степень окисления марганца уменьшается (Mn+7 – окислитель), а хлора – увеличивается (Cl- - восстановитель).
Составим схемы, отражающие процесс передачи электронов:
M
 n+7 + 5е = Mn+2 5 2
n+7 + 5е = Mn+2 5 22Cl- -2e= Cl20 2 5
Так как количества отданных и принятых электронов должно быть одинаковым, введем дополнительные множители, устанавливающие электронный баланс. Эти множители подберем по правилу нахождения наименьшего общего кратного, и они будут представлять собой коэффициенты при окислителе и восстановителе:
2KMnO4 + 10HCl = 5Cl2 + KCl + 2MnCl2 + H2O.
Далее уравняем количества атомов, не участвующих в процессах окисления-восстановления, в следующем порядке: количество атомов металлов (катионов), не изменивших степени окисления (калий); ионы кислотных остатков, не изменивших степени окисления (хлорид – анионы); количество ионов водорода; проверка правильности расстановки коэффициентов осуществляется подсчетом общего количества атомов кислорода слева и справа:
2KMnO4 + 16HCl = 5Cl2 + 2KCl + 2MnCl2 + 8H2O.
Типы ОВР. Рассмотренное выше уравнение описывает межмолекулярную ОВР. Окислитель и восстановитель являются разными веществами (атомы разных элементах находятся в разных молекулах).
Если окислитель и восстановитель являются атомами разных элементов, но находятся внутри одной молекулы, то реакция называется внутримолекулярной ОВР: 2AgNO3 = 2Ag + 2NO2 + O2.
Ag+ + e = Ag восстанавливается, окислитель
N+5 + e = N+4 восстанавливается, окислитель
2O-2 – 4e = O2 окисляется, восстановитель
2Ag+ + 2N+5 + 2O-2 = 2Ag + 2N+4 + O2
В некоторых ОВР происходит окисление и восстановление атомов или ионов одного и того же элемента. Такие реакции называются реакциями самоокисления-самовосстановления:
3H2MnO4 = 2HMnO4 + MnO2 + 2H2O
Mn+6 – e = Mn+7 2 восстановитель, окисляется
Mn+6 + 2e = Mn+4 1 окислитель, восстанавливается
2Mn+6 + Mn+6 = 2Mn+7 + Mn+4
Окислителем и восстановителем в данной реакции выступают ионы 2Mn+6, она является реакцией диспропорционирования. Если же эта реакция протекает в обратном направлении, то она будет называться реакцией конпропорционирования.
Направление ОВР. Возможность предсказать направление ОВР дает второе начало термодинамики. Если энергия Гиббса ОВР ниже нуля, то реакция может протекать в прямом направлении. Если энергия Гиббса ОВР выше нуля, то реакция в прямом направлении самопроизвольно не пойдет, а возможна в обратном направлении.
ОВР имеют важную роль в природе и технике. В природных биологических системах происходят реакции фотосинтеза в растениях, дыхания и метаболизма у животных и человека, которые являются окислительно-восстановительными. Процессы горения топлива, протекающие в топках котельных, ТЭЦ, двигателях внутреннего сгорания и реактивных двигателях, являются важными ОВР в технике и повседневной жизни. ОВР происходят при коррозии металлов, пожарах, окислении азота при сжигании топлива. Продуктами таких процессов часто являются вредные вещества, наносящие ущерб окружающей среде.
С помощью ОВР получают большинство простых веществ, в основном металлы, множество органических и неорганических веществ, а также проводят анализ и очищают вещества, например, сточные воды, металлы, газовые выбросы предприятий и т.д. В электронной и вычислительной технике, радио- и электротехнике, других областях науки и промышленности используют методы нанесения металлических покрытий в защитных и декоративных целях. ОВР лежат в основе действия топливных элементов, используемых в том числе в военной и космической технике.
Итак, ОВР являются широко используемыми реакциями, в которых происходит перемещение электронов от одних частиц к другим. Для составления уравнений используют несколько методов, мы рассмотрели метод электронного баланса. Направление ОВР можно предсказать, если известно изменение ΔG реакции.
ЛЕКЦИЯ ПО ТЕМЕ: «Электродные потенциалы и электродвижущие силы»
План
- Электрохимические процессы
- Понятие об электродном потенциале металла
- Стандартный водородный электрод
- Гальванические элементы. ЭДС гальванических элементов
- Концентрационный гальванический элемент
Электрохимические процессы
Процессы прямого превращения химической энергии в электрическую и обратно называются электрохимическими процессами. Электрохимические процессы можно разделить на две основные группы: 1) процессы превращения химической энергии в электрическую (процессы в гальванических и топливных элементах); 2) процессы превращения электрической энергии в химическую (электролиз).
Электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическими проводниками. Ионным проводником (проводником второго рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называются проводники, имеющие электронную проводимость (проводники первого рода), находящиеся в контакте с ионным проводником.
Понятие об электродном потенциале металла
При погружении металлической пластины в воду или раствор соли данного металла на границе металл – раствор возникает скачок потенциала. Появление такого скачка связано с особенностями строения кристаллической решетки металлов, в узлах которой находятся положительные ионы, заряд которых уравновешивается зарядом электронного газа. Положительно заряженные ионы в поверхностном слое металла под действием полярных молекул воды отрываются и в гидратированном состоянии переходят в раствор, который при этом заряжается положительно. В самом металле появляется избыток электронов, придающих ему отрицательный заряд. На границе металл – раствор образуется двойной электрический слой, а между металлом и окружающей его средой создается разность потенциалов, которая называется электродным потенциалом. Чем активнее металл, тем больше разность потенциалов между металлом и раствором, тем больше скачок потенциала.
 - + +
- + +Металл - + + раствор
- + +
- + +
Двойной электрический слой на границе раздела металл – раствор
В двойном электрическом слое все время происходит движение ионов, причем одни из них входят обратно в кристаллическую решетку металла, другие снова переходят в раствор. Между раствором и поверхностью металла существует равновесие:
М+е– + nН2О ↔ М+ nН2О (в растворе) + е– (в металле).
Однако такое равновесие может быть смещено в ту или иную сторону.
Величина электродного потенциала зависит от ряда факторов, из которых основными являются природа металла (чем активнее металл, тем выше Е), природа растворителя (чем полярнее растворитель, тем больше Е) и концентрация ионов металла (повышение концентрации понижает Е).
Зависимость величины электродного потенциала от концентрации ионов металла и температуры выражается формулой Нернста:
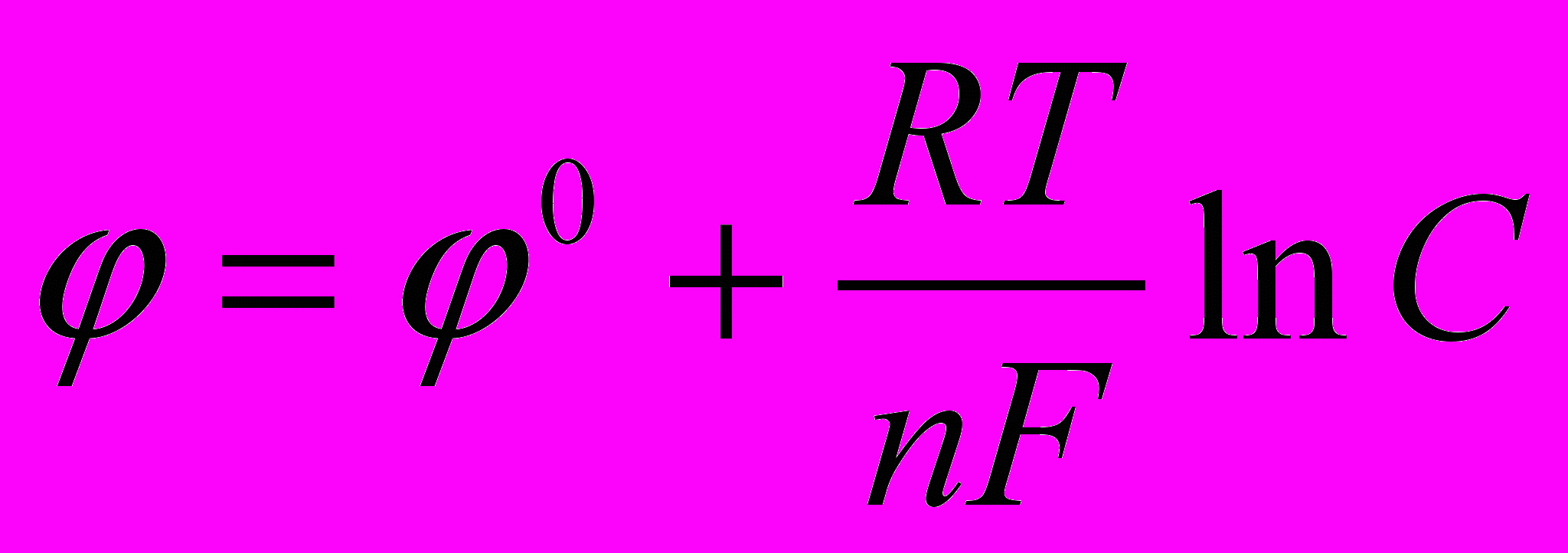
Здесь φ0 – нормальный (стандартный) электродный потенциал, возникающий на границе металл – раствор в том случае, когда металл помещен в раствор своей соли с концентрацией 1 моль/л, С – концентрация ионов металла, моль/л, R – универсальная газовая постоянная (8,314 Дж/моль˙град), Т – абсолютная температура, К, n – валентность иона, F – число Фарадея (96500 Кл/моль).
Подставляя в формулу Нернста величины R, F, значение Т = 298 К и переходя от натуральных логарифмов к десятичным, получаем сокращенную формулу Нернста:
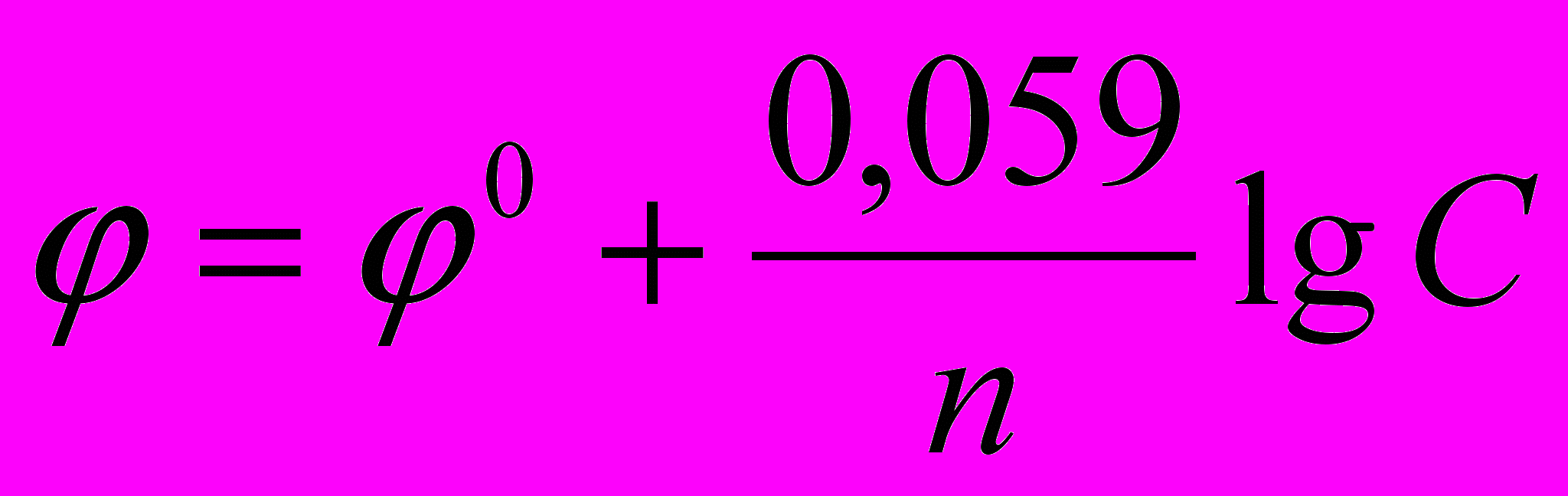 .
.Она дает возможность рассчитать величину электродного потенциала при любой концентрации ионов металла в растворе при комнатной температуре.
Стандартный водородный электрод
В настоящее время за нулевое значение принят потенциал стандартного водородного электрода. Такой электрод состоит из платиновой пластины, контактирующей с газообразным водородом, находящимся под давлением 101 кПа, и раствором, в котором активность ионов водорода равна единице. Водородный электрод относится к газовым электродам. В качестве проводника первого рода для стандартного водородного электрода служит платина. При контакте платины с водородом происходит адсорбция водорода на платине. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в платине электроны. При платина заряжается отрицательно, а раствор – положительно. Возникает скачок потенциала между платиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов водорода с образованием молекул водорода.
Равновесие на водородном электроде можно представить в виде
2Н+ + 2е ↔ Н2
Абсолютное значение потенциала водородного электрода неизвестно, но условно считают за нуль потенциал стандартного водородного электрода, то есть потенциал при Р(Н2) = 1 атм (101 кПа) и аН+ = 1 моль/л.
Кроме водородного электрода, применяются и другие электроды сравнения.
Уравнение для расчета потенциала водородного электрода можно вывести также, как выведено уравнение для расчета потенциала металлического электрода. Для 298 К оно имеет вид
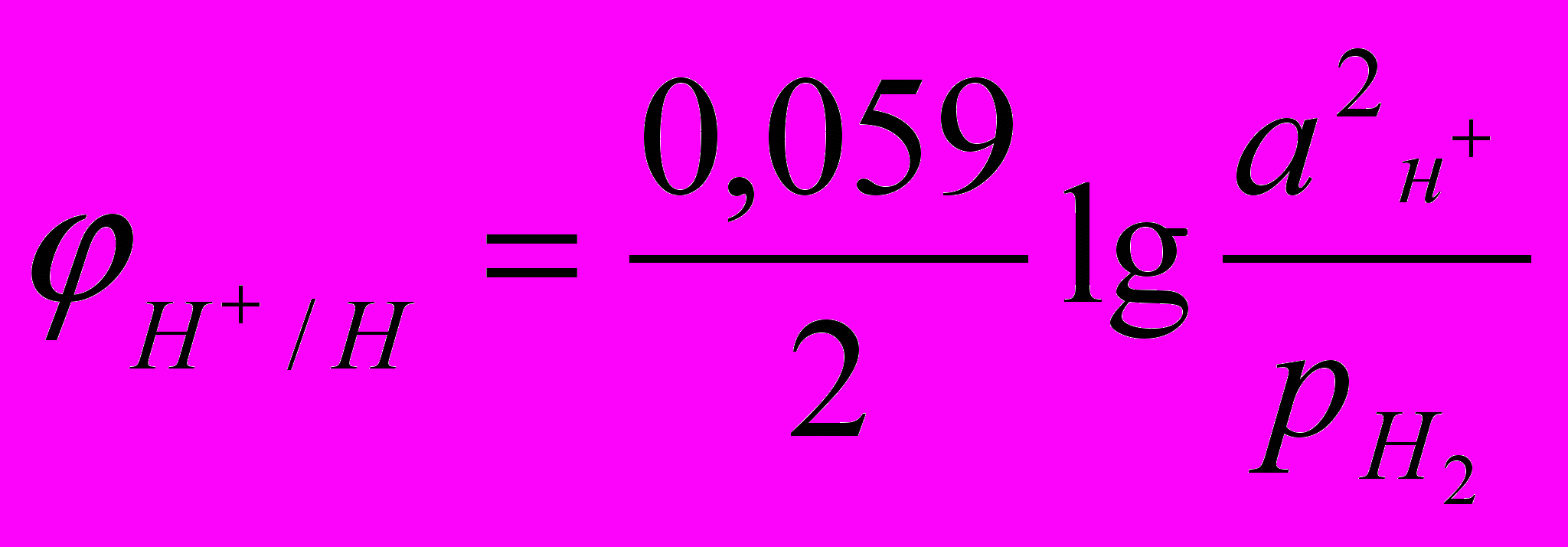
Где рН2 – парциальное давление водорода, аН+ - активность ионов водорода в электролите. Учитывая, что lgаН+=-рН, получим:
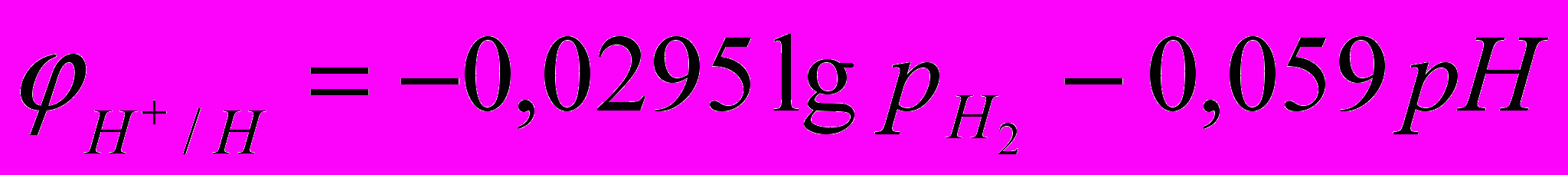
Потенциал водородного электрода принимает более отрицательное значение с увеличением давления водорода и рН.
Гальванические элементы. ЭДС гальванического элемента
Гальванический элемент состоит из двух электродов, в которых энергия химической реакции преобразуется в электрическую.
Примером может служить гальванический элемент Якоби-Даниэля. Он состоит из медной пластины, погруженной в раствор CuSO4, и цинковой пластины, погруженной в раствор ZnSO4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие: Zn–2e↔Zn2+. В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие: Cu–2e↔Cu2+. В результате возникает электродный потенциал меди.
Потенциал цинкового электрода имеет более отрицательное значение (φZn2+/Zn = -0,76 В) по сравнению с потенциалом медного электрода (φCu2+/Cu = 0,34 В). Цинковый электрод выполняет функцию анода, а медный – катода.
Итак, при работе элемента Якоби-Даниэля протекают следующие процессы:
1) Реакция окисления цинка на аноде: Zn–2e↔Zn2+.
2) Реакция восстановления меди на катоде: Cu2++2e↔ Cu.
3) Движение электронов во внешней цепи;
4) Движение ионов в растворе: анионов SO42- к аноду, катионов (Zn2+, Cu2+) к катоду.
Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получим:
Cu2++ Zn↔ Cu+ Zn2+
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, то есть электрический ток, поэтому суммарная химическая реакция в гальваническом элементе называется токообразующей реакцией.
Схема работы гальванического элемента:
Анод (–) Zn / Zn2+ // Cu2+ / Cu (+) Катод
Границу раздела между проводником первого рода и проводником второго рода обозначают одной чертой, а границу раздела между проводниками второго рода – двумя чертами.
Максимальная разность потенциалов электродов называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента: ЭДС=φк – φа.
Например, для вычисления ЭДС медно-цинкового гальванического элемента надо от нормального электродного потенциала меди вычесть нормальный электродный потенциал цинка: ЭДС= φCu2+/Cu – φZn2+/Zn = 0,34-(-0,76) = 1,1 В. Чем больше отличаются металлы по величине своего электродного потенциала, то есть чем больше они отстоят друг от друга в ряду напряжений, тем больше ЭДС гальванического элемента, построенного из этих металлов. Движущей силой электрохимических процессов, протекающих в гальванических элементах, является изобарный потенциал (энергия Гиббса).
Связь между его изменением ΔG и ЭДС гальванического элемента Е выражают уравнением: ΔG= –nFE. Здесь n – число электронов, принимающих участие в окислительно-восстановительном процессе, F – число Фарадея. Чем больше ЭДС, тем больше отличается от нуля изменение изобарного потенциала ΔG.
Изменение потенциалов электродов при работе гальванических элементов называется гальванической поляризацией. Для её уменьшения применяют вещества, увеличивающие скорость катодных процессов. Такие вещества называют деполяризаторами. К ним относятся окислители (MnO2, O2, K2Cr2O7, Cu2+) и другие. Так, в медно-цинковом элементе деполяризатором служит раствор сульфата меди. Уменьшение поляризации гальванического элемента называют деполяризацией.
Концентрационные элементы
Гальванический элемент, в котором источником энергии является не химическая реакция, а работа выравнивания концентраций (активностей) ионов, называется концентрационным гальваническим элементом. Он состоит из двух одинаковых электродов, погруженных в растворы собственных солей разной концентрации, например: Cu / Cu2+ (а1) // Cu2+ (а2) / Cu, где а1<а2. Электрод, находящийся в более разбавленном растворе, является анодом. Он растворяется и его ионы переходят в раствор. На электроде, погруженном в более концентрированный раствор, осаждаются ионы металла – он является катодом. Таким образом, на обоих электродах идут процессы, приводящие к выравниванию концентраций ионов в растворах. Концентрационный элемент будет работать до тех пор, пока активности ионов в растворах у анода и катода не будут равны.
ЛЕКЦИЯ ПО ТЕМЕ: «Электролиз как окислительно-восстановительный процесс»
План
1. Сущность процесса электролиза
2. Электролиз водных растворов
3. Электролиз расплавов
4. Перенапряжение и поляризация
5. Законы Фарадея. Выход по току
6. Применение электролиза
Электролизом называют окислительно-восстановительный процесс, протекающий на электродах под действием постоянного электрического тока, подаваемого от внешнего источника, проходящего через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую.
Процесс электролиза производится в электролизере, куда заливают электролит и устанавливают два электрода. Электрод, на котором происходит реакция восстановления, называется катодом, подключается к отрицательному полюсу внешнего источника тока. Электрод, на котором происходит реакция окисления, называется анодом, подключается к положительному полюсу внешнего источника тока.
Схема электролиза



 е- е-
е- е-




 анод + – катод
анод + – катод
Электролиз водных растворов
Характер химических реакций в водных растворах на катоде определяется положением металла в ряду стандартных электродных потенциалов. Чем меньше значение электродного потенциала металла, тем труднее восстанавливаются его ионы на катоде. По этому признаку их разделяют на три группы.
К первой группе относятся катионы металлов, находящиеся в ряду напряжений левее алюминия. Они не восстанавливаются на катоде из водных растворов, вместо них происходит восстановление ионов водорода (молекул воды): 2Н++2е=Н2.
Ко второй группе относятся катионы металлов, расположенных в ряду напряжений между алюминием и водородом. Они восстанавливаются одновременно с водородом: Zn2++2е= Zn; 2Н++2е=Н2.
К третьей группе относятся катионы металлов, находящиеся в ряду напряжений после водорода. Они восстанавливаются на катоде: Cu2++2е= Cu.
Окисление на аноде имеет свои закономерности. Анионы бескислородных кислот и их солей (Cl-, Br-, J-, S2-, CN- и т.п.) удерживают свои электроны слабее молекул воды, поэтому при электролизе окисляются в первую очередь. В то же время анионы кислородсодержащих кислот (NO3-, SO42-, PO43- и т.п.) удерживают свои электроны прочнее, чем молекулы воды, поэтому на аноде происходит окисление гидроксил-анионов: 4ОН- – 4е = 2Н2О + О2.
Характер реакций, протекающих на аноде, зависит также от природы вещества анода. Различают растворимые и нерастворимые аноды. нерастворимые аноды изготавливают из углерода (графита), платины, а растворимые – из меди, цинка, никеля, железа, свинца и их сплавов. Нерастворимый анод сам не претерпевает изменений, а лишь является передатчиком электронов. При применении растворимого анода происходит не окисление анионов из раствора, а растворение металла, то есть переход ионов металла, из которого изготовлен анод, в раствор. Этот метод используется для получения чистых металлов (электрорафинирование), а также для получения покрытий (гальваностегия).
Рассмотрим несколько примеров электролиза с нерастворимым анодом водных растворов солей.
1. Раствор сульфата натрия Na2SO4, a(Na+)=1M, a(SO42-)=1M. В растворе имеются ионы Na+, SO42-, Н+, ОН-.
Na2SO4 ↔ 2 Na+ + SO42- ; Н2О ↔ Н+ + ОН-.
Так как φ0(Na+/ Na)=-2,7В<φ0(Н+/ Н2), то на катоде будет восстанавливаться водород, а на аноде – кислород: в растворе 2Н2О ↔ 2Н+ + 2ОН-. На катоде 2Н++2е=Н2. На аноде 2ОН- – 2е = Н2О + 1/2 О2. Суммарной является реакция разложения воды: Н2О=Н2+1/2О2.
2. Раствор хлорида натрия NaCl, a(Na+)=1M, a(Cl-)=1M. В растворе имеются ионы Na+, Cl-, Н+, ОН-. NaСl ↔ Na+ + Cl-; Н2О ↔ Н+ + ОН-.
На катоде пойдет восстановление водорода: 2Н++2е=Н2. На аноде идет окисление ионов хлора: 2Cl- - 2е = Cl2.
Электролиз расплавов
Рассмотрим электролиз расплавов на примере электролиза расплава хлорида натрия. В расплаве хлорида натрия имеются ионы натрия и хлора: NaСl ↔ Na+ + Cl-; если погрузить в расплавленную соль два графитовых электрода и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов и на электродах будут протекать следующие реакции:
1) Катодный процесс – восстановление ионов натрия до металлического натрия (на отрицательном электроде) Na+ + е = Na+.
2) Анодный процесс – окисление ионов хлора на положительном электроде (с которого электроны идут во внешнюю цепь) 2Cl- - 2е = Cl2. Суммарная реакция 2NaCl = 2Na + Cl2.
Перенапряжение и поляризация
В процессе электролиза происходит изменение состава электродов с поверхности из-за образования на них продуктов электролиза. При этом образуется гальванический элемент, сила тока которого направлена обратно течению процесса электролиза. Это явление называется химической поляризацией. Для протекания электролиза необходимо приложить к электродам напряжение, большее, чем ЭДС образованного гальванического элемента. Наименьшая разность потенциалов, при которой протекает электролиз, называется потенциалом разложения Еразл.. Разность между потенциалом разложения и ЭДС гальванического элемента называется перенапряжением η.
Перенапряжение – это величина, которая показывает, насколько смещается электродный потенциал от равновесного значения.
Как катодное, так и анодное перенапряжение зависят от материала электродов, состояния их поверхности, от природы разряжающихся ионов и плотности тока.
Перенапряжение при электролизе может достигать значительной величины, что приводит к добавочному расходу электроэнергии. Поэтому стремятся создать такие условия, при которых величина η становится по возможности минимальной. Это достигается путем создания невысокой плотности тока.
Законы Фарадея
Электрохимические процессы на электродах подчиняются законам М. Фарадея.
1 закон Фарадея: массы веществ m, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества q, прошедшему через электролит: m=kq. Масса вещества, выделяющегося при прохождении одного кулона, называется электрохимическим эквивалентом k.
2 закон Фарадея: одинаковые количества электричества выделяют при электролизе на электродах эквивалентные массы веществ. Для выделения на электроде одного грамм-эквивалента любого вещества необходимо затратить одно и то же количества электричества, а именно 96500 Кл (называемого числом Фарадея).
Масса металла при электролизе на катоде, согласно законам Фарадея, может быть вычислена по формуле:
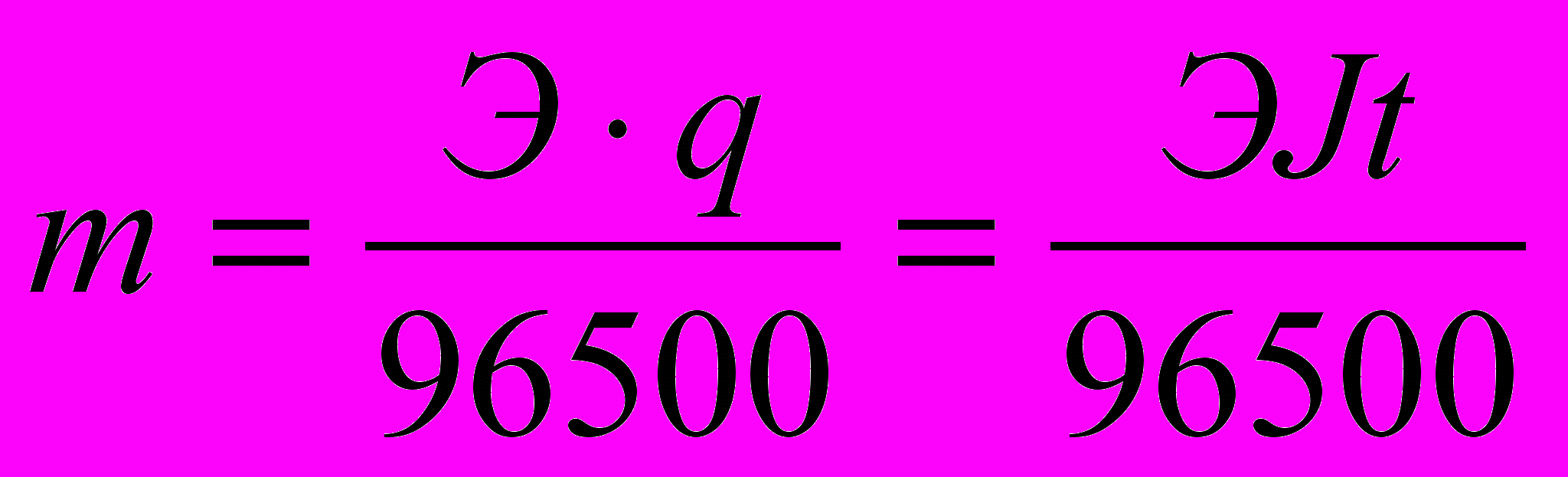 .
.Здесь m – масса металла, г; Э – химический эквивалент металла, г/моль; t – продолжительность электролиза, с.
При электролизе во многих случаях выделяется веществ меньше, чем должно получиться по законам Фарадея. Это объясняется тем, что наряду с основными электродными процессами окисления и восстановления протекают побочные, параллельные процессы (в результате химической поляризации). Поэтому вводится понятие выхода по току χ, %. Оно представляет собой отношение массы полученного вещества в данных условиях электролиза mпр к массе, теоретически вычисленной на основании закона Фарадея mтеор:
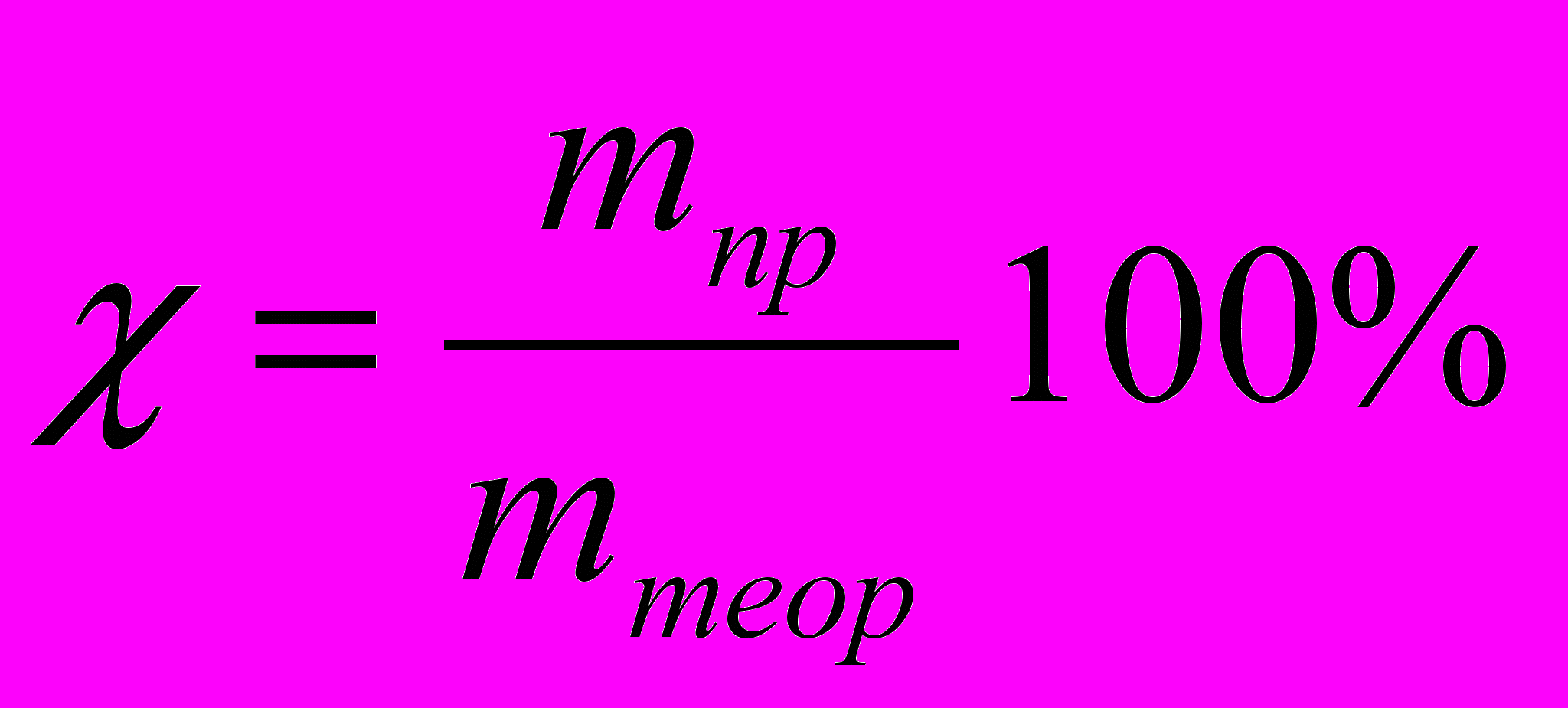
Применение электролиза
Электролиз широко используется в различных областях промышленности. Практически нет ни одной области техники, где бы он не применялся.
Электролиз в металлургии. Электролизом растворов солей получают медь, цинк, кадмий, никель, кобальт, марганец и другие металлы. На катоде происходит разряд ионов металла из раствора Mn+ + ne = M. В этих процессах используют нерастворимые аноды, на которых выделяется кислород: 2Н2О + 4е = О2 + 4Н+.
Метод электролиза используют для рафинирования металлов – меди, серебра, золота, свинца, олова и других. Анодом при рафинировании служит очищаемый металл. На аноде происходит растворение основного металла и примесей, потенциал которых отрицательнее потенциала основного металла. На катоде выделяется металл, имеющий более положительный потенциал. Так как потенциалы меди, серебра, свинца и олова положительнее, чем потенциалы других основных металлов ,то каждый из этих металлов в первую очередь выделяется на катоде, а примеси остаются в растворе.
Электролиз в химической промышленности. К наиболее крупномасштабному электролитическому процессу в химической промышленности относится электролиз раствора хлорида натрия с получением газообразных водорода и хлора на электродах и щелочи в электролизере. Кроме этого, электролизом получают фтор из расплава смеси плавиковой кислоты и фторида натрия, водород и кислород из воды, диоксид марганца из раствора сульфата марганца.
Получение гальванопокрытий. Гальваническими называются металлические покрытия, наносимые на поверхность какого-либо изделия методом электролиза. Гальваническим способом можно получить покрытия для всех металлов и сплавов. Наиболее распространены никелирование, хромирование, меднение и цинкование.
Нанесение гальванических покрытий проводится в электролизере, называемом гальванической ванной. Катодом служит изделие, на которое наносится покрытие. На катоде идёт процесс восстановления находящихся в растворе электролита ионов металла Mn+ + ne = M. Анодом обычно служит тот же металл, что и металл-покрытие. Процесс на аноде противоположен процессу на катоде: M – ne = Mn+
Электрохимическая анодная обработка металлов и сплавов. Анодная обработка изделий для придания им требуемой формы получила название электрохимической обработки металлов (ЭХОМ). Этот способ обработки металлов имеет важные достоинства, так как позволяет обрабатывать детали сложной конфигурации. Как и при обычном электролизе с растворимыми анодами, при ЭХОМ происходит анодное растворение металла M – ne = Mn+. На катоде, который называют инструментом, обычно выделяется водород 2Н++2е=Н2. Особенностью ЭХОМ по сравнению с другими методами электролиза является высокая скорость растворения металлов. В настоящее время ЭХОМ используется для обработки лопаток турбин, штампов и пресс-форм, твёрдых и тугоплавких металлов.
ЛЕКЦИЯ ПО ТЕМЕ: «Коррозия металлов»
План
1. Определение коррозии и причины её возникновения
2. Классификация коррозионных процессов. Химическая и электрохимическая коррозия
3. Коррозия металлов в различных средах
3.1. Контактная коррозия
3.2. Атмосферная коррозия
3.3. Подземная коррозия
3.4. Коррозия под действием блуждающих токов
4. Виды коррозионных разрушений
Определение коррозии и причины её возникновения
Коррозия – это самопроизвольный процесс разрушения металлов и сплавов в условиях природной среды.
При коррозии металлы окисляются и образуются продукты, состав которых зависит от условий среды.
Согласно современным представлениям, все основные изменения в органическом и неорганическом мире связаны с окислительно-восстановительными процессами. Окислительно-восстановительные реакции лежат в основе и коррозионных процессов.
Основной причиной коррозии является термодинамическая неустойчивость металлов и сплавов в окружающей среде. Подавляющее большинство металлов в земной коре находится в виде оксидов, сульфидов и других соединений. При получении металлов в металлургии их переводят из такого стабильного состояния в элементарную форму, которая нестабильна. При контакте металла с внешней окислительной средой появляется движущая сила, стремящаяся превратить их в стабильные соединения, подобные тем, которые находятся в рудах. Примером этого является коррозия стали. В результате этого элементарное железо превращается в окисленное двух- и трёхвалентное, которое соответствует таким минералам, как магнетит (Fe3O4) или лимонит (Fe2O3˙H2O).
Термодинамическая неустойчивость металлов количественно оценивается знаком и величиной изобарно-изотермического потенциала ΔG (энергии Гиббса). Самопроизвольно протекают те процессы, которые сопровождаются уменьшением энергии Гиббса, то есть для которых ΔG<0. Металлы, стоящие в ряду напряжений до водорода, имеют по сравнению с водородом более отрицательный потенциал, их окисленное состояние термодинамически более устойчиво, чем восстановленное. Для металлов, расположенных после водорода, восстановленное состояние термодинамически более устойчиво, то есть для них ΔG>0. К этой группе металлов относятся коррозионно-стойкие золото, платина, серебро и др.
Классификация коррозионных процессов. Химическая и электрохимическая коррозия
Коррозионные процессы классифицируются:
1. По механизму реакций взаимодействия металла со средой;
2. По типу коррозионной среды;
3. По характеру коррозионных разрушений на поверхности и в объёме металла;
4. По характеру механических воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По первому признаку различают два вида коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия протекает при взаимодействии металлов с окислителями в средах, не проводящих электрический ток. Механизм химической коррозии можно представить одностадийным процессом окисления металла, то есть взаимодействием поверхности металла с окислителем.
Химическая коррозия – это процесс самопроизвольного разрушения металла в среде окислительного газа (например, кислорода) при повышенной температуре. Скорость химической коррозии зависит от многих факторов, в первую очередь она определяется характером продуктов коррозии. При окислении на поверхности металла образуется твердая пленка оксидов. Скорость окисления определяется состоянием и защитными свойствами поверхностной плёнки. Это зависит от отношения объёмов оксидной плёнки Vок и прокорродированного металла Vм, из которого она образовалась. Установлено, что для пористых плёнок, не предохраняющих металл от доступа агрессивных примесей воздуха
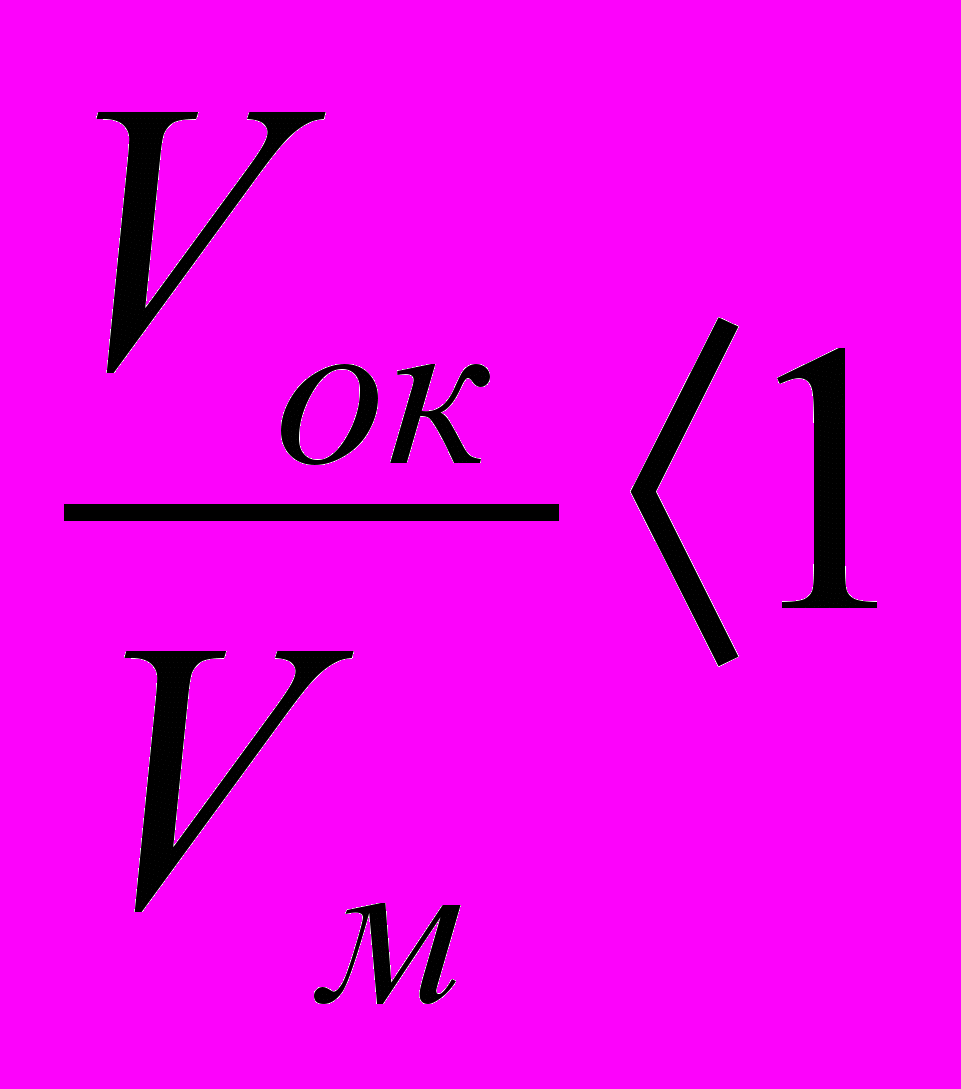 . А для плёнок, обладающими защитными свойствами,
. А для плёнок, обладающими защитными свойствами, 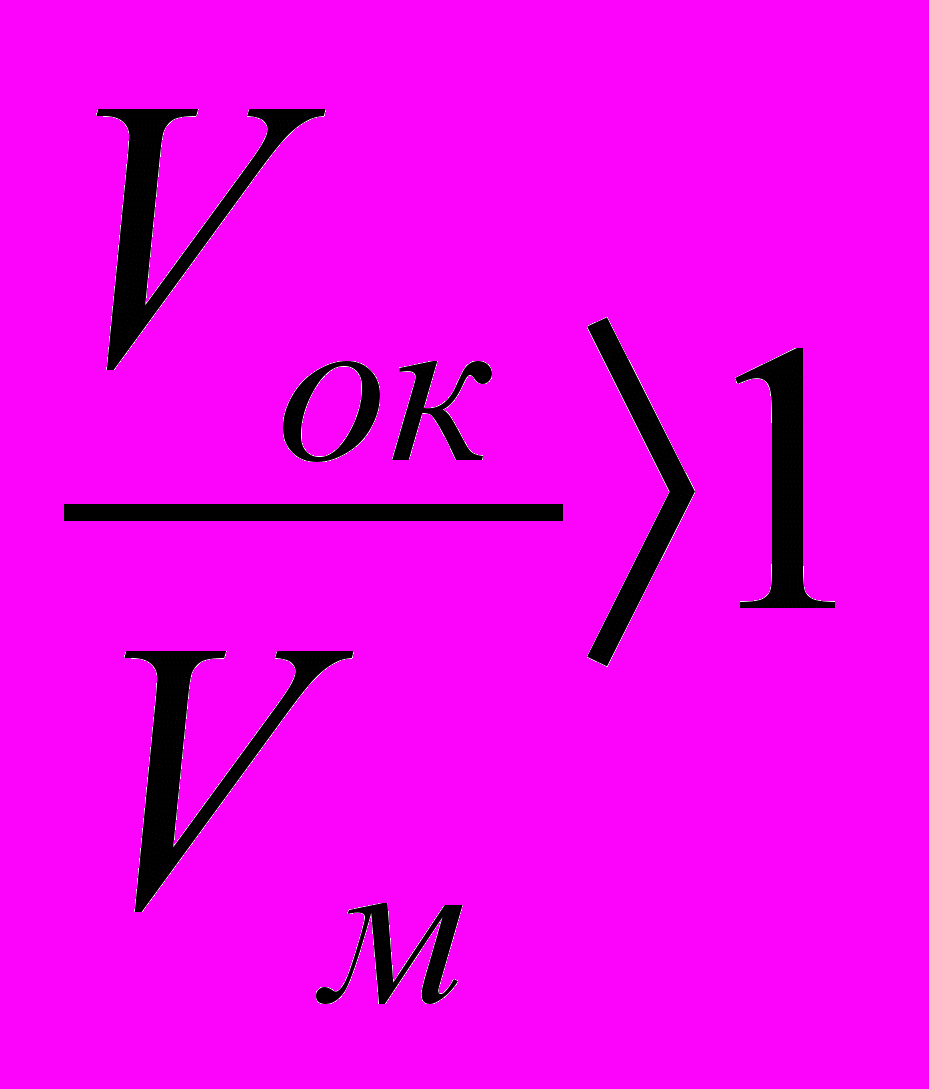 .
.Скорость химической коррозии возрастает с увеличением температуры из-за повышения коэффициента диффузии и изменения защитных свойств плёнки. Резкие изменения температуры часто вызывают быстрое разрушение защитной плёнки. Это связано с различными коэффициентами термического расширения металла и плёнки.
По условиям протекания коррозионного процесса различают газовую коррозию (протекающую в газах, парах при высокой температуре в отсутствие воды), и коррозию в жидкостях – неэлектролитах (нефть, фенол, бензин, бензол).
Электрохимическая коррозия
При электрохимической коррозии процесс взаимодействия металла с окислителем состоит из двух сопряженных реакций: анодного растворения металла и катодного восстановления окислителя. Эта коррозия может протекать в электролитах, атмосфере любого влажного газа, а также в почве.
Основным отличием электрохимической коррозии от химической является наличие влаги на поверхности металла, что приводит к контакту двух различных металлов через электролит. При этом возникают короткозамкнутые гальванопары, в результате чего появляется электрический ток. В этом случае процесс коррозии обусловлен работой гальванопары, то есть электрохимической реакцией. По этой причине электрохимическая коррозия более агрессивна по отношению к металлам, чем химическая.
Механизм электрохимической коррозии состоит в том, что происходит анодное окисление металла: M – ne = Mn+ и катодное восстановление окислителя (Ох) Ох+ne=Red.
Окислителями при коррозии служат молекулы кислорода, хлора, ионы Н+, Fe3+, NO3– и др. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода в нейтральной (щелочной) среде О2+2Н2О+4е=4ОН–, в кислой среде – восстановление водорода 2Н++2е=Н2.
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с выделением водорода или коррозией с водородной деполяризацией.
Кроме первичных реакций, в растворе протекают вторичные реакции:
Мх++хОН-=М(ОН)х
В результате взаимодействия металла с кислородом, как и при химической коррозии, образуется оксид металла: М(ОН)2=МО+Н2О.
Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов в электролите. Электролитами могут быть растворы солей, кислот и оснований, морская и атмосферная вода (содержащая кислород, углекислый, сернистый и др. газы). Основным отличием электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи.
Равновесные потенциалы водородного и кислородного электродов в зависимости от рН среды находят на основании уравнения Нернста:
φ2Н+/Н2=-0,059рН;
φО2/ОН=1,23-0,059рН.
Коррозия металлов в различных средах
Контактная коррозия
Контактная биметаллическая коррозия является разновидностью электрохимической коррозии, вызванной контактом металлов, имеющих разные электродные потенциалы в электролите. При этом коррозия металла с более отрицательным потенциалом обычно усиливается, а разрушение металла с положительным потенциалом замедляется или полностью прекращается. При конструировании учитывают возможность контактов различных металлов.
Атмосферная коррозия
На скорость атмосферной коррозии влияет влажность и газовый состав атмосферы. Влажность ,температура и степень загрязнения атмосферы влияют на качество и состав образующихся на поверхности металла плёнок. Наиболее агрессивны среды, сильно загрязненные промышленными газами (СО2, SO2, NO2, NH3, HCl), частицами солей и угольной пылью. В промышленных районах атмосферную коррозию могут интенсифицировать так называемые «кислотные дожди», основными агрессивными компонентами которых являются серные и азотные кислоты. Кислотные дожди (рН<4) легко вызывают коррозию сплавов алюминия, железа и цинка.
В зависимости от влажности атмосферы различают несколько видов атмосферной коррозии: мокрую, влажную и сухую. Мокрая атмосферная коррозия при относительной влажности до 100% наблюдается при наличии адсорбционной капиллярной или химической плёнки влаги на поверхности металла. Её толщина составляет от 0,1 мм до 1 мм. Понижение температуры интенсифицирует процесс конденсации и приводит к появлению капель влаги на поверхности металла.
Влажная коррозия возникает при влажности в атмосфере ниже 100%. Толщина плёнки влаги от 100 А0 до 0,1 мм. При влажности воздуха менее 60% наблюдается сухая атмосферная коррозия (коррозия под действием кислорода воздуха). Процесс разрушения металла подчиняется законам, характерным для газовой коррозии.
Подземная коррозия
Коррозионные разрушения металлических конструкций в почвах и грунтах вызываются подземной коррозией. Ей подвержены трубопроводы (водные, газовые, нефтяные), опоры электроконтактной сети и др. Скорость коррозии зависит от пористости и состава почвы, величины рН, наличия микроорганизмов. Подземная коррозия протекает по механизму электрохимической коррозии. Почвенная влага играет роль электролита и процесс коррозии протекает следующими образом:
Анодная реакция Fe-2e=Fe2+
Катодная реакция О2+2Н2О+4е=4ОН–
Реакции в почве Fe2++2OH-=Fe(OH)2, 4Fe(OH)2+2H2O+O2=4Fe(OH)3, 2Fe(OH)3+(n-3)H2O=Fe2O3nH2O.
Поверхность металла в местах ограниченного доступа кислорода выполняет роль катода.
Грунтовая коррозия металлических конструкций чаще всего происходит в условиях, характерных для нейтральных сред, с участием кислорода в качестве деполяризатора. В кислых почвах может происходить коррозия с водородной деполяризацией.
Исследование коррозионной активности грунтов позволили сделать вывод о том, что наиболее коррозионно-активными являются болотистые почвы, торфяники, ил. Песок и известняк практически не коррозионно-активны. Существенное влияние на скорость коррозии металлов оказывает рН почвы. В почвах с рН меньше 6,5 коррозионная активность по отношению к стали повышается. Наибольшей коррозионной активностью обладают почвы с рН<5,5. Нейтральные почвы с рН=6,5–7,5 и слабощелочные до рН=8,5 не коррозионно-активны.
На скорость коррозии влияет также величина удельного электрического сопротивления грунта. Коррозия металлических подземных конструкций зависит от содержания в почве и грунте различных солей. Так, с увеличением содержания хлоридов, сульфатов скорость коррозии возрастает. Повышение температуры также способствует повышению скорости грунтовой коррозии металлов.
Коррозия под действием блуждающих токов
Блуждающими токами называются электрические токи, протекающие в земле при использовании её в качестве токопроводящей среды. Попадая в металлические конструкции, расположенные в грунте, они вызывают коррозию. Источниками возникновения блуждающих токов в почве являются электрифицированные железные дороги постоянного тока, трамваи, линии электропередач.
Поскольку рельсы не достаточно изолированы от земли, а почва является проводником, то часть тока уходит в землю, встречая на своём пути подземные металлические сооружения. Так как контактный провод подсоединен к положительному полюсу тяговой подстанции, а рельс – к отрицательному, то в месте выхода тока из рельса образуется анодная зона, где коррозия разрушает подошву рельса и крепежные детали. При этом, чем меньше переходное сопротивление рельс-земля, тем большая часть тока возвращается к тяговой подстанции через землю и тем интенсивнее анодная зона на рельсе. Этот вид коррозии очень опасен, так как блуждающие токи нередко распространяются на несколько десятков километров и вызывают сильные повреждения металлических конструкций.
Виды коррозионных разрушений
По виду коррозионного разрушения коррозия делится на следующие виды.
- Сплошная, или общая коррозия. Она может быть равномерной, если фронт коррозионного разрушения распределяется параллельно плоскости металла, и неравномерной, когда скорость коррозии на различных участках неодинакова.
- Избирательная коррозия. Она характерна для сплавов и твердых растворов.
- Локальная коррозия. Она связана с образованием и локализацией пораженных коррозией мест в виде «раковин» разной величины.
- Питтинг - коррозия. Разрушение металла начинается в глубине, с образованием пор; часто приводит к образованию сквозных отверстий.
- Межкристаллитная коррозия. Разрушение идет по границам металлических кристаллов.
- Внутрикристаллическая коррозия. Наблюдается при коррозионном растрескивании под действием внешних механических нагрузок или внутренних напряжений.
ЛЕКЦИЯ ПО ТЕМЕ: «Защита металлов от коррозии»
План
- Легирование металлов
- Защитные покрытия
- Электрохимическая защита (катодная, анодная, протекторная). Защита от коррозии блуждающими токами
- Ингибиторы коррозии
Все методы защиты металлов от коррозии условно делятся на следующие группы: легирование металлов, защитные покрытия, электрохимическая защита, изменение свойств коррозионной среды, рациональное конструирование изделий.
Легирование металлов
Это эффективный метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, вольфрам и другие металлы. Широкое применение нашло легирование для защиты от газовой коррозии. Введение некоторых добавок в стали (титана, меди, хрома и никеля) приводит к тому, что при коррозии образуется плотная плёнка продуктов реакции, предохраняющая сплав от дальнейшей коррозии. При этом обеспечивается жаростойкость и жаропрочность сплавов.
Жаростойкость обычно обеспечивается легированием металлов и сплавов (например, стали хромом, алюминием и кремнием). Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют плотные защитные плёнки оксидов, например, SiO2, Al2O3, Cr2O3. Хром и кремний также улучшают жаропрочность сталей. Легирование также используется с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода. К коррозионностойким сплавам относятся нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы.
Защитные покрытия
Слои, искусственно создаваемые на поверхности металлических изделий для предохранения их от коррозии, называются защитными покрытиями. Применяемые в технике покрытия подразделяются на металлические и неметаллические.
Металлические покрытия. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, олово, хром, серебро), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на анодные и катодные.
К катодным покрытиям относятся покрытия, потенциал которых в данной среде имеют большее значение, чем потенциал основного (покрываемого) металла. В качестве примеров катодных покрытий для стали можно привести медь, никель, кадмий, олово, серебро. При повреждении покрытия возникает коррозионный элемент, в котором основной материал (сталь) служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
Анодные покрытия имеют меньший потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали. В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует.
Для получения металлических защитных покрытий применяются различные способы: электрохимический (гальванические покрытия), погружение в расплавленный металл, термодиффузионный и химический.
Неметаллические защитные покрытия. Они могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, полимерными плёнками, резиной.
Электрохимическая защита
Электрохимическую защиту используют для предотвращения разрушения подземных трубопроводов, кабелей, корпусов судов, резервуаров, подводных лодок и т.д.
Электрохимическая защита основана на замедлении катодных и анодных реакций микрогальванических элементов. Она осуществляется присоединением к конструкции источника постоянного тока или дополнительного электрода.
Электрохимическую защиту подразделяют на катодную и анодную.
