Предупреждение и лечение острой почечной недостаточности при критических состояниях 14. 00. 37 Анестезиология и реаниматология
| Вид материала | Автореферат диссертации |
- Общий список научных и учебно- методических трудов, 753.64kb.
- Диагностика и лечение острой сердечной недостаточности, 533.21kb.
- Новые публикации по анестезиологии, 109.72kb.
- Прогнозирование, профилактика и упреждающая интенсивная терапия полиорганной недостаточности, 907.95kb.
- Вопросы к дифференцированному зачету по дисциплине «анестезиология и реаниматология», 87.11kb.
- Протокол профилактики стресс-повреждения верхнего отдела жкт у больных в критических, 501.02kb.
- Современные принципы лечения ацидоза при критических состояниях, 188.77kb.
- Методические рекомендации по подготовке аттестационного дела на соискание квалификационной, 493.63kb.
- Интенсивное лечение эклампсической комы 14. 01. 20 Анестезиология и реаниматология, 452.57kb.
- Тесты для сертификационного экзамена по специальности «анестезиология и реаниматология», 3656.01kb.
Рециркуляция при использовании вариантов вено-венозного сосудистого доступа для гемодиализа.
Рециркуляция в экстракорпоральном контуре – это попадание очищенной крови от венозной к артериальной кровопроводящей магистрали без прохождения капиллярной системы тела человека, что нивелирует эффект экстракорпоральной детоксикации. Особое значение проблема рециркуляции в сосудистом доступе приобретает при использования высокообъемной гемофильтрации – ведь для замещения 80 - 100 мл/кг/час требуется ежеминутный обмен 120 – 150 мл жидкости, следовательно, применение наиболее эффективного способа «постдилюции» требует достижения скорости экстракорпорального кровотока 350 – 500 мл в минуту. Поэтому крайне важным становится выбор сосудистого доступа, который бы мог обеспечить такой кровоток без значимой рециркуляции. Для оценки рециркуляции крови в экстракорпоральном контуре в зависимости от скорости кровотока при различных вариантах вено-венозного сосудистого доступа проводили у 47 больных. Долю рециркуляции определяли термодилюционным способом на основе анализа температуры крови в артериальной магистрали после охлаждения диализатом на 2-3оС крови, возвращаемой в организм через венозную магистраль.
При катетеризации подключичной вены двухпросветным катетером кровоток до 200 мл в минуту не приводил к значимой рециркуляции и сопровождался увеличением клиренсов. При кровотоке 250 мл в минуту рециркуляция в среднем составила 8,4 %, клиренсы значимо не отличались от таковых при кровотоке 200 мл в минуту. Дальнейшее увеличение кровотока вело к росту рециркуляции – при кровотоке 300 она составила в среднем 28,9 %, а при кровотоке 350 мл в минуту – 43,3 % (рис. 8).
Наибольшие очищающие возможности реализовывались при кровотоке 250 мл/мин, а в последующем рециркуляция пагубно сказывалась на клиренсовых показателях, и при кровотоке 350 мл/мин они оказались достоверно меньше, чем при кровотоке 150 мл в минуту (табл. 4).
Использование билатеральной подключичной катетеризации уже при кровотоке 200 мл в минуту приводило к рециркуляции в среднем 16,4%, а при кровотоке 250 мл/мин – 29,5%.
Таблица 4 .
Клиренсовые показатели в зависимости от скорости кровотока при использовании двухпросветного подключичного катетера
| Скорость кровотока, мл в минуту | Клиренс, мл в минуту | ||
| по мочевине | по креатинину | по фосфатам | |
| 150 | 148 ± 5,6 | 142 ± 3,8 | 130 ± 4,2 |
| 200 | 176 ± 7,2 | 154 ± 2,6 | 146 ± 4,8 |
| 250 | 198 ± 12,4 | 176 ± 8,7 | 161 ± 7,9 |
| 300 | 155 ± 11,2 * | 121 ± 7,7 * | 118 ± 3,9 * |
| 350 | 79 ± 24,4 * | 67 ± 12,1 * | 72 ± 11,6 * |
* р < 0.05 по сравнению с клиренсами на кровотоке 250
При катетеризации бедренных вен применяли катетеры длиной 20 м и 15 см соответственно. Рециркуляция в сосудистом доступе при использовании 20 см бедренных катетеров была сходна с таковой у больных с двухпросветными подключичными катетерами, и была даже несколько меньше на максимальных кровотоках, что позволило эффективно увеличивать клиренсовые показатели с достижением максимальных значений на кровотоке 300 мл в минуту (рис.8)

Рис. 8. Рециркуляция в сосудистом доступе в зависимости от скорости кровотока при использовании бедренных катетеров различной длины в сравнении с подключичной катетеризацией.
Проведение высокообъемной гемофильтрации требовало достижения скорости кровотока более 350 мл в минуту. Использование стандартных вариантов катетеризации центральных вен не позволило достигнуть этого значения, поэтому 4 больным мы использовали специальные тоннелированные двухходовые катетеры, которые имплантировали под контролем ангиографии через внутреннюю яремную вену (табл. 5).
Таблица 5.
Показатели клиренса и рециркуляция в экстракорпоральном контуре при использовании тоннелированого двухходового яремного катетера
| Скорость кровотока, мл в минуту | Клиренс мл в минуту | Рециркуляция % | ||
| по мочевине, | по креатинину | по фосфатам | ||
| 150 | 151 ± 5,6 | 142 ± 3,8 | 130 ± 4,2 | 0 |
| 200 | 176 ± 7,2 | 154 ± 2,6 | 146 ± 4,8 | 0 |
| 250 | 198 ± 12,4 | 176 ± 8,7 | 161 ± 7,9 | 0 |
| 300 | 205 ± 11,2 | 187 ± 7,7 | 178 ± 3,9 | 0 |
| 350 | 219 ± 24,4 | 191 ± 12,1 | 180 ± 11,6 | 3,2 |
| 400 | 235± 14,2* | 189 ± 11,1* | 182 ± 9,2 | 5,4 |
| 450 | 260 ± 16,1* | 192 ± 18,2* | 180 ± 10,9* | 6,2 |
* р < 0.05 по сравнению с клиренсами на кровотоке 250 мл/мин
При использовании тоннелированных двухходовых яремных катетеров достижение кровотока даже в 450 мл в минуту не приводило к появлению значимой рециркуляции, а клиренсовые показатели нарастали, хотя на кровотоках более 350 мл в минуту и выходили практически «на плато», что связано с ограниченными возможностями используемых диализных мембран. Минимальная рециркуляция в сосудистом доступе даже на сверхвысоких кровотоках (450 мл в минуту) наблюдалась при использовании тоннелированных яремных двухходовых катетеров, что позволяет рекомендовать их при необходимости проведения высокообъемной гемофильтрации.
Углеводный обмен во время гемодиализа
Проведение экстракорпоральной детоксикации, как и любого другого оперативного вмешательства, сопровождается активацией катаболизма, прогрессированием гипоксии, что может полностью нивелировать положительный эффект от лечебного воздействия (Теодореску – Экзарку И., 1962). Поэтому проведение гемодиализа при ОПН зачастую прерывается из-за дестабилизации состояния больного (Даугирдас Дж., 2003). Оптимизация проведения гемодиализа должна включать компенсацию катаболического эффекта от его проведения. Стремление разработать эффективную систему нормализации углеводного обмена во время гемодиализа подвигло нас оценивать концентрацию глюкозы в крови и потери ее с эффлюентом, а также использовать для этой цели «Кибернетический комплекс» диагностики и терапии сахарного диабета, разработанный Новиковым В.К. и соавт, 1998., который основан на определении разницы ректальной температуры и температуры поверхности тела. Гормональную регуляцию углеводного обмена контролировали по динамике концентрации эндогенного инсулина и глюкагона до и после гемодиализа
Углеводный обмен во время проведения гемодиализа изучался у 28 больных с ОПН циркуляторного генеза, не страдавших сахарным диабетом и не имеющих клинико-лабораторных признаков повреждения поджелудочной железы. Концентрация глюкозы до начала диализа была несколько выше физиологической нормы (6,2 ± 2,1 ммоль/л), что характерно для критических состояний, связанных с повышенной концентраций контринсулярных гормонов надпочечников. По ходу лечения она не претерпевала существенных изменений (рис. 9).
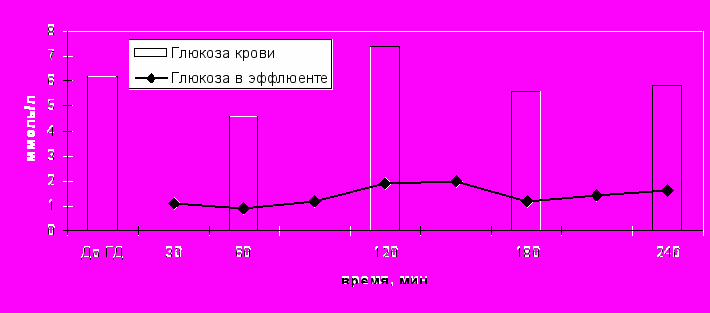 Рисунок 9. Концентрация глюкозы при проведении гемодиализа.
Рисунок 9. Концентрация глюкозы при проведении гемодиализа.В то же время, содержание глюкозы в эффлюенте было более чем значимым, составляя в среднем 1,2 ± 0,16 ммоль/л. Расчетным путем определили, что за стандартный гемодиализ у больного с эффлюентом в среднем терялось 37,4 ± 3,7 г глюкозы. В то же время, внутривенно вводилось 32 г (дважды по 40 мл 40% раствора), что должно было практически полностью нивелировать указанные потери.
Исследование температуры крови в артериальной и венозной магистралях выявило значительные энергетические потери, связанные с охлаждением крови. Стандартная температура диализирующего раствора (37 оС) основана на минимальном превышении температуры тела здорового человека (с учетом потерь энергии в кровопроводящих магистралях). Однако реальная разность температур крови в артериальной и венозной кровопроводящей магистрали экстракорпорального контура приводила к значительной потере тепловой энергии, равной в среднем 89,6 ± 15,2 кДж в час или 394,2 ± 78,4 кДж (максимально – до 2000 кДж) за 4 часа стандартного гемодиализа.
В результате мониторирования ректальной температуры и температуры поверхности тела, определено, что до начала гемодиализа соотношение температур у больных соответствовало физиологической норме – ректальная температура была в среднем на 0,78 ± 0,21°С выше температуры поверхности тела (рис. 10). Это значение сохранялось в течение 60 - 90 минут гемодиализа. В последующем на фоне незначительного снижения ректальной температуры отмечено постепенное нарастание температуры поверхности тела. К третьему часу диализа эти показатели выравнивались, а затем разница температур становилась даже отрицательной.
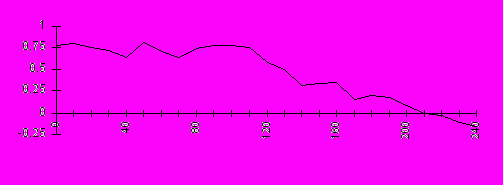
время, мин
Рисунок 10. Разность ректальной температуры и температуры поверхности тела по ходу гемодиализа.
Повышение температуры поверхности тела сочеталось с изменением концентрации гормонов, регулирующих углеводный обмен. После диализа отмечено существенное снижение содержания инсулина (c 16,2 ± 4,1 до 2,9 ± 0,9 мКе/мл, р < 0,05) на фоне значительного возрастания концентрации глюкагона (c 146, 4 ± 24, 8 до 298,2 ± 44,9 пг/мл, р < 0,05). Уменьшение концентрации инсулина и увеличение содержания глюкагона может приводить к разобщению процессов окислительного фосфорилирования, что будет сопровождаться повышением температуры тела в результате активации расщепления жиров подкожно-жировой клетчатки (Faster D.O., 1984). Схема патогенеза нарушений углеводного обмена во время гемодиализа представлена на рисунке 11.

Рисунок 11. Патогенез нарушений углеводного обмена во время гемодиализа
Итак, проведение стандартного гемодиализа сопровождается значительной активизацией катаболизма, в первую очередь проявляющейся в нарушениях углеводного обмена. Мы сравнили эффективность физических и биохимических методов компенсации нарушений углеводного обмена во время гемодиализа. В группе А (n=15) использовали стандартный диализирующий раствор, однако температуру его подбирали индивидуально с целью поддержания изотермичности крови в артериальной и венозной кровопроводящих магистралях. Больным группы B (n=21) гемодиализ проводили с использованием диализирующего раствора, который дополнительно содержал 4 ммоль/л глюкозы. В группе С (n=12) использовали оба пути воздействия на энергетический обмен - изотермический диализирующий раствор содержал 4 ммоль/л глюкозы. В группу D были включены 14 больных, которым на фоне изотермического диализа для нейтрализации избытка глюкагона проводилась постоянная дозированная инфузия инсулина и 20 % раствора глюкозы в венозную кровопроводящую магистраль аппарата «Искусственная почка» под контролем баланса температуры крои в артериальной и венозной кровопроводящих магистралях. Критерием выбора скорости и объема инфузии являлось поддержание постоянства разницы ректальной температуры и температуры поверхности тела.
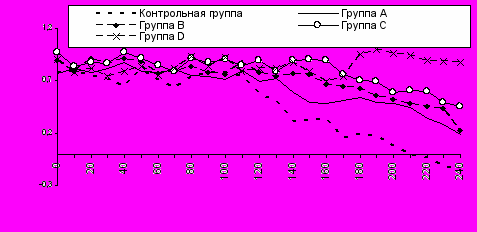
время, мин
Рисунок 12. Разница ректальной температуры и температуры поверхности тела в группах.
Изменение содержания глюкозы в плазме крови и диализирующем растворе у больных группы А (изотермический диализат) не отличалось от контроля. Динамика температурного баланса (рис. 12) также была схожа с контрольным исследованием, однако разница ректальной температуры и температуры поверхности тела хотя и значительно уменьшалась, но сохранялась положительной до конца диализа. В группе В компенсация нарушений углеводного обмена была более эффективной, однако после диализа отмечено повышение уровня глюкагона и снижение содержания инсулина не выходящее за пределы физиологической нормы. По-видимому, полной компенсации нарушений углеводного обмена добиться не удалось вследствие того, что концентрация глюкозы крови подвержена большим изменениям и не может оперативно устраняться изменением содержания ее в диализирующем растворе.
Больные группы C, гемодиализ которым проводился с использованием изотермичного и глюкозосодержащего диализата, имели наилучшую динамику по сравнению с группами А и В. Существенного изменения концентрации инсулина у них не наблюдалось, однако отмечалось снижение нормального соотношения температур и увеличение концентрации глюкагона (табл. 6).
Таблица 6
Содержание инсулина и глюкагона до и после гемодиализа
| Показатели | Значения показателей в группах | ||||
| Контрольная n=21 | А n=15 | В n=21 | С n=12 | D n=14 | |
| Инсулин до гемодиализа мКе/мл | 16,2 ± 4,1 | 15,8 ± 5,1 | 19,3 ± 7,1 | 14,7 ± 5,2 | 16,2 ± 4,8 |
| Инсулин после гемодиализа, мКе/мл | 2,2 ± 0,9 | 2,2 ± 0,9 | 4,7 ± 0,9 | 12,2 ± 0,9* | 18,9 ± 5,1** |
| Глюкагон до гемодиализа пг/мл | 146,4 ± 24,8 | 119,1 ± 34,8 | 98,4 ± 44,8 | 126,4 ± 28,8 | 152,2 ± 29, 1 |
| Глюкагон после гемодиализа, пг/мл | 298,2 ± 44,9 | 312,2 ± 22,2 | 289,4 ± 19,2 | 240,2 ± 16,4* | 162,4 ± 34,8** |
* - р < 0.05 по сравнению с контрольной группой
** - р < 0.01 по сравнению с контрольной группой
У больных группы D при использовании интрадиализной инфузии глюкозы и инсулина на фоне изотермичности диализата нарушений углеводного обмена за 4 часа гемодиализа не развивались, несмотря на то, что у этих больных потери глюкозы с эффлюентом составили в среднем 45,3 ± 4,4 г, что почти на 15 г больше, чем в контрольной группе, однако это компенсировалось за счет инфузии гипертонического раствора глюкозы. Кривая разности температур не претерпевала существенных изменений во время гемодиализа, а уровень инсулина и глюкагона оставался стабильным.
Таким образом, гемодиализ оказывает выраженный катаболический эффект, проявляющийся в потере за 4 часа стандартного гемодиализа до 2000 кДж энергии и до 37,4 г глюкозы в экстракорпоральном контуре, а также сопровождается снижением концентрации инсулина и нарастанием уровня глюкагона в плазме. Катаболизирующий эффект гемодиализа компенсируется использованием изотермичного диализата с одновременной дозированной инфузией инсулина и глюкозы под контролем температурного баланса. Критерием выбора объема и скорости инфузии является сохранение постоянства разницы ректальной температуры и температуры поверхности тела в 0,7 - 1,0° С.
Заместительная терапия при острой печеночно-почечной недостаточности
Тяжелая острая печеночная недостаточность часто приводит к развитию содружественного повреждения почек, обусловленного системной гипотонией из-за недостаточной дезактивации поврежденной печенью эндогенного оксида азота (Dagher L., 2001). Острая печеночно-почечная недостаточность, потребовавшая проведения заместительной терапии, наблюдалась нами у 29 больных. Основной ее причиной явилось значительное интраоперационное уменьшение паренхимы печени во время операций по поводу ее первичного или метастатического опухолевого повреждения. Другими причинами были фульминантные формы вирусного гепатита В, болезнь Коновалова-Вильсона, а также печеночно-почечная недостаточность, вызванная прогрессированием полиорганной недостаточности при сепсисе.
Лечение острой печеночно-почечной недостаточности у 10 больных осуществляли с использованием комбинации гемодиафильтрации и гемосорбции (группа ГД); у 19 больных лечение проводили с использованием альбуминового диализа (группа АлД). У 9 больных причиной ОППН было значительное уменьшение паренхимы печени после операций по поводу ее первичных или метастатических опухолей. При этом 7 из них была выполнена расширенная гемигепатэктомия с сохранением 3-4 сегментов печени, а двум – комбинация резекции печени и радиочастотной термоабляции многочисленных (в одном случае – 16, в другом – 24) метастатических очагов в оставшейся части печени. Показанием к альбуминовому диализу явились нарастающая энцефалопатия, выраженная гипербилирубинемия (концентрация общего билирубина более 255 мкмоль/л), гипераммониемия, появление признаков почечной недостаточности.
Несмотря на некоторую положительную лабораторную динамику значимого клинического эффекта от проведения гемодиафильтрации получено не было. Гемодинамика значимо не изменялась, напротив, даже отмечалась тенденция к снижению САД на фоне выраженной тахикардии. Изменения сознания также не происходило – напротив, в двух случаях отмечено нарастание энцефалопатии, вероятно обусловленное нарушением осмотического равновесия, характерным для гемодиализа. Изменение почечной функции в результате проведения гемодиафильтрации также не наблюдалось. При лабораторном исследовании определено, что гемодиафильтрация и гемосорбция удовлетворительно корректировали гиперазотемию и электролитные расстройства. В то же время снижение гипербилирубинемии было малозначимым, в основном за счет прямой фракции (в среднем в 1,2 раза) Таким образом, при гемодиафильтрации эффективно удалялись только гидрофильные токсические субстанции (табл. 7).
Таблица 7
Изменение основных лабораторных показателей в результате диализа
| Показатели | Ед. измерения | Значения показателей на этапах исследования | |||||
| Группа ГД (n = 10) | Группа АлД (n = 19) | ||||||
| До ГДФ | После ГДФ | Кратность снижения | До АлД | После АлД | Кратность снижения | ||
| Общий билирубин | мкмоль/л | 386 ± 86 | 324 ± 45 | 1,2 | 492 ± 105 | 207 ± 37 | 2,37 |
| Прямой билирубин | мкмоль/л | 334 ± 45 | 255 ± 89 | 1,3 | 357 ± 64 | 116 ± 29 | 3,07 |
| Непрямой билирубин | мкмоль/л | 52 ± 29 | 69 ± 45 | - | 135 ± 36 | 91 ± 31 | 1,48 |
| Аммиак | мкг% | - | - | - | 164 ± 32 | 78 ± 14 | 2,1 |
| Азот мочевины | ммоль/л | 21,1 ± 4,5 | 7,9 ± 2,2 | 2,67 | 23,4 ± 5,2 | 8,6 ± 1,9 | 2,72 |
| Креатинин | мкмоль/л | 472 ± 189 | 207 ± 48 | 2,28 | 367 ± 47 | 63 ± 14 | 6,9 |
| Общий белок | г/л | 39,1 ± 1,9 | 39,9 ± 3,6 | - | 38,4 ± 2,2 | 39,2 ± 2,9 | - |
| Альбумин | г/л | 26,8 ± 1,7 | 27,2 ± 2,2 | - | 25,9 ± 2,8 | 27,1 ± 1,9 | - |
| С-реактивный белок | мг/л | 39,1 ± 12,2 | 46,8 ± 8,4 | - | 45,9 ± 11,2 | 79,1 ± 14,1 | - |
В отличие от этого, в ближайших непосредственных результатах альбуминового диализа можно выделить три очевидных положительных эффекта, резкое снижение гипербилирубинемии, а также восстановление показателей гемодинамики и резкое снижение проявлений энцефалопатии. Уже через 4-6 часов после начала АлД отмечали появление связной речи и целенаправленных произвольных движений, а по завершению - полное купирование энцефалопатии (в среднем до 14,4 балла по шкале комы Глазго) и появление аппетита. В трех случаях восстановление ясного сознания произошло уже на 3 часу альбуминового диализа.
Также существенными оказались и изменения показателей гемодинамики. По ходу АлД через 4-6 часов после его начала отмечалось восстановление САД до физиологического уровня (в среднем с 64 ± 13 до 87 ± 5 мм рт. ст.) на фоне нормальной ЧСС и увеличения ОПСС с 1029 ± 110 до 1450 ± 86 дин.сек.см-5.м-2 (табл. 8).
Таблица 8
Показатели гемодинамики до и после альбуминового диализа
| Показатели | Число обследованных больных / выполненых операций альбуминового диализа | Значения показателей на этапах исследования | |
| до альб. диализа | после альб. диализа | ||
| САД мм рт. ст. | 19/31 | 64 ± 13 | 87 ± 5 * |
| ЧСС в минуту | 19/31 | 79 ± 19 | 83 ± 18 |
| ОПСС дин.сек.см-5.м-2 | 9/16 | 1029 ± 110 | 1450 ± 86 * |
