Предупреждение и лечение острой почечной недостаточности при критических состояниях 14. 00. 37 Анестезиология и реаниматология
| Вид материала | Автореферат диссертации |
СодержаниеМетоды исследования. Результаты собственных исследований Гемодинамическое и нефропротективное действие высокообъемной гемофильтрации при септическом шоке |
- Общий список научных и учебно- методических трудов, 753.64kb.
- Диагностика и лечение острой сердечной недостаточности, 533.21kb.
- Новые публикации по анестезиологии, 109.72kb.
- Прогнозирование, профилактика и упреждающая интенсивная терапия полиорганной недостаточности, 907.95kb.
- Вопросы к дифференцированному зачету по дисциплине «анестезиология и реаниматология», 87.11kb.
- Протокол профилактики стресс-повреждения верхнего отдела жкт у больных в критических, 501.02kb.
- Современные принципы лечения ацидоза при критических состояниях, 188.77kb.
- Методические рекомендации по подготовке аттестационного дела на соискание квалификационной, 493.63kb.
- Интенсивное лечение эклампсической комы 14. 01. 20 Анестезиология и реаниматология, 452.57kb.
- Тесты для сертификационного экзамена по специальности «анестезиология и реаниматология», 3656.01kb.
Методы исследования.
Больным проводили всестороннее клиническое, лабораторное и инструментальное обследование. В работе выполнен анализ лабораторных показателей при поступлении больных в стационар, до и после проведения операций экстракорпоральной детоксикации. Состояние больных при поступлении в стационар оценивали по шкале тяжести APACHE 2. При развитии системной гипотонии со снижением САД ниже 70 мм рт.ст. больным выполняли исследование количественного и биохимического состава мочи (мочевина, креатинин, натрий, калий, 2 – микроглобулин) (в2мг). Общеклинические исследования крови производили на автоматическом гематологическом аппарате «System 9000» (Baker, США). Определение биохимических показателей крови и мочи выполняли на автоматическом биохимическом анализаторе Technikon (Technikon, США) и биохимическом лабораторном аппарате Spektrum (Abbot, США). У части больных радиоиммунохимическим методом на аппарате Trakor – 1290 (Голландия) определялся уровень 2 – микроглобулина (в-2-мг), С-пептида, инсулина и глюкагона крови.
Многокомпонентный неинвазивный мониторинг состояния больного включал динамическое наблюдение за параметрами центральной гемодинамики, балансом водных секторов. Для оценки центральной гемодинамики и состояния водных секторов использовали аппаратно-программный комплекс "Диамант-Р", с помощью которого выполнялась импедансная спектроскопия (по Тищенко М.И.), проводимая до начала лечения и ежедневно в течение всего периода проведения заместительной почечной терапии. Кислотно-щелочное состояние (КЩС) и газы крови определяли на аппарате ABL – 300 (Radiometer, Дания).
Расчет доставки кислорода (DO2, мл/мин • м2) проводили по формуле:
DO2 = СИ (мл/мин *м2) * caO2(г/л)/1000 (норм. 550-680 мл/мин*м2).
Потребление кислорода (VO2, мл/мин • м2) определяется по формуле:
VO2 = AVR cO2(г/л)* СИ (мл/мин*м2)/1000 (норм. 115-165 мл/ мин* м2),
где AVR cO2 - артерио-венозная разница по содержанию кислорода.
Коэффициент экстракции кислорода (КЭК, %) считали по формуле:
КЭК = AVR cO2(г/л)/ caO2(г/л) *100 (норм 26-34%)
(Золотокрылина Е.С., 1997)
Состояние углеводного обмена оценивали по данным «Кибернетического комплекса», разработанного Новиковым В.К. и соавт. (патент №1718822), который основан на одновременном определении ректальной температуры и температуры поверхности тела. С целью контроля температурного баланса во время гемодиализа использовали дополнительный модуль BTM аппарата «Искусственная почка» Fresenius 4008 Н, который позволяет оценить температуру крови в выходящей и входящей магистрали аппарата «Искусственная почка», а также суммарную потерю энергии в процессе гемодиализа (в кДж). Этот же модуль использовали для оценки доли рециркуляции в экстракорпоральном контуре термодилюционным способом. Одновременно с оценкой рециркуляции исследовали клиренс по мочевине, креатинину и фосфатам, рассчитывая его по формуле
Cа - Cv
клиренс = ___________________________ х Qb
Cа
где Сa - концентрация вещества перед диализатором
Сv - концентрация вещества после диализатора
Qb - скорость кровотока (мл/мин)
Заместительная почечная терапия выполнялась в различных режимах - интермиттирующего гемодиализа, продленной гемофильтрации и гемодиафильтрации, а также высокообъемной гемофильтрации. Интермиттирующий гемодиализ выполнялся на аппаратах «Искусственная почка» 2008 С и 4008 Н (Fresenius, ФРГ). Последний аппарат, оснащенный дополнительным блоком «HDF on line», использовался для проведения также гемодиафильтрации и гемофильтрации в режиме производства замещающего раствора из диализата. Продленную гемофильтрацию и гемодиафильтрацию выполняли на специальных гемопроцессорах Prisma и Prismaflex (Gambro, Швеция) и Multifiltrat (Fresenius, ФРГ). Заместительное аппаратное лечение при острой печеночно-почечной недостаточности проводили с использованием комбинации гемодиафильтрации (ГДФ) и гемосорбции на аппарате «Искусственная почка» Fresenius 4008 H, а также альбуминового диализа на аппарате MARS (Gambro, Швеция). В отличие от гемодиализа и гемосорбции в этой системе реализован принцип опосредованной детоксикации через специальную высокопроницаемую мембрану. Перфузия крови осуществляется внутри капилляров диализатора, при этом снаружи роль диализата выполняет донорский альбумин. По градиенту концентраций происходит диффузия токсических субстанций через полупроницаемую мембрану из крови в наружный альбуминовый контур, принимающий на себя токсины. В связи с ограниченной проницаемостью мембраны (до 50 кДа) через мембрану проходят только вещества с малой и средней молекулярной массой, что позволяет избежать потери эндогенных функциональных молекул. В последующем за счет рециркуляции через обычный диализатор, сорбент и анионно-обменную смолу осуществляется регенерация связывающей способности насыщенного токсинами донорского альбумина.
Результаты, полученные при исследовании, обработаны вариационно-статистическим методом по t-критерию Стьюдента. Рассчитывали среднюю арифметическую (Х), среднее квадратическое отклонение (SD), значение t-критерия Стьюдента (t) и уровень значимости различий (р). При сравнении групп данных определяли коэффициент корреляции (k). Учитывая небольшое число наблюдений в группах, проверка статистических гипотез осуществлялась на основе непараметрических методов (Манна-Уитни, Колмогорова-Смирнова). Различие считали статистически достоверным, если уровень значимости был р < 0,05. Статистическая обработка результатов исследований выполнена на персональном компьютере с использованием пакета статистических прикладных программ Microsoft Statistica 6.0 и применением специальных программ непараметрической статистики, определяющих достоверность различий малых групп данных.
Результаты собственных исследований.
Наиболее частой причиной ОПН было нарушение почечной перфузии в результате острой сердечно-сосудистой недостаточности - острая почечная недостаточность циркуляторного генеза, которую диагностировали у 176 больных. Больные с ОПН циркуляторного генеза были разделены на 3 группы.
В первую группу были включены 46 больных, у которых почечное повреждение диагностировалось по снижению суточного диуреза (до олигурии - менее 10 мл/кг мочи в сутки) и нарастанию азотистых шлаков. Им проводили стандартный лабораторно-инструментальный мониторинг. Диагностика почечного повреждения не влекла за собой изменения стандартной интенсивной терапии, а гемодиализ начинали отсрочено (по традиционным показаниям). Эти больные составили группу сравнения.
Во вторую группу были включены 75 больных, которым при снижении темпа диуреза или нарастании креатинина или мочевины начинали применение комплекса лечебных мероприятий, названных нами «нефропротективной терапией», целью которой явилось устранение гипоксии канальцевого эпителия, а по сути и восстановление всей висцеральной микроциркуляции.
В третью группу были включены 55 больных, которым после перенесенного эпизода гипотонии проводили активную диагностику возможного почечного повреждения, включавшую оценку как количественного, так качественного состава мочи (концентрация натрия, суточная экскреция креатинина и мочевины), а также расчета скорости клубочковой фильтрации (СКФ). При выявлении ранних признаков ОПН вне зависимости от уровня азотемии и темпа диуреза в этой подгруппе назначали комплексную «нефропротективную» терапию, а при ее недостаточной эффективности незамедлительно начинали проведение заместительной почечной терапии.
Тяжесть состояния всех больных была значительна и статистически не различалась в подгруппах - по шкале APACHE II в среднем она составляла 29,6±0,6 (12,0 – 38,0) баллов. По шкале оценки органной недостаточности, связанной с сепсисом – SOFA – тяжесть состояния больных была в среднем равна 14,7±0,5 (6,0 – 20,0) баллов.
В первой группе специального медикаментозного лечения ОПН не проводилось. При лечении первой группы критерии начала ЗПТ соответствовали показаниям, характерным для терминальной почечной недостаточности – неотложными показаниями считались критическая гипергидратация, гиперкалиемия с ЭКГ-признаками, а также не поддающийся инфузионной коррекции декомпенсированный метаболический ацидоз. Плановое диализное лечение начиналось при нарастании азотистых шлаков до уремических значений (мочевины – до 50-60 ммоль/л, креатинина до 700 – 800 мкмоль/л) или появлении признаков уремической интоксикации. Методом выбора диализной терапии в этой группе был стандартный гемодиализ, который проводился 2 – 3 раза в неделю по 4 часа. В среднем было выполнено 7,6 диализов. У 11 больных в результате проводимого лечения отмечена стабилизация состояния, разрешение ОПН в течение в среднем 24,7 ± 6,2 суток. В 35 случаях (76,1 %) отмечен летальный исход на фоне нарастающих проявлений полиорганной недостаточности. У 14 больных (30,5 %) до наступления летального исхода было выполнено 1-2 гемодиализа.
Больным 2 группы при выявлении ОПН начинали проведение интенсивной медикаментозной нефропротекции, целью которой является устранение гипоксии канальцевого эпителия. Для восстановления объема циркулирующей крови и улучшения притока крови к почкам увеличивали объем инфузионной терапии под контролем ЦВД до достижения значений 60 – 80 мм вод. ст. в течение 4-6 часов. Органную перфузию потенцировали применением осмотически активных веществ (20% раствор глюкозы в количестве 400 – 800 мл в сутки, дозированная инфузия 15 % раствора маннита в дозе 2 – 3 мл /кг массы тела в сутки, 10% раствор хлорида натрия при гипонатриемии). При необходимости адреномиметической поддержки использовали дофамин, не превышая «почечных» доз - 1 – 2 мкг/кг/мин. По мере стабилизации гемодинамики через 4 – 6 часов начинали инфузию эуфиллина в дозе 8-10 мг/кг массы тела. Чаще всего в этот период еще сохранялась гипотония и тахикардия, в связи с чем указанная суточная доза вводилась дробно в 4 – 5 приемов. Восстановление кровоснабжения канальцев создает условия для эффективного использования петлевых диуретиков, одним из эффектов которых является блокада Na+-K+ АТФазы, что опосредованно позволяет значительно уменьшить кислородный долг в почке, улучшить переносимость органом гипоксии (Бреннер Б., 1995). В связи с непредсказуемостью диуретического эффекта фуросемид вводили болюсно в дозе 3 мг/кг, а затем начинали его дозированную инфузию со скоростью 0,5 мг/кг в час под контролем минутного и почасового диуреза. Этот способ введения позволил оперативно изменять дозу салуретика при избыточном диуретическом эффекте, поэтому средняя суточная доза составила 14 ± 9 мг/кг массы тела. Соблюдение последовательности и комплексности назначения лекарственных препаратов, по нашему мнению, имеет принципиальное значение, позволяет осуществить максимальную доставку к нефротелию как кислорода, так и фуросемида. Последний, введенный в условиях централизации кровообращения и спазма почечных артериол не попадает в почечную паренхиму, а напротив, может вызвать системную вазодилатацию и усугубление гипотонии (Машковский М.Д., 2007). Кроме того, при высокой концентрации увеличивается и ототоксический эффект фуросемида.
Применение интенсивной «нефропротективной» терапии имело существенное положительное действие – в течение 12 часов у 28 больных (37,3 %) отмечен значительный диуретический эффект с развитием полиурии и стабилизацией, а у 8 больных – и снижением концентрации азотистых метаболитов крови. У 14 больных (18,6 %) на фоне значимого увеличения диуреза продолжался рост креатинина и мочевины плазмы, что потребовало начала проведения заместительной почечной терапии. В то же время в 33 наблюдениях (44 %) значимого диуретического эффекта не получено. Итак, проведение медикаментозной нефропротективной терапии позволило почти у 40 % больных остановить развитие ОПН, а еще у 20 % удалось добиться «неолигурической» формы ОПН. Критерии начала проведения ЗПТ у больных второй группы не различались с таковыми в первой, а гемодиализ также проводили по стандартам ХПН. Общая летальность в группе составила 62 % (47 больных), однако она была достоверно ниже по отношению к наблюдениям в первой группе (р<0,05). В то же время причиной сохранения высокой летальности, по нашему мнению, была поздняя диагностика и, соответственно, несвоевременное начало целенаправленного лечения.
Поэтому в 3 группу были включены больные, которым после перенесенной интраоперационной или зарегистрированной в реанимационных отделениях гипотонии со снижением САД менее 70 мм рт. ст. проводили активное мониторирование почечной функции, основанное не только на количественной, но и на качественной оценке диуреза. Во-первых, изучали показатели клубочковой фильтрации на основании почасового диуреза, а также экскреции мочевины, креатинина и в2мг. Во-вторых, оценивали канальцевую реабсорбцию по концентрации натрия мочи, определяемого 2 раза в сутки и экскретируемой фракции натрия. Уже через 2 часа после гипотонии у 29 больных отмечено нарастание концентрации натрия в моче более 35 ммоль/л (в среднем 43,8 ± 12,2 ммоль/л). Концентрация азотистых шлаков крови при этом была в пределах нормы, почасовой диурез в среднем 120 ± 32 мл, однако было отмечено значительное снижение скорости клубочковой фильтрации, рассчитываемое по клиренсу в2мг. Наивысшая корреляция получена между показателями снижения скорости клубочковой фильтрации и концентрацией натрия мочи (коэффициент корреляции k =0,79, р<0,05). При повышении концентрации натрия в моче выше 35 ммоль/л в 95 % наблюдений отмечено снижение скорости клубочковой фильтрации более чем в 2 раза, что позволяет рекомендовать исследование натрия в моче в качестве раннего диагностического критерия развивающейся острой почечной недостаточности (рис. 4).
При нарастании концентрации натрия в моче более 35 ммоль/л начинали применение комплекса интенсивной «нефропротективной» терапии. У 27 больных (49%) отмечено сохранение темпа диуреза, однако в последующие сутки наблюдали постепенное нарастание азотистых шлаков крови на фоне уменьшения суточной экскреции креатинина и мочевины с мочой до 12,6 ± 4,5 и 0,6 ± 0,25 г соответственно.

Рис. 4. Зависимость скорости клубочковой фильтрации и концентрации натрия в моче после перенесенной гипотонии.
Через 24 часа после начала интенсивной терапии СКФ, рассчитанная по клиренсу в-2-мг, составила 46 ± 18 мл в минуту, по клиренсу креатинина – 52 ± 19 мл в минуту. Достоверной разницы между этими показателями получено не было. В последующие сутки отмечена стабилизация и постепенное увеличение СКФ, суточной экскреции креатинина и мочевины с мочой. Лечение гемодиализом этим больным не понадобилось, через 5-7 суток нормализовалась выделительная функция почек, что позволило прекратить применение салуретиков.
У 17 больных (31 %) несмотря на достаточный диурез азотвыделительная функция стремительно уменьшалась, в плазме нарастали концентрации азота мочевины и креатинина, а содержание их в моче оказалось крайне низким (4,2 ± 3,6 г мочевины и 0,12 ± 0,11 г креатинина соответственно). Через 24 часа после начала интенсивной терапии СКФ, рассчитанная по клиренсу в-2-мг, составила в среднем 14 ± 9 мл в минуту. Это свидетельствовало о развившемся почечном повреждении и послужило основанием для незамедлительного начала проведения заместительной почечной терапии, однако у этих больных удалось частично сохранить функционирование нефронов и добиться «неолигурической» формы острой почечной недостаточности.
У 11 больных (20%), несмотря на проводимую терапию, отмечено стремительное снижение темпа диуреза вплоть до анурии.
Нарушение выделительной функции почек создает условия для нарастания эндотоксикоза, поэтому начало ЗПТ было ранним и преследовало две взаимодополняющие цели – замещение (протезирование) утраченной функции почек и, одновременно, моделирование выделительной функции почек с целью уменьшения функциональной нагрузки на них и сохранения функционального резерва. Последнее можно расценивать также как средство профилактики почечного повреждения. Поэтому в третьей группе заместительная почечная терапия начиналась, если, несмотря на проведение всего комплекса консервативной нефропротекции, сохранялась олигурия или анурия в течение суток вне зависимости от уровня азотистых соединений крови (у 11 больных – 20%). При наличии позитивного диуретического эффекта у 14 больных с «неолигурической» ОПН суточная экскреция креатинина и мочевины с мочой была снижена и составила в среднем 12,6 и 0,43 г соответственно, а у 3 – напротив повышена, при этом у одного из больных содержание мочевины в суточной моче превысило 70 г, а креатинина – 4 г. Последнее наблюдение, безусловно, свидетельствовало о продукционном характере азотемии. По нашему мнению, это также является показанием для проведения гемодиализа. К выбору метода ЗПТ в третьей группе подходили дифференцировано в зависимости от сохранности функции почек, стабильности гемодинамики и наличия геморрагических осложнений. Раннее начало лечения на невысоком уровне азотемии определило выбор продленной вено-венозной гемофильтрации в качестве метода ЗПТ в 23 случаях. В связи с нестабильностью гемостаза 5 больным проводили ежедневную гемодиафильтрацию в режиме постдилюции с производством замещающего раствора из диализата «от line».
Критерием завершения диализного лечения было полное восстановление выделительной функции почек, которое наблюдалось у 34 больных (61,8%). Только у одного больного исходом лечения оказался кортикальный некроз, что потребовало продолжения хронического гемодиализ. Общая летальность в 3 группе составила 41,8 % и была связана с прогрессированием сердечно-сосудистой и полиорганной недостаточности (14 больных) или септического процесса с вторичными гнойными осложнениями (9 больных). У больных с неолигурической формой ОПН летальный исход наблюдался в 38,9% случаев, а при развитии анурической ОПН – 59,9% случаев.
Таким образом, общепризнанные показания для начала ЗПТ при ОПН циркуляторного генеза (критическая гиперкалиемия и гипергидратация с угрозой развития отека легких) считаем необходимым дополнить – отсутствие диуретического эффекта (вне зависимости от уровня азотемии), снижение скорости клубочковой фильтрации или нарастание азотистых метаболитов крови более чем в 1,5 раза на фоне комплексной интенсивной нефропротективной терапии. Позднее начало гемодиализа недостаточно влияет на течение патологического процесса, что и определяет крайне высокую летальность при ОПН. Оптимальные результаты лечения могут быть достигнуты только при содружественном использовании двух лечебных воздействий – интенсивной нефропротективной терапии и раннего начала проведения ЗПТ, что позволило снизить летальность при острой почечной недостаточности циркуляторного генеза на 34,2 %.
Гемодинамическое и нефропротективное действие высокообъемной гемофильтрации при септическом шоке
Использование гемофильтрации в лечении сепсиса было подробно изучено в ряде отечественных и зарубежных исследований (Ronco C., 2000; Яковлева И.И., 2002) однако предлагаемые дозы гемофильтрации не влияли на системную гемодинамику. Необходимость использования высоких доз была обоснована на экспериментальных моделях (P.Honore, 2002). В нашей работе проведено сравнение гемодинамического и нефропротективного эффекта гемофильтрации в высокой (90 мл / кг/час) и стандартной (35 мл/кг/час) дозе замещения. В первую группу были включены 24 больных, во вторую – 17 больных. Чаще наблюдали сепсис абдоминальной этиологии, реже – как следствие тяжелой сочетанной травмы и анаэробной инфекции мягких тканей (рис. 5).

Рис. 5. Этиология септического шока, леченного с использованием гемофильтрации.
Исходно тяжесть состояния больных в группах не различалась, и по шкале АРАСНЕ II составила в среднем 28,1±3,6 баллов, а гемодинамика соответствовала картине септического шока. Все больные требовали адреномиметической поддержки, как правило дофамином в средней дозе 16,5±4,2 мг/кг массы тела. У 5-ти дофамин комбинировали с адреналином, у 4 – с мезатоном. Решение о проведении гемофильтрации принимали при диагностике первых признаков почечного повреждения (снижении темпа почасового диуреза менее 0,5 мл/кг/час в условиях устраненной гиповолемии), однако по техническим причинам на момент начала гемофильтрации уже наблюдалась анурия в течение 1-4 часов.
В течение первых двух часов статистически достоверной разницы в гемодинамическом профиле между группами не отмечалось, однако на 3-м часу в первой группе САД увеличилась на 19,3%, а еще через два часа – на 47,6 % от исходного (рис. 6). К началу седьмого часа у 15 больных первой группы (63%) системная гемодинамика стабилизировалась, что позволило прекратить инфузию катехоламинов и проведение высокообъемной гемофильтрации. У остальных к этому времени удалось снизить исходные дозы дофамина и адреналина в четыре и более раз и полностью от них отказаться к концу 1-х суток лечения. Во 2-й группе нормализация показателей гемодинамики отмечалась только к исходу 12 часов гемофильтрации, а дозу дофамина до 3-4 мкг/кг/ч мин удалось снизить лишь к концу первых суток.
 Рис. 6. Среднее артериальное давление во время высокообъемной (1 группа) и стандартной (2 группа) гемофильтрации при септическом шоке
Рис. 6. Среднее артериальное давление во время высокообъемной (1 группа) и стандартной (2 группа) гемофильтрации при септическом шокеИсходные показатели газообмена в группах не различались и определялись характерным для септического шока снижением доставки и нарушением утилизации кислорода тканями, накоплением недоокисленных продуктов и прогрессированием тканевой гипоксии со снижением ВЕ до - 5,7 и -6,4 ммоль/л соответственно (табл 2). Проведение высокообъемной гемофильтрации позволило уже через 6 часов существенно повлиять на состояние газообмена – отмечено значимое увеличение доставки кислорода (с 419 49 до 560 ± 78 мл/мин/м2), сопровождавшееся однако и увеличением его потребления (с 172 31 до 196,0 ± 22 мл/мин/м2)что свидетельствует о восстановлении микроциркуляции и перфузии внутренних органов (в том числе почек). Это подтверждается нормализацией лабораторных показателей тканевой гипоксии - снижением концентрации лактата венозной крови с 4,9 0,9 до 2,1 ± 0,4 ммоль/л (р< 0,05) и устранением дефицита оснований (ВЕ вырос - 5,7 ± 2,1 до -1,2 ± 0,9 ммоль/л). К исходу первых суток газообмен в первой группе не претерпевал существенных изменений. Продолжался характерный для септического состояния рост доставки кислорода, обусловленный гипердинамическим типом кровообращения после купирования септического шока.
В отличие от этого, во второй группе через 6 часов и 24 часа лечения, несмотря на относительную стабилизацию гемодинамики, сохранялись проявления выраженной гипоксии, связанной как со снижением доставки кислорода, так и с недостаточной его утилизацией. Это подтверждалось сохранением повышенной концентрации лактата венозной крови (3,9 ± 2,1 ммоль/л), снижением насыщения кислородом гемоглобина в смешанной венозной крови (68,1 ± 3,1 %).
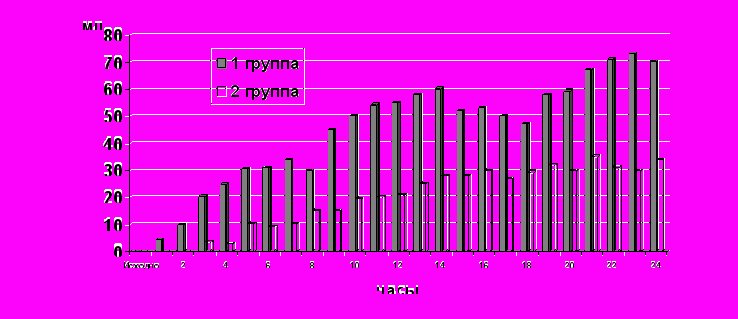
Рис. 7. Почасовой диурез при проведении высокообъемной (1 группа) и стандартной (2 группа) гемофильтрации при септическом шоке.
По мере стабилизации артериального давления и уменьшения доз адреномиметиков в первой группе наблюдалось постепенное восстановление диуреза (рис.7). Уже через 4-6 часов почасовой диурез нормализовался количественно, однако в 59% случаев наблюдалась гипернатриурия и снижение СКФ, что потребовало в последующем проведения ЗПТ. Во второй группе у 11 больных (53 %) нормализация почасового диуреза отмечена лишь на 15 часу лечения, а у 8 больных (47 %) сохраняла анурия. Быстрота стабилизации гемодинамики, восстановления почечной перфузии и устранения смешанной гипоксии существенно повлияла на дальнейшее течение ОПН (табл. 3). Наиболее тяжелая анурическая ее форма в первой группе развилась лишь у 2 больных (8 %). У 14 больных (59%) диагностировали «неолигурическую» ОПН, а у 8-ми (33 %) почечное повреждение не развилось вовсе. Во второй группе у 8 больных (47 %) септический шок осложнился анурической ОПН, еще у 8-ми (47 %) развилась неолигурическая ОПН и лишь у 1 больного (6%) функция почек оставалась интактной.
Таблица 2
Показатели газообмена по ходу гемофильтрации при септическом шоке
| Показатели | Ед. измерения | Значения показателей на этапах исследования | |||||
| 1 группа (n = 24) | 2 группа (n = 17) | ||||||
| Исходно | 6 часов | 24 часа | Исходно | 6 часов | 24 часа | ||
| DО2 | мл/мин/м2 | 419 49 | 560 ± 78 | 650 31 | 407 ±22 | 429 ± 42* | 493 ± 23** |
| VО2 | мл/мин/м2 | 172 31 | 196,0 ± 22 | 209 26 | 156 ± 17 | 147 ± 19 | 184 24 |
| КЭК | % | 41,4 ± 4,2 | 37,1 3,6 | 34,4 ± 2,2 | 38,8 ± 2,9 | 35,2 ± 2,1 | 37,4 2,6 |
| SvO2 | % | 64 ± 17,8 | 78,8 ± 11,6 | 75,2 ± 14,1 | 64,5±2,9 | 67,5 ± 7,4 | 68,1 ± 3,1* |
| Лактат венозной крови | ммоль/л | 4,9 0,9 | 2,1 ± 0,4 | 2,3 ± 1,1 | 4,7 ± 0,6 | 4,2 ± 0,9** | 3,9 ± 2,1* |
| рН | | 7.21 ± 0,09 | 7,45 ± 0,09 | 7,39 ± 1,2 | 7,26 ± 0,11 | 7,36 ± 0,08* | 7,31 ± 1,3 |
| ВЕ | ммоль/л | - 5,7 ± 2,1 | 1,2 ± 1,9 | -1,2 ± 0,9 | - 6,4 ± 1.8 | -3.2 ± 0.9** | -2,1 ± 2,2 |
* - р<0.05 при сравнении между группами по этапам исследования
** - р<0.01 при сравнении между группами по этапам исследования
Таблица 3.
Частота развития ОПН по группам
| | I группа (n=24) | II группа (n=17) |
| Анурическая ОПН | 2 (8%) | 8 (47%) |
| Неолигурическая ОПН | 14 (59%) | 8 (47%) |
| Сохранение функции почек | 8 (33%) | 1 (6%) |
Острая почечная недостаточность, развивающаяся при септическом шоке, является отражением общего нарушения органной перфузии на макро и микроциркуляторном уровне. Стабилизация гемодинамики, возможность уменьшения доз адреномиметиков и восстановление функции почек свидетельствует о возможной нормализации всего висцерального кровотока, что позволяет не допустить развития полиорганной недостаточности.
Итак, высокообъемная ГФ (с замещением 90 мл/кг/час) по сравнению со стандартной (с замещением 35 мл/кг/час) является эффективным средством стабилизации гемодинамики при септическом шоке. Быстрое восстановление в 59 % случаев позволяет предупредить развитие анурической ОПН, а в 33 % и вовсе избежать почечного повреждения. Это может быть объяснено элиминацией провоспалительных медиаторов, либо неизвестных пока токсических субстанций, выявление которых будет задачей последующих исследований. В то же время, мы считаем, что можно рекомендовать включение высокообъемной гемофильтрации в комплекс терапии септического шока, в том числе как средства нефропротекции, профилактики развития не только острой почечной, но и полиорганной недостаточности.
