Задача 9-1
| Вид материала | Задача |
- Программа курса лекций «Математические методы и модели исследования операций», 27.98kb.
- Т. М. Боровська кандидат технічних наук, доцент І. С. Колесник, 118.17kb.
- Разновозрастная итоговая проектная задача 1-4 классы, 87.27kb.
- Программа дисциплины Алгоритмы на графах Семестр, 13.21kb.
- Гиперкомплексных Динамических Систем (гдс) задача, 214.67kb.
- Домашнее задание по Теории информационных процессов и систем, 267.24kb.
- Задача линейного программирования Задача о «расшивке узких мест», 5.51kb.
- Программа учебной дисциплины вариационные методы в физике (спецкурс, дисциплины, 147.31kb.
- Варианты контрольных работ контрольная работа №1 (3 семестр), 237.84kb.
- Ручаевского Дмитрия Александровича. Карасик Л. В 1997-98 уч год. Основная часть Античная, 202.33kb.
3. Для расчёта удельных энтальпий разделим стандартные энтальпии на общую молярную массу реагентов (с учётом стехиометрических коэффициентов):
 = –13,43 кДжг–1
= –13,43 кДжг–1 = –13,56 кДжг–1
= –13,56 кДжг–1 = –8,70 кДжг–1
= –8,70 кДжг–1 = –8,35 кДжг–1
= –8,35 кДжг–1Порядок уменьшения теплотворной способности: 2) > 1) > 3) > 4).
4. Для определения эффективности с точки зрения создаваемой тяги разделим удельные энтальнии на среднюю молярную массу продуктов:
 –0,75
–0,75 –0,68
–0,68 –0,31
–0,31 –0,39
–0,39Порядок уменьшения эффективности с точки зрения тяги: 1) > 2) > 4) > 3).
Задача 9-4 (автор Лебедева О.К.)
1. Во-первых, правильное название соли – гипохлорит.
Во-вторых, гипохлорит чего – например, гипохлорит натрия.
И, в-третьих, гипохлорит – не элемент, а вещество.
2. Озон применяют для очистки питьевой воды, поскольку такая обработка не придаёт воде неприятный вкус и запах, а избыточный озон разлагается с образованием O2.
3. O2(г) = 2О(г)
4. Складывая уравнения приведённых реакций, получаем
O(г) + O(г) = O2.
Эта реакция обратна реакции п. 3, следовательно, и её тепловой эффект равен по величине и обратен по знаку тепловому эффекту реакции п. 3. Таким образом, энтальпия диссоциации молекулы кислорода равна
Eдис = –(–109 – 394) = 503 кДж/моль.
5. Уравнения реакций:
2NO2 + O3 = N2O5 + O2
NO + O3 = NO2 + O2 (N2O5)
6. Уравнение реакции:
CN– + O3 = OCN– + O2
7. Уравнения реакций:
O3 + 2I– + H2O = O2 + I2 + 2OH–
I2 + 2S2O32– = 2I– + S4O62–
Задача 9-5 (автор Лебедева О.К.)
1→ кремний.
1↓ кислород.
2→ силицид.
3↓ силан.
4↓ кварц.
5→ Ломоносов.
6→ флюс.
7→ оникс.
8→ неон.
| к | | |||||||||
| в | | |||||||||
| а | | |||||||||
| с | | к | р | е | м | н | и | й | ||
| с | и | л | и | ц | и | д | | |||
| ф | л | ю | с | | ||||||
| а | | л | о | м | о | н | о | с | о | в |
| н | е | о | н | | ||||||
| р | и | | ||||||||
| о | к | | ||||||||
| д | с | |
2. Si + 2Mg = Mg2Si
Mg2Si + 4HCl = SiH4 + 2MgCl2 ( в основном)
Si + O2 = SiO2
3. CaCO3 – карбонат кальция, кальцит, мел, известняк, мрамор (любое)
MgCO3 – карбонат магния, магнезит (любое)
Na3AlF6 – криолит, гексафтороалюминат натрия (любое)
4. Пусть взяли 100 г соли, тогда в ней приблизительно 40 г SiO2, 20 г Na2O и 40 г воды. Тогда мольное соотношение компонентов равно:
n(SiO2) : n(Na2O) : n(H2O) = (40/60) : (20/62) : (40/18) =
= 0,66 : 0,32 : 2,2 2 : 1 : 6,8.
Такое соотношение соответствует составу соли
Na2Si2O5·6H2O (Na2Si2O5 ·7H2O)
Десятый класс
Задача 10-1 (авторы Куркова Т.Н., Чибисова Н.В.)
1. Вещество М – это Рb3(OH)2(CO3)2 или Pb(OH)2 · 2PbCO3 (или (PbOH)2CO3 или Pb2(OH)2CO3) – свинцовые белила (гидроцеруссит);
К – Pb3O4 – сурик;
Ч – PbS – свинцовый блеск (галенит);
О – PbO2 – тяжелая свинцовая руда.
2. Уравнения реакций:
2Pb3(OH)2(CO3)2 + O2 = 2Pb3O4 + 2H2O + 4CO2↑ (1)
красный
Pb3(OH)2(CO3)2 + Н2S = 3 PbS↓ + 4H2O + 2CO2↑ (2)
черный
PbS + 4H2O2 = PbSO4↓ + 4H2O (3)
белый
PbSO4 + 6NaOH = Na4[Pb(OH)6] + Na2SO4 (4) Na4[Pb(OH)6] + CS(NH2)2 = PbS↓ + Na2CO3 + H2O + 2NaOH + 2NH3↑ (5)
свинцовый блеск
3PbS + 8HNO3 = 3Pb(NO3)2 + 3S + 4H2O + 2NO↑ (6)
Pb(NO3)2 + 2KI = PbI2↓+ 2KNO3 (7)
желтый
PbI2↓ + 2KI = К2[PbI4] (8)
Pb3O4 + 4HNO3 = 2Pb(NO3)2 + PbO2↓ + 2H2O (9)
коричневый
3. Реакция Х – образование «золотого дождя».
4. Примеры реакций:
1) 5PbO2 + 2Mn(NO3)2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
2) PbO2 + 4HCl = PbCl2 + Cl2↑ + 2H2O.
Задача 10-2 (авторы Тюльков И.А., Масоуд С.М.)
1. Каустическая, питьевая (пищевая), кальцинированная, кристаллическая
2.
| Название | Формула | Современное название |
| Кальцинированная сода | Na2CO3 | Карбонат натрия |
| Кристаллическая сода | Na2CO3∙10H2O | Декагидрат карбоната натрия |
| Пищевая или питьевая сода | NaHCO3 | Гидрокарбонат натрия |
| Каустическая сода | NaOH | Гидроксид натрия |
3. При взаимодействии соляной кислоты с тремя содами выделяется газ. С каустической содой (NaOH) газ не может выделяться ни при каких условиях, следовательно, с выделением газа реагировали гидрокарбонат, безводный карбонат и декагидрат карбоната натрия. Рассчитаем количество вещества в каждой навеске: 0,028 моль Na2CO3, 0,036 моль NaHCO3, 0,010 моль Na2CO3∙10H2O.
При медленном приливании раствора соляной кислоты к карбонату сначала образуется гидрокарбонат:
Na2CO3 + HCl = NaHCO3 + NaCl (1)
Для того, чтобы из раствора выделялся газ, кислоты должно быть достаточно, чтобы реагировать с получившимся гидрокарбонатом:
NaHCO3 + HCl = NaCl + CO2 + H2O (2)
Рассчитаем, сколько моль CO2 выделилось в каждом опыте. Согласно уравнению Клапейрона–Менделеева,
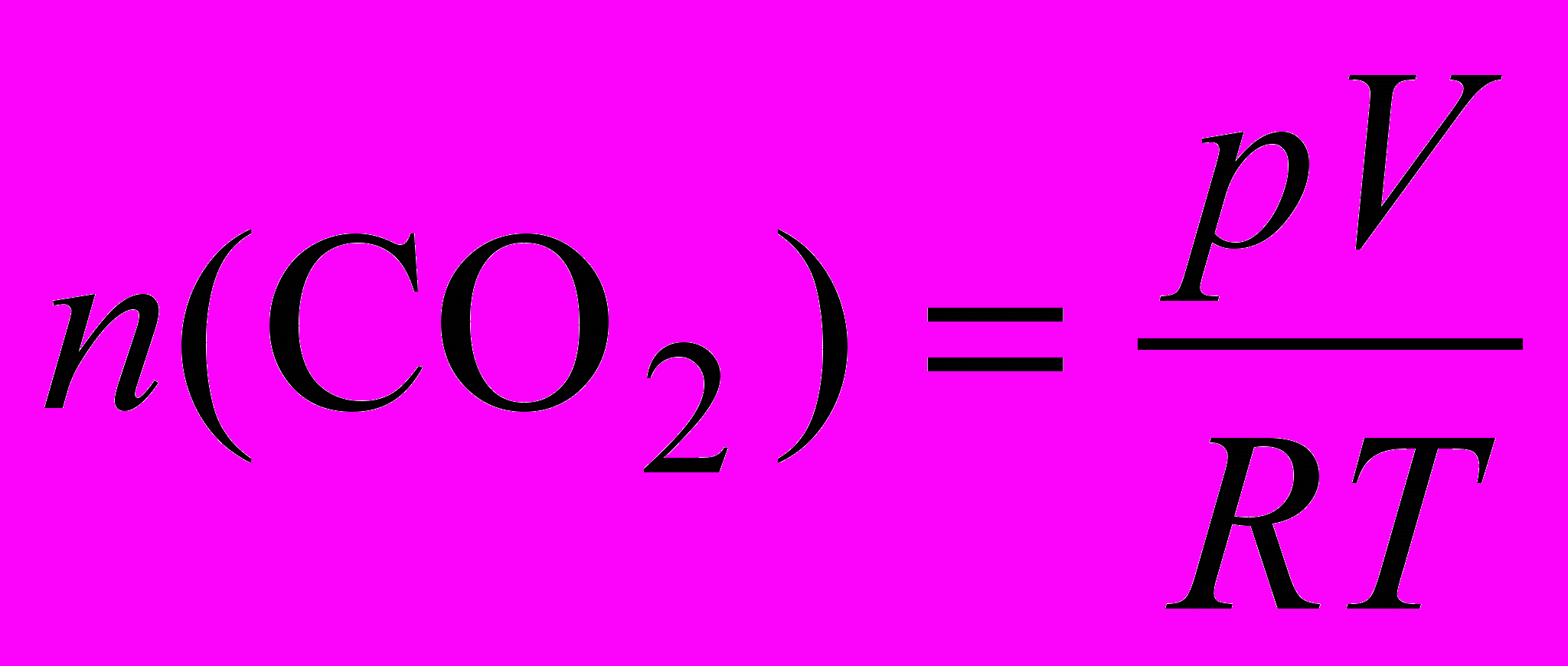 ,
,где
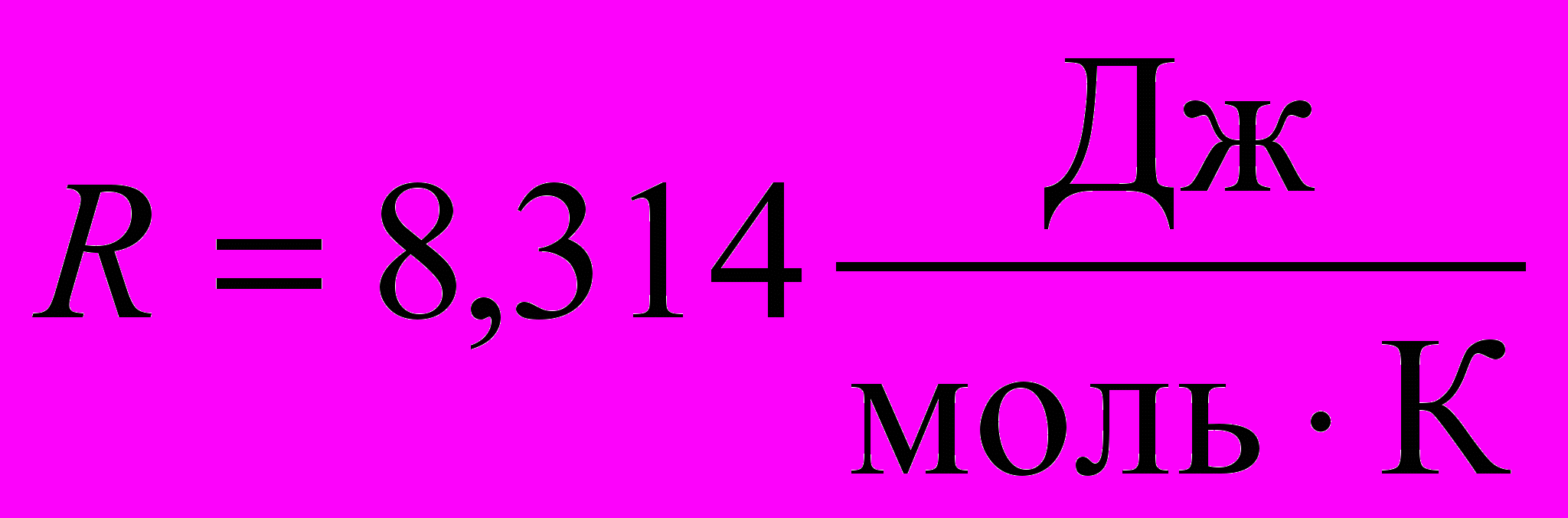 ,
, 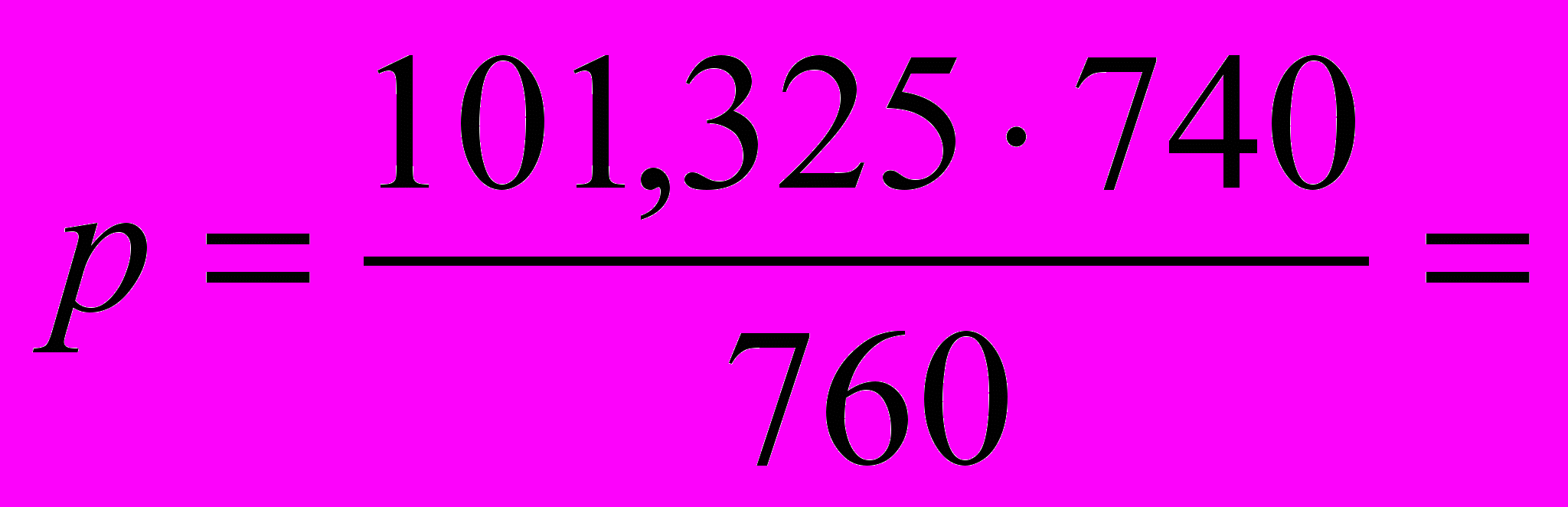 98,659 кПа, T = 295,15 K.
98,659 кПа, T = 295,15 K.Составим таблицу:
| № опыта | V(газа), мл | n(газа), моль |
| 1 | 900 | 0,036 |
| 2 | 250 | 0,010 |
| 3 | 370 | 0,015 |
Сравним данные таблицы с рассчитанными количествами каждой соды:
| Формула | Название | n(соды), моль |
| Na2CO3 | Кальцинированная сода | 0,028 |
| Na2CO3∙10H2O | Кристаллическая сода | 0,010 |
| NaHCO3 | Питьевая сода | 0,036 |
Можно заключить, что в первом опыте соляная кислота реагировала с раствором питьевой соды, во втором – с раствором кристаллической соды. Тогда третий опыт проводили с раствором кальцинированной соды.
4. Расчет содержания HCl в соляной кислоте следует проводить, исходя из данных опыта 3, поскольку только в этом опыте HCl в недостатке – в противном случае в этом опыте выделилось бы 0,028 моль CO2.
Согласно уравнению (1) потребуется 0,028 моль HCl для перевода карбоната в гидрокарбонат. Из раствора кальцинированной соды выделяется 0,015 моль CO2. Согласно уравнению (2) потребуется 0,015 моль HCl для выделения этого количества газа. Таким образом, для третьего опыта потребовалось 0,028 + 0,015 = 0,043 моль HCl.
В 15 мл (учитывая плотность, в 15,75 г) раствора содержится 0,043 моль HCl.
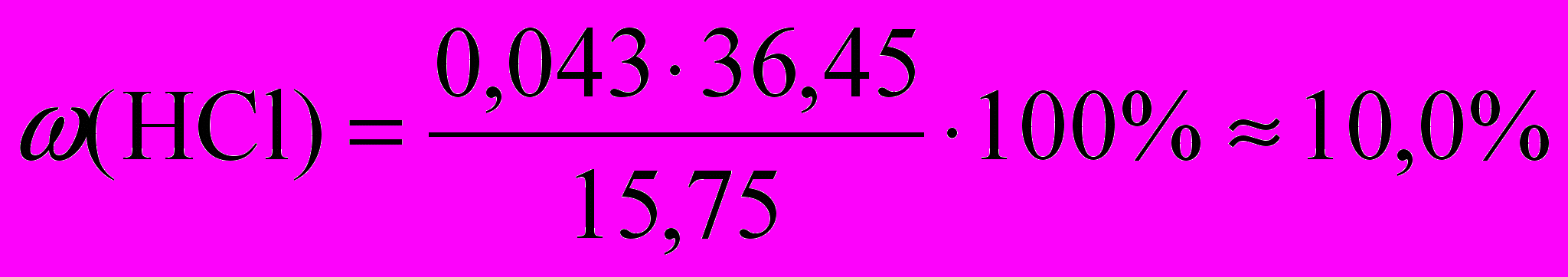 .
.Задача 10-3 (автор Панин Р. В.)
1) Поскольку соединение А состоит из трех элементов и получается при взаимодействии оксида с хлороводородом, логично предположить, что в состав А входят неизвестный элемент, кислород и хлор. Неизвестный элемент определяется по атомной массе, котора рассчитывается из весовых соотношений. Составы соединений отвечают формуле ХpYmZn, (пусть Y – элемент, массовое содержание которого дано в условии). Тогда (Y/ZХ)А : (Y/ZХ)Б : (Y/ZХ)В : (Y/ZХ)Г = 61,4/38,6 : 51,5/48,5 : 34,7/65,3 : 30/70 = 1,59 : 1,06 : 0,53 : 0,43 = 3 : 2 : 1 : 0,81. Поскольку массовая доля Y в соединениях А, Б и В относятся как 3:2:1, то в Ф, Б и В входят 3, 2 и 1 атом Y соответственно. Предположим, что Y отвечает хлору (так как в условии фигурирует хлороводород (реакция 1)), тогда в соединении В на долю оставшейся группировки атомов приходится 65,3∙35,5:34,7 = 66,8 г/моль. Аналогично можно провести расчет для соединения А 3∙35,5∙38,6:61,4=66,95 и для соединения Б 2 ∙ 35,5 ∙ 48,5 : 51.5 = 66,8. Так как вещество Д – оксид, тогда Z – группировка атомов, в которую входит кислород и неизвестный элемент, тогда на его долю приходится 66,8 – 16 = 50,8 г/моль, что соответствует ванадию. Тогда А = VOCl3, Б = VOCl2, В = VOCl, Г = VO2Cl. Исходя из окраски и уравнения реакции Д с HCl (реакция 1) следует, что Д = V2O5.
V2O5 + 6HCl = 2VOCl3 + 3H2O (реакция 1) (P2O5 необходим для связывания образующейся воды: P2O5 + H2O = 2HPO3)
2VOCl3 + Zn = 2VOCl2 + ZnCl2 (реакция 2)
V2O5 + 6HCl(конц.) = 2VOCl2 + Cl2 + 3H2O (реакция 3)
2VOCl2 = VOCl + VOCl3 (реакция 4)
VOCl3 + O3 = VO2Cl + O2 + Cl2 (реакция 5)
2) На первом этапе эти соли подвергаются гидролизу с выделением гидратированного оксида ванадия (V)
2VOCl3 + (3+n)H2O = V2O5∙nH2O + 6HCl
2VO2Cl + (1+n)H2O = V2O5∙nH2O + 2HCl
3) Исходя из физических свойств, VOCl3 имеет молекулярное строение (отрицательная температура плавления), молекула имеет форму искаженного тетраэдра.
4) V2O5 получают термическим разложением ванадата аммония в токе кислорода или на воздухе 2NH4VO3 = V2O5 + 2NH3 + H2O (350ºC) (реакция 6) для предотвращения восстановления ванадия аммиаком.
Задача 10-4 (автор Жиров А.И.)
1. Реакции термического разложения:
NH4NO2 = 2H2O + N2
NH4NO3 = 2H2O + N2O
Каталитическое разложение N2O:
2N2O = 2N2 + O2
- Для получения смеси азота и кислорода (20 объёмных, или мольных % кислорода, т. е. 1 объём кислорода на 4 объёма азота) нитрат и нитрит аммония надо использовать в молярном соотношении 1 : 1 или в весовом 72 : 64 (1,125 : 1).
- Стандартные энтальпии реакций разложения при 298 К:
NH4NO2 (кр.) = N2 (г) + 2H2O (ж)
rH298 = –285,8 2 +256,1 = –315,5 (кДж/моль).
При разложении 1 моль нитрита аммония выделяется 315,5 кДж теплоты. Реакция экзотермическая.
NH4NO3 (кр.) = 2H2O (ж) + N2O (г)
rH298 = –285,8 2 + 82 + 365,4 = –124,2 (кДж/моль).
При разложении 1 моль нитрата аммония выделяется 124,4 кДж теплоты. Реакция экзотермическая.
2N2O (газ) = 2N2 (газ) + O2 (газ)
rH298 = 0 + 0 – 82 2 = –164 кДж/моль.
При разложении 2 моль N2O выделяется 164 кДж теплоты. Реакция экзотермическая.
- Объём 1 моль нитрита аммония равен 64 : 1,69 = 37,9 (см3) или 0,0379 л. Давление 1 моль азота в таком объёме при 25 С (298 К) будет равно 1 22,4 298 : 273 : 0,0379 = = 645 (атм) = 65∙103 кПа.
Объём 1 моль нитрата аммония равен 72 : 1,72 = 41,9 (см3) или 0,0419 л. Парциальное давление азота составит 584 атм, а кислорода 292 атм.
- Объём 1 м3 при 25 С и 298 К соответствует 40,9 моль газов. Количество каждой соли, необходимое для получения такого количества газов, будет равно 40,9 : 2,5 = 16,36 (моль). Масса нитрита аммония составит 64 16,36 = 1047 (г), а нитрата аммония – 72 16,36 = 1178 (г). Общая масса равна 2225 г.
- Общее количество теплоты, выделяемое при получении 1 м3 воздушной смеси составит 16,36 (315,5 + 124,2 + 82) = 8535 (кДж).
- Все используемые реакции протекают с выделением значительных количеств теплоты, в результате реакции образуются газообразные продукты, поэтому управлять этими реакциями (контролировать их скорость) очень сложно. Кроме того, в невесомости выделение газов из расплава приведёт к образованию пены, обладающей низкой теплопроводностью.
Задача 10-5.
Итак, все схемы соответствуют важным промышленным процессам. Органическое соединение А при взаимодействии с простым веществом Б дает смесь четырех продуктов Г, из которых лишь один является бинарным, а также бинарное вещество В. Ответ напрашивается: это реакция хлорирования метана, и Г4 – тетрахлорметан, а В – хлористый водород. Реакция Ж + Н – по-видимому, реакция Кучерова. То есть одно из этих соединений – вода, а другое – алкин. Соединение Н образуется (наряду с М) при нагревании метана до 1500С. То есть, М – водород, а Н – ацетилен, С2Н2. Значит, Ж – вода, а Ф – уксусный альдегид, СН3СHO. Реакция Н с хлороводородом В с образованием важного мономера –винилхлорида (У).
Вода получается при взаимодействии метана ( А) с простым веществом Д. Согласно условию, из А и Д могут образоваться также вода и вещество Л, однако обычно это является нежелательным процессом. Поскольку в состав Ж входит кислород, простое вещество Д – О2, соединение Е – углекислый газ, СО2, а соединение Л – оксид углерода(II), СО. Атомные массы Д и З отличаются в 2 раза. Поскольку Д – кислород, З должен иметь атомную массу либо 8, либо 32. То есть, З – это сера. Тогда реакция А с З – реакция метана с серой. При пропускании метана над раскаленной серой образуются продукты соединения с серой как углерода (CS2), так и водорода (H2S). Это соединения И и К. Получение продуктов Г в результате взаимодействия метана с хлороводородом и кислородом позволяет избежать работы с ядовитым хлором и возвращать в реакцию выделяющийся при хлорировании хлороводород, окисляющийся кислородом в ходе процесса. Это уравнение полностью согласуется с выводами о структурах соединений, участвовавших в ранее рассмотренных реакциях.
Мы выяснили, что Ж – вода; реакция воды с метаном дает «синтез-газ», т.е. смесь СО (соединение Л) и Н2 (М). Осталось расшифровать два уравнения. Промышленно важным процессом, в котором водород взаимодействует с простым веществом Т с образованием бинарного продукта П, является синтез аммиака. Таким образом, при взаимодействии метана, аммиака и кислорода образуются вода и соединение Р, которое содержит углерод (из метана) и азот (из аммиака), но не является бинарным соединением. То есть в его состав может входить также водород или кислород (или оба элемента). Про соединение Р известно, что оно присоединяется к уксусному альдегиду, давая аддукт, который при отщеплении воды превращается в важный мономер. Рассмотрев все эти факты, можно сделать вывод, что вещество Р – синильная кислота, HCN. Таким образом, 10 приведенных схем надо записать в виде следующих уравнений:
- 4 CH4 + 10 Cl2 → 10 HCl + CH3Cl + CH2Cl2 + CHCl3 + CCl4
- CH4 + 2 O2 → CO2 + 2 H2O
- 2 CH4 + S8 → 2 CS2 + 4 H2S
- 4 CH4 + 10 HCl + 5 O2 → CH3Cl + CH2Cl2 + CHCl3 + CCl4 + 10 H2O
- CH4 + H2O → CO + 3 H2
- 2 CH4 → C2H2 + 3 H2
- 2 CH4 + 2 NH3 + 3 O2 → 2 HCN + 6 H2O
- 3 H2 + N2 → 2 NH3
- C2H2 + HCl → CH2=CHCl
- C2H2 + H2O → CH3CHO
Одиннадцатый класс
Задача 11-1 (автор Емельянов В.А.)
- Как известно, для газовых смесей мольные доли компонентов совпадают с объемными. Зная средние молекулярные массы двух смесей, составим систему уравнений:
0,5МА + 0,5МВ = 18∙2,
0,25МА + 0,75МВ = 20∙2.
Умножив второе уравнение на 2 и вычтя из него первое, получаем МВ = 44 а.е.м. Подставив это значение в любое из уравнений, вычисляем МА = 28 а.е.м.
- Для решения задачи воспользуемся числами, приведенными в таблице. В состав газа А входит 42,9 % элемента X, что составит 0,429∙28=12,012 а.е.м. и 57,1 % элемента Y, что составит 0,571∙28=15,988 а.е.м. Эти значения совпадают со значениями атомных масс углерода и кислорода. Проверим свою догадку на соединении Б: 0,273∙44= 12,012 а.е.м., 0,727∙44=31,988. Разница лишь в том, что в состав Б входят 2 атома кислорода. Теперь посчитаем состав В. Пусть его формула СnOm, тогда 12n : MB = 0,529, 16m : MB = 0,471, откуда 12n : 16m=0,529 : 0,471 или n : m = 1,50. Состав В – С1,5О и простейшая формула С3О2.
Итак, X – углерод, Y – кислород, А – СО, Б – СО2, В – С3О2 (недооксид углерода).
- Уравнения описанных в задаче реакций:
1) 2СО + О2 → 2СО2;
2) С3О2 + 2О2 → 3СО2;
3) СО2 + Н2О
 Н2СО3;
Н2СО3; 4) С3О2 + 2Н2О → Н4С3О4 (НООС-СН2-СООН (малоновая кислота))1;
5) СО + Н2О
 Н2 + СО2;
Н2 + СО2; 6) СО2 + NaОH → NaНСО3 или СО2 + 2NaОH = Na2СО3 + Н2О;
7) С3О2 + NaОH + Н2О → NaН3С3О4 или С3О2 + 2NaОH = Na2H2С3О4
8) СО2 + 2NH3 → NH2COONH4;
9) С3О2 + 2NH3 → CH2(CONH2)2;
10) СО + NaОH
 НСОONa;
НСОONa;11) СО + NH3
 Н2O + HСN;
Н2O + HСN; 12) СО2 + NH3
 CO(NH2)2.
CO(NH2)2.- O=С=C=C=O – недооксид углерода, пропадиен-1,3-дион.
