Т н. Прохоренко Н. Н. Обратные термодинамические циклы и холодильные установки. Термодинамика получения холода. Холодильные установки, их классификация и области применения в химической технологии. Влекции
| Вид материала | Лекции |
- 1. Цели и задачи дисциплины, 434.45kb.
- «Энергосберегающие технологии в рыбной отрасли Дальнего Востока», 57.23kb.
- Курсовой проект по дисциплине «Холодильные машины и установки» проект распредилительного, 43.46kb.
- Стандартов безопасности труда, 913.94kb.
- Рабочая программа по дисциплине дс 06. 01, дс 06. 02 «Холодильные машины и установки», 191.73kb.
- Вначале XX века, а точнее в 1910 году, в США был изобретен первый домашний холодильник,, 959.83kb.
- И адрес банка, 34.14kb.
- Оценка экономической целесообразности установки узла учета тепловой энергии, 281.16kb.
- Методика экспресс-анализа работы котельного оборудования Назначение: Экспресс-анализ, 6.96kb.
- Теплосиловые установки. Назначение, 151.27kb.
Термодинамика. Лекция 7.
К.т.н. Прохоренко Н.Н.
Обратные термодинамические циклы и холодильные установки.
Термодинамика получения холода. Холодильные установки, их
классификация и области применения в химической технологии.
В лекции 4 рассмотрены прямые и обратные циклы, введены показатели эффективности их в виде термического коэффициента полезного действия для прямых циклов и в виде холодильного коэффициента для обратных циклов. Напомним, что и в том, и в другом случае эффективность цикла представляет собой отношение «пользы» к «затратам». Для тепловых циклов «пользой» является получаемая работа, а «затратами» - количество теплоты, подводимой в цикле. Для обратного, т.е. холодильного цикла, «пользой» является количество отводимой теплоты (холода) из холодильной камеры в рабочее тело (хладоагент), а «затратами» будут количество работы из внешней среды.
Назначение холодильных установок – достижение или поддержание низких температур (по сравнению с температурой окружающей среды (атмосферы)) рабочих тел в циклах.
Классификация холодильных установок осуществляется по уровню достигаемой температуры. Различают установки умеренного холода и глубокого холода. Границей между ними приняли температуру 120К.
При использовании установок умеренного холода ставится лишь одна технологическая задача – создание и поддержание низкой температуры в холодильной камере. В ней химики-технологи реализуют необходимые им процессы химических и фазовых превращений (например, экзотермические реакции). В быту в холодильной камере размещают продукты питания, чтобы избежать их порчи.
Установки глубокого холода предназначены для производства жидкой фазы из газообразной. Установки ожижения воздуха позволяют получить жидкую фазу, которая далее идет на разделение с целью получения чистого кислорода и азота и комплекта инертных газов. Первый предназначен для металлургических процессов, второй – для производства азотной кислоты. Природный газ также ожижают с целью отделения гелия и для дальнейшей транспортировки в жидком состоянии.
- Методы достижения низких температур.
Оказывается, существует свыше 200 технологических приемов достижения низких температур, среди которых самыми распространенными в промышленности не тепловыми методами являются использование дросселирования газа и его адиабатное расширение.
- Дросселирование, как способ понижения температуры.
В общих чертах процесс дросселирования рассматривался в лекции 5. В ней этот процесс представлен был как предельный случай течения газовых сред в каналах с большими скоростями. Предельность заключалась в том, что вся работа проталкивания через малое отверстие тратится на необратимый процесс роста энтропии. Так как теплота диссипации остается в самом потоке, то инвариантом процесса дросселирования является величина энтальпии: h = const. В той же лекции 5 показано, что давление в процессе уменьшается, удельный объем, соответственно, увеличивается, энтропия растет. Зато вопрос об изменении температуры остался открытым.
Займемся этим вопросом сейчас. По существу речь идет о знаке
(∂T/∂p)h ,
причем в этой частной производной определенно знаем, что знак знаменателя отрицателен. Следовательно, если определим знак самой производной, то найдем знак ее числителя, т.е. узнаем характер изменения температуры в процессе: растет или убывает.
Выше в наших лекциях было показано, что для реальных веществ
dh = Tds + vdp, dh = cpdT – (T(∂v/∂T)p – v)dp. (7.1)
Для дросселирования h = const, т.е. dh = 0, поэтому
0 = cpdT – (T(∂v/∂T)p – v)dp.
Разделим обе части этого уравнения на dp (еще раз подчеркнем, что dp < 0) и будем помнить, что h = const, т.е.
(∂T/∂p)h = 1/cp [T(∂v/∂T)p – v] или (∂T/∂p)h = T/cp [(∂v/∂T)p – v/T] = αh. (7.2)
Величина αh в термодинамике носит название дифференциального дроссельэффекта Джоуля – Томсона. Знак этой величины по существу и определяет знак приращения ΔT при дросселировании. Рассмотрим рис. 7.1.
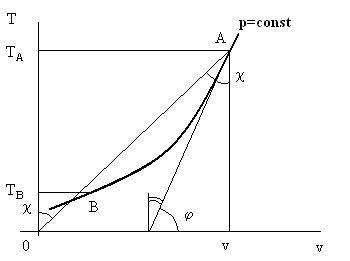
Рис. 7.1. К определению знака изменения температуры при дросселировании.
На рис 7.1 изображена изобара p = const в осях T – v. Для реальных веществ ее, как правило, строят экспериментально. Рассматривается точка А на изобаре. Эта точка характеризует состояние реального рабочего тела далеко от самого дросселя (т.е. резкого сужения или малого отверстия в мембране поперек трубы, по которой происходит течение газа). Ставится вопрос: температура за дросселем станет больше или меньше температуры в точке А? Глядя на формулу (7.2), видно, что T > 0 всегда, ср > 0 тоже. Следовательно, знак αh определяется знаком выражения в квадратных скобках. Найдем его для точки А. Проводим касательную к изобаре в точке А. Тогда tgφ = (∂T/∂v)p. В соответствии с теоремой о производной обратной функции tg(π/2 – φ) = (∂v/∂T)p.
Далее, соединим точку А с началом системы координат О и рассмотрим прямоугольный треугольник ОАv. Отношение v/T (см.(7.2)) есть tgæ, причем угол æ накрест лежащий углу АОТА и, следовательно, ему равный.
Сравнивая величину углов π/2 – φ и æ видно, что первый угол меньше второго, следовательно, (∂v/∂T)h в точке А на рис.7.1 меньше, чем отношение v/T в той же точке. Следовательно, выражение в квадратной скобке в формуле (7.2) отрицательно, тогда и αh < 0 и, окончательно, приращение температуры после дросселирования положительно. Иными словами, если до дросселя была температура TА, то после дросселя будет большая температура.
Рассматривая рис. 7.1 и проводя аналогичные построения, можно доказать, что, если до дросселя была температура TВ (см. точку В на рис. 7.1), то после процесса дросселирования температура рабочего тела уменьшится.
Если при дросселировании из точки А температура увеличивается, а при дросселировании из точки В уменьшается, то должна существовать точка С на изобаре, при дросселировании из которой температура не изменится. И действительно, проведя из начала координат О прямую, касательную к изобаре, получим точку С (см. рис. 7.2) В ней
(∂v/∂T)h = v/T,
тогда αh = (∂T/∂p)h = 0 и, следовательно, T = const.

Рис. 7.2. Иллюстрация к определению точки инверсии и линии инверсии.
Линия инверсии изображена пунктиром.
Определение. Состояние рабочего тела до процесса дросселирования, при котором после этого процесса температура не изменяется, называется состоянием инверсии, а сама точка, характеризующая это состояние, называется точкой инверсии.
Согласно этому определению точка С на рис. 7.2 является точкой инверсии. Если в координатах T – v изобразить пучок изобар, на каждой найти точку инверсии и все эти точки соединить плавной линией, то получим геометрическое место точек инверсии (см. пунктирную линию на рис. 7.2). Если дросселировать рассматриваемое вещество из состояний, точки которых расположены правее и выше линии инверсии, то температура рабочего тела после дросселя обязательно будет выше температуры до дросселя. Если эти точки будут располагаться ниже линии инверсии, то – ниже.
Рассмотрим частные случаи.
- Пусть рабочим телом при дросселировании является идеальный газ. Найдем величину (∂v/∂T)h, пользуясь уравнением состояния pv = RT. Тогда v = RT/p и (∂v/∂T)p = R/p = v/T. Выражение в квадратных скобках в (7.2) станет 0 и αh = 0. Следовательно, при дросселировании идеального газа его температура не меняется.
- Пусть рабочим телом при дросселировании является влажный пар какого-нибудь реального вещества. В лекции 2 предлагалось студентам потренироваться и получить все дифференциальные соотношения технической термодинамики. Послушные студенты могли бы получить соотношение
(∂p/∂T)v = (∂s/∂v)T или (∂T/∂p)v = (∂v/∂s)T. (7.3)
Для процесса дросселирования хотим найти (∂T/∂p)h. Но в области влажного пара любого вещества давление насыщенного пара зависит только от температуры (см. лекцию 3). Тогда (∂T/∂p)h = dT/dp. Следовательно, диффсоотношение (7.3) примет вид
dT/dp = (∂v/∂s)T =(v΄΄ - v΄)dx /(s΄΄ - s΄)dx = (v΄΄ - v΄)/(s΄΄ - s΄).
Напомним, что величины с двумя штрихами относятся к параметрам состояния сухого насыщенного пара, а величины с одним штрихом – к кипящей жидкости (см. лекцию 3). Величина dx – просто дифференциал степени сухости х влажного пара (опять-таки см. лекцию 3)
В последнем выражении справа умножим числитель и знаменатель дроби на величину T. Тогда
dT/dp = T(v΄΄ - v΄)/r ≈ Tv΄΄/r > 0. (7.4)
Снова напомним, что T(s΄΄-s΄) = r, т.е. теплоте фазового перехода (см. лекцию 3).
Строгое равенство в (7.4) в термодинамике называют уравнением Клайперона – Клаузиуса. Из него следует, что при очевидном обстоятельстве v΄΄>> v΄(примерно в 1000 раз) dT/dp всегда строго больше 0. Окончательный вывод: при дросселировании влажного пара любого вещества температура пара после дросселя только уменьшается.
Замечание. Здесь получен очень важный и общий физический результат. Он был бы невозможен без такого термодинамического инструмента, как дифференциальные соотношения термодинамики.
- Адиабатное расширение, как способ понижения температуры.
Рассмотрим процесс адиабатического расширения газообразного рабочего тела в цилиндре с поршнем или расширение при течении в соплах. Здесь снова заведомо знаем, что давление газа уменьшается dp < 0. Воспользуемся опять соотношениями (7.1), но приравняем одно другому:
Tds + vdp = cpdT – (T(∂v/∂T)p – v)dp. (7.5)
Раскроем скобки и сократим vdp справа и слева в (7.5). Далее разделим обе части полученного уравнения на dp и используем условие адиабатичности (ds = 0), получаем
Tds = cpdT – T(∂v/∂T)p dp → ds = 0 → (∂T/∂p)s = T/cp (∂v/∂T)p = αs. (7.6)
Величина αs в термодинамике называется адиабатичеким дифференциальным эффектом. Отметим, что адиабатическое расширение любого рабочего тела всегда приводит к уменьшению температуры, а вот дросселирование совсем не всегда. Рассмотрим дифференциальный дроссель эффект и адиабатический дифференциальный эффект расширения вместе:
(∂T/∂p)h = T/cp[(∂v/∂T)p – v/T] и (∂T/∂p)s = T/cp (∂v/∂T)p.
Здесь воочию видно, что при одном и том же изменении давления Δр адиабатическое расширение обеспечивает большее уменьшение температуры, чем процесс дросселирования. Таким образом, термодинамика однозначно показывает инженерам преимущества процесса адиабатического расширения в холодильной технике по сравнению с процессом дросселирования.
Замечание. Несмотря на эти рекомендации термодинамики все-таки инженеры пользуются много чаще способом дросселирования для достижения низких температур. Дело в том, что процесс адиабатического расширения на практике имеет малый коэффициент полезного действия (при расширении сжатого газа или пара, например, в цилиндре с поршнем хочется получить больше работы, которая может быть использована с пользой в самом холодильном цикле). Например, коэффициент полезного действия паровоза не больше 4%. И только изобретение П.Л. Капицей турбодетандера позволило реализовать практически адиабатное расширение с коэффициентом полезного действия около 80%, что и дало возможность создать экономичное промышленное производство жидкого воздуха в предвоенные годы.
- Экономичность холодильных технологий.
Общая теория циклов показала, что наиболее эффективным циклом является цикл Карно. Осуществить его без больших технологических трудностей возможно в двухфазных областях существования вещества, т.е. при температуре и давлениях ниже критических.
Однако, даже для цикла Карно существуют свои экономичные уровни температур, т.к. холодильный коэффициент связан с температурами охлаждения и температурой окружающей среды (см. лекцию 4):
εхк = T/(T – T0),
где Т – температура источника теплоты в цикле Карно и Т0 – температура окружающей среды (303К или 298К в зависимости от цели расчета). По своему смыслу холодильный коэффициент εхк есть отношение количества кДж «холода» к величине кДж работы, затрачиваемой на реализацию цикла. Т.е. по существу εхк представляет собой количество «холода», которое можно получить из 1 кДж работы. Для экономистов важнее знать обратную величину: сколько необходимо кДж работы (затрат) для производства 1 кДж «холода». По этой причине вводится коэффициент Карно:
τ0к = ηtк = (T – T0)/T = 1/εхк.
Коэффициент τ0к является простой функцией только температуры источника Т (температуру окружающей среды Т0 человеку сложно изменить). Если Т > Т0, то τ0к > 0. Последнее означает, что теплота передается рабочему телу с получением работы. Если температура источника ниже температуры окружающей среды (Т < Т0), то τ0к < 0. В этом случае направление потока теплоты к окружающей среде обеспечивается подводимой к рабочему телу работой.
Численные значения τ0к, т.е. абсолютные затраты работы на производство «холода» резко возрастают в области глубокого холода (см. таблицу 7.1).
Таблица 7.1
| Область конденсации | H2O | NH3 | O2 | H2 | He |
| T, K | 273 | 250 | 120 | 20 | 4.2 |
 | 0 | -0.09 | -1.28 | -12.7 | -64 |
Эта же зависимость показана на графике рис. 7.3.
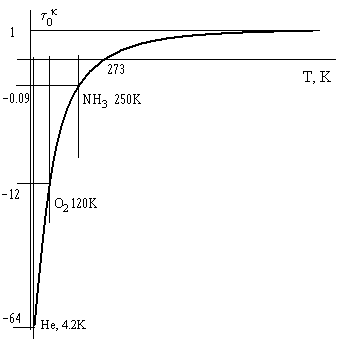
Рис. 7.3. Зависимость коэффициента Карно от температуры источника теплоты.
График построен качественно, без учета масштаба.
Из таблицы 7.1 и рис.7.3 видно, что, если в качестве хладоагента (рабочего тела) взять аммиак, то для получения 1 кДж «холода» (отводимой теплоты) необходимо затратить 0,09 кДж работы, а в холодильной камере при этом будет поддерживаться температура 250К, то есть -230С. Если же в качестве рабочего тела выбрать гелий, то для производства 1 кДж «холода» придется затратить 64 кДж работы, т.е. в 711 раз больше по сравнению с аммиачной холодильной машиной, зато температура в холодильной камере будет 4,2К. Отсюда правило для химиков-технологов – при производстве «холода» не стремиться без необходимости к чрезмерно низким температурам – они должны оправдываться термодинамическими требованиями технологии. Проще говоря, 1 кДж «холода» много дороже 1 кДж работы, а ведь надо думать и о себестоимости целевого продукта технологии.
Замечание. Из рис. 7.3 видно, что при Т → 0 К величина τ0к → -∞. Следовательно, необходимо затратить бесконечно много работы для получения 1 кДж «холода». Это свидетельствует о недостижимости абсолютного нуля (0 К). Этот постулат относят, обычно, к третьему закону термодинамики.
- Холодильные технологии.
Ранее мы выяснили, что для достижения низких температур (по сравнению с температурой внешней среды) необходимо пользоваться или процессом дросселирования, или адиабатического расширения. Но оба способа объективно требуют высокого давления рабочего тела. Поэтому в составе технологической схемы обязательно должен быть компрессор. На рис. 7.4 представлена типичная технологическая схема холодильной установки.
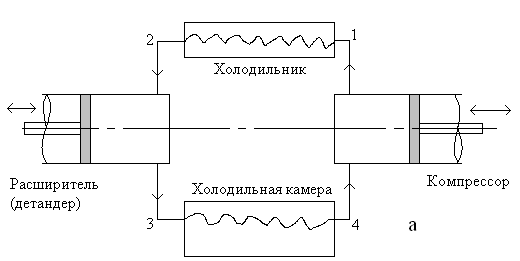

Рис. 7.4. Типичная технологическая схема холодильной установки.
Рабочее тело сначала компримируют до какого-то давления (точка 1), далее направляют в теплообменник для охлаждения и подготовки к расширению (точка 2). Затем сжатый и холодный газ направляют в расширитель (детандер) (см. 7.4-а), где газ охлаждается до заданной температуры (точка 3), одновременно совершая работу, которую частично используют на стадии сжатия. Наконец, газ направляют в теплообменник в холодильной камере (точка 4). Здесь рабочее тело (хладоагент) забирает теплоту из холодильной камеры и далее идет на всас компрессора.
На практике в установках умеренного холода вместо расширителя используют дроссель (см. рис. 7.4-б).
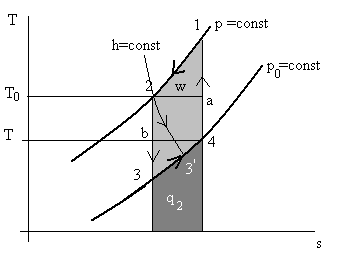
Рис. 7.5. Газокомпрессионные холодильные циклы на диаграмме Т – s.
На рис. 7.5 изображен газокомпрессионный цикл в координатах T – s. Площадь внутри цикла эквивалентна затраченной работе w, площадь под кривой p = const процесса 3 – 4 (изобарное расширение) или процесса 3΄ - 4 (дросселирование) соответствует количеству теплоты («холода») q2, взятому газом от среды в холодильной камере. Это количество теплоты на языке «холодильщиков» называют холодопроизводительностью. Из рис. 7.5 видно, что холодопроизводительность q2 цикла с расширением в детандере больше, чем с дросселем.
На рис. 7.5 внутри газокомпрессионного цикла изображен цикл Карно a2b4. Здесь Т0 – температура окружающей среды (атмосферы), Т – температура газа на выходе из теплообменника. Из рис. 7.5 видно несовершенство газокомпрессионного цикла по сравнению с циклом Карно. Действительно, площадь прямоугольника а2b4 много меньше площади фигуры 1234, а это затраты работы в установке. Одновременно видно, что количество отведенной теплоты q2 в цикле Карно много больше, чем в газокомпрессионном цикле.
Технологическая схема парокомпрессионного цикла ничем не отличается от предыдущего цикла, только в качестве рабочего тела используются пары веществ, которые находятся в области влажного пара (см. лекцию 3). Иными словами, применяются вещества в состояниях, ниже критического (см. лекцию 3). Здесь в принципе можно реализовать наиболее эффективный холодильный цикл Карно (см. рис. 7.6).
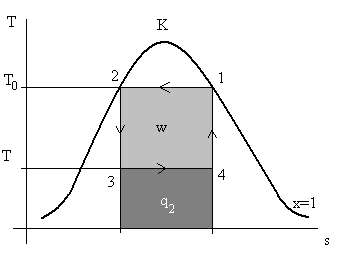
Рис. 7.6. Парокомпрессионный холодильный цикл Карно.
Нумерация точек соответствует рис. 7.4-а.
Как и выше, площадь внутри цикла соответствует работе w, которую необходимо подводить к рабочему телу, площадь под прямой 3 – 4 соответствует количеству теплоты q2, забираемой рабочим телом от среды в холодильной камере, а сумма w + q2 (это площадка под прямой 1 – 2) представляет собой количество теплоты, отдаваемой рабочим телом теплоносителю в теплообменнике за компрессором (см. рис. 7.4-а).
Этот цикл замечателен тем, что изобарный процесс в теплообменниках для области влажного пара любого вещества совпадает с изотермой (см. лекцию 3), как это необходимо для цикла Карно.
Термодинамика свидетельствует, что цикл Карно самый эффективный цикл и для производства «холода». На практике его довольно трудно реализовать. Причины следующие.
- Необратимость процессов сжатия и расширения. Трение всегда сопутствует движению, а это вызывает рост энтропии, следовательно, адиабатичность есть (термоизоляция), а изоэнтропийности нет.
- Процессы теплообмена 1 – 2 и 3 – 4 в теплообменниках реализуются только при конечной разности температур теплоносителей. Это означает, что процесс сжатия придется вести не до температуры Т0, а несколько выше. Одновременно, процесс расширения придется вести не до температуры Т, а ниже.
- Процесс сжатия 4 -1 (см. рис. 7.6.) происходит со средой, в которой находится жидкая фаза вещества. Внутри компрессора из-за этого будут гидравлические удары. Тоже самое будет и в расширителе. По этой причине долговечность работы установки будет мала.
Вопросы «на засыпку».
- Изобразить цикл Карно, как на рис. 7.6, но при условии, что процесс сжатия 4 -1 теперь стал необратимым (см. лекцию 4). Как изменится при этом холодопроизводительность и холодильный коэффициент по сравнению с идеальным циклом на рис. 7.6?
- Сделать то же самое при условии, что процесс теплообмена в холодильнике за компрессором (см. рис. 7.4-а) происходит необратимо. Как изменится холодильный коэффициент?
- Пусть теперь процесс расширения 2 -3 станет необратимым. Изобразить новый цикл на фоне идеального цикла Карно. Как изменится холодильный коэффициент?
- Пусть теперь процесс теплообмена в теплообменнике в холодильной камере станет необратимым. Изобразить новый цикл на фоне идеального цикла Карно. Как изменится холодильный коэффициент?
- Изобразить парокомпрессионный цикл на фоне идеального цикла Карно при условии, что все 4 процесса необратимы. Рассмотреть изменение холодильного коэффициента.
- Пусть «морозилка» в домашнем холодильнике заросла снегом или льдом. Как изменится холодильный цикл, если до того холодильник работал по циклу Карно? Как изменится холодильный коэффициент и холодопроизводитльность?
- Пусть теплообменная поверхность воздушного теплообменника в бытовом холодильнике (черненые трубки на задней поверхности холодильника) (см. рис. 7.4-б) покрылись слоем пыли, грязи или паутины. Изобразить новый цикл холодильника, если до того он работал по идеальному циклу Карно. Как изменится холодильный коэффициент? Как изменится холодопроизводительность?
- Пусть домашний холодильник все время работает без отключения. Как изменится температура воздуха на кухне? Дайте способ (алгоритм) расчета изменения температуры на кухне, если известен ее геометрический объем, предполагая герметичность и термическую изоляцию кухни.
- Снимем передние дверцы домашнего холодильника и выставим воздушный теплообменник на улицу, а открытые камеры холодильника пусть направлены в кухню. Как изменится температура на кухне после включения холодильника? Предложите алгоритм расчета этого изменения.
- Выставим домашний холодильник со снятыми дверцами на улицу зимой так, что воздушный теплообменник будет омываться воздухом кухни, а камеры домашнего холодильника открыты на улицу. Как изменится температура воздуха в кухне после включения холодильника? Герметизация и термоизоляция кухни подразумевается. Предложите алгоритм расчета изменения температуры воздуха на кухне. Здесь вспомните о тепловом насосе.
Пример ответа на поставленные вопросы. Рассмотрим вопрос №1. Итак, процесс сжатия в компрессоре 4 – 1 теперь стал необратимым, а все прочие обстоятельства считаем неизменными. Согласно лекции 4 необратимость всегда ведет к избыточному росту энтропии по сравнению с обратимым процессом (2 закон термодинамики). В обратимом процессе 4 – 1 величина s = const, Δs = 0. Следовательно, в необратимом Δs > 0, и точка 1' должна быть правее точки 1 и располагаться на той же изобаре, что и точка 1 (компрессор сжимает газ всегда до того же давления).
Далее сжатый газ поступает в холодильник, поверхность которого не изменилась, и температура и расход охлаждающего теплоносителя тоже. В тоже время количество теплоты, которое необходимо отвести от хладоагента, стало больше (на величину площади под кривой p=const от точки 1 до точки 1΄). Следовательно, точка 2 сместится вправо в положение 2'.
Рис. 7.7 демонстрирует изменение цикла Карно.
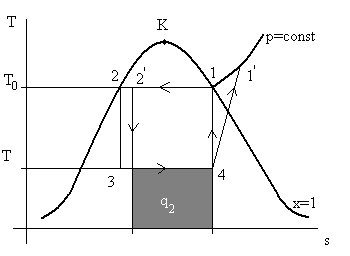
Рис. 7.7. Иллюстрация к ответу на вопрос №1.
Из рис. 7.7 отчетливо видно, что холодопроизводительность q2 нового цикла уменьшилась по сравнению с идеальным циклом Карно. Одновременно, видно, что средняя температура источника теплоты Т0 увеличилась, а температура стока теплоты Т осталась прежней. Следовательно, холодильный коэффициент уменьшился.
Еще один пример ответа. Рассмотрим вопрос №8. Итак, холодильник, установленный на кухне, работает без отключения. Пусть кухня теплоизолирована, т.е. нет потерь теплоты в окружающую среду. Из-за разности температур воздуха внутри холодильника и снаружи обязательно начнется теплоперенос из кухни в холодильную камеру (см. рис. 7.4). Далее, хладоагент забирает эту теплоту q2 и вместе с работой цикла w отдает через воздушный холодильник в воздух кухни. Составим тепловой баланс с контуром вокруг всего холодильника, видно, что в кухню все время подводится теплота в количестве w кДж.
Пусть в паспорте холодильника указана потребляемая мощность N Ватт. Напишем уравнение теплового баланса для воздуха в кухне:
cp(T) ρ(T) V(dT/dτ) = N, кДж/с.
В этом уравнении слева стоит изменение энтальпии воздуха на кухне во времени. V – геометрический объем кухни, τ – текущее время, ρ(Т) – плотность воздуха. Теперь вспомним, что для идеального газа pv = RT или ρ ≡ 1/v = p/(RT). Возьмем в справочнике зависимость истинной изобарной массовой теплоемкости, например, в виде cp(T) = а + bT, т.е. величины а и b теперь известны. Получаем
(а + bT) p/(RT) V (dT/dτ) = N или окончательно
dT/dτ = NRT/(pV(a + bT)).
Это дифференциальное уравнение первого порядка с разделяющимися переменными и решается в квадратурах. Для нас, занимающихся термодинамикой, важно лишь то, что температура на кухне будет расти так, как будто включен нагреватель с электрической мощностью N Ватт.
Реальный парокомпрессионный холодильный цикл (см. рис. 7.8) является примером того, как инженеры, руководствуясь рекомендациями термодинамики, создают работоспособные установки.
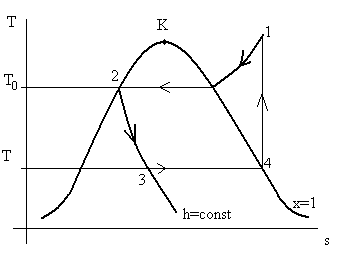
Рис. 7.8. Реальный парокомпрессионный цикл.
Процесс сжатия рабочего тела 4 – 1 происходит в однофазной области существования вещества. Это позволило избежать гидравлических ударов при сжатии: компрессор работает по сухому. Далее, вместо малоэффективного процесса расширения в детандере используется простой процесс дросселирования 2 – 3. В целом технологическая схема реального парокомпрессионного цикла соответствует технологической схеме на рис. 7.4-б. Конечно, полностью избавиться от необратимости процессов не удается никому, точно также как и от необходимости реализовывать конечную разность температур в обеих теплообменниках холодильной установки.
Пример. Определить потребляемую мощность для одноступенчатого аммиачного компрессора, работающего по сухому ходу. Найти массовый расход циркулирующего хладоагента. Требуемая холодопроизводительность 290 кВт, температура испарения -200С, температура конденсации +250С, температура переохлаждения 200С.
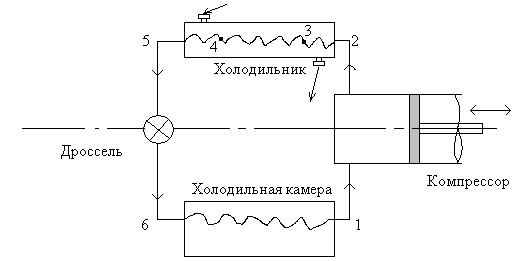
Рис. 7.9. Технологическая схема установки в задаче примера.
Решение. Рассмотрим рис. 7.9, где изображена технологическая схема аммиачной холодильной установки. Этот рисунок аналогичен рис. 7.8, но с деталями из рассматриваемой задачи. На рис. 7.10 представлен термодинамический цикл рассматриваемой установки.

Рис. 7.10. Изображение термодинамического цикла
холодильной установки для задачи примера.
Сухой насыщенный пар NH3 при температуре -200С подается на вход компрессора (точка 1). По таблицам для насыщенных паров аммиака находим давление насыщения: 1,95 бар. Одновременно определяем энтальпию аммиака в этой точке: h1=1403,6 кДж/кг.
Из точки 1 в координатах T - s проводим вертикальную прямую вверх (s = const), но пока не знаем, где остановиться. По условию задачи температура конденсации равна +250С. Тогда по таблицам насыщенных паров для аммиака определяем давление насыщения: р = 10,03 бара. Строим изобару р = 10,03 бара: она проходит по нижней пограничной фазовой кривой, далее в точке 4 начинается кипение при этом давлении, в точке 3 закончился фазовый переход и пар стал сухим, далее изобара выходит в область перегретого пара (см. лекцию 3). Точка пересечения изобары и изоэнтропы и определит точку 2 – конец процесса сжатия в компрессоре.
Далее перегретый пар аммиака с большой температурой поступает в теплообменник – конденсатор. Процесс 2 – 3 – это охлаждение перегретого пара аммиака, процесс 3 – 4 – это сам процесс конденсации и образования жидкой фазы. Процесс 4 – 5 – это процесс переохлаждения жидкости на 200С (пере- по сравнению с температурой конденсации 250С).
Переохлажденная жидкость NH3 в точке 5 поступает в дроссель, совершается процесс h=const до температуры испарения -200С. Получаем точку 6 как пересечение изоэнтальпии и изотермы. В точке 6 пар аммиака стал влажным и в таком состоянии направляется в испаритель (теплообменник) в холодильной камере, где химики-технологи требуют поддерживать температуру -200С и отводить 290 кВт теплоты из холодильной камеры.
С помощью таблиц насыщенного пара для аммиака определим энтальпию хладоагента в характерных точках цикла:
h3 =1450 кДж/кг, h4 = 304 кДж/кг.
Для определения энтальпии в точках 5 и 2 придется взять таблицы перегретого пара и жидкости или воспользоваться самой T – s диаграммой для аммиака. Тогда:
h5 = 205 кДж/кг, h2 = 1647 кДж/кг.
Теперь все готово для ответов на вопросы задачи. Действительно, удельная холодопроизводительность установки
q2 = h1 – h6 = 1403,6 – 205 = 1198 кДж/кг.
Здесь не забыли , что h5 = h6 = 205 кДж/кг. Далее, массовый расход хладоагента (аммиака) найдем из формулы
Q2 = q2 * G → G = Q2/q2 = 290/1198 = 0,242 кг/с.
Теоретическую мощность компрессора определим как:
NT = G * (h2 – h1) = 0,242 * (1647 – 1403,6) = 60 кВт.
Ответ: массовый расход аммиака в установке G = 0,242 кг/с,
теоретическая мощность компрессора NT = 60 кВт.
Замечание. Определение параметров состояния аммиака в точках 1, 2, 3, 4, 5 и расхода необходимо не только для проведения термодинамических расчетов, но и для расчета теплообменных поверхностей в холодильнике-конденсаторе. Дело в том, что расчет теплообмена между охлаждающей жидкостью и перегретым паром, этот же расчет при конденсации и теплообмене между двумя жидкостями основан на разных физических механизмах и, следовательно, имеют разные расчетные формулы для определения теплообменной поверхности. Но все эти детали студенты будут изучать при дальнейшем изучении курса процессов и аппаратов. Здесь важно подчеркнуть, что с термодинамических расчетов по существу начинается весь расчет химико-технологической установки.
