Дудина кристина Рубеновна хроническая hвv-инфекция: молекулярно-генетические методы диагностики, оптимизирующие тактику ведения пациентов
| Вид материала | Документы |
- Модели эволюции. Генетические алгоритмы, 361.44kb.
- Молекулярно-генетические механизмы активации тромбоцитов и чувствительности к антиагрегантным, 3372.01kb.
- Молекулярно-генетические методы и компьютерные технологии в системе эпидемиологического, 615.43kb.
- Пособие для пациентов Москва 2009, 178.23kb.
- Анкета участника, 37.12kb.
- Л. И. Параллелизмы в молекулярной организации генома и проблемы эволюции. В кн.: Молекулярные, 251.18kb.
- План лекции: /Кремень В. Е./ Анаэробная инфекция (определение, классификация); Анаэробная, 253.28kb.
- 1 Структурно-логическая схема дисциплины «Антикризисное управление», 27.25kb.
- «Коксиеллез-ассоциированная инфекция крупного рогатого скота и усовершенствование лабораторных, 460.33kb.
- Ультразвуковые методы диагностики в невропатологии и нейрохирургии детского возраста, 1897.14kb.
1 2
Результаты собственных исследований
На первом этапе исследования для уточнения диагноза с учетом однократного определения уровня виремии HBV в сопоставлении с активностью АлАТ в крови и оценки особенностей клинического течения хронической HBV-инфекции были обследованы 103 HBsAg-позитивные женщины на различных сроках беременности, поступивших в акушерское отделение ИКБ №1. Средний возраст пациенток данной группы составил 27 лет. Всем беременным женщинам было сделано однократное определение генетического материала гепатотропных и условно гепатотропных вирусов в крови, а также серологическое исследование на наличие в крови маркеров HCV- и HDV-инфекций. В 4,9% (5/103) случаев в группе беременных женщин обнаружен HBeAg в крови на фоне отсутствия анти-НВе в крови. На основании проведенного дополнительного обследования в 35,9% (37/103) случаев были уточнены диагнозы пациенток с хронической HBV-инфекцией, которые на этом основании распределены на подгруппы: подгруппа 1а - неактивное носительство HBV (n=43), подгруппа 1б - ХГВ без дельта-агента (n=43), подгруппа 1в - ХВГ смешанной этиологии (n=17).
Основная (74%) масса пациенток в акушерское отделение инфекционного стационара поступала с направительным диагнозом «неактивное носительство HBV». Как известно, данный диагноз в амбулаторных условиях пациенткам устанавливается, в основном, на основании отсутствия жалоб при осмотре, персистенции HBsAg на фоне постоянно нормального уровня аминотрансфераз в биохимическом анализе крови (АсАТ и АлАТ до 40 мкмоль/мин.л) в течении 6 месяцев и более. При однократном определении уровня ДНК HBV в крови методом ПЦР в рамках данного исследования только у 56,6% (43/76) HBsAg-позитивных пациенток диагноз «неактивное носительство HBV» оказался правомерен, т.к. на фоне отсутствия жалоб пациенток, нормальных показателей АлАТ и АсАТ в крови регистрировался неопределяемый уровень ДНК HBV в крови. Проведенное углубленное клинико-лабораторное обследование, включающее однократное ПЦР-обследование, 28 (36,8%) пациенткам с направительным диагнозом «неактивное носительство HBV» позволило диагностировать ХГВ без дельта-агента.
Дополнительные серологическое и молекулярно-генетическое обследования (определение анти-HCV, анти-HDV IgM и IgG в крови методом ИФА; ДНК HBV, РНК HCV, РНК HDV в крови методом ПЦР) позволили также выявить смешанную этиологию хронического вирусного поражения печени у восьми пациенток с хронической HBV-моноинфекцией, а также - у 1-ой пациентки с ХГВ+С выявить сопутствующую HDV-инфекцию. Среди 5 пациенток с направительным диагнозом «неактивное носительство HBV» у 4-х беременных женщин диагностирован ХГВ с дельта-агентом и у одной пациентки - ХГВ+С+Д. Среди беременных женщин с направительным диагнозом «ХГВ без дельта-агента» в 16,7% (3/18) случаев после проведенного дополнительного серологического обследования диагностирован ХГВ с дельта-агентом на основании обнаружения анти-HDV IgG в сыворотке крови. Таким образом, проведенное дополнительное серологическое и молекулярно-генетическое обследования позволили уточнить этиологию ХВГ у беременных женщин и в 30,2% (26/86) случаев определение уровня виремии HBV позволило уточнить вариант течения хронической HBV-моноинфекции.
Давность обнаружения HBsAg в крови у большинства пациенток подгруппы №1а и №1б составила от 1 до 5 лет (55,8% и 67,4%, соответственно, р > 0,05), напротив, у больных ХВГ смешанной этиологии - более 5 лет (76,5%). Обращает на себя внимание, что в 31% (32/103) случаев HBsAg в крови был обнаружен впервые при постановке на учет в женской консультации.
Основная (74%) масса пациенток первой группы поступала для планового родоразрешения (подгруппа №1а – 70% (30/43), подгруппа №1б – 84% (36/43), подгруппа №1в – 59% (10/17). При поступлении в стационар 78% (80/103) беременных женщин активных жалоб не предъявляли. У 23 пациенток первой группы жалобы при поступлении, в основном, были обусловлены патологией беременности и/или обострением сопутствующей патологии, из них в группе больных ХГВ без дельта-агента и ХВГ смешанной этиологии в 40% случаев регистрировались проявления геморрагического (кровоточивость десен, носовые кровотечение), астено-вегетативного синдрома (слабость), диспепсического синдромов (поташнивание, горечь во рту). Средние значения исследуемых показателей биохимического (АлАТ, АсАТ, общий билирубин, тимоловая проба, общий белок, глюкоза) и клинического анализов крови находились, преимущественно, в пределах нормальных значений. При проведении биохимического исследования крови у большинства (64%, 66/103) HBsAg-позитивных беременных женщин достоверно чаще регистрировались нормальные показатели трансаминаз (р=0,0001).
В нашем исследовании частота преждевременных родов составила 7% у неактивных носителей HBV и 18% у больных ХВГ смешанной этиологии. Помимо преждевременных родов, были также зарегистрированы стремительные роды только в 4,7% случаев у больных ХГВ без дельта-агента, запоздалые роды – у 2,3% больных ХГВ без дельта-агентом и в 5,9% случаев у больных с ХВГ смешанной этиологии. В среднем, у одной трети пациенток во всех подгруппах (подгруппа №1а – 32,6%, подгруппа №1б – 25,6%, подгруппа №1в – 47%) была выявлена различная патология беременности (анемия, водянка беременных, внутриутробная задержка развития плода 1 степени, умеренное маловодие, фетоплацентарная недостаточность, нарушения жирового обмена 2 степени, гестоз, нефропатия 1 ст., гестационный пиелонефрит, плоский плодный пузырь, частичное плотное прикрепление плаценты, гиперандрогения, хроническая внутриутробная гипоксия плода, ранний токсикоз беременных (рвота беременных), дородовое излитие околоплодных вод, отягощенный акушерско-гинекологический анамнез).
При проведении молекулярно-генетического исследования крови беременных женщин генетический материал условно гепатотропных вирусов HGV, CMV, HSV-1,2 типов и HНV 6 типа, в большинстве случаев, был выявлен у больных ХГВ без дельта-агента и частота их выявления колебалась от 2,3% до 4,7%. Выявление ДНК CMV и ДНК HSV-1,2 типов у беременных женщин с ХГВ без дельта-агента регистрировалось на фоне отсутствия специфических антител класса М и обнаружения специфических антител класса G в крови.
Генетический материал HGV в крови у неактивных носителей HBV и пациенток с ХГВ без дельта-агента обнаружен в 4,7% случаев, у больных подгруппы №1в – в 11,8% случаев (р=0,3195). У женщин с ХГВ без дельта-агента достоверно чаще выявлялась ДНК TTV по сравнению с неактивными носителями HBV (25,6% и 53%, соответственно, р=0,0473). Таким образом, выявление генетического материала условно гепатотропных вирусов в крови пациенток первой группы, а также имеющиеся данные о возможном неблагоприятном перинатальном исходе беременности у женщин с HSV-, CMV-инфекциями, говорит о необходимости включения в план обследования беременных женщин определение ДНК CMV и ДНК HSV-1,2 в крови методом ПЦР с одновременным определением специфических антител и требует их тщательного наблюдения.
В нашем исследовании, как у беременных женщин с ХГВ без дельта-агента, так и с ХВГ смешанной этиологии, в большинстве случаев, регистрировались неопределяемый (57,3%) и низкий (28,1%) уровни виремии HBV. Высокий уровень виремии HBV (≥105 копий/мл) был выявлен у 14,6% (15/103) больных и чаще регистрировался у больных ХГВ без дельта-агента с повышенной активностью АлАТ и АсАТ в крови, чем у пациенток с нормальным уровнем трансаминаз, а у беременных женщин с микст-инфекцией - на фоне отсутствия генетического материала РНК HCV и РНК HDV. Уровень виремии ДНК HBV 107 – 109 копий/мл выявлен только у 5,8% (6/103) беременных женщин.
Обращает на себя внимание, что у 3,5% (3/86) пациенток, поступавших на 38 - 40 неделях беременности для планового родоразрешения, выявлено повышение АлАТ и АсАТ в крови более 10 норм (от 12 до 23 N) на фоне высокого уровня виремии HBV (105 – 107 копий/мл) и отсутствия жалоб, что говорит о реактивации HBV на фоне беременности.
Таким образом, дополнительное однократное обследование HBsAg-позитивных беременных женщин, включающее определение в крови уровня виремии HBV, маркеров HCV-инфекции и HDV-инфекции, показало регистрацию, преимущественно, низких уровней виремии HBV, позволило уточнить этиологию ХВГ и выявить реактивацию HBV на фоне беременности.
В настоящее время значимыми критериями прогрессирующего течения ХГВ являются активность АлАТ в крови, уровень виремии HBV и степень изменения морфологии печени, которые учитываются при отборе больных ХГВ для назначения ПВТ. В связи с чем, на втором этапе исследования для клинической оценки варианта течения хронической HBV-инфекции у пациентов второй (моно-инфекция) и третьей (микст-инфекция) групп был проведен сравнительный анализ результатов однократного, двукратного и трехкратного (с интервалом в 6 месяцев в течение 1,5 – 2 лет) обследования, включающего стандартное клиническое обследование, биохимическое исследование крови и количественное определение ДНК HBV в крови в сопоставлении с морфологией печени.
Всего обследовано 189 пациентов с хронической HBV-моноинфекцией, среди них было 82 (43,4%) женщины и 107 (56,6%) мужчин, средний возраст которых составил 39 ± 1,2 лет (от 15 до 72 года). В 55,6% случаев были лица в возрасте до 40 лет. У 16 (8,5%) из 189 пациентов с хронической HBV-моноинфекцией диагностирован НВе-позитивный ХГВ. Подавляющее большинство пациентов второй группы (51,9%, 98/189), также как и подгрупп №1а, №1б (61,6%, 53/86) составили лица с давностью выявления HBsAg в крови от года до 5 лет (p > 0,05). Обращает на себя внимание тот факт, что у трети пациентов второй группы HBsAg в крови был выявлен впервые перед включением в данное исследование (26/98), как и у беременных женщин первой группы (32/103). У большинства (95,8%, 181/189) пациентов HBsAg в сыворотке крови был выявлен случайно при амбулаторном или стационарном обследовании по поводу заболеваний, не связанных с патологией печени, в качестве доноров крови, при плановом обследовании в период беременности в женской консультации, прохождении диспансеризации, а также - при появлении тяжести в правом подреберье. Случайное выявление HBsAg в крови у пациентов, включенных в данное исследование, отражает эпидемиологическую особенность HBV-инфекции, что связано, в первую очередь, с бессимптомным течением, в большинстве случаев, хронической HBV-инфекции, а также - наличием скрытой HBV-инфекции. Бессимптомное течение хронической HBV-моноинфекции у большинства пациентов подтверждают и результаты данного исследования. Так, при первичном обнаружении HBsAg в крови, как в амбулаторных, так и в стационарных условиях, состояние всех пациентов было удовлетворительным.
При обследовании пациентов, включенных в исследование, с интервалом 6 месяцев в течение 1,5 – 2-х лет клинические проявления ХГВ были достаточно скудными. Активных жалоб при динамическом наблюдении большинство (89,4%) пациентов не предъявляло. Жалобы, которые предъявляли только 10,6% (20/189) пациентов при динамическом обследовании, были не постоянными и самостоятельно проходящими. У большинства пациентов с хронической HBV-инфекцией регистрировались проявления астено-вегетативного (65%, 13/20) и диспепсического (40%, 8/20) синдромов. Основными жалобами больных ХГВ были астения (50%) и дискомфорт в правом подреберье (20%). Обращает на себя внимание, наличие сопутствующей патологии желудочно-кишечного тракта (язвенная болезнь, хронический гастрит, хронический колит, хронический холецистит) у 50% (4/8) пациентов с хронической HBV-инфекцией с проявлениями диспепсического синдрома (дискомфорт в верхних отделах живота, тяжесть в правом подреберье). При объективном обследовании 189 пациентов с хронической HBV-инфекцией только в 17,5% (33/189) случаев была выявлена гепатомегалия.
Среди 36 пациентов с ХВГ смешанной этиологии (третья группа) было 16 (44,4%) женщин и 20 (55,6%) мужчин, средний возраст которых составил 35,6 ± 2,2 лет (от 16 до 70 лет, с преобладанием лиц в возрасте до 40 лет (69,4%). Также как у пациентов с хронической HBV-моноинфекцией, у большинства больных ХВГ смешанной этиологии HBsAg в сыворотке крови был выявлен случайно при плановом обследовании. Большинство (55,6%) пациентов третьей группы, также как и подгруппы №1в (76%, 13/17), составили лица с давностью выявления HBsAg в крови более 5 лет.
При включении пациентов в исследование состояние всех пациентов было удовлетворительным. Также как и у больных с хронической HBV-моноинфекцией, клинические проявления ХВГ смешанной этиологии были достаточно скудными. Активных жалоб при динамическом наблюдении у большинства (86%) пациентов не было. Жалобы, которые предъявляли только 14% (5/36) пациентов при динамическом обследовании, были не постоянными и самостоятельно проходящими. У пациентов с ХВГ смешанной этиологии регистрировались проявления астено-вегетативного и диспепсического синдромов. При сборе анамнеза у пациентов, включенных в исследование, указаний на злоупотребление алкоголем не было. При объективном обследовании 36 пациентов с ХВГ смешанной этиологии в 6% случаев была выявлена гепатомегалия.
Среди пациентов второй группы средние значения исследуемых показателей биохимического (АлАТ, АсАТ, общий билирубин, ЩФ, ГГТП, протромбиновый индекс, тимоловая проба, общий белок) и клинического анализов крови находились, преимущественно, в пределах нормальных значений. Средние значения АлАТ и АсАТ в крови при динамическом обследовании у пациентов третьей группы, по сравнению с пациентами с хронической HBV-моноинфекцией, были выше нормальных величин (от 1,5 до 4,5 норм), и максимальные их значения регистрировались при ХВГ смешанной этиологии: HBV+HCV+HDV. Средние показатели общего билирубина и клинического анализа крови у больных ХВГ смешанной этиологии находились в пределах нормальных значений. При однократном, двукратном и трехкратном обследовании пациентов с хронической HBV-мноинфекцией доля лиц с нормальными показателями АлАТ в крови была статистически достоверно выше, чем доля пациентов, имеющих повышенный уровень АлАТ в крови (p=0,0006, p=0,0075, p=0,0048, соответственно). Эта группа представляет наибольший интерес для клиницистов, т.к. несмотря на нормальную активность АлАТ в крови, у пациентов данной категории возможны достаточно выраженные фиброзные изменения в ткани печени, что требует их более углубленного обследования. На рисунке 1 представлена доля лиц с различной активностью АлАТ в крови при динамическом обследовании у пациентов с хронической HBV-моноинфекцией.
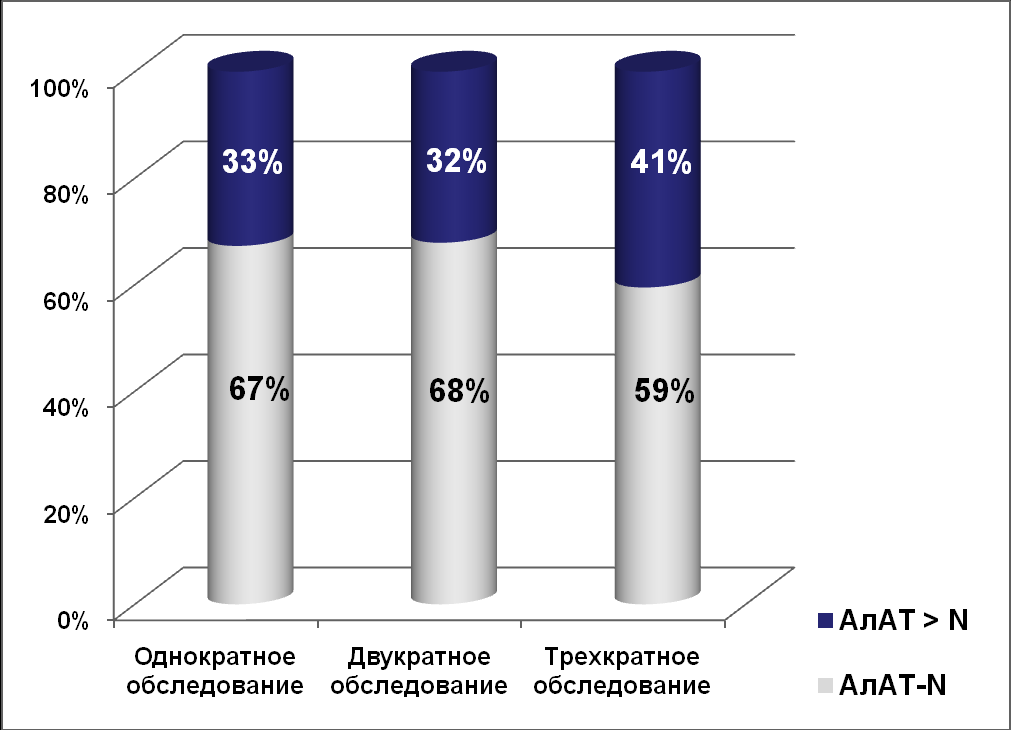
Рисунок 1. Доля лиц с нормальной и повышенной активностью
АлАТ в крови среди пациентов с хронической HBV-моноинфекцией
по результатам динамического обследования
При анализе уровня виремии HBV, второго критерия прогрессирующего течения ХГВ, выявлено, что при однократном обследовании достоверно чаще встречаются пациенты (48%) с неопределяемым уровнем ДНК HBV в крови, чем пациенты (18%) с высоким (105 – 108 копий/мл) уровнем виремии HBV (р=0,0014). Как у пациентов первой группы, так и у лиц второй группы, в большинстве случаев, регистрируются низкие (в том числе, неопределяемый) уровни виремии HBV, а высокий уровень вирусной нагрузки HBV в крови, который в настоящее время считается одним из факторов прогрессирующего течения ХГВ, выявляется, в среднем, в 21% случаев (см. рисунок 2). Различный (неопределяемый, низкий и высокий) уровень виремии HBV регистрируется у пациентов, как на фоне нормального, так и на фоне повышенного уровня активности АлАТ в крови. В тоже время, статистически достоверно чаще при однократном обследовании неопределяемый уровень виремии HBV регистрируется на фоне нормальной активности АлАТ в крови, а высокий уровень виремии HBV - на фоне повышенной активности АлАТ в крови (р=0,0129 и р=0,0018, соответственно). Обращает на себя внимание, что при динамическом обследовании пациентов второй и третьей групп выделена группа с волнообразным уровнем виремии HBV (25% и 14%, соответственно), у которых регистрировались колебания ДНК HBV в крови от неопределяемого до высокого, что необходимо учитывать при обследовании пациентов (см. рисунок 3).
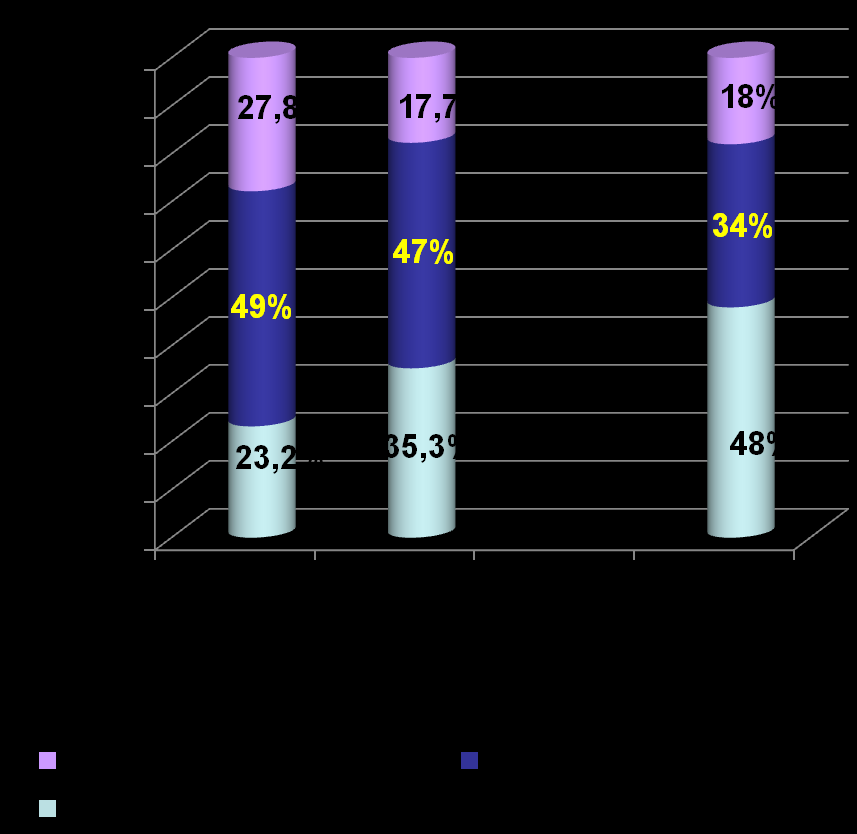
Беременные женщины
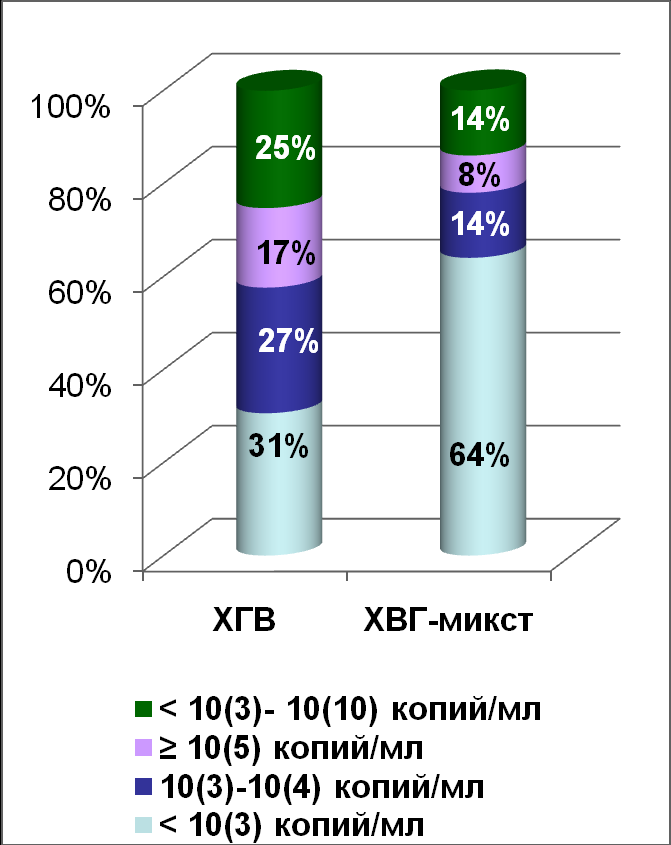
Рисунок 2.Частота выявления различных Рисунок 3. Частота выявления
уровней виремии HBV при однократном различных уровней виремии HBV
обследовании пациентов 1 и 2 групп при динамическом обследовании
пациентов 2 и 3 групп
В большинстве случаев, при двукратном, как и при однократном обследовании, у пациентов второй группы неопределяемый и постоянно низкий уровни виремии HBV регистрировались на фоне нормальной активности АлАТ в крови (97% и 57,8%, соответственно). При двукратном обследовании частота выявления различного уровня виремии HBV в зависимости от уровня активности АлАТ в крови достоверно не различалась между этими группами. Однако, среди пациентов с волнообразным (<103 – 106 копий/мл) уровнем виремии HBV достоверно чаще регистрировался повышенный уровень активности АлАТ в крови (р=0,0474). По данным трехкратного клинико-лабораторного обследования, в большинстве случаев (69,4%, 77/111), выявлены ДНК HBV-позитивные больные, как и при двукратном ПЦР-обследовании (82%, 23/28) (χ2 = 1,807, р=0,1788), в тоже время, достоверно чаще, чем при однократном (52%, 26/50) ПЦР-обследовании (χ2 = 4,513, р=0,0336). Среди больных HBeAg-негативным ХГВ, обследованных трехкратно, фактически с одинаковой частотой встречались больные с постоянно низким и волнообразным уровнями виремии HBV в крови (44,3% и 45,9%, соответственно), а доля (9,8%) пациентов с постоянно высоким уровнем виремии HBV была статистически достоверно ниже (р=0,00001). В 83,3% (5/6) случаев постоянно высокий уровень виремии HBV (> 105 копий/мл) у больных НВе-негативным ХГВ регистрировался на фоне повышенной активности АлАТ в крови. В целом, при проведении корреляционного анализа было выявлено, что существует прямая корреляционная зависимость между активностью АлАТ и высоким (≥ 105 копий/мл) уровнем виремии HBV (r=0,385, p=0,008).
Среди 16 пациентов с НВе-позитивным ХГВ (вторая группа), обследованных однократно, двукратно и трехкратно, у одной (2,9%) больной 31 года, наблюдавшейся с 2006 года, в процессе динамического наблюдения на фоне небольшого повышения АлАТ в крови (максимально до 49 мкмоль/(мин.л)) произошла спонтанная сероконверсия HBeAg-/анти-НВе+ с последующей авиремией HBV с нормализацией уровня АлАТ в крови. У 1-го пациента, 20 лет, выявлена иммунотолерантная фаза хронической HBV-моноинфекции. В целом, при динамическом обследовании (однократно, двукратно, трехкратно) у больных НВе-позитивным ХГВ регистрировались только высокие уровни виремии HBV и, в большинстве случаев (86,6%), на фоне повышенного активности АлАТ в крови (р=0,0001).
Неопределяемый уровень ДНК HBV в крови при обследовании пациентов с хронической HBV-моноинфекцией в течение 1,5 - 2-х лет был выявлен в 30,6% (34/111) случаев. Среди 34 пациентов с авиремией HBV при динамическом обследовании у 3-х (8,6%) пациентов в анамнезе были указания на проведение ПВТ за 5 - 7 лет до включения в исследование, что говорит о достижении биохимического и вирусологического ответов, подтверждаемое результатами настоящего исследования. В 20,6% (7/34) случаев у пациентов (пять из них старше 50 лет) при динамическом наблюдении на фоне авиремии HBV при трехкратном обследовании регистрировался волнообразный уровень АлАТ в крови (от 2 до 4,5 N), среди них – в 50% случаев регистрировался постоянно повышенный уровень АлАТ в биохимическом анализе крови.
Как известно, в настоящее время критериями неактивного носительства HBV являются неопределяемый уровень виремии HBV, нормальные показатели АлАТ в крови, а также - отсутствие гепатита по данным ПБП. По данным трехкратного динамического обследования среди 34 пациентов с авиремией HBV только у 23 можно было предположить неактивное носительство HBV. В течение 1,5 - 2-х лет с интервалом 6 - 12 месяцев у данных пациентов отсутствовали жалобы, общее состояние пациентов было удовлетворительным при осмотрах, на фоне персистенции HBsAg и постоянно нормального уровня трансаминаз в биохимическом анализе крови не определялась ДНК HBV (<103 копий/мл) и другие маркеры репликации HBV (анти-НВcore IgM и HВeAg в крови методом ИФА) в крови. Одна (2,9%) пациентка, несмотря на неопределяемый уровень ДНК HBV в крови в течение 1,5 лет на фоне нормальных показателей АлАТ и АсАТ в крови, с учетом обнаружения ДНК HBV в крови на фоне нормальных значений трансаминаз по данным анамнеза, не была отнесена к группе неактивных носителей HBV.
Таким образом, по данным трехкратного клинико-лабораторного обследования у пациентов с хронической HBV-моноинфекцией частота выявления ДНК HBV-позитивных больных достоверно выше, чем у пациентов с однократным ПЦР-обследованием. Динамический мониторинг HBeAg-статуса, уровня активности АлАТ и виремии HBV позволил выявить группы пациентов с активной и неактивной хронической HBV-моноинфекцией, что в дальнейшем требует различной тактики ведения пациента.
У больных ХГВ с дельта-агентом статистически достоверно чаще регистрируется повышенная активность АлАТ в крови (76,5%; χ2=9,529, р=0,002), как при наличии виремии HBV и HDV, так и на фоне её отсутствия, а также по данным однократного ПЦР-обследования, в большинстве (59%) случаев, регистрируются неопределяемые уровни, как ДНК HBV, так и РНК HDV в крови (ДНК HBV+/ РНК HDV- 29%, ДНК HBV-/ РНК HDV+ - 12%). У больных ХГВ+С также регистрируется чаще (60%) повышенная активность АлАТ в крови, но статистических достоверных различий не выявлено (χ2=1,2, р=0,2733), однако, неопределяемые уровни ДНК HBV и РНК HСV в крови регистрировались только в 40% случаев (ДНК HBV+/ РНК HСV- 46,6%, ДНК HBV-/РНК HСV+ - 6,7%, ДНК HBV+/ РНК HСV+ - 6,7%). У больных ХГВ+С+Д также регистрируется чаще повышенная активность АлАТ в крови (75%: χ2=2,000, р=0,1573, соответственно) и в 100% случаев зафиксированы неопределяемые уровни виремии HBV, HCV и HDV. В целом, при ко-инфекции HBV c HCV и HDV при динамическом обследовании достоверно чаще регистрируются неопределяемые (63,9%), чем постоянно низкие (13,9%), волнообразный (8,3%) и высокий (13,9%) уровни виремии HBV (χ2=18,935, р=0,00001, χ2=24,08, р=0,00001, χ2 = 18,935, р=0,00001, соответственно). Таким образом, у больных ХВГ смешанной этиологии в крови, в большинстве случаев, выявляется генетический материал одного из гепатотропных вирусов на фоне повышенной активности АлАТ в крови.
Следующим этапом исследования для уточнения степени воспалительной активности и стадии фиброза печени части пациентам второй группы были проведены ПБП и/или ТФ, а также - сравнительный анализ результатов инвазивного и неинвазивного методов диагностики фиброза печени.
С целью уточнения степени воспалительной активности и стадии фиброза печени 40 пациентам второй группы с различным уровнем виремии HBV была выполнена ПБП. ИГА больше 4 баллов был выявлен у 35 (87,5%), > 6 баллов - у 30 (75%) из 40 больных ХГВ (р=0,00001). Стадия фиброза печени F > 2 была выявлена в 30% случаев среди 10 пациентов с ИГА 9-12 баллов и в 4% случаев среди 25 пациентов с ИГА 4-8 баллов. Стадии фиброза печени F0 – F1 у больных ХГВ выявлена в 90% случаев, среди них только в 2,8% случаев выявлена F0. Десять (25%) из 40 пациентов, которым была произведена ПБП, были с НВе-позитивным ХГВ и имели в 100% случаев повышенный, волнообразный уровень АлАТ в крови и в 80% случаев постоянно высокий уровень виремии HBV. По данным ПБП у 3-х (30%) из 10 больных НВе-позитивным ХГВ ИГА был 2-3 балла, у 5 (50%) пациентов – 6-7 баллов по Knodell. В целом, среди пациентов, у которых была проведена ПБП, в 30% (12/40) случаев регистрировался высокий, в 17,5% (7/40) - волнообразный, в 37,5%, (15/40) - постоянно низкий и в 15% (6/40) - неопределенный уровни ДНК HBV в крови. В целом, показания для назначения ПВТ по данным ПБП были выявлены в 75% случаев, т.е. ИГА ≥ 6 баллов, среди них F > 2 в 13% случаев.
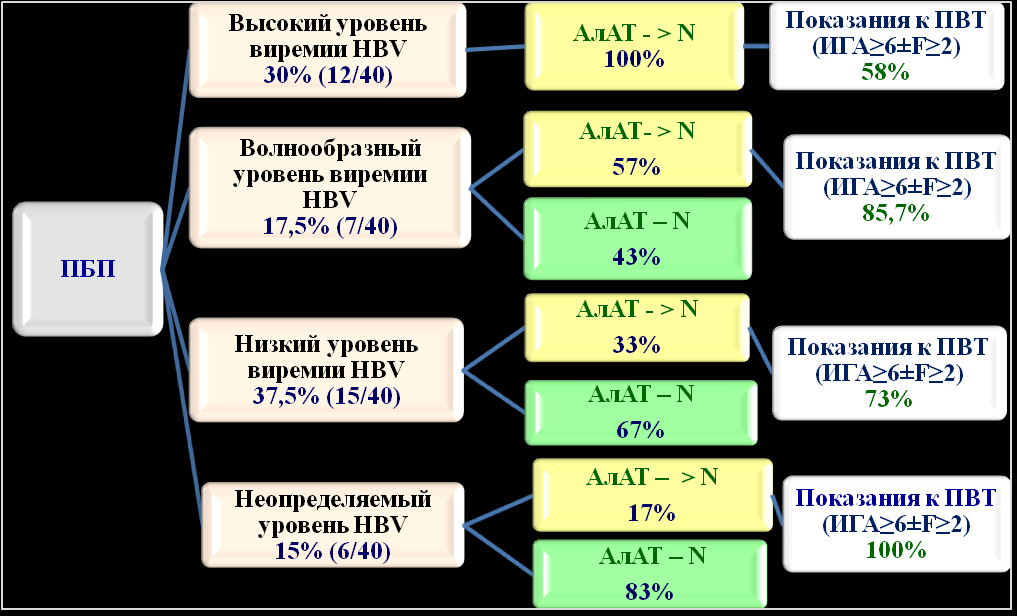
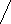
Рисунок 4. Сопоставление результатов морфологии печени с уровнем виремии HBV
и активностью АлАТ в крови при хронической HBV-инфекции
с целью определения показаний к ПВТ (n=40)
Анализируя результаты ПБП в сопоставлении с активностью АлАТ в крови и уровнем виремии HBV, было выявлено, что даже у пациентов с низким и неопределяемым уровнями виремии HBV на фоне нормальной активности АлАТ в крови были выявлены показания для проведения ПВТ (см. рисунок 4). Полученные данные говорят о том, что вне зависимости от уровня виремии HBV, активности АлАТ и АсАТ в крови всем пациентам с хронической HBV-инфекцией необходимо проведение ПБП с целью уточнения степени воспалительной активности и стадии фиброза печени.
Неинвазивная диагностика фиброза печени с помощью ТФ была проведена 70 пациентам второй группы. По данным ТФ у пациентов с хронической HBV-моноинфекцией в 75,7% случаев выявляется стадия фиброза < F2, и, в большинстве случаев (55,7%), стадия фиброза F0 по METAVIR. В группе пациентов со стадией фиброза F0 - F1 (n=53) по данным ТФ, преимущественно, регистрируется неопределяемый (30,2%) и постоянно низкий (37,7%) уровни ДНК HBV в крови. Неопределяемый уровень виремии HBV фактически c одинаковой частотой встречается у пациентов со стадией фиброза печени F0, F1 и F2 по данным ТФ. Среди 22 пациентов с постоянно низким уровнем ДНК HBV в крови большинство (77,3%) было со стадией фиброза печени F0, но также были больные со стадиями фиброза печени F1 (13,6%) и F2 (9,1%) по METAVIR. Постоянно высокий уровень виремии HBV, преимущественно, выявлялся в одинаковых пропорциях при стадиях фиброза печени F0 - F1 (50%) и F > 2 (50%) по данным ТФ. Следует отметить, что, помимо постоянно высокого уровня виремии HBV при стадии фиброза печени F4 по METAVIR по данным ТФ, который регистрировался в 50% случаев, у пациентов с данной стадией фиброза печени также выявлялись неопределяемый и волнообразный уровни ДНК HBV в крови.
В группе пациентов со стадией фиброза F0 - F1 по данным ТФ достоверно чаще регистрируются нормальные показатели АлАТ в крови (77%, р=0,00001), напротив, при выраженных стадиях фиброза печени (F ≥ 2) у пациентов чаще (от 50% до 100%) зафиксирована повышенная активность АлАТ в крови. Повышенные уровни активности АлАТ в крови (n=7) при стадии фиброза F0 по данным ТФ регистрировались при различных (от неопределяемого до высокого) уровнях виремии HBV.
Данная закономерность прослеживается и при сопоставлении уровня виремии HBV с результатами ТФ. Так, при стадиях фиброза F0-F1 у пациентов с хронической HBV-инфекцией достоверно чаще регистрируются неопределяемый и постоянно низкий уровни ДНК HBV в крови в крови (F0 - 71,8%, р=0,0180, F1 - 57,1%, р=0,00001), напротив, при прогрессирующих стадиях фиброза печени (F ≥ 2), чаще регистрируется постоянно высокий уровень виремии HBV (33,3% при F2-F3, р=0,00001; 50% при F4, р=0,00001).
Пяти из семи пациентов с авиремией HBV и повышенной активностью АлАТ в крови при трехкратном обследовании в отсутствии ПВТ в анамнезе была проведена ТФ, по результатам которой у 3 (60%) пациентов стадия фиброза печени была больше 2 (F2 - F4 по METAVIR), у 2 (40%) пациентов - стадия фиброза печени F1 по METAVIR. В подгруппе пациентов (n=23) с авиремией HBV на фоне нормальных показателей АлАТ в крови в отсутствии ПВТ в анамнезе, у которых можно было предположить неактивное носительство HBV по данным трехкратного динамического обследования, 16-ти пациентам выполнена ТФ: у 75% (12/16) пациентов диагностирована стадия фиброза печени F0, у 12,5% (2/16) пациентов - стадия фиброза печени F1 по METAVIR. Обращает внимание выявление в 12,5% (2/16) случаев стадии фиброза печени F3 по METAVIR, что не позволило рассматривать этих пациентов как неактивных носителей HBV. Учитывая данные научной литературы о возможности ТФ в ряде случаев (при остром гепатите, умеренном повышении активности АлАТ в крови и при стеатозе печени) завышать истинные показатели фиброза печени, а также выявление в нашем исследовании в группах пациентов с авиремией HBV, нормальными показателями АлАТ в крови и F3 по METAVIR, а также - с авиремией HBV, повышенными показателями АлАТ в крови и F2 – F4 по METAVIR, диффузных изменений печени и поджелудочной железы по данным УЗИ органов брюшной полости, данной категории пациентов требуется проведение ПБП для исключения стеатоза печени.
Для сравнительного анализа результатов ПБП и ТФ 21 больному ХГВ были проведены эти два исследования одновременно. При анализе результатов инвазивного и неинвазивного методов диагностики фиброза печени выявлено, что, как по данным ТФ (76,2%), так и по данным ПБП (86%), у подавляющего числа пациентов с хронической HBV-инфекцией регистрируются стадии фиброза печени F ≤ 2 (р<0,05). При сравнении результатов ПБП и ТФ у больных ХГВ в 28,6% (6/21) случаев было получено совпадение результатов этих двух исследований: по стадии фиброза печени F1 – 35,7% (5/14), по стадии фиброза печени F ≥ 2 – 33,3% (1/3). При анализе результатов этих двух исследований были выявлены расхождения в сторону занижения реального результата показателями ТФ в 52,4% (11/21) случаев, из них - при стадии фиброза F1 по данным ПБП в 50% (9/18) случаев по данным ТФ диагностирована стадия фиброза F0, а при стадии фиброза печени F ≥ 2 по данным ПБП в 67% (2/3) случаев по данным ТФ диагностирована стадия фиброза F0-F1. Также было выявлено расхождение в сторону завышения показателей фиброза на 1-2 стадии по результатам ТФ в 19% (4/21) случаев: при стадии фиброза F1 по данным ПБП в 22% (4/18) случаев по данным ТФ диагностирована стадия фиброза F2-F3. При динамическом обследовании у пациентов с расхождением показателей в пользу увеличения результатов по данным ТФ регистрировались преимущественно нормальные показатели активности АлАТ в крови.
Таким образом, у подавляющего числа пациентов с хронической HBV-моноинфекцией, включенных в исследование, по данным ПБП и ТФ регистрировались стадии фиброза печени F0 - F1. Однако, большая часть результатов ПБП и ТФ не совпадают, как в виде недооценки, так и в виде переоценки на 1 - 2 стадии фиброза печени по данным ТФ при сравнении с результатами морфологического исследования биоптата печени. Полученные результаты данного исследования позволяют сделать вывод о том, что ПБП остается «золотым стандартом» для исключения значимых гистологических изменений в ткани печени и необоснованного назначения ПВТ больным ХГВ. Как было показано, ТФ является неинвазивным методом, заменяющим ПБП, среди пациентов с минимальной и наиболее выраженными стадиями фиброза печени в сочетании с повышенной активностью АлАТ и высоким уровнем виремии HBV. В связи с этим, пациентам с авиремией HBV и нормальной активностью АлАТ в крови при динамическом обследовании оправдано проведение ТФ, что позволит отобрать пациентов, которым, в первую очередь, для уточнения диагноза необходимо проведение ПБП, только благодаря которой можно выявить выраженные некрозо-воспалительные изменения и минимальный фиброз печени.
Учитывая в последние годы появление данных о клинической значимости количественного содержания HBsAg в крови у пациентов с хронической HBV-инфекцией, следующим этапом обследования пациентов исследуемых групп был анализ концентрации HBsAg в крови у пациентов в зависимости от варианта естественного течения хронической HBV-инфекции. В ходе проведенного исследования на большой когорте HBsAg-позитивных пациентов (n=135), в 96% случаев инфицированных генотипом D HBV и обследованных однократно, двукратно и трехкратно, показано, что концентрация HBsAg в крови значимо различается между НВе-позитивной и НВе-негативной фазами хронической HBV-инфекции, что согласуется с данными литературы. Так, при однократном определении у 36 пациентов с различными вариантами течения хронической HBV-инфекции количественного содержания HBsAg в крови было выявлено, что средние значения концентрации HBsAg (275 360,33 ± 109 738,1 МЕ/мл) у больных НВе-позитивным ХГВ были достоверно выше, чем у больных НВе-негативным ХГВ (5 000,9 ± 1 567,72 МЕ/мл) и неактивных носителей HBV (1 986,5 ± 1 333,7), p < 0,05. Наиболее высокие значения концентрации HBsAg в крови, как минимальные, так и максимальные (от 179 250 до 454 400 МЕ/мл), были выявлены также в группе пациентов с НВе-позитивным ХГВ. При динамическом обследовании сохранялась выявленная связь концентрации HBsAg в крови с НBeAg-статусом пациентов, включенных в исследование (p < 0,01). Так, средний уровень HBsAg в крови 8 больных НВе-позитивным ХГВ, у которых, в основном (88%), регистрировался повышенный уровень активности АлАТ в крови, составил 119 834,6 ± 27 211 МЕ/мл. При динамическом обследовании 99 больных НВе-негативным ХГВ средний уровень HBsAg в крови составил 11 813,8 ± 1 284,8 МЕ/мл, и, в большинстве случаев (75%), регистрировались нормальные показатели АлАТ и АсАТ в крови. Средняя концентрация HBsAg в крови в крови 18 пациентов с неактивным носительством HBV, имевших неопределенный уровень ДНК HBV в крови и нормальный уровень АлАТ в крови на протяжении динамического наблюдения в течение 1,5 - 2-х лет, составила 4732,82 ± 1692,75 МЕ/мл. Как при однократном, так и при динамическом обследовании, не выявлено достоверных различий в количественном содержании HBsAg в крови между пациентами с отсутствием НВеAg в крови, а именно, с неактивным носительством HBV и НВе-негативным ХГВ.
При анализе колебаний серологического уровня HBsAg у больных НВе-негативным ХГВ при динамическом наблюдении в течение 1,5 – 2-х лет не выявлено корреляции концентрации HBsAg в крови с уровнем виремии HBV. Вне зависимости от уровня виремии HBV у одного и того же пациента выявлены, как минимальные, так и выраженные колебания концентрации HBsAg в крови при естественном течении НВе-негативного ХГВ в пределах одного - двух логарифмов. Сравнительный анализ также показал, что у больных НВе-негативным ХГВ высокие концентрации HBsAg в крови регистрировались на различных уровнях виремии HBV: как на фоне высокого уровня виремии HBV (от 11,2 до 131 200 МЕ/мл), так и на фоне неопределенного уровня ДНК HBV в крови (от 0,78 до 101 010 МЕ/мл). В тоже время, у больных НВе-негативным ХГВ с высоким уровнем ДНК HBV в крови (>105 копий/мл) регистрировались концентрации HBsAg в крови менее 1 000 МЕ/мл, и напротив, при уровне виремии HBV 1010 копий/мл от 7 333 до 11 275 МЕ/мл.
Как у пациентов с НВе-негативным ХГВ, так и у пациентов с НВе-позитивным ХГВ, статистически достоверных различий в серологическом уровне HBsAg в крови в зависимости от уровня активности АлАТ и вирусной нагрузки HBV в крови не выявляется. Однако, у больных НВе-позитивным ХГВ статистически достоверно выше концентрации HBsAg в крови, как на фоне нормальной, так и повышенной активности АлАТ в крови, чем у больных НВе-негативным ХГВ (р < 0,01). У неактивных носителей HBV, также как и у больных НВе-негативным ХГВ, концентрации HBsAg в крови статистически достоверно ниже, чем у больных НВе-позитивным ХГВ, как на фоне нормального, так и повышенного уровня АлАТ в крови (р < 0,01).
У неактивных носителей HBV концентрация HBsAg в крови менее 1 000 МЕ/мл при динамическом обследовании была зарегистрирована в 72,2% (13/18) случаев, их них у большинства (61,5%) пациентов регистрировались минимальные концентрации HBsAg в крови (от 0,1 до 42 МЕ/мл); в 38,5% случаев содержание HBsAg в крови колебалось от 100 до 860 МЕ/мл. В 11,1% случаев концентрация HBsAg колебалась от 2 430 до 9 110 МЕ/мл. В целом, у большинства (83,3%, 15/18) неактивных носителей HBV при трехкратном динамическом обследовании наблюдалось снижение концентрации HBsAg в крови, причём, у 44,4% человек регистрировались наименьшие значения концентрации HBsAg в крови (от 0,7 до 12 МЕ/мл), которые снизились через 1,5 – 2 года от неопределяемого до 2,3 МЕ/мл (см.рисунки 5 и 6).

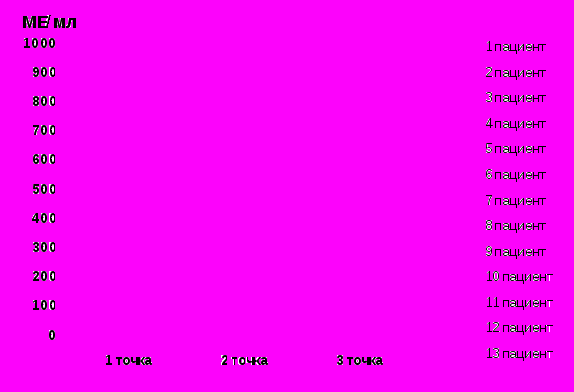
Рисунок 5. Концентрация HBsAg Рисунок 6. Концентрация HBsAg в крови
в крови менее 1 000 МЕ/мл у 13 менее 14 МЕ/мл у 7 неактивных
неактивных носителей HBV при носителей HBV при динамическом
динамическом обследовании обследовании
В ходе данного исследования при качественном и количественном определении содержания HBsAg в крови у 3 (1,5%) из 189 пациентов с хронической HBV-моноинфекцией при динамическом исследовании в течении 2-х лет зафиксировано исчезновение HBsAg в крови на фоне неопределяемого уровня виремии HBV и нормальной активности АлАТ в крови с появлением специфических антител к поверхностному антигену (у двух из них - с их защитным уровнем анти-HBs в крови).
Таким образом, у больных НВе-позитивным ХГВ достоверно выше количественное содержание HBsAg в крови, чем у пациентов с НВе-негативным ХГВ и неактивных носителей HBV. Кроме того, количественное определение HBsAg в крови позволило выявить «истинных» неактивных носителей HBV, у которых существует вероятность спонтанной элиминацией HBV. Полученные данные о низкой концентрации HBsAg в крови и последующего её уменьшения у части неактивных носителей HBV позволяют рассматривать определение количественного содержания HBsAg в качестве дополнительного критерия для выявления «истинных» неактивных носителей HBV. Как показало наше исследование, серологический уровень HBsAg менее 1 000 МЕ/мл, помимо признанных нами по результатам комплексного динамического обследования неактивных носителей HBV, также регистрировался в образцах крови с неопределяемым уровнем ДНК HBV в крови и у больных НВе-негативным ХГВ в 37% случаев. Поэтому, учитывая возможность выявления у части больных НВе-негативным ХГВ при динамическом обследовании неопределяемого уровня HBsAg на фоне нормальной активности АлАТ в крови, необходим динамический (как минимум, 1,5 - 2 года) мониторинг уровней ДНК HBV, HBsAg и АлАТ в крови у пациентов с НВе-негативной хронической HBV-инфекцией для выявления «истинных» неактивных носителей HBV. У больных с неопределяемым уровнем виремии HBV снижение концентрации HBsAg в крови при динамическом обследовании может говорить о возможном сероклиренсе HBsAg с появлением специфических анти-HBs.
Результаты исследования показали, что определение количественного содержания HBsAg в крови не является альтернативой определению уровня виремии HBV у пациентов с хронической HBV-инфекцией. Не следует забывать, что снижение концентрации HBsAg в крови может быть связано с мутациями в S-гене, а не с уровнем репликацией HBV. Учитывая тот факт, что повышение активности АлАТ и АсАТ в крови не является специфическим маркером вирусного повреждения ткани печени, комплексное количественное определение содержания HBsAg и ДНК HBV в крови позволит клиницисту определить активность хронической HBV-инфекции и выработать тактику ведения пациента.
Следующим этапом исследования было определение генетической вариабельности HBV, т.к. исследования последних лет показали, что с генотипами HBV связаны темпы прогрессирования хронического заболевания печени. В частности показано, что генотипы С и D HBV ассоциируется с более активной формой хронической HBV-инфекции. При определении генетической вариабельности HBV с помощью реакции минисеквенирования с последующей регистрацией результатов методом MALDI-TоF масс-спектрометрии у 113 HBsAg- и ДНК HBV-позитивных больных хронической HBV-инфекции (ХГВ моно- и микст-инфекция, ЦП HBV, ЦП HBV+HDV) было показано, что в изучаемой популяции пациентов достоверно чаще регистрируется инфицирование генотипом D HBV (84,8%), по сравнению с другими выявленными генотипами HBV (р<0,001), которые обнаружены в небольшом проценте случаев: генотип HBV А - в 4,5% случаев, генотип HBV С - в 2,7% случаев, а также смешанный генотип C/D HBV - в 8% случаев.
Среди 5 пациентов, инфицированных генотипом А HBV, выявлены низкий (104 копий/мл) и высокий (105 копий/мл) уровни виремии HBV в одинаковой пропорции (40%). У 2-х больных диагностирован HBeAg-негативный ХГВ с нормальным уровнем трансаминаз в крови, у 1 пациентки - НВе-позитвиный ХГВ с повышенной активностью АлАТ в крови, у одной больной - ХГВ с дельта-агентом с волнообразным уровнем ДНК HBV в крови и нормальной активностью АлАТ в крови. Обращает на себя внимание, что генотип А HBV был также обнаружен у одной пациентки ХГВ с исходом в ЦП, при однократном ПЦР-обследовании которой выявлен высокий уровень виремии - 109 копий/мл. Таким образом, при инфицировании пациентов генотипом А HBV регистрируется различная активность заболевания. У трех (100%) пациентов с генотипом С HBV выявлена высокая активность хронической HBV-моноинфекции: у 2-х больных - HBeAg-негативный ХГВ (высокая вирусная нагрузка HBV – 107-10 копий/мл, повышенная активность АлАТ и АсАТ в крови), у 1-го пациента - HBeAg-негативный ХГВ с исходом в ЦП. Среди 9 пациентов со смешанным генотипом HBV (С/D) было 7 (77,8%) больных ХГВ, 1 (11,1%) больная HBeAg-негативным ХГВ с исходом в ЦП и 1 (11,1%) больной ХГВ с ко-инфекцией HCV. Обращает на себя внимание тот факт, что у пациентов с хронической HBV-инфекцией, инфицированных смешанным генотипом С/D HBV, как на фоне нормальной, так и повышенной активности АлАТ в крови, в 100% случаев регистрируется высокий уровень виремии HBV.
Анализируя распространенность генотипов HBV в изучаемой популяции выявлено, что среди пациентов с различными вариантами хронической HBV-инфекции, регистрируется циркуляция, в основном (95,5%), генотипов D и С HBV, среди них в 8,4% случаев выявлен смешанный генотип С/D. Течение хронической HBV-инфекции у пациентов, инфицированных генотипом С и С/D HBV, в 100% случаев характеризовалось наличием высокой вирусной нагрузкой ДНК HBV в крови, преимущественно, на фоне повышенной активности АлАТ в крови. Таким образом, у пациентов, включенных в данное исследование, выявлены два значимых фактора риска развития неблагоприятного исхода хронического заболевания печени, а именно, инфицирование генотипами D, С, С/D HBV (у большинства больных) и высокий уровень виремии HBV (у 1/5 пациентов).
Наряду с определением генотипов HBV у 26 больных ХГВ и 10 больных ХГВ с исходом в ЦП была изучена мутационная изменчивость HBV. Среди обследованных 26 ДНК HBV-позитивных пациентов с ХГВ, инфицированных, преимущественно (85%), генотипом D HBV, как в группе (n=10), получавших различную ПВТ в анамнезе, так и в группе пациентов (n=16) с естественным течением ХГВ в 50% случаев выявлены различные мутации в S- и Р-генах. В группе пациентов (n=8) c естественным течением ХГВ в 50% случаев выявлены мутации как в S-гене, так и в Р-гене (F180W в S-гене + с W79R и Y89D в Р-гене; Р120Т, I86T в S-гене + T128N в Р-гене; Т116Р, T118P и S117G в S-гене + мутации S135F, H100P в Р-гене; L95S в S-гене и R110G в Р-гене), у трех (37,5%) пациентов мутации выявлены только в S-гене (T118A, D144V, Т126N), у одной (12,5%) пациентки – в Р-гене (A194D). Обращает на себя внимание, что у больных ХГВ с естественным течением при различных уровнях ДНК HBV в крови регистрируются мутации в S- и Р-генах, однако, в большинстве (62,5%) случаев, мутации были выявлены у пациентов с высоким уровнем виремии HBV у больных НВе-позитивным и НВе-негативным ХГВ (р=0,3173). Среди пациентов, получавших терапию «интерферон+ламивудин» в анамнезе, в 50% случаев выявлены мутации и только в Р-гене (n=1 - S85F, n=1 - L180M в сочетании T184S). У пациента, получавшего терапию ИФН в анамнезе и инфицированного генотипом А HBV, обнаружена мутация в Р-гене (S219A). У 2-х (100%) пациентов, получавших терапию ИФН и инфицированных генотипом С HBV, мутаций в S- и Р-генах не обнаружено. Обращает на себя внимание, что мутация Т118А в S-гене была выявлена только у больных НВе-позитивным ХГВ, как при естественном течении, так и у пациентов, у которых в анамнезе было проведение различной ПВТ. Среди 10 ДНК HBV-позитивных больных ЦП, у которых проводилось определение мутационной изменчивости HBV, 90% пациентов были инфицированы генотипом D и в 70% случаев были вывялены замены. В 57% случаев выявлены мутации только в S-гене (F80S; L109I; 2 пациента - T118A, из них у одного в сочетании с I110F), в 28,6% случаев – мутации только в Р-гене (Q130D; N139D), у 14,4% случаев сочетание мутаций Y134N и M133T в S-гене и V142E в Р-гене. У одного пациента, инфицированного генотипом А HBV, мутаций не выявлено. Не выявлено связи уровня виремии HBV и концентрации HBsAg в крови с наличием или отсутствием выявленных аминокислотных замен в S- и Р-генах HBV.
Таким образом, среди 36 пациентов дикий штамм HBV выявлен в 50% случаев при ХГВ и 30% случаев при ЦП (р > 0,05). При этом описанные в научной литературе мутации в S-гене, связанные с уровнем репликации HBV, исходами в ГЦК, в нашем исследовании выявлены не были. У больных ХГВ с естественным течением чаще регистрируются сочетанные мутации S- и Р-генов (50%), а также мутации в S-гене (37,5%). Напротив, у больных ЦП с естественным течением чаще регистрируются мутации в S-гене (50%), а сочетанные мутации S- и Р-генов – в 14,3% случаев (р > 0,05). Выявленные точечные мутации в S- и Р-генах, не описанные в научной литературе, могут быть потенциально клинически значимыми.
Анализ полиморфизма 7 генов (по Huang, 2007) показал, что, как у лиц контрольной группы (старше 50 лет и без клинических признаков ЦП), так и больных ЦП различной этиологии, преобладает выявление «неблагоприятных» генотипов генов AZIN1 (GG), TRL4 (CC), TRPM5 (СС+СТ), SNP5 (GG) и «благоприятные» генотипы полиморфизмов rs 2290351 (SNP4 - GG) и rs 17740066 (SNP6 - GG). «Неблагоприятные» полиморфизмы СТ и СС гена TRРМ5 чаще выявлялись у больных ЦП различной этиологии по сравнению с контрольной группой, однако, различия статистически не достоверны.
Только у больных ЦП HCV-этиологии достоверно реже выявлялся «благоприятный» полиморфизм (AG) гена AZIN1 (антизим-ингибитора-1) по сравнению с лицами контрольной группой (χ2=3,672, р=0,0553). У больных алкогольным ЦП по сравнению с лицами контрольной группы достоверно реже выявлялись «неблагоприятные» генотипы SNP4: AG+AA - р=0,0451; AG - р=0,0310. «Неблагоприятный» полиморфизм (GG) гена AQP4, в большинстве (71,7%) случаев, выявлялся у лиц контрольной группы, а у пациентов с ЦП различной этиологии встречался от 38,5 до 67,6%, и по сравнению с контрольной группой статистически достоверно реже у больных ЦП HBV-этиологии (р=0,0429) и смешанной вирусной этиологии (р=0,0017).
Анализ полиморфизма 4 генов, отвечающих за метаболизм алкоголя, показал, что в большинстве случаев, в исследуемых группах встречаются «благоприятные» генотипы генов ADH1B (GG – 76,9% - 95%), ALDH2 (GG – 100% во всех группах) и CYP2E1-pstI (GG – 88,5% - 100%). Напротив, среди больных ЦП различной этиологии и лиц контрольной группы чаще встречался «неблагоприятный» полиморфизм гена CYP2E1-taqI (СС – 76,3% - 96,2% и 78,3%, соответственно). У больных ЦП HBV- и неуточненной этиологии достоверно чаще по сравнению с контрольной группой встречался «неблагоприятный» полиморфизм (GА) гена ADH1B (р=0,0019 и р=0,00285, соответственно). У больных ЦП HBV-этиологии, как при моно-инфекции, так и при микст-инфекции, достоверно реже по сравнению с лицами контрольной группы выявлялись «благоприятный» генотип (CG) СYP2E1-taqI: р = 0,0397 и р = 0,0398, соответственно.
Таким образом, в обследованной популяции, как среди лиц контрольной группы, так и среди больных ЦП различной этиологии, в большинстве случаев, регистрируются «неблагоприятные» генотипы изучаемых генов, что при действии дополнительных факторов, приводящих к развитию хронического заболевания печени, могут способствовать развитию ЦП.
Частота выявления генетически детерминированных рисков развития неблагоприятного исхода хронического заболевания печени у больных ЦП вирусной, алкогольной и неуточненной этиологий представлена на рисунке 7.
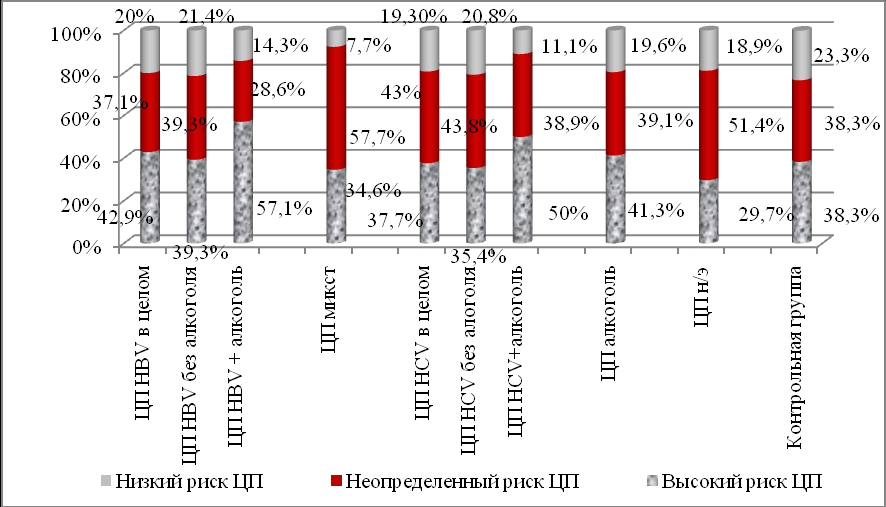
Рисунок 7. Частота выявления генетически детерминированных рисков развития неблагоприятного исхода хронического заболевания печени у больных ЦП вирусной, алкогольной и неуточненной этиологий
При анализе генетического риска развития ЦП, в целом, среди всех подгрупп пациентов с ЦП, наименее часто регистрировался низкий риск развития ЦП и его максимальная частота выявления составила 21,4% при ЦП HBV-этиологии без сопутствующего алкогольного поражения печени. Учитывая самое минимальное (7,7%) выявление генетически детерминированного низкого риска развития ЦП у пациентов с ЦП вирусной смешанной этиологии, можно предположить, что это отражает независимый от генетической предрасположенности вклад сочетанного инфицирования (HBV, HCV, HDV) в развитие неблагоприятного исхода ХВГ. В большинстве случаев, независимо от этиологии ЦП регистрировались высокий (от 29,7% до 57,1%) и неопределенный (от 28,6% до 57,7%) риски развития ЦП. У больных ЦП HBV-этиологии и, в целом, у больных ЦП смешанной вирусной этиологии высокий генетически детерминированный риск развития ЦП выявлялся достоверно чаще, чем низкий генетически детерминированный риск развития ЦП (χ2 -4,242, р=0,0394 и χ2 -5,650, р=0,0175, соответственно). У больных ЦП смешанной вирусной этиологии неопределенный генетически детерминированный риск развития ЦП также выявлялся достоверно чаще, чем низкий генетически детерминированный риск развития ЦП (χ2=14,770, р=0,0001). Таким образом, полиморфизмы 7 генов, которые определялись с высокой частотой у больных с неблагоприятным исходом хронической HCV-инфекции (Huang, 2007), показали в нашем исследовании аналогичную значимость, как у больных ЦП HCV-этиологии, так и у пациентов с ЦП иной этиологии.
Дополнительно для оценки возможного вклада генетического полиморфизма генов человека в развитие ЦП было проанализировано распределение генетических рисков развития неблагоприятного исхода ХГВ среди пациентов с высокой активностью хронической HBV-инфекции (HBе-позитивный ХГВ, n=13; НВе-негативный ХГВ с высоким уровнем виремии HBV (≥ 105 копий/мл) и повышенной активностью АлАТ в крови, n=37; неактивные носители HBV, n=35, 10 больных ХГВ с неэффективностью ПВТ в анамнезе), см.рисунок 8. У пациентов с высокой активностью хронической HBV-моноинфекции, как при НВе-позитивном, так и НВе-негативном ХГВ, преимущественно, регистрировались высокий (38,5% и 46,1%, соответственно) и неопределенный (20% и 42,9%, соответственно) генетические риски развития неблагоприятного исхода ХГВ, что наблюдалось и у пациентов с ЦП различной этиологии. Наиболее часто в рассматриваемых группах пациентов с хронической HBV-инфекцией низкий риск развития ЦП встречался в 37,1% случаев у пациентов с минимальной активностью заболевания, а именно, у неактивных носителей HBV и достоверно чаще только по сравнению с больными НВе-негативным ХГВ (χ2-4,055, р=0,0440).
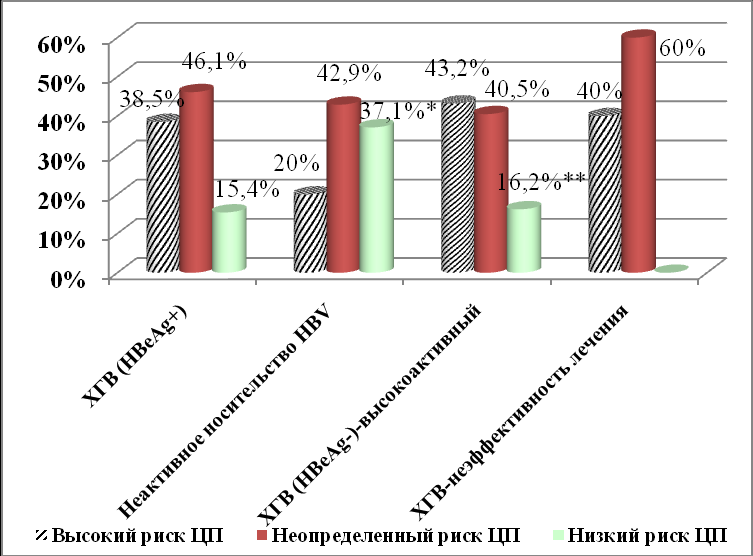
*-** р=0,0440
Рисунок 8. Частота выявления варианта генетического риска развития неблагоприятного исхода у пациентов с различной активностью течения хронической HBV-моноинфекции
Низкий генетически детерминированный риск развития ЦП у неактивных носителей HBV встречался достоверно чаще по сравнению с высоким генетическим риском развития ЦП (χ2=4,242, р=0,0394). У больных НВе-негативным ХГВ достоверно чаще регистрировались высокий и неопределенный генетически детеминированные риски развития ЦП по сравнению с низким генетическим риском развития ЦП (χ2=10,958, р=0,0009, χ2=9,656, р=0,0019, соответственно). В группе больных НВе-позитивным ХГВ не выявлено статистически достоверных различий в частоте выявления высокого и неопределенного генетически детеминированных рисков развития ЦП по сравнению с низким генетическим риском развития ЦП (χ2=1,759, р=0,1847 и χ2=2,889, р=0,0892, соответственно). У пациентов с неэффективностью ПВТ в анамнезе, регистрировались только высокий и неопределенный генетически детерминированные риски ЦП. Таким образом, на основании проведенного генетического анализа было выявлено, что у большинства пациентов с ЦП различной этиологии регистрируются высокий и неопределенный генетически детерминированные риски развитии ЦП, а в группе пациентов с минимальной активностью хронической HBV-инфекции выявлена максимальная частота регистрации низкого генетически детерминированного риска развития ЦП, что говорит о целесообразности использования данного показателя как критерия возможности неблагоприятного исхода заболевания и необходимости его учета при решении вопроса о назначении ПВТ.
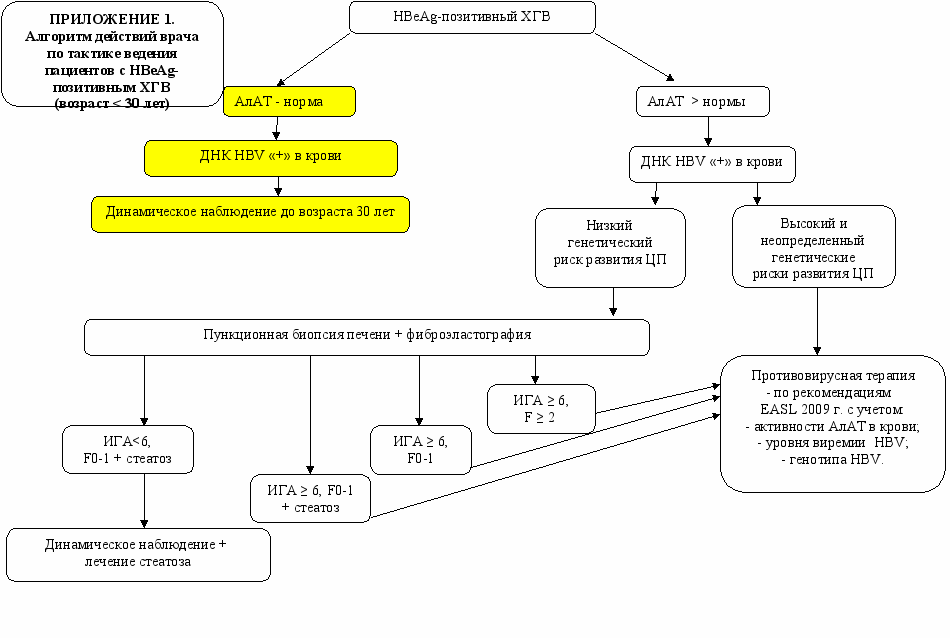
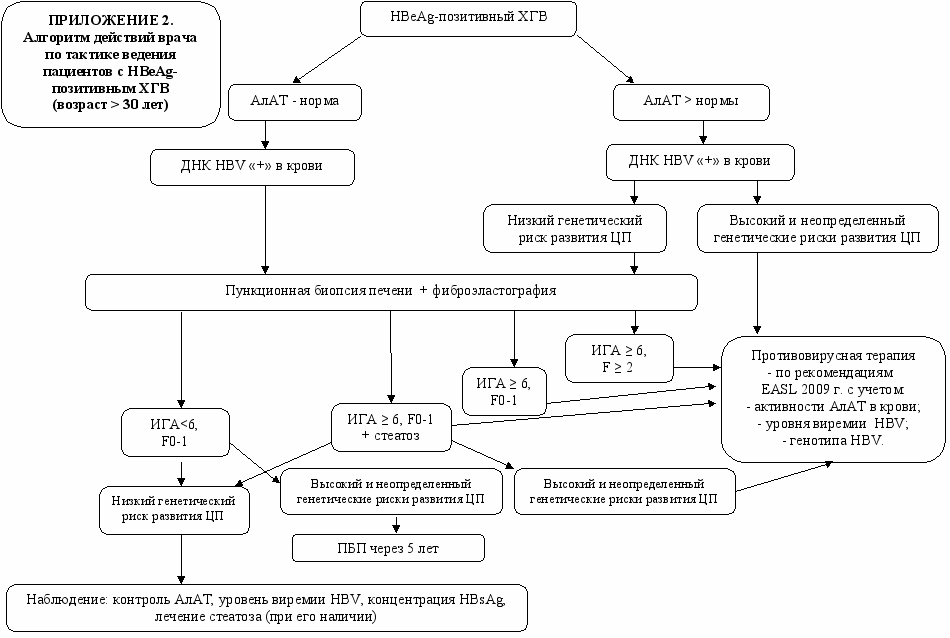
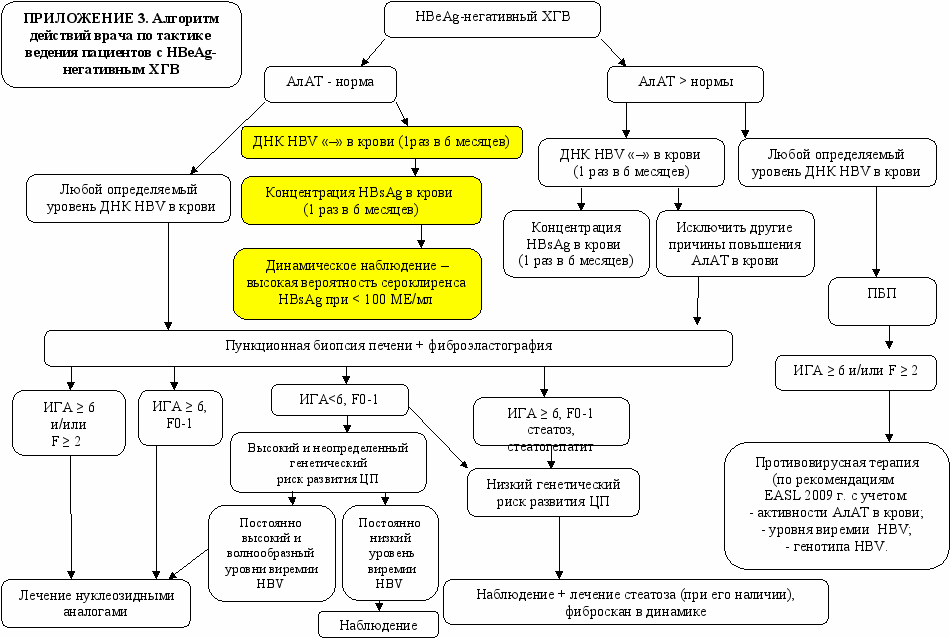
На основании полученных данных в ходе проведения данного исследования был разработан алгоритм действий врача при обследования пациента с различными вариантами хронической HBV-инфекции (см. приложение 1, 2,3).
ВЫВОДЫ
1. Пациенты с хронической HBV-моноинфекцией нуждаются в комплексном обследовании по определенному диагностическому алгоритму, включающему динамическое определение уровней активности АлАТ, количественного содержания ДНК HBV, концентрации HBsAg в крови для выявления неактивных носителей HBV, а также пациентов с любым детектируемым уровнем HBV, которым с целью выявления показаний для назначения ПВТ требуется проведение ПБП и определение генетического риска ЦП.
2. У беременных женщин отмечается мягкое течение хронической HBV-инфекции: в большинстве случаев, поводом для госпитализации является не наличие данного заболевания, а плановое родоразрешение (70% - при неактивном носительстве HBV, 84% - при ХГВ, 59% - при ХВГ смешанной этиологии); преимущественно, отсутствуют жалобы при поступлении в стационар; частота выявления патологии беременности в указанных трёх подгруппах пациенток достоверно не различается (р > 0,05); в тоже время, определение уровня виремии HBV в 30,2% случаев позволяет уточнить вариант течения хронической HBV-моноинфекции.
3. Среди пациентов, включенных в исследование, доминирует выявление HBеAg-негативного варианта хронической HBV-инфекции, при котором достоверно чаще регистрируется нормальная активность АлАТ в крови (63,9%, p=0,0021) и низкий (103-4 копий/мл) уровень виремии HBV (при однократном, двукратном и трехкратном обследованиях от 18 до 52,5%).
4. HBеAg-позитивный вариант хронической HBV-моноинфекции диагностирован у 7% пациентов и характеризуется выявлением высокого (≥ 105 копий/мл) уровня виремии HBV в 100% случаев (у 93,3% в сочетании с повышенным уровнем активности АлАТ в крови) и различной степенью повреждения ткани печени (ИГА от < 4 до 7 баллов, стадия фиброза F0-F4).
5.Показания для назначения ПВТ по данным биопсии печени (ИГА ≥ 6 и/или F ≥ 2) были выявлены у больных хронической HBV-моноинфекцией с различной активностью АлАТ в крови, как в отсутствии, так и при наличии виремии HBV: при различных диапазонах определяемого уровня виремии HBV с повышенной активностью АлАТ в крови - у 64% больных, с нормальной активностью АлАТ - у 83% пациентов; у лиц высоким уровнем виремии HBV в 58%, у пациентов с низкой виремией HBV – в 73% случаев.
6. Как по данным ПБП (86%), так и по данным ТФ (76,2%), у подавляющего числа больных ХГВ регистрируются стадии фиброза печени F < 2, однако, в 52,4% случаев выявлена недооценка, а в 19% случаев - переоценка на 1-2 стадии фиброза печени по данным транзиентной фиброэластографии.
7.Средняя концентрация HBsAg в крови у больных НВе-позитивным ХГВ (119 834,6 ± 27 211 МЕ/мл) достоверно выше по сравнению с больными НВе-негативным ХГВ и неактивными носителями HBV (11 813,8 ± 1 284,8 МЕ/мл, 4 732,8 ± 1 692,78 МЕ/мл, соответственно, р < 0,05, р < 0,01).
8. Корреляционный анализ не выявил связи уровня виремии HBV и количественного содержания HBsAg в крови у пациентов с НВе-негативной хронической HBV-моноинфекцией, однако, в отсутствии виремии HBV у большинства (83%) пациентов с неактивным носительством HBV при трехкратном динамическом обследовании в течение 1,5 – 2-х лет регистрировались концентрации HBsAg в крови менее 1 000 МЕ/мл, причем у 38,9% пациентов данной группы - менее 15 МЕ/мл с последующим динамическим снижением до минимальных значений (0,09 - 2,3 МЕ/мл).
9. Среди пациентов с ХГВ и ЦП, преимущественно, инфицированных генотипом D HBV, частота выявления дикого варианта HBV достоверно не различалась в группах больных ХГВ и больных ЦП HBV-этиологии, в 56% случаев выявлены различные аминокислотные замены в регионах S- и Р-генов HBV, не связанные с уровнем виремии HBV и концентрацией HBsAg в крови; только мутация Т118А в S-гене регистрировалась, как в группе больных ХГВ, так и больных ЦП HBV-этиологии.
10. Как у лиц контрольной группы, так и у больных ЦП различной этиологии, выявлены, в большинстве случаев, «неблагоприятные» варианты аллелей генов AZIN1, TRL4 (rs4986791), TRPM5 (rs886277), SNP5 (rs2290351), AQP2 (rs2878771), CYP2E1-ptsI, высокий и неопределенный генетически детерминированные риски развития ЦП, не обнаружено отдельных вариантов полиморфизма изучаемых генов, независимо влияющих на развитие ЦП, а максимальная частота регистрации генетически детерминированного низкого риска развития ЦП обнаружена в группе неактивных носителей HBV.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Учитывая возможное однократное отсутствие ДНК HBV в крови на фоне повышения активности АлАТ, наличие виремии HBV на фоне нормальных значений трансаминаз в крови, а также - отсутствие в течение длительного времени виремии HBV на фоне нормальной активности АлАТ в крови, для своевременного выявления лиц, нуждающихся в назначении ПВТ, целесообразно комплексное динамическое обследование с помощью предложенного алгоритма тактики ведения пациентов с хронической HBV-моноинфекцией, включающее определение уровней активности АлАТ, АсАТ в крови, виремии HBV, УЗИ органов брюшной полости 1 раз каждые 6 месяцев, морфологическое исследование ткани печени, определение генетически детерминированного риска развития ЦП.
2. Динамический мониторинг количественного содержания HBsAg в крови показан пациентам с неопределяемым уровнем виремии HBV, нормальным уровнем активности АлАТ в крови в течение 1,5 – 2-х лет в качестве дополнительного критерия неактивного носительства HBV как состояния с минимальным риском реактивации HBV.
3. Пациентам с НВе-негативной хронической HBV-моноинфекцией вне зависимости от уровня активности АлАТ в крови и уровня виремии HBV показано проведение морфологического исследования пунктата печени, полученного методом ПБП.
4. При наличии противопоказаний для проведения ПБП у пациентов с хронической HBV-моноинфекцией в качестве альтернативного метода диагностики фиброза печени возможно использование ТФ, однако, учитывая большой процент расхождений результатов ПБП и ТФ по данным проведенного исследования, целесообразно ТФ дополнять другими сертифицированными серологическими неинвазивными методами диагностики фиброза печени.
5. Целесообразно проведение динамического мониторинга уровня активности АлАТ, АсАТ в крови, виремии HBV у женщин на различных сроках беременности, что позволит своевременно выявлять пациенток, у которых существует высокий риск реактивации HBV во время беременности и после родов, что, в первую очередь, требует решения вопроса о назначении ПВТ без учета триместра беременности и проведения активно-пассивной иммунизации для снижения риска вертикальной передачи HBV-инфекции.
6. Во время беременности целесообразно проведение серологического обследования на наличие маркеров HDV- и HCV-инфекций для исключения у HBsAg-позитивных пациенток ХВГ смешанной этиологии.
СПИСОК СОКРАЩЕНИЙ
АлАТ - аланинаминотрансфераза
АсАТ – аспартатаминотрансфераза
ГЦК - гепатоцеллюлярная карцинома
ИГА – индекс гистологической активности
ИФА - иммуноферментный анализ
ПВТ – противовирусная терапия
ПЦР - полимеразная цепная реакция
ПБП – пункционная биопсия печени
ТФ – транзиентная фиброэластография
ХВГ – хронический вирусный гепатит
ХГВ - хронический гепатит В
ХГВ+С- хронический гепатит В с ко-инфекцией HCV
ХГВ+Д- хронический гепатит В с ко-инфекцией HDV
ХГВ+С+Д- хронический гепатит В с ко-инфекцией HCV + HDV
ЦП - цирроз печени
ЩФ-щелочная фосфатаза
ГГТП -гаммаглютамилтранспептидаза
HBsAg- поверхностный антиген вируса гепатита В
HBV - вирус гепатита В
HCV - вирус гепатита С
HDV – вирус гепатита Д
СПИСОК НАУЧНЫХ РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ:
- Ющук Н.Д., Знойко О.О., Сафиуллина Н.Х., Дудина К.Р., Келли Е.И., Климова Е.А., Каширин В.И., Брагинский Д.М., Кушлинский Н.Е., Любимова Н.В., Васильев А.Ю., Пенкина Т.В., Данилин А.Г. Диагностическая роль выявления коллагена IV типа и гиалуроновой кислоты в сыворотке крови больных хроническим гепатитом С для определения стадии фиброза печени // Терапевтический архив.- 2005.- №4.- Т.77.- С.50-55.
- Дудина К.Р., Шутько С.А., Знойко О.О., Климова Е.А., Трубицына Ю.Г., Кузина Л.Е., Кузин С.Н., Брагинский Д.М., Каширин В.И., Чешик Д.С., Серобян А.Г., Пенкина Т.В., Коршунов И.Б., Вьючнова Е.С., Ющук Н.Д. Количественное содержание HBsAg в крови у пациентов с различными вариантами хронической HBV-инфекции // Терапевтический архив. – 2008. - №11. - С.29-32.
- Малахова М.В., Ильина Е.Н., Говорун В.М., Шутько С.А., Дудина К.Р.,
Знойко О.О., Климова Е.А., Ющук Н.Д. Масс-спектрометрическое генотипирование вируса гепатита В // Бюллетень экспериментальной биологии и медицины. -2009. - №2. -Т.147. - С.181-187.
- Шутько С.А., Дудина К.Р., Знойко О.О., Климова Е.А., Каширин В.И., Чешик Д.С., Ющук Н.Д. Клиническое значение динамического определения уровня вирусной нагрузки в крови у пациентов с естественным течением хронической HBV-моноинфекции // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. -2009. - №6. – Т.ХIХ. - С.28-33.
- Дудина К.Р., Знойко О.О., Трубицына Ю.Г., Шутько С.А., Кузьмин В.Н., Серобян А.Г., Ревазян Н.Р., Петрова Т.В., Блохина Н.П., Ющук Н.Д. Этиологическая структура заболеваний у беременных женщин с повышенной активностью АлАТ и АсАТ в крови, поступающих в акушерское отделение инфекционного стационара // Терапевтический архив. – 2010. - №11. - С.45-48.
- Ющук Н.Д., Блохина Н.П., Знойко О.О., Дудина К.Р., Шутько С.А. Проблемы диагностики гепатоцеллюлярной карциномы в клинической практике // Хирург. – 2010. - №12. - С.21-24.
- Дудина К.Р., Знойко О.О., Трубицына Ю.Г., Шутько С.А., Голохвастова Н.О., Пыпкина Е.В., Скрупский К.С., Ющук Н.Д. Клинико-диагностическое значение уровня виремии у беременных женщин с хронической HBV-инфекцией // Лечащий врач. – 2010. - №11. - С.23-26.
- Ющук Н.Д., Климова Е.А., Знойко О.О., Кареткина Г.Н., Максимов С.Л., Мартынов Ю.В., Шухов В.С., Дудина К.Р., Маев И.В., Ивашкин В.Т., Маевская М.В., Буеверов А.О., Федосьина Е.А., Малышев Н.А., Блохина Н.П., Никитин И.Г., Чжао А.В., Андрейцева О.И., Богомолов П.О. Протокол диагностики и лечения больных вирусными гепатитами В и С // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2010. - №6. - Т.ХХ. - С.4-60.
- Чоговадзе А.Г., Генерозов Э.В., Николаева В.В., Поплевченков К.Н., Веретинская А.Г., Анохина И.П., Дудина К.Р., Знойко О.О., Маевская М.В., Ведерникова А.В., Ивашкин В.Т. Ассоциация полиморфизмов генов ADH1B, ALDH2 и CYP2E1 c развитием алкогольной зависимости и алкогольного цирроза печени. Наркология. – 2011. - №1. - С. 50-56.
- Цыганова Е.В., Знойко О.О., Ющук Н.Д., Дудина К.Р., Исагулянц М.Г., Петракова Н.В., Петрова Т.В., Михайлов М.И. Острый гепатит неуточненной этиологии // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2011. - №1. – Т.ХХI. - С.32-39.
Дудина К.Р., Знойко О.О., Шутько О.О., Климова Е.А., Кузина Л.Е., Брагинский Д.М., Блохина Н.П., Ющук Н.Д. Динамическое определение количественного содержания HBsAg в крови в сопоставлении с уровнем вирусной нагрузки у пациентов с хронической HBV-моноинфекцией // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2011. - №4. - Т.ХХI. – С.30 – 36.
- Ющук Н.Д., Знойко О.О., Климова Е.А., Дудина К.Р., Кареткина Г.Н., Ильина Е.Н., Максимов С.Л. Генетическая изменчивость вирусов гепатита человека и ее клиническое значение // Москва. - МГМСУ. - 2007. - 139 С. Монография.
- Чешик Д.С., Дудина К.Р., Малышев Н.А. Хроническая алкогольная интоксикация и наркомании у больных, находящихся в отделении вирусных гепатитов // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - Приложение №22. -Том XIV. -№1. - Материалы Девятой Российской конференции «Гепатология сегодня». – М. - 22-24.03 2004. - А104. - С.29.
- Чешик Д.С., Дудина К.Р., Знойко О.О., Брагинский Д.М., Малышев Н.А. Роль гипоальбуминемии в клинических проявлениях отёчно-асцитического синдрома у больных циррозами печени различной этиологии // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - Приложение №24. – Т.XV. - №1. - Материалы Девятой Российской конференции «Гепатология сегодня». – М.- 28-30.03 2005. - А 144. -С.40.
- Znoyko O.O, Dudina KR, Shutko SA, Isaguliants MG. Viral hepatitis co-infections in human immunodeficiency virus positive patients recorded by Moscow Infectious Disease hospital during 2006 // 3rd International Workshop on HIV and Hepatitis Co-infection Paris. – France. -7-9 June 2007. - Abstract 28. – P. 24.
- Трубицына Ю.Г., Знойко О.О., Дудина К.Р., Ревазян Н.Р., Серобян А.Г., Малышев Н.А., Москалёва Т.Н., Петрова Т.В., Шутько С.А., Ющук Н.Д. Этиологическая структура заболеваний печени у беременных // Материалы VI Всероссийской научно-практической конференции «Вирусные гепатиты – проблемы эпидемиологии, диагностики, лечения и профилактики». – М. -29-31.03 2007. - С. 73-74.
- Шутько С.А., Дудина К.Р., Знойко О.О., Климова Е.А., Ильина Е.Н., Малахова М.В., Каширин В.И., Чешик Д.С., Вьючнова Е.С., Пенкина Т.В., Коршунов И.Б., Ющук Н.Д. Распространенность генотипов вируса гепатита В среди пациентов с хронической HBV-инфекцией, госпитализированных в стационары г.Москвы // Материалы XIII Российской конференции “Гепатология сегодня». – М. - 17-19.03 2008. - А156. - С.44.
- Шутько С.А., Дудина К.Р., Знойко О.О., Климова Е.А., Ющук Н.Д. Показатели уровня вирусной нагрузки HBV в сыворотке крови больных хроническим гепатитом В при динамическом обследовании // Тезисы докладов VI научно-практической конференции «Инфекционные болезни и антимикробные средства». – М. - 02-03.10. 2008. - С.65.
- Дудина К.Р. Шутько С.А. Анализ генетических факторов риска развития цирроза печени у больных с различными исходами хронической инфекции вирусами гепатита В и С // ГОУ ВПО «МГМСУ Росздрава» XXXI Итоговая конференция молодых ученых МГМСУ труды конференции. – М. -16-30.03. 2009. - С.104-105.
- Шутько С.А., Дудина К.Р. Клиническое значение определения ДНК HBV и уровня вирусной нагрузки в крови у больных с различными вариантами хронической HBV-инфекции // ГОУ ВПО «МГМСУ Росздрава» XXXI Итоговая конференция молодых ученых МГМСУ труды конференции. –М. - 16-30.03. 2009. - С. 399-400.
- Вавилова Е.В., Дудина К.Р. Клинико-лабораторная характеристика и этиологическая структура пациентов с циррозом печени, поступающих в хирургическое отделение портальной гипертензии // Материалы 57 Итоговой студенческой научной конференции ГОУ ВПО МГМСУ Росздрава. - М. - 2009. - С.75.
- Дудина К.Р., Шутько С.А., Знойко О.О., Кузина Л.Е., Ющук Н.Д. Динамическое определение концентрации HBsAg в зависимости от уровня вирусной нагрузки в крови пациентов с хронической HBV-инфекцией // Материалы Х Юбилейного съезда научного общества гастроэнтерологов России. – М. - 02 - 05.03.2010. - С.67.
- Пыпкина Е.В., Дудина К.Р. Серологический уровень HBsAg у пациентов с хронической HBV-инфекцией // Материалы 58-ой Итоговой студенческой научной конференции ГОУ ВПО МГМСУ Росздрава. – М. – 2010. - С.93-94.
- Дудина К.Р., Знойко О.О., Шутько С.А., Климова Е.А., Генерозов Э.В., Чоговадзе А.Г., Ющук Н.Д. Роль полиморфизма генов человека в развитии цирроза печени у больных хроническими вирусными гепатитами // VIII научно-практическая конференция «Инфекционные болезни и антимикробные средства». – М. -05-06.10.2010. - С.24-26.
- Знойко О.О., Дудина К.Р., Шутько С.А., Климова Е.А., Чешик Д.С., Каширин В.И. Российский пациент с хроническим гепатитом В – от клинических исследований к реальной практике // VIII научно-практическая конференция «Инфекционные болезни и антимикробные средства». - М. -05-06.10.2010 г. - С.28.
- Козина А.Н., Дудина К.Р. Клиническая значимость методов диагностики фиброза печени у пациентов с хронической HBV-инфекцией // Материалы 59-ой Итоговой студенческой научной конференции ГОУ ВПО МГМСУ Минздравсоцразвития России. – М. – 2011. - С.45 - 46.