Семенова Елена Анатольевна Цели урок
| Вид материала | Урок |
СодержаниеДополнительный вопрос Внимание вопрос! |
- Семенченко Ивана Даниловича для учащихся 5 -11 классов Автор: Гармс Елена Анатольевна,, 119.63kb.
- Елена Анатольевна Гречишникова Основные направления деятельности: антимонопольный контроль, 131.64kb.
- Константинова Елена Анатольевна урок, 268.75kb.
- Новикова Елена Анатольевна г. Дзержинск 2007 г урок, 90.94kb.
- Горбашко Елена Анатольевна, Проректор по международным образовательным программа, 152.21kb.
- Вданном проекте рассматриваются изменения, происходящие в природе в разные времена, 194.42kb.
- «Зачем нужен сотовый телефон?», 15.19kb.
- Панова Елена Александровна (изо) Парамонов Григорий Валентинович (русский язык) Семёнова, 50.79kb.
- Мамонтова Елена Анатольевна, к э. н., доцент кафедры Иип сонина Галина Васильевна., 13.24kb.
- Щербакова Ирина Анатольевна. Цели урок, 124.13kb.
Урок с использованием элементов здоровьесберегающих технологий (сохраняем осанку)
на тему:
Алюминий,
его физические и химические свойства
(9 класс)

Подготовила:
учитель химии МОУ СОШ №5
Семенова Елена Анатольевна
Цели урока:
- Конкретизировать знания учащихся о свойствах металлов 3 А группы на примере алюминия.
- Продолжить формировать умения давать характеристику элемента по его положению в периодической системе химических элементов Д.И. Менделеева, на основе строения атома объяснять физические и химические свойства металла, прогнозировать его применение.
- Продолжать формирование умений наблюдать, сравнивать, делать выводы на основе своих исследований, проводить химический эксперимент, соблюдать правила техники безопасности. Развивать познавательную деятельность учащихся.
Задачи урока:
Образовательная – выявление и оценка степени овладения системой знаний и комплексом навыков и умений об амфотерных элементах и их соединениях на примере алюминия, готовности учащихся успешно применять полученные знания на практике, позволяющих обеспечить обратную связь и оперативную корректировку учебного процесса.
Развивающая – развитие критического мышления, самостоятельности и способности к рефлексии, обеспечение системности учения, а так же развитие терминологического мышления; умения ставить и разрешать проблемы, анализировать, сравнивать, обобщать и систематизировать.
Воспитательная – воспитание положительной мотивации учения, правильной самооценки, чувства ответственности, уверенности и требовательности к себе.
Оборудование: Аl металлический (порошок), неметалл-окислитель (йод), гидроксид натрия, соляная кислота, сульфат меди (II), фарфоровая чашка, пипетка, асбестовая сетка, тренога.
Ход урока.
- Организационный момент.
- Проверка домашнего задания.
а) Задание у доски (один учащийся на доске выполняет письменное домашнее задание).
Составить генетический ряд металла Са и осуществить цепочку химических превращений.
Ca → CaO → Ca(OH)2→CaSO4
2Ca + O2 → 2CaO
CaO + H2O → Ca(OH)2
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
б) Химический кроссворд.
На интерактивной доске учитель выводит кроссворд и вместе с классом разгадывает его. После того, как учащиеся отгадали весь кроссворд, учитель выводит на экран ключевое слово. Ключевое слово – это тема сегодняшнего урока «алюминий».
-
м
е
т
а
л
л
х
л
о
р
п
л
ю
м
б
у
м
х
и
м
и
я
о
к
и
с
л
е
н
и
е
и
н
д
е
к
с
о
к
с
и
д
м
а
г
н
и
й
Вопросы:
- Элементы, атомы которых в реакциях отдают свои электроны
- Элемент с зарядом ядра +17
- Произнесите на “химическом языке” свинец
- Наука о составе, строении и свойствах элементов и их соединений.
- Процесс принятия элементов электронов, в результате которого понижается его степень окисления.
- Число, которое показывает число атомов данного элемента в формуле
- Химические соединения, которые состоят из двух химических элементов одним из которых является кислород со степенью окисления -2.
- Элемент с относительной атомной массой 24.
- Объяснение нового материала
В период открытия алюминия (19 век) - металл был дороже золота. Англичане хотели почтить богатым подарком великого русского химика Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции Наполеона.
Задаётся проблемный вопрос: «Почему сегодня алюминий называют металлом будущего?» ( Раскрываются цели и план урока).
● Строение и свойства атома алюминия.
Задание 1: Дать характеристику элемента по его положению в периодической системе, объяснить строение атома.

Al
2 8 3
1s2 2s2 2p6 3s2 3p1 3d0 - простая формула электронной конфигурации атома Al


| | ↑↓  | ↑ | | | | | | | | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | ↑↓ | ↑↓ | ↑↓ | ↑↓ | | ||||||||
| ↑↓ | | ||||||||||||
Графическая формула электронной конфигурации атома Al в обычном состоянии.
| | ↑  | ↑ | ↑ | | | | | | | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | ↑↓ | ↑↓ | ↑↓ | ↑↓ | | ||||||||
| ↑↓ | | ||||||||||||
Графическая формула электронной конфигурации атома Al в возбужденном состоянии.
Дополнительный вопрос: Укажите возможные степени окисления Al.
● Нахождение в природе
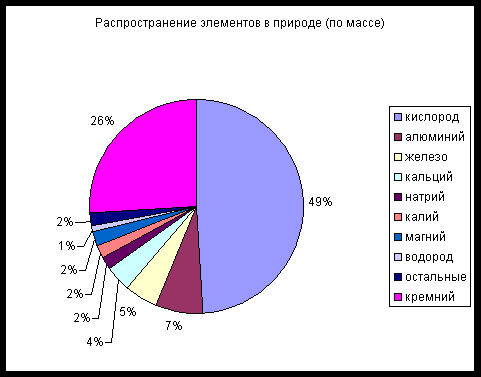
Задание 2.
Рассмотрите диаграмму «Распространение элементов в природе». Определите, какое место занимает Al среди других элементов. (7% - третье место).
● Физические свойства Al.
Показать ребятам образцы изделий из алюминия и ответить вместе с ним на вопрос: «Какими же физическими свойствами обладает алюминий?»
Вывод. Алюминий – металл серебристо- белого цвета, лёгкий (Ƿ- 2,7 г./ см.3), плавится при температуре 6600С. обладает хорошей ковкостью, пластичностью, электрической проводимостью и теплопроводностью, легко поддаётся обработке, образует лёгкие и прочные сплавы.
Физические свойства алюминия определяют области его применения.
● Применение алюминия.
Задание 3. Используя рисунок 15, стр. 60 учебника, назовите области применения алюминия.
Алюминий применяют:
- для производства различных сплавов;
- в авиа-, авто -, суда -, приборостроении, электротехнике, изготовление корпусов космических ракет, химической аппаратуры, строительстве мостов, зданий, в быту;
(алитирование);
- термит (смесь алюминия и оксидов железа) - для сварки рельсов;
- получение металлов особой чистоты (алюмотермия).
● Физ. минутка
Учитель просит учащихся отложить ручки и тетради, сесть на стул, расправив плечи, а ступни ног полностью поставить на пол. Затем необходимо положить книгу себе на голову и постараться удержать ее в течение 15 секунд. Учитель объясняет, что это упражнение и такой способ посадки позволяет избежать таких заболеваний как: кифоз, сколиоз и других, связанных с искривлением позвоночника и нарушением осанки.
● Химические свойства.
Задание 4. Определите место Al в электрохимическом ряду напряжения, сделайте вывод об его активности.
Al относится к активным металлам.
Al – сильный восстановитель, он с легкостью отдает 3 валентных электрона, проявляя при этом постоянную степень окисления +3.
Внимание вопрос! Почему в алюминиевой кастрюле можно варить суп? (ответ: алюминий покрыт тонкой, но очень прочной оксидной пленкой, какой нет у других металлов)
- Взаимодействие Al с простыми веществами (О2, I2, S ).
4Al + 3О2 → 2Al2O3 (оксид алюминия - амфотерный)
H2O
2Al + 3I2 → 2AlI3 (йодид алюминия)
Опыт 1:
В фарфоровой ступке тщательно размешаем одинаковые объемы порошка алюминия и кристаллического йода. Затем, смесь аккуратно собрать в кучку на середине дна ступки. Сделать в вершине кучки углубление. Поставить ступку под тягу! И только после этого добавить
в сделанное углубление 1 каплю воды. Произойдет сильное разогревание смеси, начнется выделение огня с брызгами горящего алюминия.
2Al + 3S → Al2S3
2Al + N2 → 2AlN
- Взаимодействие Al с соединениями других металлов?
2Al + Cr2O3 → 2Cr + Al2O3
- Взаимодействие со сложными веществами
Опыт 3:
Поместите в три пробирки алюминиевые стружки. В пробирку 1 добавьте раствор соляной кислоты, во вторую – раствор гидроксида натрия, в третью – раствор сульфата меди (II).
Объясните явления, напишите уравнения реакций в молекулярном и ионном виде.
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Al + CuSO4 → Al2(SO4)3 + Cu
● Закрепление нового материала:
Задание 5: Составить генетический ряд для алюминия:
Al→ Al2O3→ Al(ОН)3→ Al2(SО4)3
Обобщение: Алюминий восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду напряжения металлов, взаимодействует с простыми веществами – неметаллами. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий покрывается плотной оксидной пленкой.
● Обобщение.
Рассмотрев свойства алюминия, области применения металла и его сплавов, дайте ответ на главный вопрос урока: «Почему алюминий называют металлом будущего?»
Вывод: Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий нашёл большое применение в авиационном и космическом транспорте, применение во многих отраслях народного хозяйства. Особое место алюминий и его сплавы занимают в электротехнике, а за ней будущее нашей науки и техники.
● Учитель заканчивает урок четверостишием:
« Я металл, серебристый и лёгкий,
И зовусь самолётный металл,
И покрыт я оксидною плёнкой,
Чтоб меня кислород не достал».
● Оглашение оценок за урок.
● Домашнее задание: § 13 (до страницы 60), выполнить цепочку химических превращений.
