Исследование генотоксического действия импульсных электромагнитных излучений с большой пиковой мощностью 03. 00. 04 биохимия
| Вид материала | Исследование |
- Календарный план учебных занятий по дисциплине «Методы контроля состояния окружающей, 249.17kb.
- Урок по теме: "Человек в мире электромагнитных излучений", 115.86kb.
- Новые методы защиты населения крупных городов от электромагнитных полей, шума и радоновыделения, 102.38kb.
- При рассмотрении угроз утечки информации по каналам побочных электромагнитных излучений, 1307.18kb.
- Обеспечение нормативных требований к метеорологическим условиям и качеству воздуха, 637kb.
- Защита от электромагнитных излучений, 131.7kb.
- Курс предпрофильной подготовки для обучающихся 9-го класса: "Использование электромагнитных, 97.06kb.
- Учебная программа по дисциплине теория и техника антенн толмачев А. И. Врезультате, 52.61kb.
- Методические указания и описание лабораторной работы по дисциплине "Вычислительная, 151.65kb.
- В. В. Кочетков Социально-психологическая составляющая информационной войны, 53.13kb.
На правах рукописи
ГУДКОВА Ольга Юрьевна
ИССЛЕДОВАНИЕ ГЕНОТОКСИЧЕСКОГО ДЕЙСТВИЯ ИМПУЛЬСНЫХ ЭЛЕКТРОМАГНИТНЫХ ИЗЛУЧЕНИЙ С БОЛЬШОЙ ПИКОВОЙ МОЩНОСТЬЮ
03.00.04 – биохимия
автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Пущино – 2006
Работа выполнена в лаборатории регуляции в биомедицинских системах
Института биофизики клетки РАН, г. Пущино
Научные руководители:
доктор биологических наук, профессор Чемерис Николай Константинович
кандидат физико-математических наук Гапеев Андрей Брониславович
Официальные оппоненты:
доктор биологических наук Корыстов Юрий Николаевич
доктор биологических наук Пашовкин Тимофей Николаевич
Ведущая организация:
Филиал института биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, г. Пущино
Защита диссертации состоится «_____» апреля 2006 г. в ____ часов ____ мин. на заседании диссертационного совета Д 002.038.01 при Институте биофизики клетки РАН по адресу: 142290, Московская область, г. Пущино, ул. Институтская, 3.
С диссертацией можно ознакомиться в Центральной библиотеке НЦБИ РАН по адресу: 142290, Московская область, г. Пущино, ул. Институтская, 3.
Автореферат разослан «_____» марта 2006 г.

Ученый секретарь Диссертационного совета,
кандидат биологических наук Т.И. Смолихина
Общая характеристика работы
Актуальность темы.
Интерес к биологическому действию импульсных электромагнитных излучений с большой пиковой мощностью (ИЭМИ БПМ) возник сравнительно недавно вслед за созданием и распространением радиолокационных излучающих систем, генерирующих высокомощные электромагнитные импульсы (десятки и сотни кВт) с крайне короткой длительностью (десятки нс). При действии таких ЭМИ импульсная напряженность электрического поля в облучаемом биологическом объекте приближается к максимально достижимой из-за близости к величине напряженности пробоя [Albanese et al., 1994; Девятков и др., 2000]. В этих экстремальных условиях можно ожидать наличия прямого повреждающего действия ИЭМИ БПМ на ДНК клеток. Опосредованные механизмы генотоксического действия ИЭМИ БПМ могут быть обусловлены как увеличением температуры облучаемого объекта, так и термоупругим возбуждением в облучаемом объекте акустических колебаний с последующей поляризацией молекул и образованием свободных радикалов [Guy et al., 1975; Olsen & Lin, 1983], потенциальная генотоксичность которых хорошо известна.
На сегодняшний день работы, в которых было исследовано биологическое действие ИЭМИ БПМ на различные объекты, немногочисленны. Обнаружено, что облучение крыс ИЭМИ БПМ приводит к нарушению их оперантного поведения [Akyel et al., 1991], значительному снижению физической выносливости и изменению когнитивных функций [Raslear et al., 1993], что связано с нагревом тела животных. Воздействие ИЭМИ БПМ вызывает повреждение изолированного хрусталика глаз [Creighton et al., 1987] и уменьшает интервал между сокращениями препаратов сердца лягушки [Pakhomov et al., 2000]. Обнаружено уменьшение скорости роста карциномы Walker у крыс и увеличение средней продолжительности жизни животных-опухоленосителей после in vivo облучения ИЭМИ БПМ [Девятков и др., 1994]. Показано увеличение количества деградирующих опухолевых клеток и опухолевых клеток на стадии лизиса после облучения ИЭМИ БПМ in vitro [Девятков и др., 1998]. Воздействие ИЭМИ БПМ прерывает индивидуальное развитие Drosophila [Bolshakov et al., 2000, 2001a], замедляет рост грибов Fusarium sp. и подавляет скорость синтеза РНК и ДНК в опухолевых клетках мастоцитомы P-815 [Bolshakov et al., 2000, 2001b]. Показано отсутствие специфического действия ИЭМИ БПМ на проводниковую функцию нейронов гиппокампа крыс; переходное и обратимое уменьшение амплитуды спайков было вызвано исключительно увеличением температуры при облучении [Pakhomov et al., 2003]. В настоящее время существуют лишь единичные работы, посвященные исследованию генотоксических эффектов ИЭМИ БПМ на клетках человека и животных. Например, Natarajan и др. (2002) показали, что облучение моноцитов человека ИЭМИ БПМ может увеличивать активность связывания фактора NF-κВ с ДНК, что приводит к трансактивации экспрессии генов-мишеней, изменяя тем самым структуру хроматина.
В последние годы большое внимание уделяется оценке генотоксического действия непрерывных и модулированных ЭМИ радиочастотного диапазона (РЧ ЭМИ). В ряде исследований обнаружены индукция повреждений нитей ДНК, увеличение количества дицентрических хромосом, ацентрических участков и микроядер при действии РЧ ЭМИ [Maes et al., 1993; Lai & Singh, 1995; Zotti-Martelli et al., 2000; d’Ambrosio et al., 2002; Tice et al., 2002]. В то же время, в серии работ показано отсутствие каких-либо прямых мутагенных, генотоксических или канцерогенных эффектов РЧ ЭМИ [Verschaeve & Maes, 1998; Brusick, 1998; Vijayalaxmi et al., 2000; Li et al., 2001].
Из приведенных данных видно, что результаты по оценке генотоксического действия РЧ ЭМИ противоречивы, а работы по исследованию генотоксических эффектов ИЭМИ БПМ практически отсутствуют. Поэтому исследование возможности прямого повреждающего действия ИЭМИ БПМ, не обусловленного нагревом облучаемого объекта, представляет большой научный интерес. Однозначный ответ на вопрос о потенциальной генотоксичности ИЭМИ БПМ и знание механизмов действия такого излучения, как на клеточном уровне, так и на уровне организма человека и животных позволит разработать научно обоснованные санитарно-гигиенические нормативы для обслуживающего персонала и населения, попадающего в зону действия ИЭМИ.
Цель работы.
Целью настоящей работы являлось исследование потенциальной генотоксичности импульсных ЭМИ сверхвысоких (СВЧ) и крайне высоких (КВЧ) частот с большой пиковой мощностью (ИЭМИ КВЧ БПМ и ИЭМИ СВЧ БПМ).
Задачи исследования.
1. Исследование прямого повреждающего действия ИЭМИ СВЧ БПМ и ИЭМИ КВЧ БПМ на ДНК различных типов клеток (эритроцитах лягушки, лейкоцитах и лимфоцитах крови человека и лейкоцитах крови мыши) in vitro.
2. Оценка возможности повреждения ДНК активными формами кислорода (АФК), образующимися под действием ИЭМИ КВЧ БПМ.
а) Определение продукции АФК в водных растворах под действием ИЭМИ КВЧ БПМ.
б) Исследование механизмов образования АФК в водных растворах при облучении ИЭМИ КВЧ БПМ.
Научная новизна работы.
Впервые исследовано прямое генотоксическое действие ИЭМИ БПМ на клетках различных биологических объектов. Показано отсутствие индукции повреждений ДНК под действием ИЭМИ для гомойотермных видов (мышь, человек) и увеличение поврежденности ДНК при действии ИЭМИ на клетки животных пойкилотермного вида (лягушка), обусловленное увеличением температуры суспензии облучаемых клеток. В результате модификации метода "комета-тест" была существенно увеличена его чувствительность. Показана возможность применения комета-теста в мониторинговых исследованиях с использованием популяций земноводных на примере эритроцитов лягушки Xenopus laevis.
Установлено, что облучение водных растворов ИЭМИ КВЧ БПМ приводит к образованию в них Н2О2, которая потенциально может вызывать повреждения ДНК в различных клетках. Исследование механизмов образования Н2О2 при облучении показало, что образование Н2О2 в облучаемом ИЭМИ КВЧ БПМ растворе происходит в результате суммарного влияния тепла и возбуждаемых ИЭМИ КВЧ БПМ термоакустических колебаний.
Научно-практическое значение.
Полученные результаты свидетельствуют о том, что ИЭМИ с параметрами, характерными для современных радиолокационных станций, не обладает прямым генотоксическим действием, что может быть использовано при научном обосновании безопасных санитарно-гигиенических нормативов для обслуживающего персонала и населения, попадающего в зону действия такого излучения.
Апробация работы.
Результаты работы были представлены на Пущинских конференциях молодых ученых (Пущино, 2003 – 2005), на международной конференции «Высокоинтенсивные физические факторы в биологии, медицине, сельском хозяйстве и экологии» (Саров, 2004), международных научно-технических конференциях «Медэлектроника. Средства медицинской электроники и новые медицинские технологии» (Минск, 2003 и 2004); в материалах 3-го международного симпозиума по нетепловому воздействию электромагнитных полей и ионизированных газов «Электромед-2003» (Сан Антонио, Техас, 2003), 25-го ежегодного заседания BEMS (Гавайи, 2003).
Публикации.
По результатам работы опубликовано 3 статьи в рецензируемых отечественных и зарубежных журналах, 5 статей в сборниках, а также 6 тезисов докладов.
Структура и объем диссертации.
Диссертационная работа состоит из разделов ″Введение″, ″Обзор литературы″, ″Материалы и методы исследования″, ″Результаты и обсуждение″, ″Заключение″, ″Выводы″, ″Список литературы″. Диссертация изложена на _____ страницах машинописного текста, содержит _____ рисунков, _____ таблиц и список литературы из ______ ссылок.
Список принятых сокращений. ИЭМИ БПМ – импульсное электромагнитное излучение с большой пиковой мощностью, РЧ ЭМИ – ЭМИ радиочастотного диапазона, СВЧ – сверхвысокие частоты, КВЧ – крайне высокие частоты, УПМ – удельная поглощенная мощность, ППМ – плотность потока мощности, ФБ-ЭДТА - фосфатно-солевой буфер с 1 мМ ЭДТА (этилендиаминтетраацетат динатриевая соль), АФК – активные формы кислорода, ЭМС – этилметансульфонат, %ДНК – процентное содержание ДНК.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальный материал.
В работе использовались самцы Южно-африканской гладкой шпорцевой лягушки Xenopus laevis, которые содержались в водопроводной дехлорированной воде при 20-23оС. Цельную кровь лягушек, полученную путем декапитации животных, разводили фосфатно-солевым буфером (в мМ: 136.7 NaCl, 2.7 KCl, 8.1 Na2HPO4, 1.5 KH2PO4; pH=7.0) с 1 мМ ЭДТА (ФБ-ЭДТА) до концентрации эритроцитов 1106 клеток/мл.
Свежую донорскую кровь закупали на станции переливания крови. Донорами служили здоровые мужчины в возрасте от 25 до 30 лет. В качестве антикоагулянта использовался цитрат натрия. Кровь разводили в 7 раз в ФБ-ЭДТА, чтобы конечная концентрация лейкоцитов составляла 1.0-1.5106 клеток/мл.
Лимфоциты периферической крови человека получали центрифугированием 1 мл разведенной цитратной крови в градиенте фиколл-верографин по [Хейфец и Абалакин, 1973]. Полученную суспензию разводили в ФБ-ЭДТА до концентрации лимфоцитов 1.5106 клеток/мл.
В работе использовались самцы мышей аутбредного стока NMRI. Цельную кровь получали путем декапитации животных. Далее лейкоциты отмывали и разводили в ФБ-ЭДТА до концентрации 1106 клеток/мл.
Импульсное ЭМИ СВЧ БПМ.
Для облучения образцов крови человека, суспензий лимфоцитов крови человека и эритроцитов лягушки использовали экспериментальный стенд "РОДОН" на основе импульсного магнетрона типа МИ-522 (8.8 ГГц, длительность импульса 180 нс, импульсная мощность 65±5 кВт, частота следования импульсов 50 Гц, средняя мощность 400±10 мВт). Суспензию клеток облучали в течение 40 мин в специальных пластиковых кюветах цилиндрической формы диаметром 10 мм и высотой 1 мм, помещаемых внутрь волновода сечением 23×3.4 мм2 на расстоянии 25-30 мм от фланца волновода. При средней падающей мощности 400 мВт и объеме образца 50 мкл средняя скорость роста температуры в кювете составляла около 0.37±0.01оС/с, соответствующая средняя удельная поглощенная мощность (УПМ) - 1.6 кВт/кг, величина стационарного перегрева в среднем составила около 3.5±0.1оС.
Суспензию эритроцитов лягушки, приготовленную для облучения, делили на три части: 1) отрицательный контроль (образец помещался в неподключенный к установке отрезок волновода при стационарной температуре 25±1оC); 2) имитация воздействия (образец помещался в неподключенный к установке отрезок волновода при температуре 29±1оC, имитация повышения температуры при облучении); 3) облучение. В начале облучения ИЭМИ СВЧ температура клеточной суспензии была 25±1oС. Затем за 10-15 с температура увеличивалась до стационарного уровня 29±1oС, который поддерживался до окончания экспозиции в течение 40 мин. Непосредственно после указанных воздействий (1 – 3) аликвоты по 40 мкл от каждой части суспензии использовали для приготовления препаратов для микроскопии.
Суспензию лимфоцитов, выделенных из крови доноров, делили на несколько частей: 1) отрицательный контроль (образец помещался в неподключенный к установке отрезок волновода при стационарной температуре 23±1оC); 2) имитация воздействия (образец помещался в неподключенный к установке отрезок волновода при температуре 27±1оC, имитация повышения температуры при облучении); 3) облучение; 4) второй отрицательный контроль (образец инкубировали при температуре 37±0.5оC); 5) положительный контроль (клетки инкубировали при 37±0.5оC в присутствии этилметансульфоната (ЭМС, 5 мМ), рекомендованного препарата для проведения положительных контролей для оценки чувствительности "комета-теста" [Hartmann et al., 2003]). Непосредственно после указанных воздействий аликвоты по 30 мкл от каждой части суспензии разводили в соотношении 1:1 в ФБ-ЭДТА и использовали для приготовления препаратов для микроскопии.
В отдельной серии экспериментов по окончании облучения аликвоты по 30 мкл отбирались от каждой части суспензии, к ним добавляли равный объем ФБ-ЭДТА (предварительно прогретого при 37оС), помещали на 30 мин в инкубатор при 37±0.5оС и затем готовили препараты для микроскопии.
Импульсное ЭМИ КВЧ БПМ.
Для облучения образцов крови мыши использовали генератор на основе импульсного магнетрона (37 ГГц, длительность импульса 60 нс, импульсная мощность 20 кВт, частота следования импульсов 50 Гц, интенсивность 0.24 Вт/см2). Расчетная средняя УПМ составила 4 кВт/кг. Суспензию клеток (по 200 мкл) в течение 20 мин облучали в специальных пластиковых кюветах цилиндрической формы диаметром 10 мм и высотой 5 мм, помещаемых на открытый конец волновода сечением 7.23.4 мм2. Облучение проводили при различных температурных условиях: 0; +4; +25оС. Контрольные препараты содержали в аналогичных условиях, но не облучали.
Облучение образцов ионизирующим излучением.
Облучение препаратов (слайдов) с эритроцитами лягушки проводили на ГУБЭ (Гамма установка биологическая экспериментальная, источник γ-радиации 60Со) в дозах 50, 100 и 200 сГр (мощность дозы 40 сГр/мин).
Готовые препараты с лейкоцитами цельной крови или изолированными лимфоцитами крови человека облучали на РУТ-15 (Рентгеновская установка терапевтическая 15, рентгеновские лучи) в дозах 1.5, 2.74 и 5.48 Гр (мощность дозы 1.17 Гр/мин). Препараты с лейкоцитами цельной крови мыши облучали на РУТ-15 в дозе 4 Гр (мощность дозы 1 Гр/мин, фокусное расстояние 37 см).
Во всех случаях облучение проводили на льду, чтобы исключить влияние ферментов репарации.
Обработка образцов алкилирующим агентом.
Образцы крови обрабатывали алкилирующим агентом ЭМС в концентрации 5 мМ в течение 40 мин при 20±1оС (лягушка) или в концентрации 1-10 мМ в течение 20 мин при 37±0.5оC (человек).
Инкубация при различных температурах.
Учитывая увеличение температуры при облучении образцов ИЭМИ БПМ, в отдельной серии экспериментов исследовали влияние различных температурных условий на индукцию повреждений ДНК в клетках. Аликвоты суспензии эритроцитов лягушки инкубировали в течение 40 мин при температурах 20, 25 и 30оС. Образцы крови человека или суспензии лимфоцитов инкубировали в течение 40 мин при 23, 27, 33 и 37оС. Затем из каждой части суспензии готовили по 3 препарата для "комета-теста".
Щелочной вариант комета-теста.
Для оценки повреждений ДНК в клетках использовали щелочной вариант комета-теста с некоторыми модификациями. Метод основан на анализе картины электрофореза индивидуальных клеток, ДНК которых окрашена флуоресцентным красителем. Свое название метод получил из-за визуального сходства получаемых электрофореграмм с кометами: имеется яркая флуоресцирующая "голова кометы" и "хвост", образующийся в результате миграции поврежденных или расплетенных участков ДНК после электрофореза в геле агарозы. Для анализа готовили 3-х слойные препараты. Слой легкоплавкой агарозы с клетками помешали между двумя слоями 0.5% легкоплавкой агарозы. Затем препараты помещали в лизирующий раствор (2.5 М NaCl, 10 мМ Tris-HCl, 1% Triton X-100 (для образцов из крови человека и мыши дополнительно добавляли 1% N-lauryl-sarcosine), 100 мМ ЭДТА; pH=10.0) на 25 мин при 22оС (эритроциты лягушки) или при 37оС (образцы крови человека и мыши) в темноте. Далее препараты выдерживали в щелочном растворе (0.3 М NaOH, 1 мМ ЭДТА; pH>13.0) в течение 20 мин при 4оС в темноте. Электрофорез проводили при 4оС в течение 20 мин при напряженности электрического поля 3.2 В/см (эритроциты лягушки), 2.4 В/см (образцы крови человека) или 3.1 В/см (образцы крови мыши). Препараты окрашивали бромистым этидием (1 мкг/мл в ФБ) в течение 1 ч при 20-22оС в темноте. Все процедуры проводили при искусственном освещении с использованием ламп накаливания во избежание возникновения дополнительных повреждений ДНК в клетках [Speit et al., 1999].
Анализ препаратов.
Препараты исследовали под модифицированным световым микроскопом "Biolam" (LOMO, Россия) с люминесцентной насадкой. Для возбуждения флуоресценции использовали суперяркий светодиод с максимумом эмиссии 505 нм. Для захвата изображений нуклеоидов использовалась цифровая телекамера LCL-902HS высокой чувствительности (0.001 Lux) и разрешения 768494 pixels. Для регистрации и анализа изображений нуклеоидов использовали программное обеспечение, разработанное в лаборатории Регуляции в биомедицинских системах ИБК РАН. Все эксперименты проводились в соответствии с протоколами "слепого" контроля, с применением рандомизации при выборе биологических образцов для анализа. Уровень повреждений ДНК в клетках оценивали по процентному содержанию ДНК в хвосте кометы. В каждом независимом эксперименте для каждого образца (отрицательный и положительный контроли, температурное воздействие, облучение ИЭМИ, обработка ЭМС) фотометрировали 3-5 препаратов. На каждом слайде регистрировали и обрабатывали по 25 изображений комет. Затем для каждого образца по 75 изображениям рассчитывался средний процент ДНК в хвосте кометы. Средние значения и стандартные ошибки среднего для каждой серии экспериментов вычислялись по результатам повторных, независимых экспериментов (n>5). Статистический анализ данных проводили по непараметрическому критерию Манна-Уитней (p<0.05).
Облучение водного раствора ИЭМИ КВЧ БПМ.
Образцы (2 мл) 1 мМ фосфатного буфера (бидистиллированная вода (4 мкСи); Na2HPO4 • 7H2O; NaH2PO4 • H2O; рН 6.8) облучали в чашках Петри в течение 2.5, 5 и 10 мин с использованием пирамидальной рупорной антенны с апертурой 3427 мм при длительностях импульсов ИЭМИ КВЧ БПМ 100, 200, 400 или 800 нс и частотах следования импульсов 500 или 1000 Гц. Толщина слоя облучаемого образца составляла около 2 мм. При длительности импульса ИЭМИ КВЧ 400 нс и частоте следования импульсов 500 Гц средняя плотность потока мощности (ППМ) на выходе излучателя, согласно расчетам, составляла около 0.4 Вт/см2. Облучение образцов проводили в нескольких вариантах (Рис.1): а) в чашках Петри непосредственно на излучающем торце антенны; б) в бакпечатках через 15-мм слой желатина и силиконовую прокладку толщиной 5 мм на пленке "Парафилм" с обеспечением надежного акустического контакта с помощью геля для УЗИ; в) в бакпечатках через 15-мм слой желатина на пленке "Парафилм" с воздушной прослойкой между желатином и образцом (без акустического контакта между образцом и желатином). Имитацию воздействия проводили по схеме, представленной на Рис.1г, экранируя чашку Петри с образцом от воздействия ИЭМИ КВЧ 15-мм слоем дистиллированной воды, помещенной в пластиковую чашку Петри диаметром 65 мм. Контрольные образцы не подвергались облучению и содержались в чашках Петри при комнатной температуре (21±1оС) в течение соответствующего времени облучения. Для определения кинетики изменения температуры фосфатного буфера при облучении проводили измерения температуры буфера через каждые 15 с в течение 10 мин воздействия ИЭМИ КВЧ БПМ (400 нс, 500 Гц или 200 нс, 1000 Гц) с помощью стеклянного микротермистора с точностью ±0.05оС.
Р
 ис.1. Схемы облучения образцов ИЭМИ КВЧ БПМ и имитации воздействия.
ис.1. Схемы облучения образцов ИЭМИ КВЧ БПМ и имитации воздействия.1 – пирамидальная рупорная антенна; 2 – образец в чашке Петри диаметром 35 мм; 3 – слой 20% желатина толщиной 15 мм в бакпечатке; 4 – силиконовая прокладка толщиной 5 мм; 5 – образец на пленке "Парафилм"; 6 – чашка Петри диаметром 65 мм с водой.
Термостатирование.
Учитывая увеличение температуры буфера при облучении ИЭМИ КВЧ БПМ, в отдельной серии экспериментов исследовали влияние тепла на образование АФК (в эквиваленте [Н2О2]). Для этого образцы (2 мл) фосфатного буфера в чашках Петри диаметром 35 мм содержали в термостате при 49.00.5оС (имитация нагрева буфера при облучении) в течение 5–25 мин. Для определения кинетики изменения температуры фос-фатного буфера при термостатировании при 49.0±0.5оС проводили измерения температу-ры в образцах каждые 0.5–1 мин в течение 1 ч с помощью стеклянного микротермистора.
Насыщение фосфатного буфера азотом проводили путем 30-мин барбатирования при комнатной температуре под воздухонепроницаемым куполом в соответствии с методикой [Bruskov et al., 2002]. Концентрация кислорода в растворах измерялась с помощью электрода Кларка.
Оценку количества образовавшихся АФК проводили в эквиваленте [Н2О2], поскольку известно, что перекись водорода является конечным продуктом восстановления кислорода и характеризуется длительным по сравнению с другими формами АФК периодом полураспада (около 4 ч). Для количественного определения Н2О2 использовали высокочувствительный метод усиленной хемилюминесценции в системе люминол–парайодфенол-пероксидаза, регистрацию проводили на жидкостном сцинтилляционном счетчике Бета-1 [Bruskov et al., 2002]. Непосредственно перед измерением в каждый образец вносили 150 мкл "счетного раствора" (0.5 М Трис-HСl буфер, рН 8.5, 10 мкМ 4-йодфенола, 10 мкМ люминола и пероксидаза). В каждом эксперименте проводили измерения [Н2О2] в трех образцах с последующим расчетом средней концентрации и величины стандартной ошибки. Процедура калибровки счетчика в диапазоне наномолярных концентраций перекиси водорода проводилась по [Bruskov et al., 2002].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Глава 1. Исследование прямого повреждающего действия ИЭМИ СВЧ БПМ и ИЭМИ КВЧ БПМ на ДНК различных типов клеток in vitro.
1.1. Исследование прямого повреждающего действия ИЭМИ СВЧ БПМ на ДНК эритроцитов лягушки.
В литературе отсутствуют данные, полученные методом "комета-тест" на эритроцитах X. laevis при оценке повреждающего действия различных генотоксических факторов. Поэтому, чтобы показать адекватность наших экспериментальных условий при обнаружении известных генотоксических агентов, в отдельной серии экспериментов на эритроцитах X. laevis мы оценили генотоксическое действие различных доз ионизирующего излучения (0, 50, 100 и 200 сГр, -излучение) и алкилирующего агента ЭМС (5 мМ). Мы показали, что после облучения эритроцитов лягушки в дозе 50 сГр уровень повреждения ДНК увеличивается более чем в 3 раза по сравнению с уровнем повреждения ДНК в соответствующем контроле (p<0.05). Дозы 100 и 200 сГр вызывали еще больший уровень повреждений ДНК в клетках, который линейно возрастал с увеличением дозы (Рис.2). После 40-мин инкубации эритроцитов при 20оС в присутствии ЭМС содержание ДНК в хвосте кометы увеличилось почти в 4 раза (p<0.05) от 1.2±0.2% при 0 мМ ЭМС до 4.6±0.9% при 5 мМ ЭМС (Рис.2). Таким образом, мы показали, что "комета-тест" в наших экспериментальных условиях позволяет регистрировать достоверное увеличение уровня повреждений ДНК в эритроцитах лягушки после облучения -излучением и обработки ЭМС in vitro в концентрации 5 мМ.
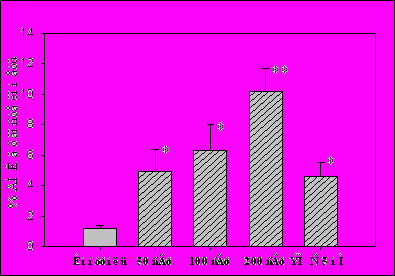
Рис.2. Процентное содержание ДНК в хвосте кометы в эритроцитах лягушки после действия различных доз -излучения и обработки ЭМС (5 мМ). * - p<0.05, ** - p<0.01, n=8.
При облучении эритроцитов лягушки ИЭМИ СВЧ температура внутри волновода составляла 291oC. Следует отметить, что нормальная физиологическая температура для лягушек Xenopus laevis близка к 201oC. Согласно существующим данным, нагрев индуцирует образование в растворах АФК, которые, взаимодействуя с ДНК, могут приводить к образованию 8-оксогуанина, биомаркера повреждений ДНК, разрывам цепей ДНК, гидролизу гликозильных связей и дезаминированию цитозина [Bruskov et al., 2002; Lindahl, 1993]. Поэтому в отдельной серии экспериментов мы исследовали влияние различных температур (20, 25 и 30oC; 40 мин) инкубации клеточной суспензии на целостность ДНК в эритроцитах лягушки. Результаты показали увеличение повреждений ДНК в эритроцитах с увеличением температуры инкубации (Рис.3). Повреждения ДНК, вызванные инкубацией клеток в течение 40 мин при 30oC, были достоверно выше по сравнению с инкубацией при 20oC (p<0.003) и 25oC (p<0.02).
С учетом этих данных, имитацию облучения мы проводили при температуре 291oC. Затем мы сопоставляли данные по инкубации клеток при 30oC, имитации и облучению ИЭМИ СВЧ (Рис.3).
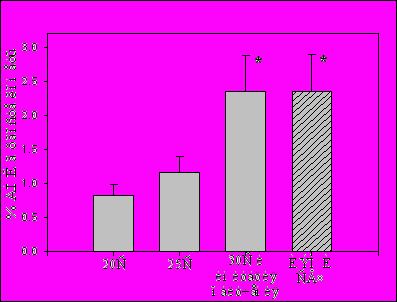
Рис.3. Процентное содержание ДНК в хвосте кометы после температурного воздействия, имитации облучения и ИЭМИ СВЧ облучения эритроцитов лягушки в течении 40 мин. * - р<0.05, n=15.
Из Рис.3 видно, что имитация облучения и облучение эритроцитов ИЭМИ СВЧ вызывают одинаковый уровень повреждений ДНК (P>0.99). В тоже время уровень повреждения ДНК при имитации облучения и облучении ИЭМИ СВЧ достоверно выше уровня повреждения ДНК после инкубации клеток при температурах 25оС (p<0.05) и 20oC (p<0.02).
Таким образом, полученные нами результаты позволяют заключить, что ИЭМИ СВЧ при выбранном режиме воздействия не оказывает прямых генотоксических эффектов на ДНК эритроцитов лягушки in vitro. Увеличение поврежденности ДНК в клетках при действии ИЭМИ СВЧ, представленное на Рис.3, обусловлено увеличением температуры суспензии облучаемых клеток на 3.5±0.1oC, что подтверждено в экспериментах по имитации облучения и в экспериментах с инкубацией клеток в течение 40 мин в соответствующих температурных условиях [Chemeris et al., 2004]. В условиях такого повышения температуры увеличение уровня повреждения ДНК может быть связано с ростом скорости депуринизации / депиримидинизации ДНК в физиологических условиях.
1.2. Исследование прямого повреждающего действия ИЭМИ СВЧ БПМ на ДНК лейкоцитов и лимфоцитов крови человека.
Учитывая тот факт, что при облучении клеточной суспензии ИЭМИ СВЧ происходит ее нагрев на 3.5±0.1оС, мы исследовали влияние различных температур инкубации на возникновение повреждений ДНК в лейкоцитах цельной крови и изолированных лимфоцитах крови человека. Было обнаружено, что инкубация клеток в течение 40 мин при температурах 23, 27, 33 и 37оС не влияет на уровень поврежденности ДНК в исследованных клетках. Облучение клеток ИЭМИ СВЧ в течение 40 мин также не вызывало дополнительных повреждений ДНК по сравнению с отрицательным и имитационным контролями (Табл.1).
Таблица 1. Процентное содержание ДНК в хвосте кометы в лейкоцитах и изолированных лимфоцитах крови человека после 40-мин инкубации при различных температурах, облучения ИЭМИ СВЧ, обработки ЭМС и действия ионизирующего излучения и в лейкоцитах цельной крови человека, инкубированных при различных температурах, облученных ИЭМИ СВЧ или обработанных ЭМС в течение 40 мин и затем дополнительно инкубированных в течение 30 мин при 37оС. * - р<0.01.
| Условия воздействия | Лейкоциты цельной крови (n=18) | Изолированные лимфоциты (n=10) | Лейкоциты цельной крови (с дополнительной инкубацией) (n=8) |
| 23oC | 1.20 0.20 | 0.47 0.06 | 0.94 0.15 |
| Облучение ИЭМИ СВЧ | 1.26 0.26 | 0.38 0.05 | 0.84 0.10 |
| 27oC | 1.30 0.14 | 0.45 0.05 | 0.91 0.16 |
| 37oC | 1.24 0.18 | 0.43 0.09 | 0.88 0.15 |
| ЭМС 5 мМ | 6.8 0.4* | 5.5 0.6* | 16.0 1.0* |
| 2.74 Гр | 3.7 0.5* | 6.2 1.0* | - |
После облучения лейкоцитов цельной крови ИЭМИ СВЧ процентное содержание ДНК в хвосте кометы составило 1.26±0.26%, что достоверно не отличалось от процентного содержания ДНК в хвосте кометы после инкубации клеток при различных температурах (P>0.86). После облучения изолированных лимфоцитов ИЭМИ СВЧ процентное содержание ДНК в хвосте кометы составило 0.38±0.05%, что также достоверно не отличалось от процентного содержания ДНК в хвосте кометы после инкубации клеток при различных температурах (P>0.31). Напротив, инкубация клеток в течение 40 мин при 37оС в присутствии ЭМС (первый положительный контроль) в концентрации 5 мМ приводила к существенному достоверному увеличению уровня поврежденности ДНК, который более чем в 5 раз превышал уровень поврежденности в соответствующем контроле. Ионизирующее излучение (второй положительный контроль) в дозе 2.74 Гр также приводило к достоверному увеличению уровня повреждений ДНК в клетках (Табл.1).
Ранее было показано, что дополнительная инкубация лимфоидных клеток при 37оС после окончания воздействия электромагнитного излучения позволяла выявить физиологические изменения структуры хроматина, возникающие в результате работы ферментных систем [Гапеев и др., 2003]. Поэтому в специальной серии экспериментов лейкоциты цельной крови после 40-мин облучения ИЭМИ СВЧ дополнительно инкубировали в течение 30 мин при 37оС. Было обнаружено, что дополнительная инкубация лейкоцитов в течение 30 мин при 37оС приводит к снижению уровня повреждений ДНК, однако достоверных различий в содержании ДНК в хвосте кометы в лейкоцитах, инкубированных при различных температурах и облученных ИЭМИ СВЧ, не наблюдается (Табл.1). Процентное содержание ДНК в хвосте кометы уменьшается с 1.26±0.26% (без дополнительной инкубации) до 0.84±0.10% (с дополнительной инкубацией), но недостоверно (P>0.3). В то время как ЭМС в концентрации 5 мМ вызывает существенное увеличение поврежденности ДНК в лейкоцитах, которая возрастает при дополнительной инкубации более чем в 2 раза (Табл.1). Таким образом, дополнительная инкубация образцов крови в течение 30 мин при 37оС после окончания облучения не приводила к проявлению повреждающего действия ИЭМИ СВЧ.
Полученные нами результаты позволяют заключить, что ИЭМИ СВЧ при выбранном режиме воздействия не оказывает прямого генотоксического действия на ДНК нативных лейкоцитов цельной крови и изолированных лимфоцитов крови человека [Chemeris et al., 2006]. Это может быть обусловлено либо отсутствием прямого повреждающего действия ИЭМИ СВЧ, либо высокой эффективностью репарационных систем, которые успевают отрепарировать возможно возникающие при действии ИЭМИ БПМ повреждения ДНК.
1.3. Исследование прямого повреждающего действия ИЭМИ КВЧ БПМ на ДНК лейкоцитов цельной крови мыши.
Возможное повреждающее действие ИЭМИ КВЧ БПМ было исследовано методом комета-тест на лейкоцитах крови мыши in vitro. Исследование проводили при различных температурах: 0оС – облучение на льду, чтобы исключить возможность влияния ферментов репарации, +4оС и +23оС (точность поддержания температуры ±1оС). Показано, что с повышением температуры при облучении лейкоцитов мыши ИЭМИ КВЧ с 0 до 23оС достоверно увеличивается уровень повреждений ДНК в контрольных образцах с 0.85±0.07 до 1.61±0.23 % (p<0.05). Облучение лейкоцитов крови мыши ИЭМИ КВЧ не вызывает возникновения дополнительных повреждений в облученных клетках по сравнению с контролем (Рис.4). Напротив, облучение крови мыши γ-излучением в дозе 4 Гр приводит к существенному достоверному увеличению уровня повреждений ДНК, который в 10 раз превышает уровень повреждений ДНК в соответствующем контроле.
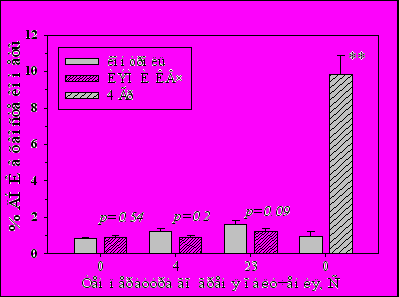
Рис.4. Изменение процентного содержания ДНК в хвосте кометы в лейкоцитах цельной крови мыши после действия -излучения и 20-мин облучения ИЭМИ КВЧ при различных температурах. ** - p<0.01, n=5.
Полученные нами результаты позволяют заключить, что ИЭМИ КВЧ БПМ при выбранном режиме воздействия (37 ГГц, длительность импульса 60 нс, импульсная мощность 20 кВт, частота следования импульсов 50 Гц, средняя мощность 60 мВт) не оказывает прямого генотоксического действия на ДНК нативных лейкоцитов цельной крови мыши [Гудкова и др., 2004]. Можно было предположить, что ИЭМИ КВЧ способно оказывать не прямое, а опосредованное генотоксическое действие, например, при участии АФК, которые, как известно, могут индуцировать повреждения ДНК напрямую и/или в результате влияния на активность ферментных систем [McName et al., 2000; Petersen et al., 2000; Тронов и Константинов, 2000]. В связи с этим особый интерес представляет исследование механизмов действия ИЭМИ БПМ, опосредованных свободно-радикальными процессами.
Глава 2. Оценка возможности повреждения ДНК активными формами кислорода, образующимися под действием ИЭМИ КВЧ БПМ.
2.1. Определение продукции АФК в водных растворах под действием ИЭМИ КВЧ БПМ.
Методом усиленной хемилюминесценции мы обнаружили, что облучение 1 мМ фосфатного буфера ИЭМИ КВЧ БПМ (37 ГГц, 20 кВт, 400 нс, 500 Гц) приводит к образованию в нем Н2О2, количество которой линейно зависит от времени экспозиции (Рис.5). Необходимо отметить, что скорость образования Н2О2 при фиксированных параметрах ИЭМИ КВЧ (400 нс, 500 Гц) сохраняется постоянной 0.7±0.2 нМ/мин.
Р
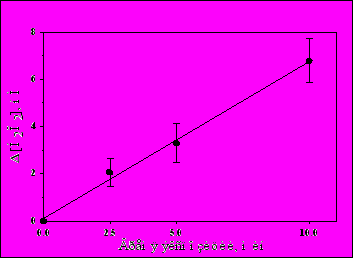 ис.5. Зависимость образования Н2О2 от времени экспозиции ИЭМИ КВЧ БПМ (400 нс, 500 Гц).
ис.5. Зависимость образования Н2О2 от времени экспозиции ИЭМИ КВЧ БПМ (400 нс, 500 Гц).Исследование образования Н2О2 при различных параметрах ИЭМИ КВЧ БПМ показало сложный характер зависимости, демонстрирующий отсутствие образования перекиси водорода при длительностях импульсов 100 и 200 нс и увеличение скорости образования Н2О2 с увеличением ППМ излучения (Рис.6). Это прямо показано в экспериментах, проведенных при равной энергетической нагрузке (0.4 Вт/см2) с 5 мин экспозицией: при длительности импульсов 400 нс и частоте следования импульсов 500 Гц образовалось 3.3±0.8 нМ Н2О2, а при 200 нс и 1000 Гц – -0.3±1.0 нМ.
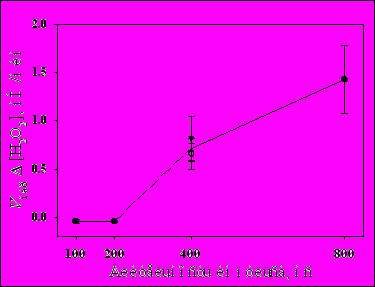
Рис.6. Зависимость скорости образования [H2O2] при облучении ИЭМИ КВЧ БПМ от длительности импульсов при фиксированной частоте следования импульсов 500 Гц.
Факт отсутствия образования Н2О2 при коротких длительностях импульсов ИЭМИ КВЧ БПМ заслуживает отдельного особого внимания и дополнительных исследований с использованием генераторов ИЭМИ КВЧ БПМ, способных обеспечить плавное изменение длительности импульсов и достаточно большое время экспозиции образцов.
2.2. Исследование механизмов образования АФК в водных растворах при облучении ИЭМИ КВЧ БПМ
В результате определения кинетики нагрева фосфатного буфера при облучении ИЭМИ КВЧ БПМ с одинаковой ППМ излучения (0.4 Вт/см2 при 400 нс и 500 Гц или 200 нс и 1000 Гц) были получены близкие значения параметров кинетических кривых. Усредненные данные представлены на Рис.7а(1). Кинетика температуры буфера при облучении ИЭМИ КВЧ хорошо аппроксимируется экспоненциальной зависимостью с постоянной времени 3.24±0.03 мин, а уровень нагрева буфера через 10 мин облучения составляет 46.7±0.2оС.
Для исследования роли тепла в образовании АФК под действием ИЭМИ КВЧ БПМ мы создавали аналогичные условия нагрева образцов, помещая их в твердотельный термостат при температуре 49.0±0.5оС. В таких условиях кинетика нагрева буфера также хорошо аппроксимируется экспоненциальной зависимостью с постоянной времени 4.46±0.04 мин и за 10 мин образец нагревается до 46.1±0.2оС, что сравнимо с уровнем нагрева за 10 мин облучения ИЭМИ КВЧ (Рис.7а(2)). В результате определения количества образовавшейся перекиси в течение 25 мин нагрева образцов в термостате была получена характерная зависимость образования H2O2 от времени нагрева (Рис.7б). Измерения показали, что за 10 мин нагрева буфера в термостате при уровне нагрева, сравнимом с таковым при облучении образцов ИЭМИ КВЧ, в растворе образуется 0.8±0.1 нМ перекиси водорода.
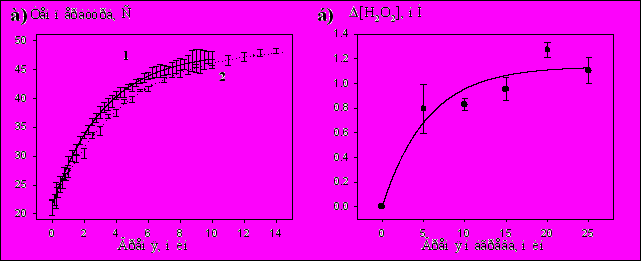
Рис.7. а) Кинетика нагрева фосфатного буфера при (1) облучении ИЭМИ КВЧ БПМ (400 нс и 500 Гц или 200 нс и 1000 Гц) и (2) термостатировании при Т=49.0±0.5оС;
б) Зависимость образования Н2О2 от времени нагрева образцов фосфатного буфера в термостате при 49.0±0.5оС.
Таким образом, нагрев, сопровождающий воздействие ИЭМИ КВЧ БПМ, вносит незначительный вклад в образование Н2О2 в процессе облучения (0.8±0.1 нМ по сравнению с 6.8±0.9 нМ). Следовательно, в образовании Н2О2 в растворе при облучении ИЭМИ КВЧ БПМ принимают участие дополнительные механизмы.
Для проверки предположения об образовании Н2О2 под действием акустических колебаний, возбуждаемых в растворе ИЭМИ КВЧ БПМ [Андреев и др., 2001], мы провели специальную серию экспериментов при облучении буфера через слой 20% желатина, плотно прилегающий к фосфатному буферу. ИЭМИ КВЧ БПМ не проникает через слой желатина толщиной 15 мм, но в результате быстрого нагрева нижнего пограничного слоя желатина, т.е. кратковременного термоупругого расширения и затем сжатия, возбуждает в нем акустические импульсы, распространяющиеся через желатин и дальше в буфер. Слой желатина с силиконовой прокладкой препятствуют также распространению тепла, появляющегося в результате поглощения ИЭМИ КВЧ в желатине, в образец фосфатного буфера. Если между слоями желатина и буфера нет акустического контакта (воздушная прослойка), то возбуждаемые ИЭМИ КВЧ акустические колебания не проникают в буфер и затухают в слое желатина. Результаты измерений образования Н2О2, полученные в этих экспериментах, представлены в Табл. 2.
Таблица 2. Образование Н2О2 при различных условиях воздействия в течение 10 мин.
| Условия воздействия | [Н2О2], нМ |
| Контроль | 0.0±0.5 |
| Имитация облучения (экранирование образцов от ИЭМИ КВЧ) | 0.1±0.1 |
| Облучение ИЭМИ КВЧ БПМ (400 нс, 500 Гц) | 6.8±0.9 |
| Облучение через слой желатина | 5.1±0.8 |
| Облучение через слой желатина без акустического контакта | -0.6±0.4 |
| Термостатирование при 49.0±0.5оС (имитация нагрева при облучении) | 0.8±0.1 |
| Облучение в герметичных условиях | 6.8±0.1 |
| Облучение после дополнительного насыщения азотом | 4.0±0.3 |
| Облучение в присутствии 1 мМ гуанозина | 3.1±0.4 |
Облучение через слой желатина приводит к образованию в буфере Н2О2 только при наличии надежного акустического контакта между облучаемым желатином и буфером. Таким образом, можно заключить, что образование Н2О2 в облучаемом ИЭМИ КВЧ БПМ растворе происходит в результате суммарного влияния тепла и возбуждаемых ИЭМИ КВЧ БПМ термоакустических колебаний.
Считается, что образование Н2О2 в водных растворах может являться результатом активации растворенного в воде атмосферного кислорода, и в этом случае на продукцию Н2О2 прямое влияние оказывает концентрация растворенного O2 (наличие "кислородного эффекта") [Брусков и др., 2001, 2002; Bruskov et al., 2002]. В связи с этим необходимо было выяснить, изменяется ли [O2] в растворе в процессе облучения. Измерение [O2] до и после 10-мин облучения ИЭМИ КВЧ БПМ (400 нс, 500 Гц) показало отсутствие изменения количества кислорода в буфере: 0.33±0.01 мМ и 0.32±0.01 мМ соответственно. При облучении буфера в герметичных условиях под пленкой, препятствующей доступу атмосферного кислорода в буфер из окружающего воздуха, Н2О2 образовывалось столько же, сколько и при облучении в отсутствии воздухонепроницаемой пленки (Табл.2). Однако при дополнительном насыщении облучаемого буфера азотом продукция Н2О2 уменьшалась в 1.7 раза, а при добавлении в облучаемый буфер 1 мМ гуанозина (перехватчика синглетного кислорода [Halliwell et al., 1998]) – уменьшалась в 2.2 раза (Табл.2). Таким образом, мы показали наличие "кислородного эффекта", т.е образование Н2О2 в процессе облучения ИЭМИ КВЧ БПМ частично обусловлено активацией кислорода, содержащегося в буфере, но не поступающего извне. Результаты эксперимента с гуанозином свидетельствуют о том, что цепочка реакций, ведущих к образованию перекиси водорода в облучаемом буфере, включает образование синглетного кислорода, что еще раз подтверждает наличие активации содержащегося в буфере кислорода.
Чтобы оценить время жизни АФК, образующихся в буфере под действием ИЭМИ КВЧ БПМ, в специальной серии экспериментов фосфатный буфер после облучения ИЭМИ КВЧ оставляли в герметично закрытых флаконах при комнатной температуре в течение 1, 2, 3 и 4 ч. Оказалось, что, по крайней мере, в течение 4 ч после облучения количество образовавшихся в растворе АФК не уменьшается, даже имеется тренд в сторону его увеличения (Рис.8).
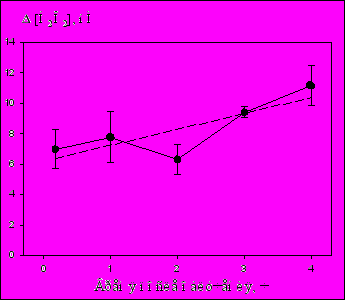
Рис.8. Изменение концентрации Н2О2 после облучения ИЭМИ КВЧ БПМ (400 нс, 500 Гц, время экспозиции 10 мин).
Таким образом, мы напрямую показали, что образование Н2О2 в облучаемом ИЭМИ КВЧ буфере в основном связано с действием возбуждаемых в нем термоакустических колебаний. В наших экспериментах зависимость образования Н2О2 под действием ИЭМИ КВЧ БПМ от ППМ излучения имела выраженный S-образный характер и при низких ППМ образования Н2О2 не наблюдалось. Однако следует отметить, что образование Н2О2 в растворах под действием различных факторов сильно зависит от ионного состава и величины pH раствора. В отдельной серии экспериментов при использовании натрий-бикарбонатного буфера (2.33 мМ NaHCO3, pH 8.5), содержащего хлорид анионы (0.53 мМ NaCl), через 10 мин облучения ИЭМИ КВЧ БПМ (400 нс, 500 Гц) мы зарегистрировали существенное увеличение образования Н2О2 (94.02.8 нМ), почти в 14 раз превышающее количество Н2О2, образующейся при облучении 1 мМ фосфатного буфера [Гудкова и др., 2005]. При облучении раствора Хенкса (pH 7.5), наиболее близкого по ионному составу к плазме крови, в нем образовывалось меньшее количество Н2О2 (около 16 нМ), что может быть связано с присутствием в этом физиологическом растворе сульфат анионов, подавляющих образование Н2О2 [Брусков и др., 2003]. Потенциальная генотоксичность АФК и, в частности, Н2О2 хорошо известна [Petersen et al., 2000; Тронов и Константинов, 2000]. Методом комета-тест было показано, что генотоксическое действие на изолированные лимфоциты крови человека оказывает перекись водорода в концентрации 25 мкМ [Тронов и Константинов, 2000], а на лимфоидные клетки человека линии ТК6 – в концентрации 1 мкМ и выше [McName et al., 2000]. В наших экспериментальных условиях за 10 мин облучения ИЭМИ КВЧ БПМ концентрация образовавшейся Н2О2 не превышала 100 нм, т.е. была ниже той, которая обладает генотоксическими свойствами in vitro. Возможно, при других условиях воздействия, параметрах и временах экспозиции объекта ИЭМИ БПМ скорость образования Н2О2 и соответственно ее количество будут выше. В этом случае нельзя отрицать возможного генотоксического действия ИЭМИ БПМ, опосредованного свободно-радикальными процессами.
ВЫВОДЫ
1. ИЭМИ СВЧ БПМ с выбранными параметрами (8.8 ГГц, длительность импульса 180 нс, импульсная мощность 65 кВт, частота следования импульсов 50 Гц, средняя УПМ 1.6 кВт/кг, время экспозиции 40 мин) не оказывает прямого генотоксического действия на нативные эритроциты лягушки Xenopus laevis in vitro. Увеличение уровня повреждений ДНК в эритроцитах лягушки при действии ИЭМИ СВЧ БПМ обусловлено увеличением температуры суспензии облучаемых клеток.
2. ИЭМИ СВЧ БПМ с выбранными параметрами не вызывает возникновения прямого повреждения ДНК в интактных лейкоцитах и изолированных лимфоцитах крови человека после 40 мин облучения in vitro в диапазоне температур 23-37оС.
3. Облучение ИЭМИ КВЧ БПМ с выбранными параметрами (37 ГГц, длительность импульса 60 нс, импульсная мощность 20 кВт, частота следования импульсов 50 Гц, интенсивность 0.24 Вт/см2, время экспозиции 20 мин) не вызывает прямого повреждения ДНК в интактных лейкоцитах крови мыши in vitro в исследованном диапазоне температур.
4. Под действием ИЭМИ КВЧ БПМ (37 ГГц, импульсная мощность 20 кВт, длительность импульса 400 нс, частота следования импульсов 500 Гц, интенсивность 0.4 Вт/см2) в водных растворах образуется Н2О2 в наномолярных концентрациях. Показано, что образование Н2О2 происходит в результате суммарного влияния тепла и возбуждаемых ИЭМИ КВЧ БПМ термоакустических колебаний. Обнаруженный факт образования Н2О2 под действием ИЭМИ КВЧ БПМ имеет принципиальное значение для дальнейших исследований генотоксического действия ИЭМИ БПМ.
Исследование выполнено при поддержке EOARD/ISTC (проект №017011/№2350) и Российского фонда фундаментальных исследований (проект № 03-04-49210).
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи в журналах
1. Chemeris N.K., Gapeyev A.B., Sirota N.P., Gudkova O.Yu., Kornienko N.V., Tankanag A.V., Konovalov I.V., Buzoverya M.E., Suvorov V.G., Logunov V.A. DNA damage in frog erythrocytes after in vitro exposure to high peak-power pulsed electromagnetic field. // Mutation Res., 2004, Vol. 558, pp. 27-34.
2. Гудкова О.Ю., Гудков С.В., Гапеев А.Б., Брусков В.И., Рубаник А.В., Чемерис Н.К. Исследование механизмов образования активных форм кислорода в водных растворах под действием импульсного электромагнитного излучения крайне высоких частот с большой пиковой мощностью. // Биофизика, 2005, Т. 50, Вып. 5, с. 773-779.
3. Chemeris N.K., Gapeyev A.B., Sirota N.P., Gudkova O.Yu., Tankanag A.V., Konovalov I.V., Buzoverya M.E., Suvorov V.G., Logunov V.A. The lack of direct DNA damage in human blood leukocytes and lymphocytes after in vitro exposure to high power microwave pulses. // Bioelectromagnetics, 2006, Vol. 27, No.3 (early view).
Статьи в сборниках
4. Чемерис Н.К., Рубаник А.В., Гапеев А.Б., Гудкова О.Ю., Сирота Н.П. Исследование генотоксических эффектов импульсных электромагнитных полей с большой пиковой мощностью. Материалы Международной научно-технической конференции "Медэлектроника 2003. Средства медицинской электроники и новые медицинские технологии", г. Минск, Беларусь, 20-21 ноября 2003 г., Мн.: БГУИР, 2003, с.42-45.
5. Сирота Н.П., Гапеев А.Б., Гудкова О.Ю., Танканаг А.В., Чемерис Н.К. Аппаратно-программный комплекс для мониторинга генотоксического действия физико-химических факторов методом комета-тест. Материалы Международной научно-технической конференции "Медэлектроника 2003. Средства медицинской электроники и новые медицинские технологии", г. Минск, Беларусь, 20-21 ноября 2003 г., Мн.: БГУИР, 2003, с. 49-52.
6. Гапеев А.Б., Гудкова О.Ю., Гудков С.В., Рубаник А.В., Чемерис Н.К. Образование активных форм кислорода под действием ИЭМИ КВЧ БПМ. Материалы Международной научно-технической конференции "Медэлектроника 2004. Средства медицинской электроники и новые медицинские технологии", г. Минск, Беларусь, 9-10 декабря 2004 г., Мн.: БГУИР, 2004, с. 41-44.
7. Гудкова О.Ю., Гапеев А.Б., Сирота Н.П., Танканаг А.В., Суворов В.Г., Логунов В.А., Бузоверя М.Э., Коновалов И.В., Чемерис Н.К. Оценка прямого генотоксического действия импульсных микроволн с большой пиковой мощностью методом комета-тест. В кн.: Высокоинтенсивные физические факторы в биологии, медицине, сельском хозяйстве и экологии. Труды международной конференции. / Под ред. В.Д. Селемира, Г.М. Спирова, В.И. Карелина. – Саров: РФЯЦ-ВНИИЭФ, 2005, с. 129-137.
8. Chemeris N.K., Gapeyev A.B., Sirota N.P., Gudkova O.Yu., Tankanag A.V., Konovalov I.V., Buzoverya M.E., Suvorov V.G., Logunov V.A. The in vitro assessment of potential genotoxicity of high power microwave pulses. In NATO Security through Science Series – B: Physics and Biophysics: S.N. Ayrapetyan and M.S. Markov (eds.) Bioelectromagnetics: Current Concepts. Springer, 2006, pp.135-154.
Тезисы докладов
9. Скорочкина (Гудкова) О.Ю., Корниенко Н.В., Горелов Д.В., Якушев Е.Ю., Гапеев А.Б. Оценка влияния алкилирующих агентов на геном земноводных методом "комета-тест". Тез. докл. 7-й Пущинской школы-конференции молодых ученых "Биология - наука 21-го века", Пущино, 14-18 апреля 2002 г., с. 77.
10. Chemeris N.K., Gapeyev A.B., Sirota N.P., Skorochkina (Гудкова) O.Yu., Konovalov I.V., Buzoverya M.E., Suvorov V.G., Logunov V.A. Assessment of the genotoxic effects of high peak-power pulsed electromagnetic field with the use of comet assay. In Proc. of Third International Symposium on Nonthermal Medical/Biological Treatments Using Electromagnetic Fields and Ionized Gases "ElectroMed 2003", San Antonio, Texas, June 11-13, 2003, pp. 55-56.
11. Gapeyev A.B., Chemeris N.K., Sirota N.P., Skorochkina (Гудкова) O.Yu., Kovovalov I.V., Buzoverya M.E., Suvorov V.G., Logunov V.A. High peak-power pulsed electromagnetic field does not cause any significant effect on chromatin of frog erythrocytes determined by the comet assay. Abstract Book of 25th Annual Meeting of BEMS, Maui, Hawaii, June 22-27, 2003, p. 362.
12. Гудкова О.Ю., Туртикова О.В., Горелов Д.В., Гапеев А.Б., Сирота Н.П. Исследование генотоксических эффектов электромагнитных излучений при различных режимах воздействия. Тез. докл. 8-й Международной Пущинской школы-конференции молодых ученых "Биология - наука XXI века", Пущино, 17-21 мая 2004 г., с. 81.
13. Туртикова О.В., Гудкова О.Ю., Гапеев А.Б., Сирота Н.П. Зависимость чувствительности метода комета-тест от условий электрофореза. Тез. докл. 8-й Международной Пущинской школы-конференции молодых ученых "Биология - наука XXI века", Пущино, 17-21 мая 2004 г., с. 96.
14. Гудкова О.Ю., Гудков С.В., Гапеев А.Б. Механизмы образования активных форм кислорода в водных растворах при облучении импульсным ЭМИ КВЧ. Тез. докл. 9-й Международной Пущинской школы-конференции молодых ученых "Биология - наука XXI века", Пущино, 18-22 апреля 2005 г., с. 113.
