Разработка методов селекции и повышения продуктивности штаммов-продуцентов эргоалкалоидов в сапрофитных условиях культивирования 03. 00. 23-Биотехнология
| Вид материала | Лекции |
- Задачи селекции : повышение урожайности сортов культурных растений, увеличение продуктивности, 105.58kb.
- Удк (631. 527+631. 531): 635. 34 Научное обоснование и разработка системы методов селекции, 1105.12kb.
- «Отдалённая гибридизация-метод селекции организмов», 483.68kb.
- Темы курсовых работ по биотехнологии на 2010-2011 учебный год № п/п, 79.65kb.
- Биотехнология в воспроизводстве и селекции крупного рогатого скота имеет особое значение., 299.72kb.
- Удк 631. 524. 7: 631. 559: 635. 753 Оценка и отбор исходного материала петрушки ( Petroselinum, 615.1kb.
- Электронное научное издание «Труды мэли: электронный журнал», 138.02kb.
- Удк 635. 649:(631. 52+631. 53) Теоретическое обоснование и практическое использование, 946.29kb.
- Совершенствование биотехнологий высокоочищенной α-циклодекстринглюканотрансферазы, 372.26kb.
- Разработка биологических препаратов для повышения питательности и эффективности использования, 672.8kb.
На правах рукописи
Барсегян Антон Геворкбекович
РАЗРАБОТКА МЕТОДОВ СЕЛЕКЦИИ И ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ ШТАММОВ-ПРОДУЦЕНТОВ ЭРГОАЛКАЛОИДОВ В САПРОФИТНЫХ УСЛОВИЯХ КУЛЬТИВИРОВАНИЯ
03.00.23-Биотехнология
Автореферат
диссертации на соискание ученой степени кандидата
биологических наук
МОСКВА- 2009г.
Диссертационная работа выполнена во Всероссийском научно-исследовательском институте лекарственных и ароматических растений (ВИЛАР) РАСХН
Научный руководитель:
кандидат биологических наук Савина Татьяна Алексеевна
Официальные оппоненты:
доктор биологических наук Краснопольская Лариса Михайловна
доктор биологических наук Юдина Татьяна Георгиевна
Ведущая организация:
ОАО Институт «Прикладной биохимии и машиностроения»
Защита состоится «14» декабря 2009 г в 14 часов на заседании диссертационного совета Д 006.070.01 во Всероссийском научно-исследовательском институте лекарственных и ароматических растений (ВИЛАР) РАСХН (117216, г. Москва, ул. Грина 7) по адресу: 123056, г. Москва, ул. Красина д. 2.
С диссертацией можно ознакомиться в библиотеке ВИЛАР по адресу: 117216, г. Москва, ул. Грина 7
Автореферат разослан « » 2009 г.
Ученый секретарь диссертационного совета
Д 006.070.01
доктор фармацевтических наук А.И. Громакова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Вторичный метаболизм сапрофитно культивируемых микроорганизмов, в том числе мицелиальных грибов традиционно привлекает внимание исследователей, что обусловлено перспективностью промышленного использования их с целью получения большого разнообразия биологически активных веществ. К таким соединениям принадлежат различные алкалоиды, терпеновые соединения, полифенолы, гликозиды, специфичные пептиды и так далее.
Одной из самых изученных и распространенных групп алкалоидов, продуцируемых мицелиальными грибами, являются эргоалкалоиды, или алкалоиды спорыньи. Свое название они получили по тривиальному наименованию своих основных продуцентов – грибов-паразитов злаков из рода Claviceps (ergot, спорынья).
В настоящее время эргоалкалоиды занимают важное место в фармацевтической промышленности, так как используются в качестве фармакологических средств разнообразного направления и механизма действия. Считается, что большинство эффектов эргоалкалоидов объясняется их взаимодействием с рецепторами нейромедиаторов адреналина, норадреналина, дофамина и серотонина.
На сегодняшний день в мире выпускается более 80 лекарственных средств на основе эргоалкалоидов. Применяются эргоалкалоиды как индивидуально, так и в составе многочисленных комбинированных лекарственных препаратов. В России (ВИЛАР) на основе эргоалкалоидов разработаны препараты Абергин, Новокристин, Беллатаминал и Эргометрина малеат различного спектра действия.
Основным источником для получения эргоалкалоидов является спорынья пурпуровая ( Claviceps purpurea (Fr.) Tul). В промышленном производстве гриб спорыньи используется как паразитарная культура и выращивается на посевах ржи. Данный способ имеет ряд существенных недостатков, к примеру, получение только одного урожая склероциев в год и значительная зависимость от погодных условий.
В настоящее время для получения эргоалкалоидов активно ведутся работы по изучению использования сапрофитной культуры гриба спорыньи.
Получение эргоалкалоидов, основанное на глубинном культивировании сапрофитных штаммов, имеет ряд преимуществ. Данный способ позволяет создать экологически чистое безотходное производство, получать стандартное сырье независимо от времени года, сократить время выращивания сапрофитной культуры, снизить производственные затраты и так далее.
Несмотря на многочисленность ранее проведенных исследований, эффективная технология получения пептидных эргоалкалоидов из сапрофитных культур отсутствует, или охраняется патентами, являясь собственностью коммерческих организаций. В Российской Федерации на сегодняшний день нет промышленных штаммов-продуцентов эргоалкалоидов в сапрофитных условиях культивирования.
Учитывая фармакологическую ценность эргоалкалоидов, разработка путей биотехнологического получения алкалоидов спорыньи является важным фактором обеспечения сырьем производства целой группы препаратов в фармацевтической промышленности.
Цель и задачи работы
Целью диссертационной работы являлось изучение гриба Claviceps purpurea (Fr.) Tul. в условиях сапрофитного культивирования, разработка методов селекции штаммов-продуцентов эргоалкалоидов и приемов экзогенной регуляции их продуктивности.
Для достижения поставленной цели решались следующие задачи:
- Получить мицелиальную культуру спорыньи C. purpurea эргокриптинового штамма BKMF-3602Д;
- Изучить морфологические признаки и биохимические характеристики мицелиальной культуры спорыньи C. purpurea эргокриптинового штамма;
- Исследовать возможность экзогенной регуляции гормональными эффекторами ростовых и биосинтетических процессов у мицелиальной культуры спорыньи C. purpurea эргокриптинового штамма;
- Выбрать эффективные концентрации регуляторов роста для повышения реализации биосинтетического потенциала продуцирования мицелиальной культуры спорыньи C. purpurea эргокриптинового штамма;
- Изучить влияние индуцированного мутагенеза физических (УФ облучение) и химических (колхицин) мутагенных факторов на морфологические признаки, ростовые и биохимические характеристики мицелиальной культуры спорыньи C. purpurea эргокриптинового штамма;
- Изучить влияние селективных факторов на морфологические признаки и биохимические характеристики мицелиальной культуры спорыньи C. purpurea эргокриптинового штамма;
- Изучить возможность сочетания методов направленной селекции и индуцированного мутагенеза для получения штамма гриба спорыньи с измененными морфологическими и биохимическими характеристиками, на примере мицелиальной культуры спорыньи C. purpurea эргокриптинового штамма;
- Дать оценку морфологических и биохимических характеристик модифицированных линий мицелиальной культуры спорыньи C. purpurea эргокриптинового штамма;
- Использовать экзогенное воздействие регуляторов роста в эффективных концентрациях для повышения алкалоидообразования у модифицированных линий мицелиальной культуры спорыньи C. purpurea эргокриптинового штамма;
- Разработать инструкцию по методам селекции сапрофитных штаммов спорыньи пурпуровой – продуцентов эргоалкалоидов.
Научная новизна работы
Изучена возможность максимальной реализации адаптивного потенциала продуктивности эргоалкалоидов в пределах генетической нормы реакции за счет воздействия рострегулирующими факторами на мицелий гриба спорыньи в условиях глубинного культивирования.
Для увеличения влияния на биосинтетическую активность впервые использовали фиторегуляторы, ассоциированные с транспортными биодеградируемыми наночастицами из полибутилцианоакрилата.
В работе впервые исследованы возможности сочетания методов направленной селекции и индуцированного мутагенеза с целью получения генетически измененных линий мицелиальной культуры спорыньи C. purpurea эргокриптинового штамма BKMF-3602Д, обладающих способностью к биосинтезу эргоалкалоидов в условиях in vitro.
Предложенная методология отбора вариантных линий, и экзогенной регуляции ростовых и биосинтетических процессов гриба C. purpurea позволяют получать эргоалкалоиды при глубинном способе культивирования.
Получен сапрофитный штамм C. purpurea – продуцент эргокриптина, зарегистрированный под №04868244-005-2009-Е24-09 ВИЛАР.
Практическая значимость работы
Разработана инструкция по методам селекции сапрофитных штаммов спорыньи пурпуровой – продуцентов эргоалкалоидов. Предложенная методология может быть адаптирована для получения генетически измененных линий других сапрофитных микроорганизмов.
Разработан способ реализации адаптивного потенциала продуктивности эргоалкалоидов в пределах генетической нормы реакции за счет воздействия рострегулирующими факторами на мицелий гриба спорыньи в условиях глубинного культивирования.
Получен сапрофитный штамм C. purpurea – продуцент эргокриптина, зарегистрированный под №04868244-005-2009-Е24-09 ВИЛАР, перспективный для проведения дальнейших работ по селекции и повышению продуктивности.
Основные положения, выносимые на защиту
Способы экзогенного управления ростовыми и биосинтетическими характеристиками сапрофитного штамма гриба спорыньи регуляторами роста стимулирующего и ретардантного действия;
- Эффективные дозы воздействия индукторами мутагенеза и оптимальная плотность конидий гриба спорыньи для получения вариантных линий;
- Селективные факторы и их концентрации, обеспечивающие отбор линий с повышенной биосинтетической активностью;
- Сочетание методов направленной селекции и индуцированного мутагенеза для получения сапрофитного штамма гриба спорыньи с измененными морфологическими и биохимическими характеристиками;
- Инструкция по методам селекции сапрофитных штаммов спорыньи пурпуровой – продуцентов эргоалкалоидов И 04868244-007-2009 ВИЛАР.
Апробация работы
Основные положения диссертационной работы доложены и обсуждены на 4-й Российской научно-практической конференции «Актуальные проблемы инноваций с нетрадиционными природными ресурсами и создания функциональных продуктов» (Москва 2007), Симпозиуме «Биотехнология и медицина в 21 веке» в рамках Международного медицинского Форума «Индустрия здоровья» (Москва 2008), VI Всероссийской научной конференции «Биомедицинские технологии» (Москва 2008).
Связь задач исследований с проблемным планом НИР
Диссертационная работа выполнена в соответствии с «Программой фундаментальных исследований по научному обеспечению развития агропромышленного комплекса Российской Федерации» на 2001-2005 и 2006-2010 гг., а также согласно тематическому плану теоретических и прикладных научно-исследовательских работ ВИЛАР.
Публикации
По материалам диссертации опубликовано 5 научных работ.
Объем и структура диссертации
Диссертационная работа изложена на 172 страницах компьютерного текста, состоит из введения, обзора литературы (глава 1), четырех глав экспериментальной части, выводов, списка литературы, включающего 171 источник, в том числе 98 иностранных, приложений. Работа содержит 35 рисунков и 52 таблицы.
Во введении обоснована актуальность темы, сформулированы цели и задачи исследования, представлены научная новизна и практическая значимость работы.
В первой главе на основе обзора данных литературы дана характеристика эргоалкалоидов, описаны их строение, классификация и пути биосинтеза, указаны основные источники и способы получения, показана значимость эргоалкалоидов для медицинской промышленности. Объяснена перспективность использования сапрофитной культуры гриба спорыньи в качестве источника эргоалкалоидов. Обоснована рациональность использования методов экзогенной регуляции биосинтеза эргоалкалоидов для повышения продуктивности сапрофитной культуры, а также рациональность использования методов направленной селекции и индуцированного мутагенеза для получения штаммов-продуцентов эргоалкалоидов в сапрофитной культуре.
В разделе «Объекты и методы исследования» приведены сведения об объекте изучения, о методах и приборах, используемых в экспериментах.
Глава 3 посвящена исследования морфофизиологических и биохимических характеристик гриба Claviceps purpurea штамма BKMF-3602Д в условиях сапрофитного культивирования.
В четвертой главе представлены данные по экзогенной регуляции биосинтетической активности Claviceps purpurea штамма BKMF-3602Д ингибиторами и регуляторами роста.
Пятая глава содержит сведения по мутагенезу и направленной селекции исходной культуры.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1.Объекты и методы исследования
Объектом исследования служила мицелиальная форма гриба спорыньи Claviceps purpurea (Fries) Tulasne, полученная из склероциев селекционного эргокриптинового штамма BKMF-3602Д и вариантные линии на ее основе.
Для проведения исследования были использованы склероции спорыньи с известным содержанием целевого алкалоида (α и β изомеров эргокриптина не менее 0,7%). Из половинок склероциев получали мицелиальную культуру на поверхности агаризованной питательной среды, в состав которой входили: сахароза – 100,0 г/л, KH2PO4 – 0,25 г/л, FeSO4·7H2O – 0,02 г /л, MgSO4 ∙ 7 Н20 – 0,25 г/л., ZnSO4·7H2O – 0,015 г/л, KCl – 0,125 г/л, Ca(NO3)2 – 1,0 г/л, аспарагин – 10,0 г/л, дрожжевой экстракт – 0,1г/л, агар – 18,0 г/л. Культивирование проводили в течение 30 суток при температуре (24± 1) Сº. В активном состоянии культура поддерживалась методом периодических пересевов.
Для получения глубинной культуры гриба спорыньи использовали жидкую питательную среду следующего состава: сахароза –100,0 г/л, лимонная кислота – 10,0 г/л, KH2PO4 – 0,5 г/л., FeSO4·7H2O – 0,007 г /л., MgSO4 ∙7 Н20 – 0,5 г/л., ZnSO4·7H2O – 0,006 г/л., KCl – 0,125 г/л, Ca(NO3)2 – 0,5 г/л, дрожжевой экстракт – 0,1 г/л, NH4NO3 – 1,0 г/л, рН питательной среды 5,2. В каждую колбу объемом 500 мл, при заполнении стерильной средой в соотношении 1/5 (100 мл) помещали аликвоту суспензии конидий из расчета 1 мл суспензии конидий, плотностью 3,5∙106 шт/мл, на 100 мл питательной среды.
Культивирование проводили при температуре 26±1 оС на подвесной качалке с эллиптической траекторией качания, совершающей 98-100 об/мин.
Для полной характеристики физиологического состояния культуры были использованы величины абсолютной и логарифмической скорости роста, а также продуктивности и удельной продуктивности мицелия (по воздушно-сухой массе, в г/ л питательной среды).
Морфологические исследования осуществляли визуально, при помощи бинокулярной лупы МБС-2 и светового микроскопа МББ-1. Учитывали диаметр колоний, форму и характер края колоний, цвет воздушного и субстратного мицелия.
Конидиогенез регистрировали методом микроскопии по числу конидий в мл. Подсчет конидий проводили при помощи камеры Горяева.
Для предварительной оценки присутствия производных индола алкалоидной природы использовали колориметрический метод анализа, основанный на определении суммарного содержания индольных производных после их конденсации с п-диметиламинобензальдегидом (п-ДМБА) по методу Румпеля.
Качественный контроль накопления индольных производных мицеллиальной культурой осуществляли методом тонкослойной хроматографии (ТСХ) на пластинках «MERK» размером 20 х 20 см.
Алкалоидную природу производных индола подтверждали посредством ЯМР- и УФ-спектроскопии.
Для качественного анализа аминокислот, содержащихся в мицелии гриба, был использован метод тонкослойной хроматографии (ТСХ) в системе растворителей бутанол : уксусная кислота : вода (4 : 1 : 1 об.), с последующей обработкой пластинок раствором нингидрина.
Количественное содержание аминокислот определяли по методу ВЭЖХ по методике Gratzfeld-Huesgen для ВЭЖХ хроматографа Agillent 1100 Series.
Исследовали влияние широкого диапазона доз мутагенных факторов физической (УФ облучение) и химической (колхицин) природы.
УФ облучение проводили с использованием ламп БУВ 15 с номинальным бактерицидным потоком, интенсивностью 1,5 бакт, путем обработки конидий.
Обработку колхицином проводили посредством высева конидий на чашки Петри с агаризованной питательной средой, содержащей в своем составе колхицин. В работе использовали колхицин «Sigma» (США).
Выживаемость культуры оценивали подсчетом колоний на чашках Петри.
В качестве селективных агентов использовали 5-метил-D,L-триптофан (5-МТ) («Serva», Германия) – аналог аминокислоты триптофана и сумму α-,β-эргокриптинов оснований (ГУП ПЭЗ ВИЛАР, Москва) – конечный продукт биосинтеза.
Регуляторы роста использовали в форме коммерческих препаратов: Гиббереллин (Россия), хлорхолинхлорид (ССС) и 2-хлорэтилфосфоновая кислота (2-ХЭФК, компазан, этефон) («Биттерсрельд», Германия). Концентрацию регуляторов роста рассчитывали по действующему веществу.
Наночастицы получали методом анионной полимеризации бутилцианокрилата с последующим включением в состав полимеризационной среды фиторегулятора. Степень включения активного вещества в наночастицы составляла до 90%.
Все работы с мицелиальной культурой проводили в стерильных условиях.
Планирование экспериментов осуществляли с использованием методов постановки факторных экспериментов. Эксперименты ставили в 3-5 повторностях. Контрольный вариант по тексту обозначали как «чистая культура». При статистическом анализе опытов использовали дисперсионный, регрессионный и корреляционный методы оценки (определяли средние значения, стандартные отклонения ошибки средних, критерии Стьюдента, Фишера, коэффициенты регрессии и корреляции).
2. Морфофизиологические характеристики сапрофитной культуры гриба спорыньи эргокриптинового штамма
Морфофизиологическая характеристика гриба спорыньи в условиях глубинного культивирования
В условиях глубинного культивирования между инокуляцией и началом роста мицелия отмечался заметный лаг-период. Активный рост культуры начинался с 3 суток культивирования, достигая своего максимального значения по массе на 28 сутки. В последующие сутки ростовые процессы приостанавливались.
Начало конидиогенеза отмечали на 12 сутки культивирования. При этом максимум конидидиообразования наблюдался на 24 сутки что соответствовало снижению скорости роста культуры (рис.1).
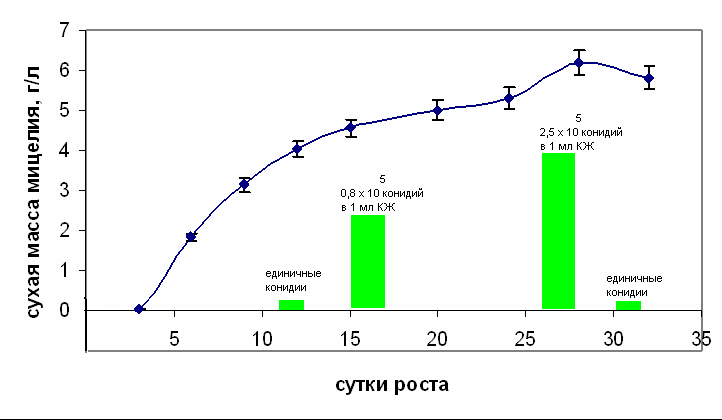 Рис.1. Динамика роста и показатели конидиогенеза мицелия гриба Claviceps purpurea в условиях глубинного культивирования
Рис.1. Динамика роста и показатели конидиогенеза мицелия гриба Claviceps purpurea в условиях глубинного культивированияДля более полной характеристики мицелиальной культуры было решено исследовать содержание основных аминокислот, принимающих участие в синтезе эргоалкалоидов (табл. 1).
Таблица 1
Содержание аминокислот-предшественников синтеза эргоалкалоидов в мицелиальной культуре C. purpurea в условиях глубинного культивирования
| Исследуемый образец | Содержание аминокислот, мг/г | ||||||
| Триптофан | Метионин | Пролин | Валин | Лейцин | Изо-лейцин | Фенил-аланин | |
| «чистая культура» | 0,30 ± 6·10-4 | 0,59± 2·10-4 | 1,09± 6·10-4 | 0,14 ± 5·10-4 | 0,14 ± 6·10-4 | 0,16 ± 7·10-4 | 0,32 ± 2·10-4 |
Было установлено, что количественным преимуществом обладали следующие аминокислоты – пролин, метионин, триптофан и фенилаланин. Однако тест на содержание индольных производных показал, что, несмотря на присутствие в мицелии гриба необходимых аминокислот, синтез данной группы веществ не инициировался. Было сделано предположение, что уровень синтезируемых аминокислот не достаточен для реализации биосинтетического потенциала продуцирования эргоалкалоидов. Было решено повысить продуктивность мицелия посредством экзогенной регуляции.
3.Экзогенная регуляция биосинтетической активности C. purpurea регуляторами роста
Изучение экзогенного воздействия гормоноподобных эффекторов ретардантного действия на рост, морфологию и биосинтетическую активность сапрофитной культуры C. purpurea эргокриптинового штамма
Установлено, что эффекторы ретардантного действия ССС и 2-ХЭФК оказывали значительное тормозящее влияние на накопление биомассы на всех стадиях роста культуры (рис.2) и ингибировали процесс конидиогенеза.
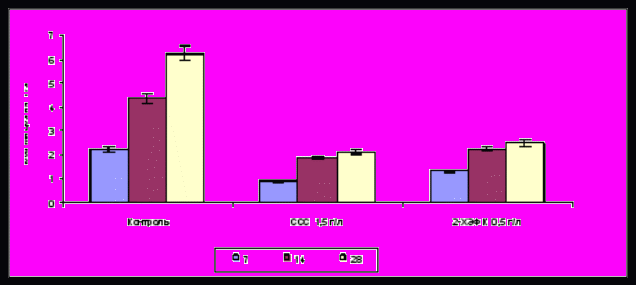
Рис.2 Влияние гормоноподобных эффекторов ретардантного действия на накопление биомассы на 7 14 и 28 сутки культивирования
В ответ на введение в питательную среду высоких концентраций изучаемых эффекторов наблюдалось существенное увеличение биосинтеза аминокислот, предшественников биосинтеза эргоалкалоидов (рис.3).
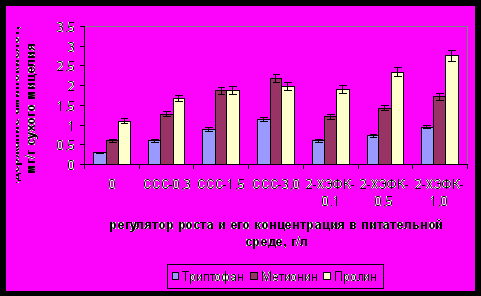
Рис.3. Влияние ССС и 2-ХЭФК на образование аминокислот мицелиальной культурой C. purpurea в условиях глубинного культивирования
При увеличении биосинтеза эндогенных аминокислот, вызванного повышением концентрации ретардантов в питательном субстрате, наступала инициация синтеза индольных соединений (рис. 4). Инициация синтеза индольных производных наступала при добавлении в состав питательной среды ССС в концентрации 0,6 г/л и 2-ХЭФК в концентрации 0,5 г/л.
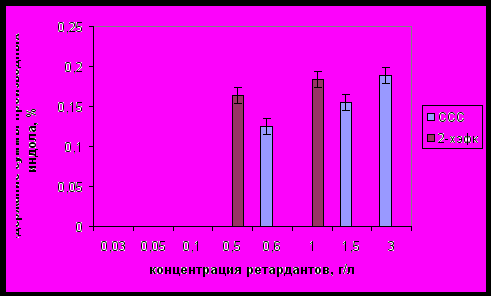
Рис.4. Влияние концентрации ингибиторов роста ретардантного действия на суммарное содержание индольных производных в мицелии гриба
Для обоих ингибиторов роста, инициация синтеза индольных производных происходила при достаточно высоком, практически равном уровне биосинтеза в мицелии основных аминокислот. С увеличением содержания в мицелии эндогенных аминокислот происходило увеличение содержания суммы сложных производных индола. Проведенный анализ количественного содержания эндогенных аминокислот и их соотношений показал, что на активацию биосинтетических процессов в мицелии большее влияние оказывало не соотношение, а их количественное содержание.
Изучение экзогенного воздействия гибберелловой кислоты на рост, морфологию и биосинтетическую активность сапрофитной культуры C. purpurea эргокриптинового штамма
Экзогенное введение ГК в питательный субстрат позволяло значительно интенсифицировать процессы роста культуры. При использовании ГК в диапазоне концентраций 1-50 мг/л питательной среды, стационарная фаза роста наступала уже на 21 сутки культивирования. Период нарастания культуры при этом сокращался на 7 суток (табл. 2).
Таблица 2
Влияние ГК на нарастание биомассы мицелиальной культуры C. purpurea в условиях глубинного культивирования
| Сутки роста | Масса сухого мицелия, г/л | ||||
| Концентрация ГК в питательном субстрате, мг/л | |||||
| 0 (контроль) | 1 | 10 | 50 | 100 | |
| 7 | 2,21±0,16 | 4,16±0,01 | 3,64±0,01 | 3,49±0,01 | начало роста |
| 14 | 4,32±0,66 | 13,92±0,04 | 13,26±0,01 | 12,71±0,07 | 2,18±0,03 |
| 21 | 5,12±0,32 | 14,16±0,01 | 16,71±0,03 | 18,24±0,02 | 7,40±0,13 |
| 28 | 6,19±0,24 | 14,22±0,02 | 16,79±0,02 | 18,31±0,02 | 16,42±0,05 |
ГК в концентрации 50 мг/л оказывала положительное влияние на биосинтез аминокислот-предшественников и производных индола. При этом суммарное содержание сложных производных индола возрастало до 0,2% от сухой массы мицелия (табл. 3).
Таблица 3
Суммарное содержание индольных производных в мицелии C. purpurea, выращенном в условиях глубинного культивирования на средах с различным содержанием ГК
| Суммарное содержание индольных производных, % | Концентрация ГК в питательной среде, мг/л | ||||
| 0 | 1 | 10 | 50 | 100 | |
| 0 | 0,091±0 | 0,128±0,013 | 0,202±0,014 | 0,123±0,013 | |
Изучение совместного влияния гормоноподобных эффекторов ретардантного действия и стимулятора роста гибберелловой кислоты на рост и биосинтетическую активность сапрофитной культуры C. purpurea эргокриптинового штамма
Изучали влияние синтетических ингибиторов роста ретардантного действия ССС и 2-ХЭФК при их совместном присутствии с ГК. В эксперименте использовали 2 концентрации ГК 1 и 50 мг/л. Ретарданты вводили в состав питательных сред на 6-е сутки культивирования, параллельно началу активного конидиогенеза в концентрациях ССС – 1,5 и 2-ХЭФК – 0,5 г/л. Анализ проводили на 21 сутки культивирования, что соответствовало началу фазы стационарного роста культуры на среде с ГК.
Положительное действие изучаемых ретардантов отмечалось на фоне концентрации ГК 50 мг/л. При этом более выраженным оказалось действие 2-ХЭФК. Так, при введении ССС в концентрации 1,5 г/л суммарное содержание индольных производных возрастало на 25 %, а при введении 2-ХЭФК в концентрации 0,5 г/л на 47 % (табл. 4).
Таблица 4
Суммарное содержание индольных производных и масса сухого мицелия гриба C. purpurea при выращивании на средах, содержащих ГК и гормоноподобные эффекторы ретардантного действия в условиях глубинного культивирования
| Суммарное содержание индольных производных, % | Регулятор роста и его концентрация в питательном субстрате | |||||||
| ССС 1,5 г/л | 2-ХЭФК 0,5 г/л | ГК 1 мг/л | ГК 50 мг/л | ГК 1мг/л | ГК 50 мг/л | |||
| ССС 1,5 г/л | 2-ХЭФК 0,5 г/л | ССС 1,5 г/л | 2-ХЭФК 0,5 г/л | |||||
| 0,155±0,110 | 0,163±0,007 | 0,091±0 | 0,202 ± 0,014 | 0,151 ± 0,013 | 0,163 ± 0,007 | 0,189 ± 0,007 | 0,240 ± 0,011 | |
| Масса мицелия на 21 сутки, г/л | 2,02±0,13 | 2,49±0,21 | 14,16± 0,01 | 18,24± 0,02 | 5,99±0,10 | 6,22±0,38 | 7,05±0,16 | 8,14±0,22 |
Установлено, что изучаемые регуляторы роста влияли на качественный состав производных индола, отмечался сдвиг алкалоидообразования в сторону клавиновых алкалоидов и изомерных форм пептидных эргоалкалоидов (табл. 5). При совместном присутствии ГК и эффекторов ретардантного действия отмечался сдвиг биосинтетической активности в сторону образования эргокриптина и эрготамина.
Следует отметить, что результаты исследования по влиянию ингибиторов роста ССС и 2-ХЭФК на биосинтетическую активность мицелия гриба спорыньи в сапрофитных условиях культивирования представлены впервые.
Исследование возможности использования биодеградируемых наносомальных систем доставки регуляторов роста
В поисковых исследованиях была обнаружена возможность повышения суммарного выхода производных индола посредством
Таблица 5
Влияние регуляторов роста на качественный состав производных индола, продуцируемых гриба C. purpurea *
| Состав производных индола | Регулятор роста и его концентрация в питательном субстрате | ||||||
| ССС 0,6; 1,5; 3 г/л | 2-ХЭФК 0,5; 1,0 г/л | ГК 1; 10; 50 мг/л | ГК 1мг/л | ГК 50 мг/л | |||
| ССС 1,5 г/л | 2-ХЭФК 0,5 г/л | ССС 1,5 г/л | 2-ХЭФК 0,5 г/л | ||||
| 1.вещество группы эргоксина 2. сетоклавин | 1. вещество группы эргоксина 2. β-эргокриптин | 1. вещество группы эргоксина 2. эрготаминин 3. предположительно клавиновый алкалоид | 1. сетоклавин 2. эрготамин 3.эрготаминин | 1. сетоклавин 2. сумма эргокриптининов | 1. сетоклавин 2. эрготамин 3.эрготаминин | 1.сетоклавин 2. сумма эргокриптининов 3. сумма эргокриптинов | |
*По данным ТСХ
Таблица 6
Влияние ССС, 2-ХЭФК и ГК на накопления индольных производных мицелием гриба C. purpurea в условиях глубинного культивирования
| Концентрация регуляторов роста, не связанных с транспортными наноносителями, контроль | Концентрация регуляторов роста, связанных с транспортными наноносителями | |||||||
| ССС | 2-ХЭФК | ГК | ССС | 2-ХЭФК | ГК | |||
| 1,5 г/л | 0,5 г/л | 50 мг/л | 0,3 г/л | 1,5 г/л | 0,1 г/л | 0,5 г/л | 10 мг/л | 50 мг/л |
| Суммарное содержание индольных производных,%* | ||||||||
| 0,155 ± 0,110 | 0,163 ± 0,007 | 0,202 ± 0,014 | 0,304 ± 0,011 | 0,307 ± 0,007 | 0,337 ± 0,014 | 0,358 ± 0,014 | 0,243 ± 0,007 | 0,192 ± 0,011 |
введения регуляторов роста в более низких концентрациях в комплексе с полимерными транспортными наночастицами (табл.6).
При оценке суммарного содержания производных индола в мицелии на 21 сутки культивирования, было обнаружено, что, при введении в состав питательного субстрата комплексов ССС и 2-ХЭФК с наноносителями, содержание индолопроизводных возрастало в среднем в 2 раза при снижении концентрации эффекторов в 5 раз. При этом действие комплекса с 2-ХЭФК было более выражено. Эффект воздействия комплекса с ГК был несколько ниже, содержание индольных производных в мицелии при снижении концентрации эффектора в 5 раз повышалось всего на 20 % .
5.Мутагенез и направленная селекция
Определение оптимальных доз мутагенов
В исследованиях по влиянию мутагенных и селективных факторов частота образования колоний очень низка, поэтому в экспериментах использовали достаточно высокую плотность высева, соответствующую 3,6 х 103 конидий в 1 мл, то есть превосходящую в сто раз плотность, обеспечивающую рост единичных колоний.
Для мицелиальной культуры спорыньи наблюдался волновой характер ростовой реакции на разные дозы мутагенных факторов. Обнаружено стимулирующее (5 сек.; 0,05 мМ), ингибирующее (30-45 сек.; 0,5-2,5 мМ), сублетальное (50-55 сек.; 3-3,5 мМ) и летальное (60 сек.; 4 мМ) действие УФ и колхицина соответственно на конидиоспоры (рис. 5).
Для проведения работ по получению штамма-продуцента нами были выбраны стимулирующие (5 сек.; 0,05 мМ), ингибирующие (30 и 40 сек.; 1,0 мМ) и сублетальные (55 сек; 3,5 мМ) дозы УФ интенсивностью 1,5 бакт и колхицина, соответственно. Было выделено и проанализировано по 50 колоний, выросших из конидий, подверженных воздействию УФ и колхицина в отобранных дозах. Установили, что эффективным мутагенным фактором, позволяющим получать линии со способностью к синтезу производных индола, является только УФ-облучение ингибирующего и сублетального типов воздействия.
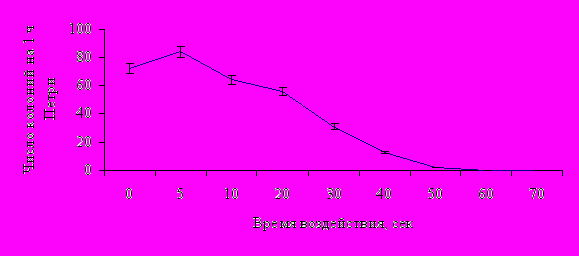
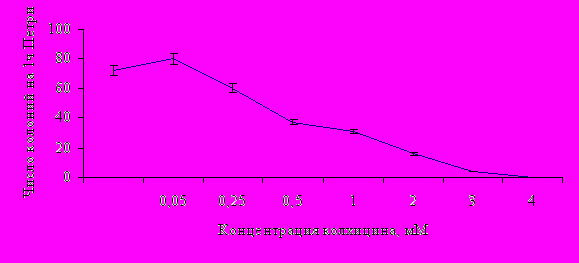
Рис. 5. Дозовые кривые по росту конидий гриба спорыньи в зависимости от времени воздействия УФ света, интенсивностью 1,5 бакт и концентрации колхицина в питательной среде, мМ
Ступенчатый мутагенез
В результате работ по индуцированному мутагенезу мицелиальной культуры C. purpurea было получено 3 линии, обладающие способностью к синтезу производных индола в глубинной культуре и устойчивых к пассированию на агаризованной питательной среде. С отобранными линиями проводили работы по ступенчатому мутагенезу по схеме (рис.6).
В ходе работ по ступенчатому мутагенезу было в общей сложности проанализировано 360 колоний. В результате было получено четыре вариантных линии, отличавшихся от исходной культуры по морфологическим характеристикам, особенностям роста и у которых можно было предположить наличие биосинтеза минорных количеств эргоалкалоидов в поверхностной и глубинной культурах. С отобранными линиями проводили работы по направленной селекции.

Рис.6. Схема работ по ступенчатому мутагенезу
Направленная селекция
В качестве селективных агентов использовали токсичный аналог аминокислоты триптофана – 5метил триптофан (5-МТ) и алкалоид - эргокриптин в форме основания. Работы осуществляли по схеме рис.7.
Впервые было использовано сочетание методов селективных сред и индуцированного мутагенеза для получения продуктивных вариантов C. purpurea. В результате было получено 6 линий, растущих в глубинной культуре, обладающих способностью к синтезу индольных производных, и устойчивых к систематическим пересевам на стандартной агаризованной питательной среде. Линия Е24 была отобрана как наиболее продуктивная (табл.7).
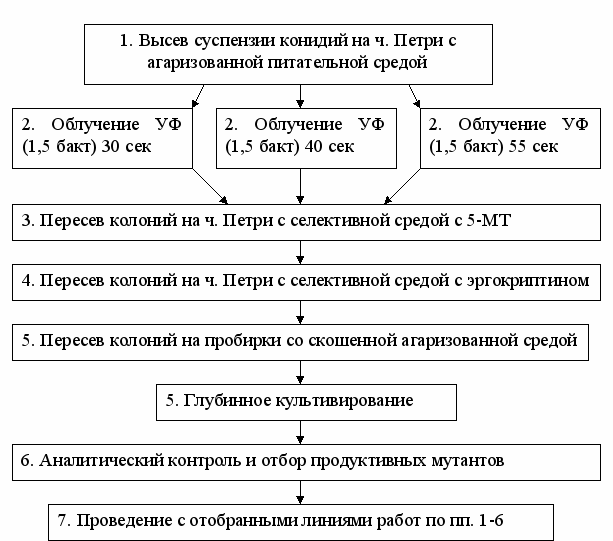
Рис.7. Схема работ по направленной селекции
Таблица 7
Характеристика вариантных линий сапрофитной культуры спорыньи, полученных посредством сочетания методов направленной селекции и индуцированного мутагенеза
| Вариант | Суммарное содержание производных индола в мицелии, % | Наличие эргоалкалоидов в мицелии гриба* |
| Е3 | 0,192 | сумма α-,β-эргокриптининов |
| Е8 | 0,137 | эрготамин |
| Е13 | 0,137 | β-эргокриптин |
| Е21 | 0,240 | сумма α-,β-эргокриптининов |
| Е24 | 0,256 | а) эрготаминин б) β-эргокриптин |
| Е28 | 0,240 | а) эрготаминин б) сумма α-,β-эргокриптининов |
*По результатам ТСХ
Культура спорыньи Е24 отличалась от исходной культуры по ростовым, морфологическим, и биохимическим показателям. Суммарное содержание производных индола в мицелии линии Е24 составило 0,256%. Анализ методом ТСХ показал наличие в мицелии пептидных эргоалкалоидов β-эргокриптина и эрготаминина.
С полученной сапрофитной линией Е24 было проведено исследование по экзогенной регуляции биосинтеза, посредством введения ГК в наиболее эффективной концентрации, отобранной в предыдущих исследованиях. При таком способе выращивания макисмальный уровень мицелиальной массы возрос на 70%, а суммарное содержание производных индола в мицелии гриба превосходило на 18,7% данный показатель для линии Е24, выращенной на стандартной питательной среде. Качественный анализ показал наличие в мицелии гриба суммы α-,β-эргокриптинов и их изомеров.
Алкалоидная природа соединений индольной природы, выделенных из мицелия линии Е24 была подтверждена методами УФ- и ЯМР-спектроскопии (рис.8 и 9).
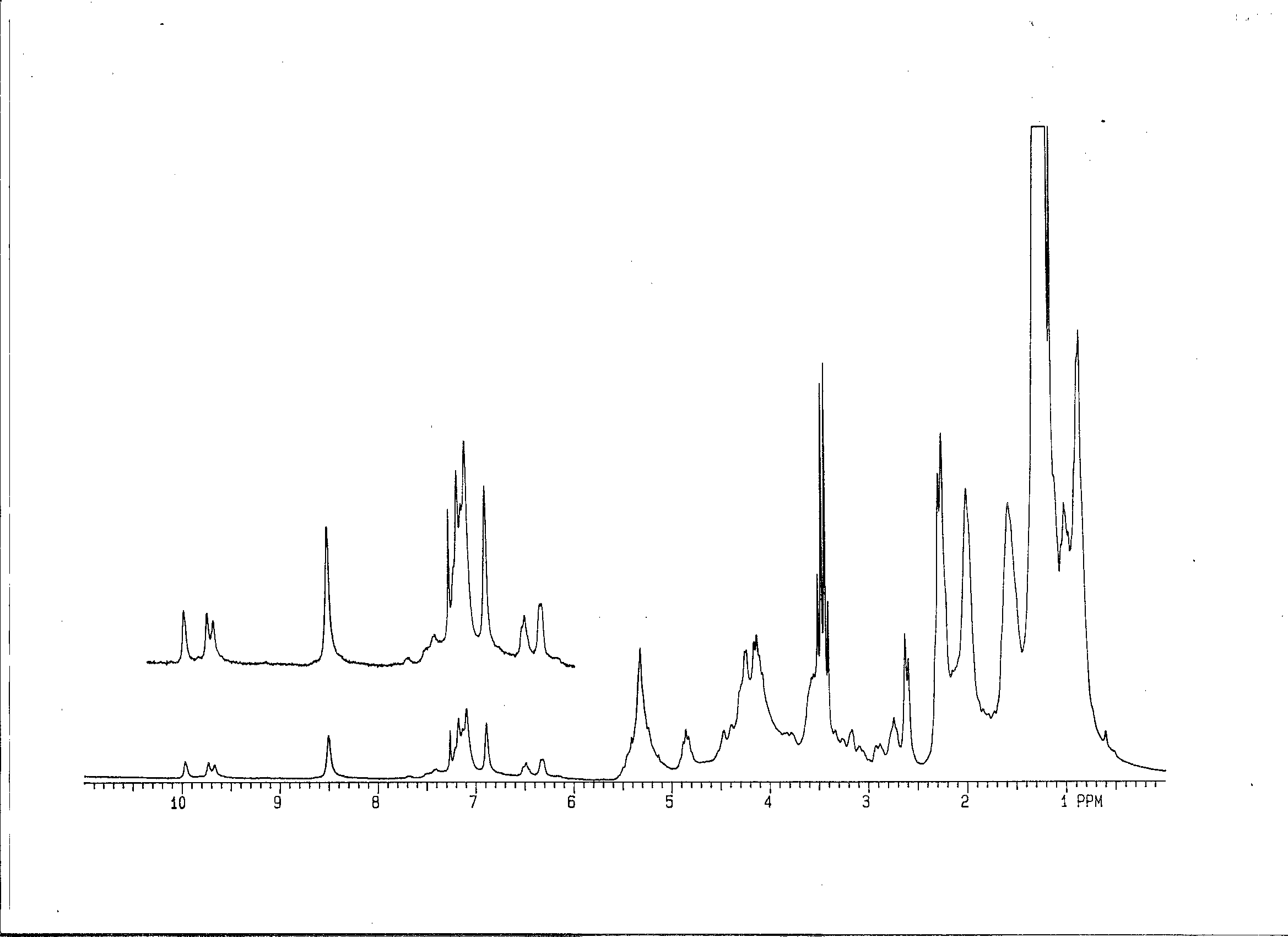
Рис.8. IН-ЯМР-спектр извлечения из мицелия гриба спорыньи вариантной линии Е24, выращенной в условиях глубинного культивирования на питательной среде с добавлением 50 мг/л ГК в CDCl3.
Синглет в области 9,7-9,9 м.д. относится к сигналу протона NH-пептидной группировки эргоалкалоидов. Синглет в области около 8,5 м.д. относится к протону NH-группы индольной части молекулы. Синглет около 6,9 м.д. соответствует протону С-2 положения индольного фрагмента молекулы, дублет в области 6,31-6,39 м.д. соответствует протону С9 лизергиновой части молекулы эргоалкалоида. Триплет в области 4,8 м.д. относится к протону С5` положения пептидной части молекулы.
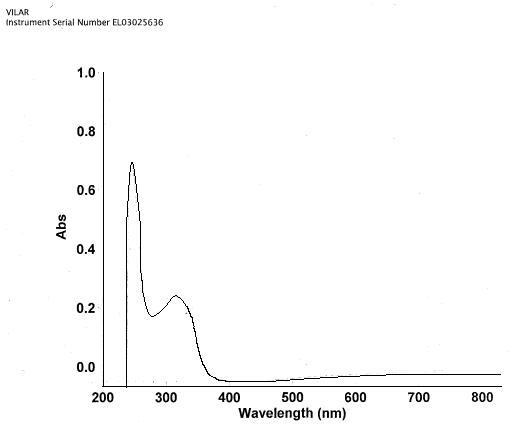
Рис. 9. УФ-спектр экстрактивных веществ из мицелия гриба спорыньи вариантной линии Е24, выращенной в условиях глубинного культивирования на питательной среде с добавлением 50 мг/л ГК в 50 % метаноле.
УФ-спектр эфирного извлечения из мицелия имел максимум поглощения при λ=313 нм и минимум около λ=280 нм, что соответствует минимумам и максимумам поглощения, характерным для лизергиновой кислоты и ее производных – пептидных эргоалкалоидов.
ВЫВОДЫ
1. На основе изучения физиологических и биохимических особенностей сапрофитной культуры гриба спорыньи в условиях in vitro изучена возможность мобилизации адаптивного потенциала продуктивности в пределах генетической нормы реакции рострегулирующими факторами. Отработан подход к получению генетически измененных линий, обладающих способностью к биосинтезу эргоалкалоидов, с использованием методов направленной селекции и индуцированного мутагенеза.
2. Отработаны способы экзогенной регуляции ростовых и биосинтетических характеристик мицелиальной культуры гриба спорыньи. Регуляторы роста ССС, 2-ХЭФК и ГК в концентрациях 0,6 г/л, 0,5 г/л и 50 мг/л, соответственно, стимулируют синтез пептидных и клавиновых эргоалкалоидов до уровня 0,2% от массы мицелия.
3. Установлено, что совместное влияние регуляторов роста ГК и 2-ХЭФК на процессы вторичного метаболизма отличалось сдвигом биосинтетической активности в сторону образования алкалоида эргокриптина, а ГК и ССС в сторону образования алкалоида эрготамина.
4. Наиболее эффективным индуктором мутагенеза является УФ-облучение интенсивностью 1,5 бакт на протяжении 30, 40 и 55 секунд. В качестве селективных агентов целесообразно использовать 5-МТ и конечный продукт метаболизма - сумму оснований α-,β-эргокриптинов.
5. Сочетание методов направленной селекции и индуцированного мутагенеза позволило выделить клеточные линии с искомыми изменениями биосинтетического потенциала сапрофитной культуры гриба C. purpurea. Получен штамм сапрофитной культуры C. purpurea – Е24-09 ВИЛАР, характеризующийся нарастанием мицелия – 6-7 г/л сухой массы; содержанием производных индола – 0,256% от сухой массы мицелия, присутствием алкалоидов β-эргокриптина и эрготаминина.
6. По результатам работы разработана инструкция по методам селекции сапрофитных штаммов спорыньи пурпуровой – продуцентов эргоалкалоидов И 04868244-007-2009 ВИЛАР; составлен паспорт на сапрофитный штамм Claviceps purpurea (Fr.) Tul. продуцент эргокриптина №04868244-005-2009-Е24-09 ВИЛАР.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Получение конидиального материала спорыньи для проведения работ по воздействию мутагенными факторами / А.Г. Барсегян, Т.А. Савина // Конференции « Здоровье и образование в 21 веке»: Тезисы докладов. М., 2006. –С. 310.
2. Селекция вариантных линий Claviceps purpurea эрготаминового штамма со способностью к биосинтезу индольных производных в сапрофитной культуре / А.Г. Барсегян, Т.А. Савина, Р.И. Бобылева // Сборник научных трудов «Нетрадиционные ресурсы, инновационные технологии и продукты». – 2007. – Вып.16. – С. 211-215.
3. Зависимость выживаемости конидий штамма Claviceps purpurea продуцента эргокриптина от различных концентраций 5- метил-DL- триптофана / А.Г. Барсегян, Т.А. Савина, Р.И. Бобылева // X1V Российский национальный конгресс «Человек и лекарство»: Сборник материалов конгресса. М.,16-20 апреля 2007. С. 798-799.
4. Воздействие мутагенов на конидии гриба Claviceps purpurea эргокриптинового штамма / Барсегян А.Г. // Сборник научных трудов «Разработка, исследование и маркетинг новой фармацевтической продукции». – Пятигорск, 2007. – Выпуск 62. – С.436-438.
5. Изучение экзогенного воздействия гормоноподобных эффекторов ретардантного действия на биоситтетическую активность сапрофитной культуры Claviceps purpurea (Fr) Tul. эргокриптинового штамма / А.Г. Барсегян, Т.А. Савина, Р.И. Бобылева // Вопросы биологической, медицинской и фармацевтической химии. – 2009. - №1. С. 15-18.
