Фундаментальные аспекты создания на основе минерала бишофит магний-содержащих лекарственных средств 14. 00. 25 фармакология, клиническая фармакология
| Вид материала | Автореферат |
- Клиническая эффективность и фармакоэпидемиология лекарственных средств у детей с аллергическим, 462.25kb.
- Литература, 23.14kb.
- Тер-арутюнянц артем андреевич сравнительная оценка специфической фармакологической, 311.83kb.
- «Клиническая фармакология» Специальность: 111201 Ветеринария Пояснительная записка, 94.74kb.
- Антимикробные препараты у больных с внебольничными инфекциями респираторного тракта:, 651.17kb.
- «Экспериментальная и клиническая фармакология» журнал к сведению, 84.61kb.
- Программа вступительных испытаний для специальности магистратуры 1-79 80 10 Фармакология,, 197.39kb.
- Антиметастатическая активность препаратов природного происхождения 14. 00. 25 фармакология,, 1023.15kb.
- Учебное пособие для медицинских вузов / сост. С. В. Мальчикова. Киров: Кировская государственная, 1247.91kb.
- Оптимизация фармакотерапии плоского лишая 14. 00. 25. фармакология, клиническая фармакология, 214.56kb.
В литературе обсуждается вопрос о том, какие именно биологические системы/биохимические механизмы вовлечены в патогенез аффективных расстройств и на какие из них действует магний. Существуют различные точки зрения относительно механизма влияния дефицита магния на поведенческие реакции. Так, снижение уровня внеклеточного магния облегчает активацию NMDA-рецепторов [Mayer M.L. et al., 1984], что ведет к повышению возбудимости нейронов в области гиппокампа и голубого пятна [Grunze H., Walden J., 1997]. NMDA-опосредованная гиперактивность, как полагают Shiekhattar R. и Aston-Jones G. [1992], является одной из составляющих патогенеза депрессий. Поэтому антагонисты NMDA-рецепторов или высокие дозы солей магния могут проявлять антидепрессантную активность [Decollogne S. et al., 1997; Poleszak E. et al. 2004] и анксиолитический эффект [Poleszak E. et al. 2004]. Дефицит магния влияет также на баланс моноаминов в головном мозге, таких, как катехоламины и серотонин [Kantak K.M., 1988]. Согласно литературным данным, магний приводит к уменьшению ночной секреции кортиколиберина и, соответственно, кортизола, а значит и к снижению активности гипоталамо-гипофизарной системы как при внутривенном [Murck H., Steiger A., 1998], так и при пероральном введении [Held K. et al., 2002]. Вероятно, это также может являться дополнительной составляющей в антидепрессантоподобном механизме действия солей магния, т.к. при депрессиях часто фиксируется повышение активности гипоталамо-гипофизарной системы [Holsboer F., 2000]. McCoy M.A. с соавт. [2000] сообщают, что при дефиците магния наблюдается изменение содержания 3,4-дигидроксифенилаланина и дигидроксифенилалниновой кислоты в полосатом теле и дофамина в коре и мозжечке.
В экспериментах исследуемые соли магния проявили наибольшую активность в комбинации с пиридоксином. Гомеостаз магния и пиридоксина тесно взаимосвязаны. С одной стороны, пиридоксин вероятно способствует транспорту магния в клетку и его депонированию, с другой – магний активирует пиридоксалькиназу [Planells E. et al., 1997]. Пиридоксин также участвует в реакциях синтеза многих нейромедиаторов (серотонина, норадреналина, дофамина, ГАМК) [Dakshinamurti K. et al., 1988; Guilarte T.R., 1989; Viswanathan M. et al., 1988]. Этим можно объяснить тот факт, что в исследованиях соли комбинированные с витамином В6, проявили максимальный эффект.
Таким образом, в ходе исследований было подтверждено, что дефицит магния у крыс приводит к депрессивно-подобному поведению и повышенной тревожности. При введении солей магния у магнийдефицитных животных в тесте «открытое поле» происходило восстановление поисковой активности и снижение тревожности, что проявлялось в более частом посещении центральной части установки, увеличении частоты актов груминга. В тесте «крестообразный лабиринт» под действием солей магния уменьшалась продолжительность латентного периода до выглядывания из темного отсека, увеличивалось число посещений темных и светлых рукавов лабиринта. В тесте вынужденного плавания увеличивался латентный период до первого эпизода пассивного плавания, уменьшалось время пассивной иммобилизации, что также говорит о антидепрессантоподобном эффекте солей магния. При этом лидерами по большинству показателей оказались Mg L-аспарагинат и Mg хлорид в комбинациях с витамином В6, которые по эффективности оказались сопоставимы с препаратом сравнения магне В6 и значительно превзошли Mg сульфат.
Магний важен для регуляции обмена нейромедиаторов и модулирования функции рецепторов в ЦНС, в том числе ответственных за формирование депрессивно-подобного и тревожного поведения у животных [Singewald N. et al., 2004]. Рядом авторов было показано, что при дефиците магния изменяется чувствительность к действию фенамина [Holl J.E. et al. 1978] и серотонина [Bac P. et al., 1994]. Что касается уровня медиаторов в ЦНС у магнийдефицитных животных, то мнения ученых по этому поводу расходятся. Chutkow J.G. [1979] показал, что при дефиците магния уровень моноаминов (норадреналина, 5-гидрокситриптофана и дофамина) не изменяется, по сравнению с контролем. Согласно исследованиям Amyard N. с соавт. [1995], в мозговой ткани мышей с генетически обусловленной гипомагнезиемией уровень норадреналина был достоверно выше, чем у контрольной группы и мышей с генетически обусловленной гипермагнезиемией, в то время как концентрация серотонина и дофамина во всех трех группах была примерно одинаковой.
В данной серии исследований было показано, что содержание животных на безмагниевой диете сопровождалось снижением концентрации магния в некоторых структурах головного мозга и изменениями показателей нейрофармакологических тестов. Содержание магния во фронтальной коре, гиппокампе и стриатуме недостоверно снижалось на 7,617,781%, 57,1222,173% и 14,8632,970% соответственно, тогда как изменение содержания магния в гипоталамусе было незначительным.
При оценке фенаминовой стереотипии у магнийдефицитных животных отмечено уменьшение длительности латентного периода в среднем на 14,89% и достоверное увеличение длительности фенаминовой стереотипии в среднем на 19,44%, по сравнению с интактными крысами. При изучении гиперкинеза, вызванного 5-окситриптофаном, в группе магниевого дефицита наблюдалось снижение выраженности его проявления вдвое (p<0,05). При введении ареколина у магнийдефицитных животных происходило статистически значимое увеличение латентного периода в среднем на 164,33%, а также уменьшение длительности тремора в среднем на 40,13% (p<0,05), по сравнению с интактными крысами. По влиянию на судорожный эффект никотина, а также на гипотермические эффекты клофелина и апоморфина достоверных различий между интактной группой и магнийдефицитными животными обнаружено не было.
Тот факт, что в проведенных исследованиях в группе дефицита магния наблюдалось усиление фенаминовой стереотипии, согласуется с данными, полученными Holl J.E. с соавт. [1978]. Они показали, что уже на 11 день магнийдефицитной диеты крысы были более чувствительны к действию D-амфетамина: у данной группы животных LD50 для D-амфетамина снизилась в 2 раза, по сравнению с интактным контролем. Данный феномен может объясняться усилением синтеза и накопления норадреналина в ЦНС у животных с врожденным дефицитом магния [Amyard N. et al., 1995].
el-Beheiry H. и Puil E. [1990] исследовали способность нейронов реагировать на вводимые ионофорезом медиаторы в среде, содержащей низкие концентрации магния. Эффекты ацетилхолина дозозависимо подавлялись при снижении содержания магния в омывающей клетки жидкости [el-Beheiry H., Puil E., 1990]. По мнению Bloc A. [1999] дефицит магния приводит к достоверному снижению уровня ацетилхолина в мозговой ткани, особенно в полосатом теле, мозжечке, промежуточном мозге. Возможно, с этим связана меньшая выраженность тремора при введении ареколина магнийдефицитным животным, по сравнению с группой контроля.
Полученные результаты экспериментов согласуются с литературными данными, согласно которым при дефиците магния происходит снижение интенсивности аудиогенных судорог у животных при введении 5-гидрокситриптофана (5-HT). В частности, Bac P. c соавт. [1994] изучал различные аспекты серотонинергической нейротрансмиссии и показал, что ниаламид и флуоксетин снижают выраженность судорог у магнийдефицитных животных.
В данных исследованиях в условиях компенсации уровня магния в организме магнийдефицитных животных наблюдалось восстановление показателей нейрофармакологических тестов. Отмечалось уменьшение длительности фенаминовой стереотипии в группе животных, получавших магне В6, в среднем на 39,78% (p<0,05), Mg L-аспарагинат и Mg хлорид в комбинациях с витамином В6 – на 30,84% (p<0,05) и 26,46% (p<0,05) соответственно, Mg хлорид – на 21,62% (p<0,05) и Mg L-аспарагинат – на 20,17% (p<0,05), по сравнению с магнийдефицитными животными. При этом отличия от группы магне В6 были достоверны для большинства солей, кроме Mg хлорида, а комбинация Mg L-аспарагината с витамином В6 достоверно превосходила по активности Mg L-аспарагинат.
При оценке влияния на гиперкинез, вызванный введением 5-гидрокситриптофана, отмечено увеличение выраженности его проявления в группах Mg L-аспарагината и Mg хлорида в комбинациях с витамином В6 в среднем в 2,5 (p<0,05) и 2 раза (p<0,05) соответственно, в группах Mg L-аспарагината и Mg хлорида – в среднем в 1,5 раза, магне В6 – в 0,8 раза, по сравнению с группой магниевого дефицита. Статистически значимых различий между группами, получавшими соли магния, обнаружено не было.
При введении ареколина во всех группах, получавших соли магния, отмечено достоверное уменьшение длительности латентного периода, по сравнению с магнийдефицитными животными: в группах Mg хлорида и его комбинации с витамином В6 – на 71,04% и 78,67% соответственно; в группах Mg L-аспарагината и его комбинации с витамином В6 – на 75,29% и 75,24% соответственно; для магне В6 – на 73,65%. По влиянию на ареколиновый тремор наибольшую эффективность проявили группы Mg хлорида и его комбинации с витамином В6 – длительность тремора увеличилась на 27,12% и 33,47% соответственно, по отношению к животным с дефицитом магния. Для групп Mg L-аспарагината и его комбинации с витамином В6, а также магне В6 данные изменения составили – 24,83%, 24,64% и 20,34% соответственно.
По мнению Mayer M. с соавт. [1984], низкие внеклеточные концентрации магния облегчают активацию NMDA-рецепторов, что приводит к повышенной возбудимости нейронов. С другой стороны, активность данного вида рецепторов потенциал зависимо [Morris R.M., 1992] блокируется ионами магния. In vitro эта блокада вызывается при концентрации Mg2+ равной 1 мМ, что соответствует уровню магния в спинномозговой жидкости и плазме крови [Morris R.M., 1992]. Известно, что NMDA-рецепторная система вовлечена в патофизиологию депрессивных состояний [Skolnick P., 2002]. Этим объясняется способность антагонистов NMDA-рецепторов (магния, цинка) оказывать антидепрессанто-подобный эффект [Bergman R.M. et al., 2000; Decollogne S. et al., 1998; Murck H., 2002].
Возможно, что магний модулирует активность серотонинергической медиаторной системы опосредованно, так как, по мнению некоторых авторов [Poleszak E., 2006], повышает активность триптофангидроксилазы. Эти факты свидетельствуют о ведущей роли серотонинергических механизмов в антидепрессанто-подобной активности магния.
Таким образом, магнийдефицитная диета потенциирует показатели фенаминовой стереотипии, ослабляет гиперкинез, вызванный 5-окситриптофаном и ареколином. При этом чувствительность магнийдефицитных и интактных животных к действию малых доз апоморфина и клофелина достоверно не различалась. Компенсация уровня магния в организме животных приводит к восстановлению вышеуказанных изменений до показателей у контрольных животных. При этом в большинстве случаев (влияние на фенаминовую стереотипию; гиперкинез, вызванный триптофаном; ареколиновый тремор) прослеживается тенденция к большей эффективности солей магния в комбинации с пиридоксином.
Роль дефицита магния в формировании судорожной готовности
Магний играет важную роль в формировании судорожной готовности. Так в ряде исследований описаны генерализованные тонико-клонические судороги у больных с изолированной идиопатической гипомагнезиемией [Dharnidharka V.R., Carney P.R., 2005]. С другой стороны, у больных эпилепсией детей часто наблюдается гипомагнезиемия, имеющая положительную корреляцию с тяжестью течения заболевания [Benga I. et al., 1985]. Проблема коррекции обмена магния у больных эпилепсией актуальна еще и потому, что при терапии антиконвульсантами, в частности, фенобарбиталом, гексамидином, дифенином, может возникать гипомагнезиемия [Bonuccelli U. et al., 1982; Christiansen C. et al., 1974; Steidl L. et al., 1987; Yassa R., Schwartz C., 1984].
В экспериментальных исследованиях Lopiano L. с соавт. [1989] установили большую интенсивность судорог, вызванных коразолом, уже в первые дни магнийдефицитной диеты. С другой стороны, в исследованиях Maurois P [2001] был продемонстрирован положительный эффект солей магния.
В данных исследованиях снижение уровня магния в плазме и эритроцитах сопровождалось изменением судорожного порога. На 7 неделе магнийдефицитной диеты у крыс отмечалось повышение судорожной готовности на 30% при снижении пороговой дозы коразола с 79,20 (72,96÷85,97) мг/кг до 49,48 (47,57÷51,47) мг/кг, по сравнению с группой контроля (табл. 2). В дозе коразола 80 мг/кг у магнийдефицитных животных происходило укорочение периода до первого вздрагивания на 33,6% (p<0,05) и уменьшение времени до первого эпизода клонических судорог на 32,6% (p<0,05).
В литературе давно дискутируется роль дефицита магния в патогенезе судорог различной этиологии. Так, Derchansky M. с соавт. [2004] разработал модель, воспроизводящую судорожную активность в клетках гиппокампа in vitro, основанную на низком уровне магния в искусственной спинномозговой жидкости. При этом противосудорожную активность в рамках этой модели проявили вальпроаты и бензодиазепины. Swartzwelder H.S. с соавт. [1988] показали, что решающую роль в снижении судорожного порога при низком содержании магния in vitro играет угнетение ГАМК-ергического контроля. В проведенных исследованиях активность солей магния изучалась на модели судорог, вызванных введением коразола, механизм действия которого обусловлен блокадой хлорного канала ГАМКА-рецепторного комплекса [Воронина Т.А., Неробкова Л.Н., 2005; Куценко С.А., 2002]. Maurois P. с соавт. [2001] описал у магнийдефицитных мышей большую выраженность судорог, спровоцированных интенсивной звуковой стимуляцией. При данной патологии он отметил положительный эффект как классических противоэпилептических препаратов (в том числе и тропных к ГАМК-рецепторам), так и Mg хлорида, Mg лактата, Mg пидолата и Mg ацетилтаурината.
Таблица 2. Влияние солей магния (50 мг элементарного магния на кг массы тела) на пороговую дозу коразола (мг/кг) у крыс в условиях алиментарного дефицита магния
| Изучаемый препарат | TID16 (M-m÷M-m) | TID50 (M-m÷M-m) | TID84 (M-m÷M-m) |
| Интактная группа | 69,60 (64,12÷75,56) | 79,20 (72,96÷85,97) | 90,11 (83,01÷97,82) |
| Диета | 35,27 (33,91÷36,69) | 49,48 (47,57÷51,47) | 69,42 (66,74÷72,21) |
| Mg L-аспарагинат в комбинации с витамином В6 | 63,63 (56,41÷71,77) | 83,19 (73,75÷93,84) | 108,77 (96,42÷122,68) |
| Mg хлорид в комбинации с витамином В6 | 59,41 (52,79÷66,85) | 81,15 (72,12÷91,32) | 110,85 (98,51÷124,74) |
| Mg L-аспарагинат | 57,30 (53,95÷60,86) | 74,95 (70,57÷79,60) | 98,02 (92,29÷104,11) |
| Mg хлорид | 58,59 (50,65÷67,78) | 79,32 (68,57÷91,75) | 107,37 (92,82÷124,20) |
| магне В6 (Mg лактат дигидрат в комбинации с витамином В6) | 55,02 (51,45÷58,83) | 72,55 (67,85÷77,58) | 95,67 (89,47÷102,30) |
| Mg сульфат | 55,37 (51,27÷59,79) | 73,27 (67,84÷79,13) | 96,96 (89,78÷104,72) |
Примечание: TID (threshold increased dose) – доза коразола, вызывающая судороги интенсивностью 4 балла у 16, 50 и 84% животных.
В данных исследованиях (табл. 2) компенсация дефицита магния сопровождалась изменением пороговой дозы коразола, вызывающей судороги в 50% случаев. В зависимости от увеличения (восстановления) пороговой дозы коразола (TID50), снизившейся во время диеты, изучаемые соли могут быть ранжированы следующим образом: Mg L-аспарагинат в комбинации с витамином В6 [83,19 мг коразола/кг] ≥ Mg хлорид в комбинации с витамином В6 [81,15 мг коразола/кг] ≥ Mg хлорид [79,32 мг коразола/кг] > Mg L-аспарагинат [74,95 мг коразола/кг] > Mg сульфат [73,27 мг коразола/кг] > магне В6 [72,55 мг коразола/кг].
Таким образом, наибольшую противосудорожную активность в проведенных исследованиях продемонстрировали соли магния в комбинации с витамином В6 (Mg L-аспарагинат и Mg хлорид в комбинациях с витамином В6), которые заметно превзошли оба препарата сравнения (Магне В6 и Mg сульфат). Существуют литературные данные, свидетельствующие о том, что дефицит пиридоксина сам по себе может приводить к судорожному синдрому у детей [Goutieres F., Aicardi J., 1985].
Дефицит магния и атеросклероз
Дефицит магния является одним из условий возникновения таких ассоциированных с атеросклерозом патологий, как дисфункция эндотелия и тромбоз [Maier J.A. et al., 2004]. С другой стороны, дефицит магния является одним из звеньев в патогенезе нарушения метаболизма липидов, что проявляется, в том числе, изменением их содержания в крови и повышенным риском атерогенеза. Согласно литературным данным [Abraham G.E., Grewal H., 1990; Gueux E. et al., 1991; Harris M.N. et al. 1988; Peacock J.M. et al., 1999; Takeda R., 2001], магний является природным гиполипидемическим фактором. Takeda R. с соавт. [2001] отмечали, что у магнийдефицитных животных увеличивается уровень липопротеинов низкой плотности и триглицеридов и снижается концентрация липопротеинов высокой плотности. При этом указанные изменения имели прямопропорциональную зависимость от содержания магния в рационе.
В данном исследовании снижение уровня магния в плазме и эритроцитах сопровождалось повышением уровня триглицеридов на 35,2% (p<0,0001), общего холестерина – на 38,7% (p<0,0001), ЛПНП – в 4 раза (p<0,0001), индекса атерогенности – в 3 раза (p<0,0001), снижением концентрации ЛПВП – на 28,7% (p<0,0001), по сравнению с группой контроля. Содержание аполипопротеина А1 уменьшилось на 48,7% (p<0,001), а липопротеина В – выросло на 74,1% (p<0,001) (табл. 3). При этом между концентрацией атерогенной фракции липопротеинов и магнием в эритроцитах была обнаружена прямая отрицательная зависимость. Полученные данные свидетельствуют о нарушении липидного состава крови, а, следовательно, и о повышенном риске атеросклеротического поражения сердечно-сосудистой системы у магнийдефицитных животных.
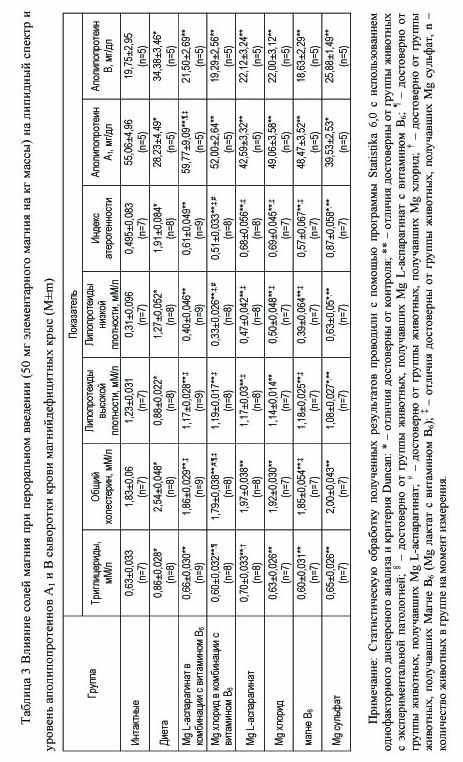
Наиболее явное влияние дефицита магния на липиды плазмы – повышение уровня триглицеридов [Rayssiguier Y. et al., 1981; Gueux E. et al., 1991; Nassir F. et al., 1995]. Важная характеристика магний-дефицитной гиперлипидемии – повышение липопротеинов с высоким содержанием триглицеридов и снижение концентрации липопротеинов высокой плотности [Gueux E. et al., 1991]. Увеличение липопротеинов с высоким содержанием триглицеридов связано со значительным увеличением в плазме концентрации аполипопротеина B [Nassir F. et al., 1995]. Снижение липопротеинов высокой плотности сопровождается соответствующим снижением в плазме аполипопротеина E и A1. В работе Gueux E. и соавт. [1984] сообщается о снижении активности липопротеинлипазы, печеночной липазы и лецитин-холестерол ацетилтрансферазы.
Параллельно с восстановлением уровня магния в плазме крови и эритроцитах, происходила нормализация липидного статуса животных. Содержание триглицеридов сыворотки крови наиболее выраженно снижалось у крыс, получавших Mg хлорид в комбинации с витамином В6 (0,60±0,03 мМ/л) и препарат сравнения магне В6 (0,60±0,03 мМ/л), в среднем на 30%, по сравнению с магнийдефицитными животными (p<0,05). При этом Mg хлорид в комбинации с витамином В6 по действию на данный показатель был (p<0,05) эффективнее, чем Mg L-аспарагинат (0,70±0,03 мМ/л).
Концентрация общего холестерина в сыворотке крови снизилась, по сравнению с диетой, и статистически значимо не отличалась от контрольных значений. При этом Mg сульфат продемонстрировал достоверно менее выраженное влияние на уровень общего холестерина (2,00±0,04 мМ/л), по сравнению с солями-лидерами – Mg хлоридом в комбинации с витамином В6 (1,79±0,04 мМ/л), магне В6 (1,85±0,05 мМ/л) и Mg L-аспарагинатом в комбинации с витамином В6 (1,86±0,03 мМ/л). Также были выявлены статистически значимые различия между Mg хлоридом и его комбинацией с витамином В6.
У животных, получавших соли магния, выявлен более высокий (р<0,0001), чем у магнийдефицитных, уровень ЛПВП и аполипопротеина А1. При этом концентрация ЛПВП в группе Mg сульфата была статистически значимо ниже, чем в других группах, получавших соли. Наибольшее содержание аполипопротеина А1 было зафиксировано в группах, получавших Mg L-аспарагинат и Mg хлорид в комбинациях с витамином В6 (на 111,7% (р<0,0001) и 84,2% (р<0,001) выше, чем в диетной группе, соответственно). Уровень аполипопротеина А1 в группе Mg L-аспарагината в комбинации с витамином В6 превосходил аналогичный показатель для группы Mg сульфата на 33% (р<0,01).
После введения изучаемых солей происходило возвращение к норме уровня ЛПНП. Наименьшие концентрации были обнаружены в группах солей, комбинированных с пиридоксином. При этом отмечались следующие межгрупповые различия: в группе Mg сульфата уровень ЛПНП (0,63±0,05 мМ/л) был достоверно выше, чем в группах других солей; Mg хлорид (0,50±0,04 мМ/л) отличался (р<0,05) от лидера – Mg хлорида в комбинации с витамином В6 (0,33±0,02 мМ/л). Параллельно со снижением ЛПНП, в группах, получавших соли магния, уменьшилось содержание в крови аполипопротеина В.
Индекс атерогенности оказался минимальным в группах, получавших Mg хлорид и Mg L-аспарагинат в комбинациях с витамином В6 и магне В6 (ниже, чем в диетной группе на 73,3% (р<0,0001), 68,1% (р<0,0001) и 70% (р<0,0001) соответственно). В группе Mg хлорида данный показатель был выше, чем в группе Mg хлорида в комбинации с пиридоксином, но ниже, чем у животных, получавших Mg сульфат.
Таким образом, в ходе данной серии исследований установлено, что дефицит магния приводит к повышению уровня триглицеридов, ЛПНП, общего холестерина, аполипопротеина В, индекса атерогенности и снижению концентрации ЛПВП. В результате лечения солями магния происходит нормализация уровня триглицеридов, общего холестерина, ЛПВП, аполипопротеина A1 и снижается концентрация ЛПНП, аполипопротеина В, индекса атерогенности. При этом комбинированные с пиридоксином соли магния обладали большим гиполипидемическим действием. По большинству показателей исследуемые соли магния статистически значимо превосходили препарат сравнения Mg сульфат и не уступали комбинированному препарату магнеB6.
Нарушения гомеостаза магния и его коррекция в патогенезе формирования уролитиаза
Одним из факторов, провоцирующих уролитиаз, как было показано еще 78 лет назад Hammarsten G, является дефицит магния [Hammarsten G., 1929]. Предполагается, что низкая экскреция магния с мочой является фактором риска при формировании кальциевых камней [Evans R.A. et al., 1967], так как магний выполняет роль одного из ингибиторов кристаллизации оксалата и фосфата кальция in vitro [Kohri K., 1988; Li M.K. et al., 1985; Bizaz S. et al., 1978]. Дефицит пиридоксина также может инициировать уролитиаз, а назначение его при гипероксалурии тормозит образование кристаллов оксалата.
В результате проведенных исследований было установлено, что в группе животных, получавших магний-дефицитную диету, снижение уровня магния в плазме и эритроцитах сопровождалась увеличением кальция в плазме крови на 20,29% (p<0,01).
При микроскопии мочевого осадка контрольных крыс у 20% животных встречались единичные трипельфосфаты. У всех крыс с гипомагнезиемией мочевой осадок был представлен фосфатами (фосфатами кальция – в среднем до 78 кристаллов или триппельфосфатами – до 20 кристаллов), оксалатами кальция в 50% случаев (до 12 кристаллов). Кристаллы у 80% магнийдефицитных животных располагались в виде конгломератов, чего не наблюдалось у группы контроля.
При измерении рН достоверных отличий выявлено не было и, в среднем, составило 6,25±0,18 для контрольной и 6,81±0,20 для диетной групп. Исследования электролитного состава мочи показали, что при дефиците магния, по сравнению с интактным контролем, наблюдается снижение суточной экскреции магния с мочой на 58,64% (р<0,05), повышение экскреции кальция на 82,4% (р<0,001), фосфатов на 75,4% (р<0,0001) и оксалатов на 90,7% (р<0,0001), увеличение соотношения Са/Mg в 4,5 раза (р<0,0001). Статистически значимо в магнийдефицитной группе увеличилась фракционная экскреция магния на 116% (p<0,0001), кальция на 259% (p<0,0001), фосфора на 454% (p<0,0001); снизился клиренс креатинина на 51% (p<0,05). При этом все показатели, характеризующие уролитиаз, находились в прямой отрицательной зависимости от концентрации магния в эритроцитах.
У животных, получавших соли магния, уровень магния в плазме и эритроцитах стал статистически значимо выше, чем в группе магний-дефицитных животных. Необходимо отметить, что, несмотря на статистически значимые межгрупповые различия, в группах животных, получавших препараты магния, все изменения были в пределах верхних границ физиологической нормы.
Концентрация магния в моче после введения солей повысилась, по сравнению с группами контроля и патологии. Суточная экскреция магния с мочой из расчета на 100 г массы тела животного статистически значимо возросла, по сравнению с магнийдефицитной группой. По данному показателю лидерами были Mg L-аспарагинат в комбинации с витамином В6 [939,23±57,65 мкг/100 г] и Mg хлорид в комбинации с витамином В6 [893,84±70,18 мкг/100 г]. Фракционная экскреция магния после введения солей снизилась, по сравнению с дефицитом (за исключением Mg сульфата), но по-прежнему отличалась от контроля без значимых межгрупповых различий.
Концентрация кальция в плазме крови статистически значимо снизилась, по сравнению с группой дефицита магния (от 10% в группе Магне В6 до 22% в группе Mg L-аспарагината), и не отличалась от контроля. Снижение уровня кальция в моче, по сравнению диетой (p<0,0001), составило от 55% для группы магне В6 до 63% для группы Mg L-аспарагината в комбинации с витамином В6. Фракционная экскреция кальция во всех группах, получавших соли магния, статистически значимо снизилась, по сравнению с группой алиментарного дефицита магния (от 69,5% для группы Mg сульфата до 79,5% для группы Mg хлорида в комбинации с витамином В6).
Параллельно с незначительным повышением концентрации фосфора в плазме крови при введении солей магния снизился уровень фосфора в моче, по сравнению с группой магнийдефицитных животных (p<0,0001). Наибольшее снижение достигнуто в группе Mg L-аспарагината в комбинации с витамином В6 (63,8%), наименьшее – в группе магне В6 (50,8%). Также в группах, получавших соли магния, статистически значимо, по сравнению с магнийдефицитными животными, снизилась фракционная экскреция фосфора.
После введения солей магния статистически значимо снизились соотношение Ca:Mg мочи, концентрация оксалатов в моче (лидером по коррекции этих показателей являлся Mg L-аспарагинат в комбинации с витамином В6), практически полностью исчезла кристаллурия. По степени коррекции гипероксалурии и выделения кристаллов исследуемые соли проявили сходную эффективность без статистически значимых различий.
Клиренс креатинина достоверно по сравнению с диетой увеличивался в группах животных, получавших Магне В6 (116,6%) и Mg L-аспарагинат (101,6%).
Таким образом, дефицит магния сопровождается выраженными изменениями состава мочи (кристаллурией, фосфатурией, кальциурией, оксалурией), являющимися главными предикторами уролитиаза. Коррекция гипомагнезиемии с помощью солей магния сопровождалась возвращением к норме уровня фосфатов, кальция, магния и оксалатов мочи. Хотя достоверных отличий между солями выявлено не было, прослеживается тенденция большей эффективности солей магния в комбинации с витамином В6.
Лечение препаратами магния является наиболее оптимальной терапией при гипероксалурии у пациентов со значительной экскрецией цитрата. Khan S.R. и соавт. [1993] полагают, что применение окиси магния связано с тем, что ионы магния связывают в моче до 40% щавелевой кислоты. С другой стороны, соли магния образуют с оксалатами соединения, которые по растворимости в 15-20 раз превосходят оксалат кальция. Согласно литературным данным [Monico C.G. et al., 2000], присутствие ионов магния необходимо для протекания реакции связывания глиоксиловой кислоты с α-кетоглютаровой кислотой при участии фермента α-кетоглутаратглиоксилат-карболигазы. При дефиците этого фермента в организме накапливается глиоксилат, который при участии лактатдегидрогеназы превращается в щавелевую кислоту.
Дефицит магния в патогенезе гиперальгезии и иммуно-воспалительной реакции
Дефицит магния часто сопровождает различные формы дисфункции ноцицептивной/антиноцицептивной системы [Alloui A. et al., 2003], которые лежат в основе таких патологий, как мигрень [Mauskop A., 1999; Smeets M.C. et al., 1994; Mauskop A. et al., 1993] и различные формы цефалгии [Goksel B.K. et al., 2006; Durlach J. et al., 2005; Altura B.M., Altura B.T., 2001; Mauskop A. et al., 2002]. В ряде исследований было показано, что существует связь между хронической мышечной болью (фибромиалгией, в частности) и снижением количества магния в эритроцитах и плазме [Eisinger J. et al., 1994; 1996; Abraham G.E., Flechas J.D., 1992; Prescot E. et al., 1994; Romano T.J., Stiller J.W., 1993], с другой стороны, недавно вновь был поднят вопрос об иммуновоспалительных процессах как важной составляющей в патологии дефицита магния [Weglicki W.B. et al., 1992; 1994; 2001]. Необходимо отметить, что именно воспалительная реакция, по мнению Mazur A. и соавт. [2007], является связующим звеном между дефицитом магния и развитием осложнений со стороны сердечно-сосудистой системы (атеросклероз, эндотелиальная дисфункция, тромбозы, пролапс митрального клапана).
Еще в 1932 году Kruse H.D. c соавт. сообщил, что периферическая вазодилатация и гиперемия являются частью симптомокомплекса, вызванного дефицитом магния у крыс. После этого многие исследователи [Bois P. et al., 1963; Kraeuter S.L., Schwartz R., 1980] стали связывать эти симптомы с дегрануляцией тучных клеток и последующим выделением гистамина и факторов воспаления, что аналогично анафилактической реакции. Weglicki W.B. с соавт. [1992] предположили, что воспаление при дефиците магния вызывается ранней нейрогенной реакцией, вследствие выделения субстанции P. Другие авторы полагают, что важным звеном воспалительного процесса является окислительный стресс [Rayssiguier Y. et al., 1992]. Фагоциты, активность которых тесно связана с системой комплемента, при дефиците магния проявляют высокую метаболическую активность и вырабатывают пероксиды, цитокины, медиаторы липидной природы, повреждающие ткани и ведущие к генерализованному воспалению [Weglicki W.B., Phillips T.M., 1992].
Недавние исследования показали, что клетки иммунной системы активируются уже через несколько дней дефицита магния [Malpuech-Brugère C. et al., 1999]. Поскольку концентрация магния в клетке жестко регулируется и изменяется в небольшой степени, даже когда внеклеточная концентрация магния резко падает, общий внутриклеточный магний при кратковременном дефиците может не изменяться [Vormann J. et al., 1998]. Этот факт позволяет предположить, что быстрая реакция иммунных клеток на дефицит магния вызывается снижением внеклеточной концентрации магния. Bussière F.I. с соавт. [2002] показали, что снижение кальция плазмы крови вызывает значительное уменьшение воспалительного ответа при дефиците магния. Этот факт подтверждает предположение о том, что одной из причин воспалительной реакции при дефиците магния служит нарушение регуляции уровня кальция в клетке.
Таким образом, дефицит магния играет важную роль в патогенезе иммуно-воспалительных процессов. В эксперименте такая системная иммуно-воспалительная реакция проявляется периферической вазодилатацией (гиперемия ушных раковин) [Kruse H.D. et al., 1932], увеличением общего количества лейкоцитов [Bussière F.I. et al., 2003; Malpuech-Brugère C. et al., 2000], массы селезенки [Bussière F.I. et al., 2003] и медиаторов воспаления (макрофагов, интерлейкина 6, ФНО-, 2-макроглобулина, 1-гликопротеина, нейтрофилов и эндотелиальных клеток) [Malpuech-Brugère C. et al., 2000].
В результате проведенных исследований было показано, что содержание животных на безмагниевой диете сопровождалось гиперемией открытых участков тела (ушных раковин, хвоста и лап). Наряду со снижением концентрации магния в плазме и эритроцитах, был отмечен подъем уровня кальция в плазме крови с 2,25±0,09 до 2,71±0,09 мМ/л (р<0,01). Кроме того, в 2 раза снизилось соотношение магний/кальций плазмы крови (р<0,0001).
На фоне развития дефицита магния у животных наблюдались признаки системной иммуно-воспалительной реакции. Так общее количество лейкоцитов в группе магнийдефицитных животных выросло в среднем на 47% (с 15,20±0,65 до 24,87±1,95 млн. в 1 мл крови), по сравнению с интактными животными. При этом в абсолютных величинах количество сегментоядерных нейтрофилов увеличилось с 2,33±0,153 до 4,40±0,98 млн./мл (р<0,001), эозинофилов – с 0,15±0,11 до 2,86±0,53 млн./мл (р<0,0001), моноцитов – с 0,66±0,07 до 1,48±0,82 млн./мл (р<0,01), лимфоцитов – с 12,00±0,49 до 15,53±0,68 млн./мл (р<0,01). В процентном соотношении в лейкоцитарной формуле магнийдефицитных крыс также произошло увеличение сегментоядерных нейтрофилов (с 15,33±0,41 до 17,67±1,08%), эозинофилов (с 1,00±0,71 до 11,67±2,68%), моноцитов (с 4,33±0,41 до 5,67±2,68%), появились единичные базофилы, чего не наблюдалось в группе интактного контроля. Относительное содержание лимфоцитов в группе дефицита магния снизилось с 79,00±0,71 до 62,67±2,27%.
Интенсивность гиперемии ушных раковин возросла с 0,22±0,16 в интактной группе до 1,76±0,23 балла в группе магнийдефицитных животных. Коэффициент массы селезенки увеличился с 0,36±0,03 % в интактной группе до 0,42±0,03 % в группе животных, получавших магнийдефицитную диету. При этом все показатели находились в прямой отрицательной зависимости от концентрации магния в эритроцитах.
При введении магниевых солей наблюдалось постепенное уменьшение иммуно-воспалительной реакции. Так, к 13 дню введения солей магния наблюдалось статистически значимое снижение количества лейкоцитов во всех исследуемых группах, по сравнению с магнийдефицитными животными. Восстановление общего количества лейкоцитов сопровождалось нормализацией лейкоцитарной формулы.
По мере устранения дефицита магния также уменьшалась гиперемия ушных раковин животных, и к 17 дню введения солей в группах животных, получавших Mg L-аспарагинат и Mg хлорид в комбинациях с витамином В6, интенсивность окраски ушных раковин статистически значимо снизилась, по сравнению с группой магнийдефицитных животных. Статистически значимой разницы между экспериментальными группами, получавшими соли магния, обнаружено не было.
К 20 дню введения магниевых солей коэффициент массы селезенки снизился с 0,42±0,03 % в группе магнийдефицитных животных до 0,33±0,04 % (в среднем) в группах животных, получавших соли магния. Достоверной разницы между экспериментальными группами, получавшими различные соли магния, также обнаружено не было.
Необходимо отметить, что соли магния приводили не только к компенсации дефицита магния, но и к снижению концентрации кальция в сыворотке крови. При этом уровень кальция у животных, получавших Mg хлорид и его комбинацию с пиридоксином, был достоверно ниже, чем у группы крыс, которым вводили магне В6.
Таким образом, применение солей магния приводит к достоверному снижению общего количества лейкоцитов крови, уменьшению интенсивности гиперемии ушных раковин животных, снижению коэффициента массы селезенки и, тем самым, устранению иммуно-воспалительной реакции, развивающейся у магнийдефицитных животных. В зависимости от скорости нормализации количества лейкоцитов в периферической крови соли магния можно расположить в следующем порядке: Mg хлорид > Mg хлорид в комбинации с витамином В6 > Mg L-аспарагинат > Mg L-аспарагинат в комбинации с витамином В6 > магне В6 (Mg лактат с витамином В6).
В патогенезе повышения порога болевой чувствительности при дефиците магния задействованы как центральные, так и периферические механизмы. По данным Malpuech-Brugère C. [2000] при дефиците магния наблюдается системная иммунно-воспалительная реакция, образуется большое количество медиаторов воспаления, простагландинов, которые повышают чувствительность нервных окончаний к раздражающим агентам. В 1997 году Dubray C. с соавт. [1997] описал дефицит магния как новую модель гиперальгезии центрального генеза. При этом механическая гиперальгезия прекращалась после введения дизоцилпина (МК-801) – неконкурентного антагониста NMDA-рецепторов [Dubray C. et al., 1997]. Как показано в исследованиях in vitro, при низких концентрациях магния облегчается открытие Na+-Ca2+-каналов NMDA-рецепторов [Mayer M.L., 1984]. В результате введения MgSO4 под мозговые оболочки у магнийдефицитных животных повышался болевой порог к механическим раздражителям. Это подтверждается исследованиями Ishizaki K. с соавт. [1999] и Takano Y. с соавт. [2000], в которых подоболочечное введение MgSO4 приводило к блокированию второй NMDA-зависимой фазы реакции в формалиновом тесте. Begon S. с соавт. [2000] и Xiao W.H., Bennett G.J. [1994] показали, что как системное, так и внутриоболочечное введение магния оказывает «антигиперальгезический» эффект у животных с нейропатической болью.
В наших исследованиях при исследовании спинальной альгезии в условиях дефицита магния было выявлено статистически значимое повышение болевой чувствительности (табл. 4). Так, у магнийдефицитных крыс напряжение, вызывающее рефлекс отдергивания хвоста, снизилось на 32,5%, вокализацию – на 20,5%, пролонгированную вокализацию – 23,8%, по сравнению с интактным контролем. При исследовании болевой чувствительности в тесте механического давления в группе, получавшей диету, выявлено снижение массы груза, вызывающей отдергивание лапы, на 42% (р<0,05).
Была обнаружена прямая зависимость между уровнем магния и порогом болевой чувствительности животных (r=0,71; p<0,0001).
Таблица 4. Влияние солей магния при пероральном введении (из расчета 50 мг элементарного магния на кг массы) на величину болевого порога у крыс в условиях алиментарной гипомагнезиемии (Mm)
| | Тест электрического раздражения корня хвоста, V (вольт) | Тест механического давления | ||
| Рефлекс отдергивания хвоста | Вокализация | Пролонгированная вокализация | Болевой порог, граммы | |
| Интактные | 0,35±0,02 (n=7) | 0,46± 0,02 (n=7) | 0,58±0,01 (n=7) | 292,92±9,28 (n=12) |
| Диета | 0,24±0,01* (n=11) | 0,36±0,02* (n=11) | 0,44±0,02* (n=11) | 166,47±4,37* (n=17) |
| Mg L-аспарагинат с витамином В6 | 0,37±0,01**,‡ (n=10) | 0,47±0,02**,‡ (n=10) | 0,59±0,01**,‡ (n=10) | 325,83±6,39*,**,¶,†,‡,# (n=6) |
| Mg хлорид с витамином В6 | 0,38±0,01**,‡ (n=9) | 0,44±0,01** (n=9) | 0,58±0,01**,‡ (n=9) | 323,33±8,33*,**,¶,#,†,‡ (n=6) |
| Mg L -аспарагинат | 0,37±0,02**,‡ (n=9) | 0,46±0,02**,‡ (n=9) | 0,58±0,01**,‡ (n=9) | 263,75±11,87**,‡ (n=4) |
| Mg хлорид | 0,36±0,02**,‡ (n=11) | 0,43±0,01** (n=11) | 0,58±0,01** (n=11) | 260,00±9,72*,**,‡ (n=7) |
| магне В6 | 0,36±0,02**,‡ (n=11) | 0,47±0,01**,‡ (n=11) | 0,59±0,01**,‡ (n=11) | 287,50±10,27**,‡ (n=6) |
| Mg сульфат | 0,32±0,01** (n=9) | 0,42±0,01 (n=9) | 0,54±0,01*,** (n=9) | 191,43±12,79* (n=7) |
Примечание: Статистическую обработку полученных результатов проводили с использованием однофакторного дисперсного анализа и Shieffe: * – отличия достоверны от контроля; ** – отличия достоверны от группы животных с экспериментальной патологией; § – достоверно от группы животных, получавших Mg L-аспарагинат с витамином В6; ¶ – достоверно от группы животных, получавших Mg L-аспарагинат; # – достоверно от группы животных, получавших Mg хлорид; † – достоверно от группы животных, получавших магне В6 (Mg лактат с витамином В6); ‡ – отличия достоверны от группы животных, получавших Mg сульфат, n – количество животных в группе на момент измерения.
В результате перорального введения солей магния отмечалось достоверное восстановление порога болевой чувствительности в тесте электрического раздражения хвоста до величин, характерных для интактного контроля (табл. 4). В целом, по большинству показателей соли магния, как комбинированные с пиридоксином, так и без него, не уступали по эффективности препарату сравнения магне В6, хотя значимых различий между ними выявлено не было. Животные, получавшие препарат сравнения Mg сульфат, были статистически значимо более чувствительны к действию электрического тока, чем крысы, получавшие все другие соли магния.
В условиях компенсации дефицита магния у животных наблюдалась нормализация порога болевой чувствительности при механическом раздражении. Так на 15 день введения солей у животных, получавших Mg L-аспарагинат и Mg хлорид в комбинациях с витамином В6, отмечалось максимальное, по сравнению с другими группами, восстановление порога болевой чувствительности. Остальные соли по данному показателю статистически значимо отставали от солей – лидеров. Mg L-аспарагинат и Mg хлорид достоверно превосходили препарат сравнения Mg сульфат.
Таким образом, в данной серии экспериментов было показано, что дефицит магния приводит к гиперальгезии, в которой задействованы как центральные, так и периферические механизмы. Это согласуется с существующими литературными данными [Begon S. et al., 2001].
Известно, что ионотропные рецепторы возбуждающих аминокислот (NMDA и AMPA) играют важную роль в передаче болевых импульсов в спинном мозге и механизмах повышения чувствительности к боли [Coderre T.J., Melzack R.J., 1992; Seltzer Z. et al., 1991]. При кратковременной болевой стимуляции AMPA-рецепторы опосредуют передачу болевого импульса и обеспечивают базовый уровень болевого восприятия, в то время, как NMDA-рецепторы остаются в неактивном состоянии, т.к. заблокированы ионами магния при нормальном уровне этого биоэлемента в организме [Mayer M.L., Westbrook G.L., 1987]. Однако, при хронической боли активированы оба типа рецепторов. Интенсивная стимуляция первичных афферентных волокон вначале приводит к активации AMPA и пептидных рецепторов, а затем, когда частота стимулирующих импульсов превышает определенный порог, потенциал-зависимый магниевый блок NMDA-рецепторов устраняется и данные рецепторы активируются [Mayer M.L., Westbrook G.L., 1987]. Как следствие, открытие рецепторного канала ведет к поступлению кальция в нейроны, что, в свою очередь, вызывает активацию протеинкиназы С, образование оксида азота и, в конечном счете, транскрипцию генов раннего ответа (c-Fos; c-Jun) [Ren K., Dubner R., 1999; Woolf C.J., Costigan M., 1999]. Активность NMDA-рецепторов может также модулироваться пептидами, такими как субстанция Р, которая высвобождается вместе с глутаматом из первичных афферентных нервных волокон и поддерживает передачу болевой импульсации [Liu H. et al., 1997; Malcangio M. et al., 1998]. Все вышеописанные процессы отвечают за долговременные изменения, связанные с хронической болью [Coderre T.J., 1993; Wong, C.S. et al., 1995]. Дефицит магния облегчает открытие канала NMDA-рецептора. Кроме того, при магнийдефицитной диете Coderre T.J [1993], Mayer M.L. и Miller R.J. [1990] наблюдали дозозависимый анальгетический эффект, следующий за введением под мозговые оболочки ингибитора протеинкиназы С хелеритрина. Протеинкиназа С является ключевым ферментом в цепи событий, следующих за активацией NMDA-рецепторов, кроме того, этот процесс зависит еще и от связывания глутамата и глицината со своими участками на этом рецепторе. Специфичный ингибитор синтетазы оксида азота (NO) 7-нитроиндазол при дефиците магния оказывает антигиперальгезический эффект. NO играет важную роль в активации NMDA-рецепторов, а следовательно, важен при передаче болевых импульсов в спинном мозге. NO участвует в формировании механизма положительной обратной связи, благодаря которому повышается высвобождение глутамата и субстанции Р из первичных афферентных окончаний [Galland L., 1991-1992; Sorkin L.S., 1993].
В ходе исследований установлено, что при пероральном введении солей магния происходит компенсация дефицита магния и нормализация, повысившейся во время магнийдефицитной диеты, центральной и периферической болевой чувствительности. При этом при оценке периферической чувствительности выявлено, что по эффективности Mg хлорид и Mg L-аспарагинат комбинированные с пиридоксином, статистически значимо превосходили данные соли в чистом виде. По большинству показателей все соли статистически значимо превосходили препарат сравнения Mg сульфат и были сопоставимы с магне В6. Таким образом, при пероральном введении солей магния происходит угнетение активности ряда звеньев ноцицептивной системы и усиливается эффективность механизмов контроля за восприятием болевых импульсов.
Роль магния в регуляции гемостаза и гемореологии
Впервые о возможном угнетающем действии магния на свертывающую систему крови сообщил Shionoya Т. в 1927 г. С тех пор было проведено множество исследований с целью объяснения механизма влияния магния на процессы свертывания крови, агрегацию тромбоцитов и фибринолиз. В группе магнийдефицитных животных было показано значительное уменьшение активированного парциального тромбопластинового и тромбинового времен, увеличение показателей вязкости крови, а при последующем введении магния восстановление данных показателей [Scheibe F., 2000; Seelig M.S., 1993]. Кроме того, существует множество исследований влияния дефицита магния на процессы агрегации тромбоцитов. В условиях гипомагнезиемии отмечены увеличение АДФ-индуцированной и коллаген-индуцированной агрегации тромбоцитов, снижение уровня антитромбина-3, протеина S, тромбоксана В2, протеина С и эндотелина-1 [Scheibe F., 2000; Seelig M.S., 1993; Kh R. et al., 2000].
В проведенных исследованиях снижение уровня магния в организме животных сопровождалось изменением ряда гемореологических параметров. К 8 неделе диеты в группе магнийдефицитных крыс произошло статистически значимое увеличение показателей вязкости крови во всем диапазоне скоростей сдвига. При скорости сдвига 200 с-1, 50 с-1, 10 с-1 показатели вязкости крови превышали величины контрольной группы в среднем на 19%, 43% и 85% соответственно. Индекс агрегации эритроцитов достоверно увеличился на 36%, по сравнению с интактными животными. Данные изменения могут свидетельствовать о выраженных нарушениях структуры и функции эритроцитарных мембран, а также активации процессов агрегатообразования. Полученные результаты согласуются с ранее проведенными исследованиями Scheibe F. и соавт. [2000], в которых показано увеличение вязкости крови морских свинок в условиях дефицита магния.
В эксперименте в группе магнийдефицитных животных отмечались изменения структурно-функциональных свойств мембран эритроцитов, что подтверждается увеличением вязкости взвеси эритроцитов. При скоростях сдвига 200 с-1, 50 с-1 и 10 с-1 наблюдалось достоверное увеличение вязкости взвеси эритроцитов, по отношению к контрольной группе крыс, на 20,76%, 12,71% и 18,80% соответственно.
В условиях алиментарного дефицита магния у животных происходило повышение процессов агрегации тромбоцитов. При добавлении индуктора АДФ в концентрации 0,5 мкмоль индекс агрегации статистически значимо увеличивался на 55,45%, что свидетельствует о повышенной стимуляции обратимой первичной волны агрегации тромбоцитов. Процессы полной активации тромбоцитов, выделения гранулярного содержимого и, тем самым, включения отсроченной вторичной волны агрегации тромбоцитов, исследовали при добавлении АДФ-индуктора в концентрации 5,0 мкмоль. При этом наблюдалось достоверное увеличение степени агрегации на 66,19%. В коллаген-индуцированной агрегации в группе магнийдефицитных животных степень агрегации повысилась на 63,21% (р<0,05), что указывает на увеличение сосудистого механизма агрегации тромбоцитов. Количество тромбоцитов крови магнийдефицитных крыс, по отношению, к интактной группе достоверно не изменялось.
Вязкость бедной тромбоцитами плазмы статистически значимо увеличилась на 15,72%. Увеличение вязкости бедной плазмы может быть связано с достоверным, по отношению к группе интактных крыс, уменьшением времени образования нитей фибрина в группе магнийдефицитных животных на 26,65%. При этом в данной группе показатели тромбинового и протромбированного времени, а также активированного парциального тромбопластинового времени (АПТВ), по сравнению с интактными крысами, статистически значимо не изменялись.
Между содержанием магния в эритроцитах и некоторыми показателями гемореологии, агрегации и гемостаза была обнаружена достоверная зависимость.
К 20 дню введения солей магния наблюдалось уменьшение показателей вязкости крови. При скорости сдвига 200 с-1 в группе животных, получавших Mg L-аспарагинат в комбинации с витамином В6, вязкость крови снизилась на 19,13%; Mg хлорид в комбинации с витамином В6 – на 24,43%; Mg L-аспарагинат и Mg хлорид – на 22,93% и 18,96% соответственно; а магне В6
