Концепция современного естествознания рабочая программа, методические указания по выполнению контрольных работ для студентов заочной формы обучения
| Вид материала | Рабочая программа |
| Примеры решение задач Примеры решения задач Примеры решения задач |
- Методические указания по выполнению контрольных работ для студентов заочной формы обучения, 442.15kb.
- Методические указания для студентов заочной формы обучения, 310.64kb.
- Методические указания по их выполнению по дисциплине «исследование систем управления», 134.73kb.
- Методические указания к выполнению контрольных работ по дисциплине «Налоги и налогообложение», 387.21kb.
- Методические указания по выполнению контрольных работ для студентов заочной формы обучения, 255.7kb.
- Программа и методические указания к выполнению контрольных работ для студентов заочной, 243.39kb.
- Методические указания по выполнению контрольных работ для студентов заочной формы обучения, 343.56kb.
- Методические указания по выполнению рефератов и контрольных работ по курсу «экология», 187.76kb.
- Методические указания по выполнению контрольных работ для студентов специальности 080402, 146.59kb.
- Методические указания к выполнению контрольных работ для студентов направления (521100), 252.97kb.
ПРИМЕРЫ РЕШЕНИЕ ЗАДАЧ
I. Шар и сплошной цилиндр имеют одинаковую массу (5 кг каждый) и катятся с одинаковой скоростью 10 м/с. найти отношение их кинетических энергий.
Дано: m1=m2 = m; v1=v2 = v
Найти: Eк1 / Ек2
Решение: по условию шар и сплошной цилиндр катятся, т.е. происходит поступательное движение их центров масс и одновременно вращательное движение этих тел относительно их собственных осей вращения. Кинетическая энергия катящегося шара равна:
а цилиндра: Ек1= m v2 / 2 + I1 ω12 / 2,
Ек2 = m v2 / 2 + I1 ω22 / 2,
где I1, I2 и ω1 , ω2 - моменты инерции и угловые скорости соответственно шара и цилиндра.
Момент инерции шара I1 = 0,4 m r12 , а цилиндра I2 = 0,5 m г22 , где r1 и г2 -радиусы шара и цилиндра. Так как линейная и угловая скорость связаны соотношением ω = v/r, то выражение для EK1 и Еk2 приобретает следующий вид:
EK1 = m v2 / 2 + 0,4 m r12 ω 2 / r12 = 0,7 m v2
Ек2 = m v2 / 2 + 0,5 m r22 ω 2 / г22 = m v2
откуда ЕК1/ Ек2 = 0,7
Ответ: Ек1 / Ек2 = 0,7
2. Кислород массой 320 г. нагревают при постоянном давлении от 300 до 310 К. Определить количество теплоты, поглощенное газом, изменение внутренней энергии и работу расширения газа.
Дано: m = 320 г. = 0,32 кг; Т1 = 300 К; Т2 = 310 К; М = 32 · 10-3 кг/моль Найти: A, Q, ∆U
Решение: считаем газ идеальным. Количество теплоты, необходимое для нагревания газа при постоянном давлении, находим, используя 1 начало термодинамики для изобарного процесса:
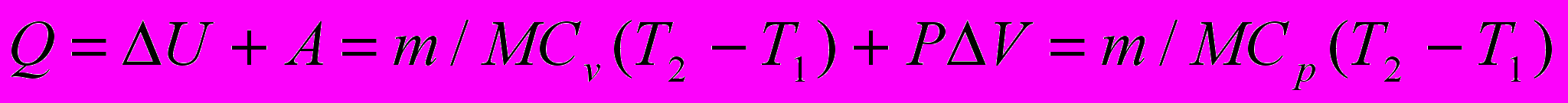
где молярные теплоемкости при постоянном объеме Cv и при постоянном давлении Ср равны:
Cv = iR/2; Cp = (i + 2)R/2
Молекулы кислорода двухатомные, поэтому для них число степеней свободы i = 5. С учетом записанных выражений для молекулярных теплоемкостей, выражение для Q принимает вид:
Q = m(i + 2)R(T2-T1)/2M (1)
Изменение внутренней энергии:
∆U=(m/M)Cv (T2-T1)=(m/M)(i/2) R(T2-T,) (2)
Работа расширения газа при изобарном процессе А = Р∆V так как согласно уравнению Клайперона-Менделеева: Р∆V= (m / M) R ∆T, то получаем:
А = Р∆V= (m/М)R∆T ={m/М)R(Т2-Т1) (3)
Подставляя числовые значения в формулы (1), (2) и (3), имеем:
Q = [0,32 (5+2) 8,31 (310 - 300] / (2 • 32 • 10-3) = 2910 Дж
∆U=[0,32 • 5 • 8,3 1 (310 - 300)] / (2 • 32 – 10-3) = 2080 Дж
А = [0,32 - 5 • 8,3 1 (310 - 300)] / 32 – 10-3 = 830 Дж
Ответ: Q = 2910 Дж; ∆U= 2080 Дж; А = 830 Дж
3. Давление света (длина волны 0,55 мкм) нормально падающего на зеркальную поверхность равно 9 мкПа. Определить концентрацию фотонов вблизи поверхности.
Дано: λ = 0,55 • 10-6 Па, ρ=1
Найти: n
Решение: давление света при нормальном падении на поверхность с коэффициентом отражения р:
p = I(l+ρ)/c = w (1+ρ) (1)
где I - интенсивность излучения, с - скорость света в вакууме, w = I / с - объемная плотность энергии излучения.
Энергия одного фотона ε = hс / λ, где h - постоянная Планка. Объемная плотность энергии излучения:
w= nhc/ λ (2)
где n – концентрация фотонов.
Подставляем (2) в (1) получаем:
p = nhc(l+ρ)/ λ (3)
откуда: n= λP/hc(1+ρ)
n = (0,55 • 10 -6 · 9 · 10-6) / [(6,62 • 10-34 • 3 • 108 (1 + 1)] = 2,49 • 1013 м--3
Ответ: n = 2,49 • 1013 м-3
4. Красная граница фотоэффекта для никеля равна 0,257 мкм. Найти длину волны света, падающего на никелевый электрод, если фототок прекращается при задерживающей разновидности потенциалов, равной 1,5В.
Дано: λк = 0,257 мкм; U= 1,5 В
Найти: λк
Решение: Согласно уравнению Эйнштейна для внешнего фотоэффекта
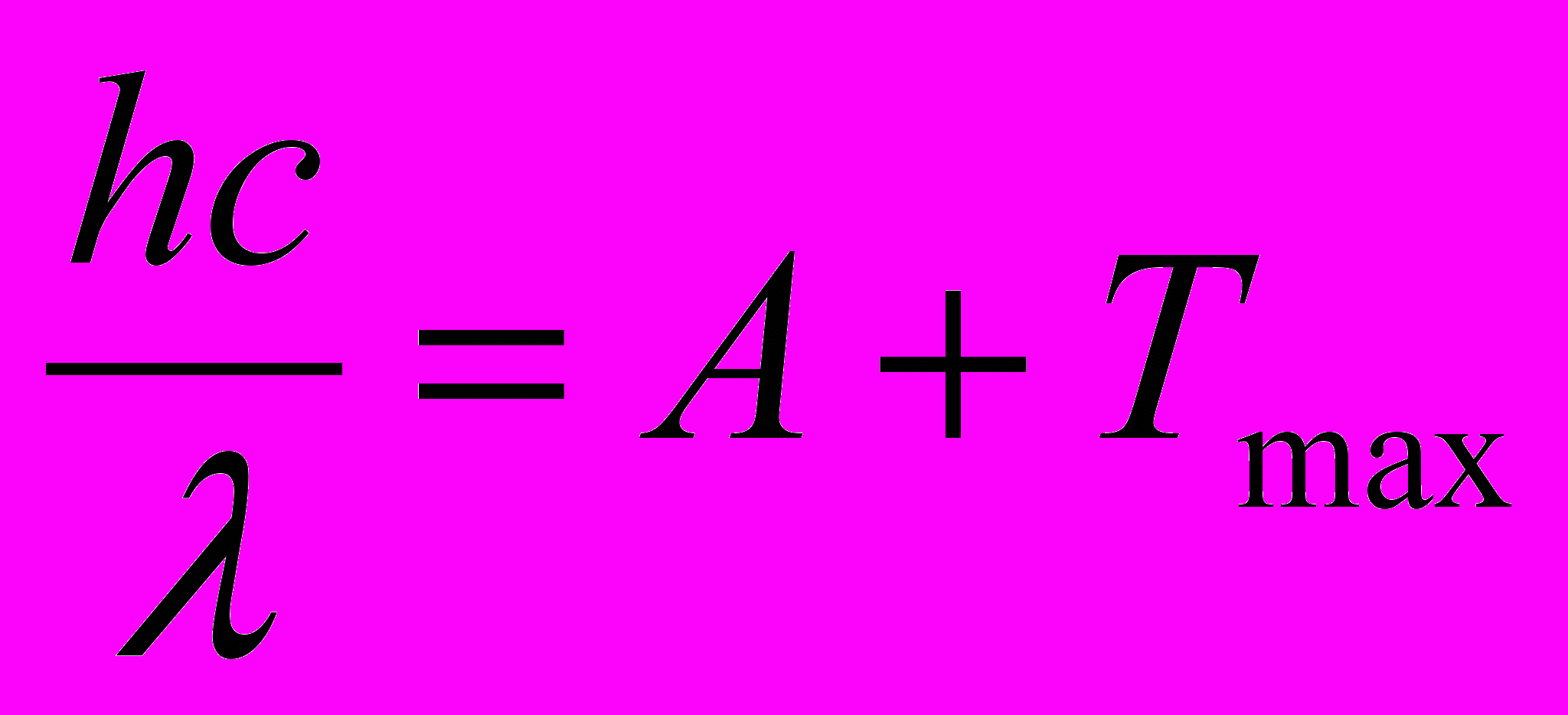
где h - постоянная Планка; с - скорость света в вакууме; λ - длина волны света; А -работа выхода электронов из металла; Ттах - максимальная кинетическая энергия фотоэлектронов.
Красная граница фотоэффекта определяется из условия равенства энергии фотона е = hc / λ работе выхода электронов A, т.е.
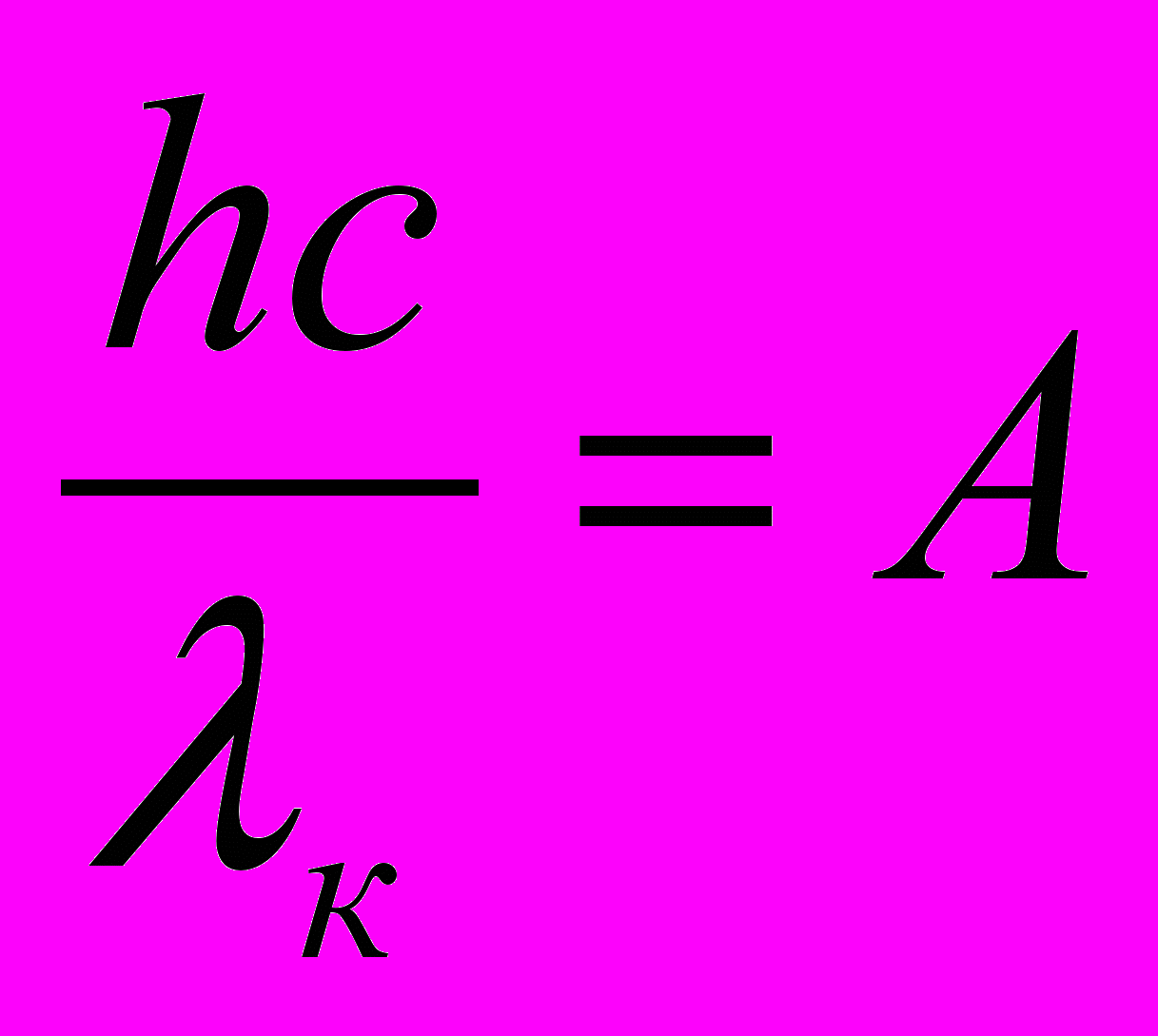
Максимальная кинетическая энергия фотоэлектронов может быть определена через задерживающую разность потенциалов U:
Tmax=eU
где е - элементарный заряд (заряд электрона).
Подставляя выражение (2) и (3) в (1), получим
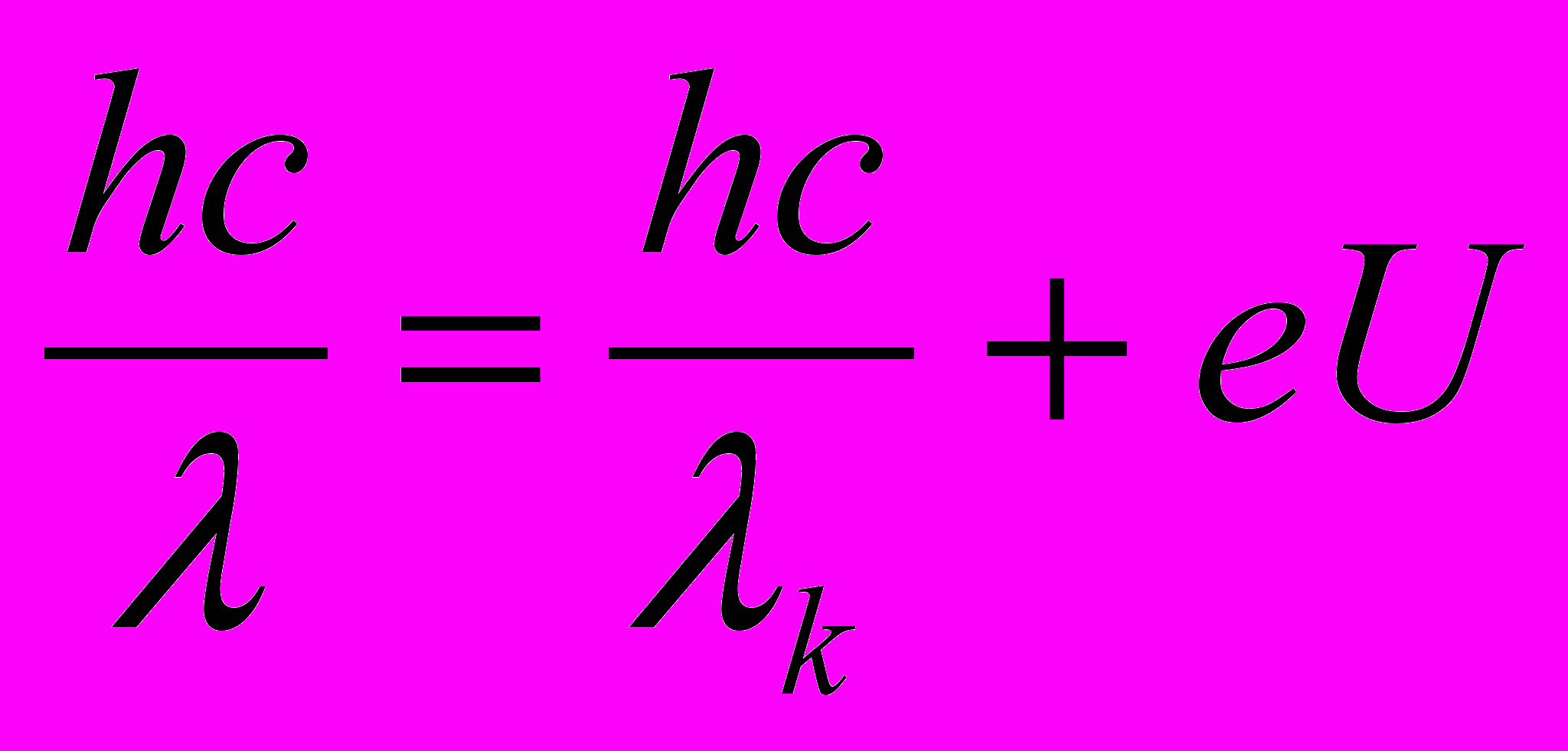 (4)
(4)Из уравнения (4) найдем длину волны света:
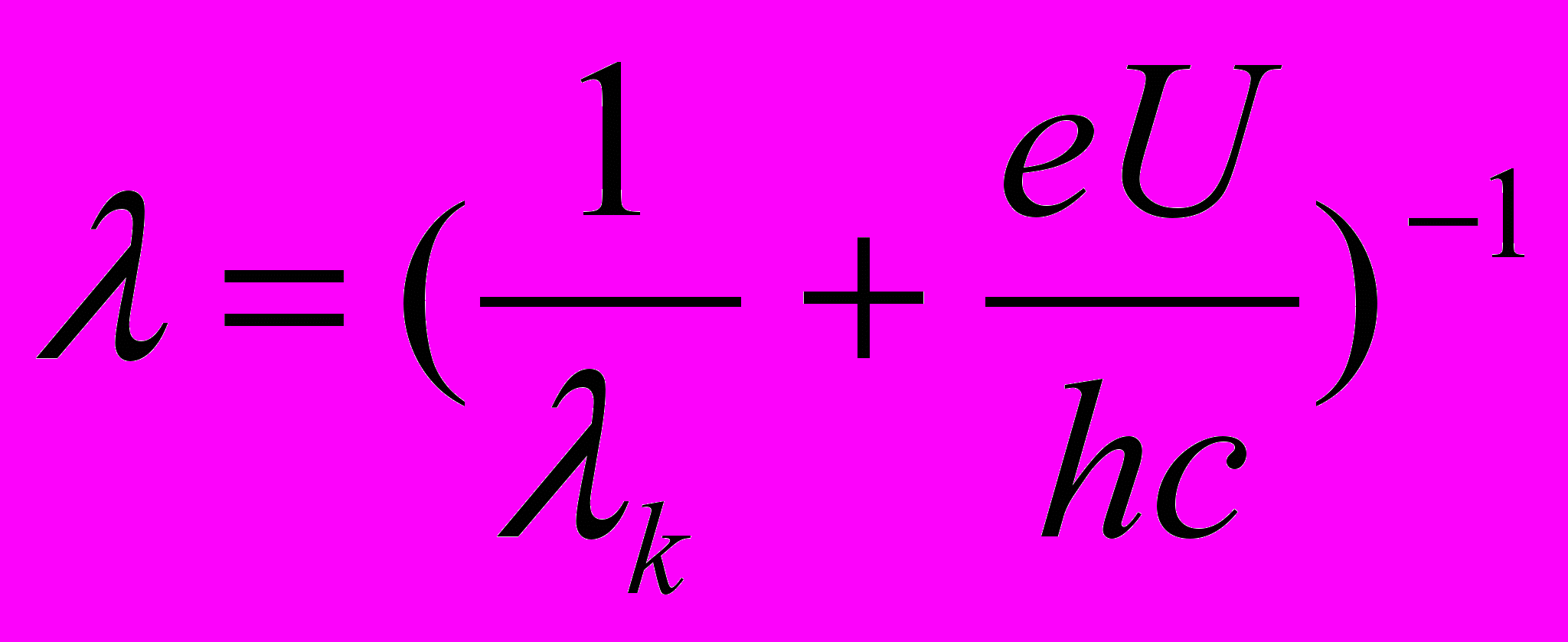 (5)
(5)Подставляя в (5) числовые значения, получим:
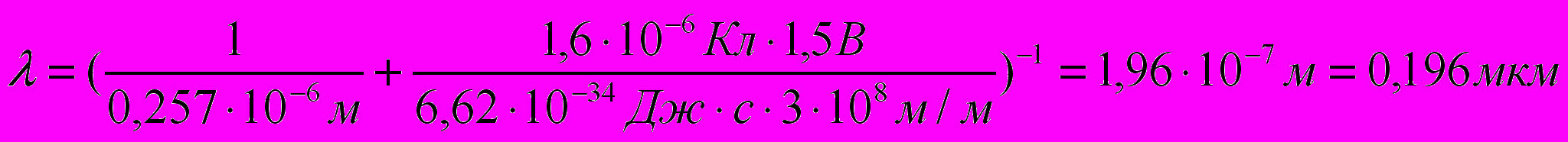
Ответ: λ = 0,196 мкм
Задание № 7. В это задание включены задачи, решение которых даст возможность студенту уяснить принцип корпускулярно-волнового дуализма, который сыграл важнейшую роль для построения новой физической теории - квантовой механики. В основе квантовой механики лежат гипотеза де Бройля, соотношения неопределенностей Гейзенберга. Фундаментом квантовой механики является уравнение Шредингера, которое играет такую же роль как и уравнения Ньютона в классической механике. Законы квантовой механики носят вероятностный характер.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
1. Вычислить длину волны де Бройля электрона, движущегося со скоростью v =0,75 с (с - скорость света в вакууме).
Дано: v = 0,75 с; с = 3 • 108 м/с
Найти: λ
Решение: длина волны де Бройля для частиц определяется формулой:
λ = h/p (1)
где: h - постоянная Планка, р - импульс частицы. При движении частиц со скоростями, близкими к скорости света в вакууме, масса частицы зависит от скорости. Поэтому в выражении для импульса
p=mv m = f(v), (2)
.
где m - масса движущейся частицы. Зависимость массы от скорости выражается отношением:
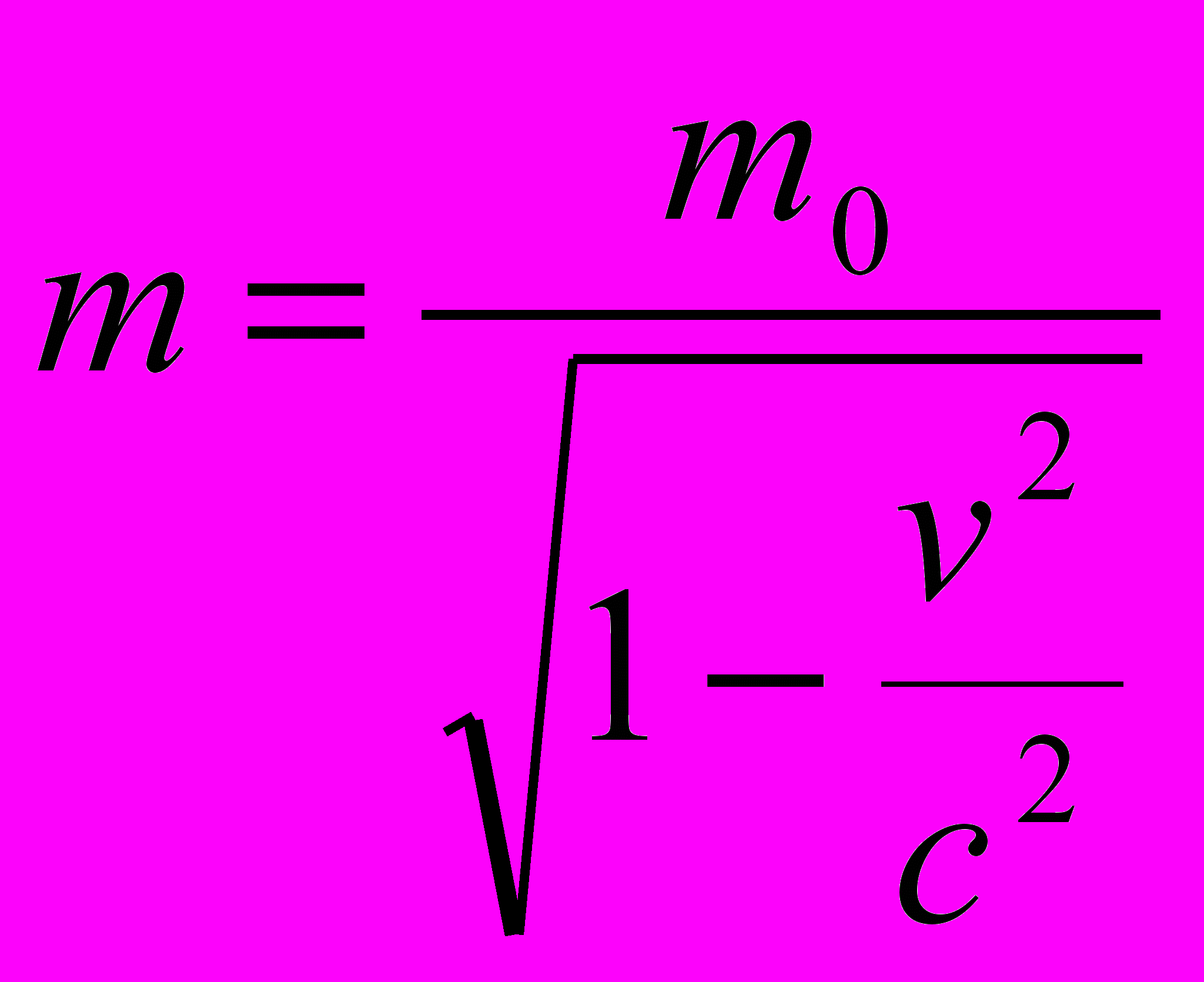 (3)
(3)где m0- масса покоя частицы, v - скорость движения частицы. Подставив в выражение (1) значение р и m из формулы (2) и (3), получим:
λ = h√(l-v2/c2)/m0v
По условию задачи скорость движения электрона равна 0,75 с. Подставив это значение в формулу (4) имеем:
λ = h √ (1 - 0,752 с2 / с2) / m0 0,75 с = (h / m0 с) [√ (1 - 0,752)] / 0,75]
где (h / m0 с) - компгоновская длина волны Λ. Учитывая это, получим:
λ=0,88Λ
Находим из таблиц Λ или вычисляем, зная массу покоя электрона
Λ =2,42 10-9м=2,42нм
λ = 0,88·2,42 нм = 2,24 нм
Ответ: λ= 2,24 нм
2. Масса движущегося электрона в три раза больше массы его покоя. Чему равна минимальная неопределенности координаты электрона? .
Дано: m = 3m0; m0= 0,91 • 10-30 кг
Найти: ∆хmin
Решение: согласно соотношениям неопределенности Гейзенберга
∆x∆p≥h/2π (1)
где ∆x и ∆p - неопределенности координаты и импульса частицы; h - постоянная Планка. Учитывая, что импульс равен
p=mv (2)
где m - масса, a v - скорость частицы, соотношение (I) можно представить в виде:
∆x≥h/2πm∆vx (3)
Такая неопределенность скорости ∆vx , как и сама скорость не может превышать скорости света в вакууме, то
.
∆xmin = h/2πmc (4)
.
по условию задачи m =3m0, тогда (см. (4))
∆xmin = h/6πm0 c
6,62 · 10-34 Дж с / (6 • 3,14 • 0,91 • 10-30 кг 3 • 108 м/с) = 1,28 • 10-13 м Ответ: ∆xmin= 1,28·10-13 м
Задание № 8. Выполняя это задание студент должен знать, что энергия взаимодействия нуклонов в ядрах атомов обусловлена сильным взаимодейств Энергия связи, приходящейся на один нуклон различна для разных ядер. Зависимость энергии связи от атомного числа делает энергетически возможным два процесса:
1 . деление тяжелых ядер на несколько легких ядер;
2. синтез легких ядер (термоядерные реакции).
Термоядерные реакции протекают в недрах Солнца и звезд. Энергия, излучаемая Солнцем является источником жизни на Земле.
Во всех ядерных реакциях выполняются законы сохранения: энергии, импульса, момента импульса, электрического заряда, числа нуклонов и др.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
1. Вычислить в мегаэлектрон-вольтах энергию ядерной реакции
.
59 1 60
С0 +n → Со+γ
27 0 27
.
.
Выделяется или поглощается энергия при этой реакции?
Решение: энергия ядерной реакции:
Е = ∆mс2 (1)
где ∆m - дефект массы реакции, с - скорость света в вакууме. Если ∆m - выражать в а.е.м., то формула (1) примет вид:
Е = 931∆m [МэВ]
Дефект массы равен ∆m=mCo60+mn-mCo59
Так как число электронов до и после реакции сохраняется, то вместо значений масс ядер воспользуемся значением масс нейтральных атомов, которые приводятся в справочных таблицах •
mСо59 = 58,95182 а.е.м.; mn = 1,00867 а.е.м.
mCo 60 = 59,95250 а.е.м.
∆m = (59,96075 - 59,95250) а.е.м. = 0,00825 а.е.м.
Реакция идет в выделением энергии, т.к. ∆m > 0
Е = 931 МэВ/а.е.м. · 0,00825 а.е.м. = 7,66 МэВ
2. Сколько энергии выделяется при образовании 1 г гелия из протонов и нейтронов?
Дано: m = 1,0 г = 10-3 кг
Найти: Е
Решение: выделившуюся энергию найдем по формуле взаимосвязи масс и
энергии
Е = ∆mс2n
.
где ∆m - изменение массы при образовании одного ядра атома гелия (дефект массы), с - скорость распространения света, n - число атомов гелия в массе m. Дефект массы определим из равенства
∆m=Zmp+(A-Z)mn-ma
где Z - зарядовое число элемента, равное порядковому номеру элементам таблице Менделеева, для гелия Z = 2; mр - масса прогона, mn - масса нейтрона.
mр = 1,00783 а.е.м.; mn = 1,00867 а.е.м.
.
массовое число, для гелия А =4; mа - масса атома гелия; mа = 4,00260 а.е.м. Подставим эти значения в расчетную формулу (2):
∆m = [2 - 1,00783 + (4 - 2) 1,00867 - 4,00260] а.е.м. = 0,0304 а.е.м. = 5,05 10-29 кг
Учтем, что n = (m / M) Na
Число атомов в одном г. равно n = 10-3 NA/M,
где NA - постоянная Авогадро, М - молярная масса; для гелия М = 4 • 10-3 кг/моль
Подставим значения в формулу (1):
Е = (5,05 · 10-29 кг • 10-3 • 6,023 • 1023 моль-1• 9 • 101б м2/с2 / 4 -10-3 кг/моль = 6,84 • 1011 Дж Ответ: Е =6,84 • 1011 Дж
.
Задание № 9. Вода - основа жизни на Земле. Студенты должны уяснить себе, что уникальные свойства воды связаны со структурой ее молекул. Важное значение в живой природе имеют водородные связи, на которых держится вся жизнь на Земле. Вода является не только уникальным растворителем, но и средой обитания многих живых организмов. Обратите внимание, что максимальная плотность у воды при 4 °С. .
Задания № 10, № 11 и № 12. Выполнение этого задание преследует цель акцентировать внимание студентов на важнейших для жизни химических элементов -органогенных элементах. Студент должен уяснить, что уникальными свойствами обладает не только углерод - основа жизни на Земле, но и другие химические элементы, которые наиболее распространены в живых организмах и составляют приблизительно 99 % массы живого.
Ниже приводится фрагмент из текста ответа на задание № 12.
К
ислород, (лат. Oxygenium), О, химический элемент VI группы периодической системы Менделеева; ат. н. 8, ат. м. 15,9994. В свободном виде встречается в виде двух модификаций - О2 ("обычный" кислород) и О3 (озон).
О2 - самый распространенный на Земле элемент; в виде соединений составляет около 1/2 массы земной коры; входит в состав воды (88,8 % по массе) и множество тканей живых организмов (ок. 70 % по массе).
Физиологическое значение кислорода огромно. Это единственный газ, который живые организмы могут использовать для дыхания. Окисление кислородом углеводов, жиров и белков служит источником энергии живых организмов. В организме человека содержание кислорода составляет 61% от массы тела. В виде различных соединений он входит в состав всех органов, тканей, биологических жидкостей. Отсутствие кислорода вызывает остановку жизненных процессов и гибель организма. Без кислорода человек может прожить всего несколько минут. При дыхании поглощается кислород, который принимает участие в окислительно-восстановительных процессах, происходящих в организме, а выделяются продуктов окисления органических веществ - вода» оксид углерода (IV) и другие вещества. Как наземные, так и водные живые организмы дышат кислородом: наземные -свободным кислородом атмосферы, а водные - кислородом, растворенным в воде.
В „природе происходит своеобразный круговорот кислорода. Кислород из атмосферы поглощается животными, растениями, человеком, расходуется yа процессы горения топлива, гниение и прочие окислительные процессы. Оксид углерода (IV) и вода, образующиеся в процессе окисления, потребляются зелеными растениями, в которых с помощью хлорофилла листьев и солнечной энергии осуществляется фотосинтез, т.е. синтез органических веществ из оксида углерода (IV) и воды, сопровождающийся выделением кислорода. Для обеспечения кислородом одного человека нужны кроны двух больших деревьев. Зеленые растения поддерживают постоянный состав атмосферы.
Задания №№ 13,14,15,16. Выполняя эти задания, студент знакомится с биологическими концепциями естествознания, изучает структурные уровни организации материи и знакомится с основополагающими жизненными системами.
К фундаментальным биологическим знаниям, без которых невозможно понять сущность жизнедеятельности организмов, относится клеточная теория. Одно из ее положений гласит, что клетка является структурно-функциональной единицей всех живых организмов.
Без знаний химического состава клетки - основной единицы жизни нельзя понять механизм сложнейших процессов, которые протекают в живых организмах. Студент должен знать, что все проявления жизнедеятельности клетки связаны с химическими превращениями веществ.
Задания преследуют цель акцентировать внимание студента на особую роль нуклеиновых кислот в природе - хранение и передача наследственной информации.
Обратите внимание, что нуклеиновые кислоты всех живых существ от вирусов до высших многоклеточных организмов обладают сходством химического состава.
Ниже приводится фрагмент из текста ответа на задание № 16.
.
Биологические полимеры - нуклеиновые кислоты, распадаясь образуют мономеры - нуклеотиды. Структурными единицами каждого нуклеотида являются фосфат (остаток фосфорной кислоты), углеводный остаток сахара, содержащего пять атомов углевода, - дезоксирибозы (в ДНК) или рибозы (в РНК)
Дезоксирибоза
ДНК всего органического мира образованы соединением четырех видов нуклеотидов. Их структуры приведены ниже. Как видно, у всех четырех нуклеотидов углевод и фосфорная кислота одинаковы. Нуклеотиды отличаются только по азотистым основаниям, в соответствии к которыми их называют: нуклеотид с азотистым основанием аденин (сокращенно А), нуклеотид с гуанином (Г), нуклеотид с тимином (Т) и нуклеотид с цитозином (Ц). По размерам А - Г, а Т - Ц; размеры А и Г несколько больше, чем Т и Ц
Рибоза
Как и в ДНК, структура РНК создается чередованием четырех типов нуклеотидов, но состав нуклеотидов РНК несколько отличается от нуклеотидов ДНК, т.е. углевод в РНК не дезоксири-боза, а рибоза, отсюда и название РНК. Кроме того, в РНК вместо азотистого основания тимина входит другое, близкое по строению основание,
называемое урацилом (У).
Задания № 17 и № 18, Выполняя эти задания, студент должен уяснить, что биосфера - это сложная система, составной частью которой является человечество. Многообразие живых организмов - основа организации и устойчивости биосферы. Спасти человечество может только создание целого комплекса мер по охране биосферы.
Задание № 19. Выполняя это задание студент знакомится с индивидуально-психологическими особенностями личности человека. К этим особенностям
относятся: темперамент, характер, способности.
Ниже приведен фрагмент ответа на задание № 19.
Холерический темперамент деятельности характеризует вспыльчивого человека. О таком человеке говорят, что он слишком горяч, не сдержан. Вместе с тем такой индивид быстро остывает и успокаивается, если ему уступают, идут на встречу. Его движения порывисты, но непродолжительны.
Для холерика нестерпимо любое ожидание. Для него неприятно время, проведенное на автобусной остановке. Ему трудно стоять спокойно. Он суетится, постоянно заглядывает вперед, чтобы выяснить, не показался ли наконец автобус, и, измучившись даже недолгим ожиданием, идет торопливо к следующей остановке, а по дороге его, естественно, обгоняет долгожданный автобус. На очередной остановке все повторяется, в результате холерик нередко приходит домой пешком.
Торопливость, суетливость - характерные черты холерика. Затеяв с кем-нибудь спор, он горячится, перебивает собеседника и совершенно не способен прислушаться к его аргументации. Повышенная общительность - одно из свойств характера холерика. Если сосед по электричке обратился в Вам еще раньше, чес Вы заняли свободное место, да к тому же затронул вопрос, совершенно не относящийся к предстоящей поездке, - он наверняка холерик. Мировая литература богата описаниями подобных людей.
Портрет человека с неудержимым темпераментом - Ноздрева - талантливо изобразил Н.В. Гоголь в романе "Мертвые души". Вот как характеризует подобных людей сам Гоголь: "Они скоро знакомятся, и не успеешь оглянуться, как. уже говорят тебе "ты". Дружбу заведут, кажется, навек, но почти всегда так случается, что подружившийся подерется с ними того же вечера на дружеской пирушке. Они всегда говоруны, кутилы, лихачи..." Ноздрев дома "больше дня никак не мог усидеть. Чуткий нос его слышал за несколько десятков верст, где была ярмарка со всякими съездами и балами; он уже в одно мгновение ока был там, спорил и заводил сумятицу...". Встретившись, "в ту же минуту он предлагал вам ехать куда угодно, хоть на край света, войти в какое хотите предприятие, менять все, что ни есть, на все, что хотите. Ружье, собака, лошадь - все было предметом мены, но вовсе не с тем, чтобы выиграть; это происходило просто от какой-то неугомонной юркости и бойкости характера". Вспомните, как Ноздрев продавал Чичикову мертвые души, как предлагал различные варианты обмена, игры в карты и шашки, при этом ссорился к оскорблял его.
Задания № 20 и № 21 являются итоговыми. Студент должен понимать смысл основных терминов, включенные в это задание.
Ниже представлен фрагмент ответа на задание № 21 .
Аннигиляция - превращение элементарных частиц и античастиц в другие частицы (например при аннигиляции пары электрон-позитрон возникают фотоны).
Ноосфера - учение Вернадского - сфера разума, ставшая по своему воздействию на планету сравнимой с геологической силой.
Самоорганизация - процесс взаимодействия объектов, в результате которого возникает новый порядок или структура в системе.
