Сахарный диабет 1 типа у детей: возможности управления и контроля за заболеванием (по результатам проспективного наблюдения) 14. 01. 08 педиатрия
| Вид материала | Автореферат |
- Сахарный диабет 2 типа, 89.86kb.
- Что такое диабет?, 30.26kb.
- Сахарный диабет у детей: причины возникновения, симптомы и признаки, диагностика, лечение, 107.19kb.
- Юлия Назина Диабет. Лучшие рецепты народной медицины, 1768.63kb.
- Сахарный диабет у детей, 89.39kb.
- "Сахарный диабет. Синдром диабетической стопы", 66.36kb.
- Сахарный диабет мелких домашних животных, 130.15kb.
- Питание при сахарном диабете, 43.84kb.
- Лекция по патологической физиологии, 164.58kb.
- Подпрограмма «Сахарный диабет на 2012 2014 годы» Паспорт Подпрограммы, 71.38kb.
СОДЕРЖАНИЕ РАБОТЫ.
Объект и методы исследования.
Для решения сформулированных задач выполнено проспективное обследование 356 пациентов в возрасте от 1 до 18 лет с сахарным диабетом типа 1, наблюдавшихся в эндокринологическом отделении КГБУЗ «Красноярская краевая детская больница» с 1998 по 2007 год.
Дизайн исследования.
На этапе планирования создана база данных пациентов, в которую включались вновь заболевшие дети и все больные, получающие лечение в эндокринологическом отделении КГБУЗ «Красноярская краевая детская больница» с 1998 по 2007 год. В финале исследования сформированы группы больных, классификационный признак – продолжительность заболевания (рис. 1).
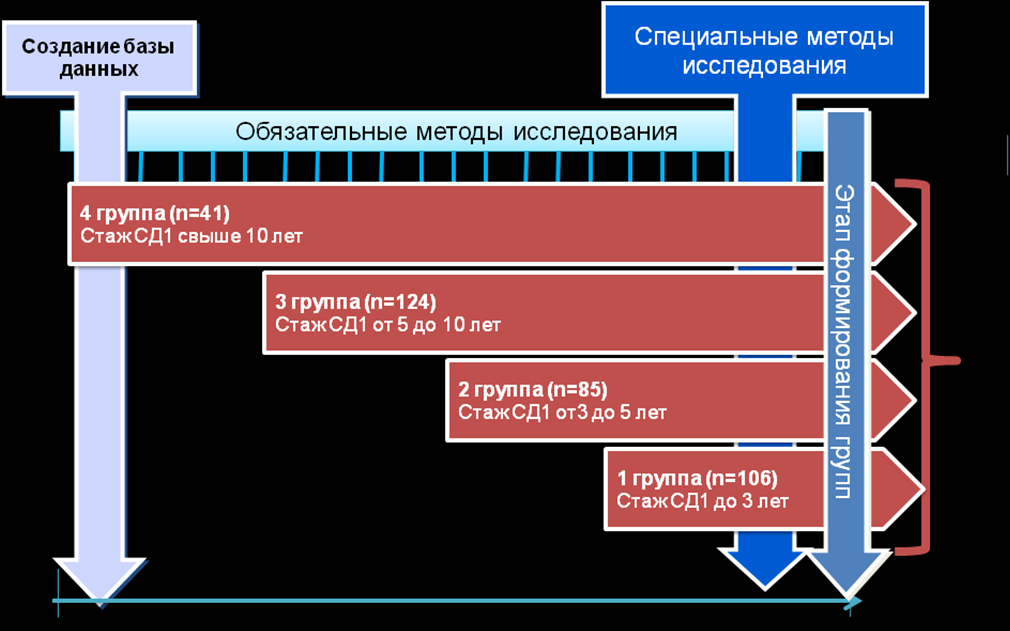
Рис. 1. Дизайн исследования.
Критерии включения:
1. Основное заболевание – сахарный диабет 1 типа;
2. Возраст – до 18 лет;
3. Наличие добровольного информированного согласия на обследование;
4. Регулярное обследование в эндокринном стационаре ККДБ.
Критерии исключения:
1. Наличие клинических и лабораторных признаков сахарного диабета не 1 типа (MODY, СД 2 типа, панкреатогенный СД, СД в составе генетических синдромов, неонатальный СД);
2. Нерегулярное наблюдение эндокринологом ККДБ (неявка на обследование более 1 года);
3. Достижение возраста 18 лет.
Все больные 1-2 раза в год госпитализировались в эндокринное отделение, где проводился комплекс обязательных исследований для метаболического контроля заболевания и ранней диагностики микрососудистых осложнений (спектр исследований – в таблице 2.). В период 2004-2007 гг. изучались маркеры эндотелиальной дисфункции. В финале наблюдения, на этапе формирования групп, в исследование включены 356 детей и подростков с сахарным диабетом 1 типа: 1 группу (n=106) составили дети и подростки, болеющие СД1 не более 3 лет; 2 группа (85 больных) – пациенты с продолжительностью заболевания 3-5 лет; 3 группа (124 человек) – больные СД1, имеющие стаж болезни 5-10 лет; 4 группа – (41 больной) – дети и подростки, свыше 10 лет болеющие СД1. Общее количество наблюдений – 2324 эпизода, среднее количество эпизодов обследования на 1 пациента составило 6,5 (от 4 эпизодов в 1 группе до 7,9 в 4 группе). Распределение пациентов по возрастно-половому составу представлено в таблице 1.
Таблица 1.
Распределение пациентов по группам в зависимости от пола и возраста.
| Группа | Кол-во обследован-ных, n | Кол-во мальчиков | Средний возраст обследованных | ||
| Абс. | % | За период исследования | При включении в исследование | ||
| 1 | 106 | 49 | 46,23 | 12,8 (11,5-12,3) | 11,6 (9,9-11,4) |
| 2 | 85 | 38 | 44,71 | 12,6 (11,3-12,0) | 10,9 (9,0-10,6) |
| 3 | 124 | 63 | 50,81 | 12,3 (11,7-12,1) | 9,7 (8,5-9,6) |
| 4 | 41 | 18 | 43,90 | 12,9 (12,5-13,1) | 9,9 (9,0-10,5) |
| Итого | 356 | 168 | 47,19 | 12,6 (11,8-12,1) | 10,4 (9,4-10,1) |
Группы контроля формировались следующим образом:
- При исследовании фракций липидов для сравнения показателей – в 1 группу контроля (К-1) включены здоровые дети с нормальной массой тела (n=50, ср. возраст 12,3; 95%ДИ: 11,4-12,2 г.); во 2 контрольную группу (К-2) – дети с алиментарным ожирением 1-2 степени (n=50, ср. возраст 12,5; 95%ДИ: 11,3-12,6 г.).
- При исследовании эндотелина-1 с целью уточнения чувствительности и специфичности метода – дополнительно проведен анализ крови у группы здоровых детей сопоставимого возраста (21 человек, мальчики – 52,3%, ср. возраст 13,7; 95% ДИ:12,29-13,85 г.), без нарушений углеводного обмена и других органических соматических заболеваний.
- При сонографическом исследовании сосудов для возможности сопоставления данных обследованы 16 соматически здоровых детей (мальчики – 61%, ср. возраст 14,0; 95% ДИ: 12,9-15,6 г.).
В процессе анализа результатов все пациенты основных групп были разделены на 4 подгруппы в зависимости от качества долгосрочной компенсации в соответствии с критериями ISPAD, 2009 г.: подгруппу оптимальной компенсации (ОК) составили пациенты с хорошей или оптимальной компенсацией углеводного обмена (НвА1с ниже 7,5%); подгруппа субоптимальной компенсации (СК) – пациенты со стабильной субоптимальной компенсацией (НвА1с – в диапазоне от 7,5 до 9%); подгруппа некомпенсированных пациентов (НК) – хронически декомпенсированные больные, с НвА1с стабильно выше 9%; подгруппа лабильной компенсации (ЛК) – дети с СД1, показатель гликированного гемоглобина которых колебался от низких до высоких величин, без тенденции к стабилизации (стабильность компенсации оценивалась минимум за 2 года).
Материалы, использованные в исследовании (табл. 2): медицинские карты стационарного больного, форма № 003\у, (N=2324); компьютерная база данных эндокринологического отделения; журналы учета поступивших и выбывших больных; статистические отчеты краевого медицинского информационно-аналитического центра (КМИАЦ); регистр больных сахарным диабетом краевого информационно-аналитического центра (КМИАЦ).
Таблица 2.
Диагностический спектр и полнота обследований, проводившихся в течение периода наблюдения при каждой госпитализации.
| Метод исследования | Кол-во пациентов, n | % от числа больных | |
| СД1 | Контроль | ||
| 1. Выкопировка данных медицинской документации | 356 | 100 | 100 |
| 2. Общеклинический осмотр | 356 | 100 | 100 |
| 3. Неврологические нейропатические тесты | 356 | - | 100 |
| 4 Лабораторные методы исследования | |||
| 356 | 100 | 100 |
| 356 | - | 100 |
| 356 | 100 | 100 |
| 356 | - | 100 |
| 356 | - | 100 |
| 104 | - | 29 |
| 3. Инструментальные и функциональные исследования | |||
| 356 | - | 100 |
| 62 | - | 17 |
| 356 | - | 100 |
| 4. Диагностика эндотелиальной дисфункции | |||
| 63 | 21 | 18 |
| 56 | 16 | 16 |
| 56 | 16 | 16 |
| 56 | 16 | 16 |
| 56 | 16 | 16 |
Клинические, биохимические, инструментальные исследования проведены в КГБУЗ «Красноярская краевая детская больница» и на кафедре биохимии с курсом медицинской химии КрасГМУ. Клинические методы диагностики заключались в общеклиническом и специализированных неврологическом, офтальмологическом осмотрах (выявление диабетических нейропатии и ретинопатии). Учитывались данные анамнеза, наследственность, перенесенные ранее и сопутствующие заболевания, приверженность к лечению по результатам самоконтроля гликемии. Состояние углеводного обмена оценивалось по показателям гликемии в течение суток (в ранние утренние часы, до и через 2 часа после завтрака, до и через 2 часа после обеда, до и через 2 часа после ужина, перед сном и ночью) 3-кратно в течение 3 последовательных дней с вычислением среднего показателя в каждой пробе крови, также рассчитывалась амплитуда колебаний гликемии (САКГ) и среднесуточная гликемия (ССГ). Показатель гликированного гемоглобина, фракция А1с, анализировался при каждом поступлении больного в стационар. Физическое развитие оценивалось в каждой точке исследования по результатам антропометрии. Рост, масса и индекс массы тела сопоставлялись с центильными таблицами, рекомендованными ВОЗ (2009). Для оценки степени отклонения роста и массы от средних значений индивидуально для каждого пациента вычислялся коэффициент стандартного отклонения (SDS); индекс массы тела (ИМТ) рассчитывался по формуле: отношение массы тела (кг) к квадрату роста (м). Для диагностики нефропатии проводились исследования микроальбумина трехкратно в ночной или суточной порции мочи иммунотурбидиметрическим методом (PLIVA-Lachema Diagnostika, Чехия, кат. №: 10007760) и скорости клубочковой фильтрации по формуле Шварца (Schwartz, G.J., 1985). Неврологические тесты для диагностики дистальной нейропатии включали: опрос жалоб больных с подсчетом баллов субъективных нейропатических симптомов по шкалам TSS и NSS; объективные симптомы нейропатии уточнялись по шкалам нейропатического дисфункционального счета (NDS) и нейропатического счета нижних конечностей – NISLL; нарушения чувствительности тестировались в соответствии с рекомендациями Perkins B.A., 2001 (болевая – 10-граммовым монофиламентом Semmes-Weinstein; тактильная – ватными тампонами; температурная – стандартным прибором Thioterm с металлическим и пластмассовым наконечниками; вибрационная – двухпозиционным методом с использованием стандартного градуированного камертона частотой 128 Гц). Стимуляционная ЭМГ проводилась с использованием аппарата для электромиографии «Нейромиан», Россия; исследовались большеберцовые и малоберцовые нервы на обеих конечностях, с супрамаксимальной стимуляцией. Диагноз диабетической ретинопатии устанавливался по результатам осмотра глазного дна на широкий зрачок, в соответствии с классификацией, рекомендованной Федеральной целевой программой «Сахарный диабет» 2002 г.
Для выявления признаков эндотелиальной дисфункции выполнено исследование эндотелина-1 в ЭДТА-плазме венозной крови (иммуноферментным методом с использованием набора «Эндотелин 1-21», Biomedica Medizinprodukte GmbH&Co, кат № BI-20052, Австрия) и комплекс ультразвуковых методов (сканер «iU 22», Philips) оценки состояния периферических артерий (общие сонные, плечевые артерии, артерии нижних конечностей и почек): измерение диаметров сосудов, линейных систолической и диастолической скоростей кровотока, расчет индексов резистивности и пульсативности до и в течение проведения тестов на эндотелий-зависимую (проба с реактивной гиперемией) и эндотелий-независимую (проба с нитроглицерином) вазодилатацию; а также измерение толщины комплекса интима-медиа общих сонных артерий, определение коэффициента растяжимости (distensibility coefficient, DS), индекса жесткости и модуля Юнга; по результатам измерения артерий нижних конечностях рассчитывался лодыжечно-плечевой индекс (рекомендации Американской диабетологической ассоциации, 2003).
Все дети и подростки с сахарным диабетом получали лечение в соответствии с рекомендациями Федеральной программы «Сахарный диабет» и международной ассоциации детского диабета – ISPAD, 2009 г.: инсулинотерапия в режиме многократных инъекций с использованием человеческих генноинженерных инсулинов и/или инсулиновых аналогов, питание с адекватным количеством углеводов. По показаниям проводилось лечение выявленных осложнений в соответствии с вышеуказанными рекомендациями.
Статистическая обработка результатов исследования проведена с помощью пакета прикладных программ STATISTIСA v. 6.0 (StatSoft-Russia, 1999 г.) и BIOSTATISTIСA. Методы статистического анализа выбирались после определения соответствия выборок закону нормального распределения с учетом теста Шапиро-Уилка. В случае отклонения выборок от нормального распределения в сравнительном анализе использовались непараметрические критерии (хи-квадрат, Краскела-Уоллиса, Манна-Уитни, Колмогорова-Смирнова для независимых групп, либо критерий Уилкоксона для зависимых групп). Различия считались статистически значимыми при значениях р<0,05. Для исследования взаимосвязи нормально распределенных качественных признаков использовали непараметрический коэффициент ранговой корреляции Спирмена.
Результаты исследования и их обсуждение.
В соответствии с поставленной целью по результатам проспективного 9-летнего наблюдения осуществлена комплексный анализ состояния здоровья детей и подростков детей с сахарным диабетом 1 типа Красноярского края.
Одной из задач исследования была оценка статистических показателей заболеваемости в исследуемой когорте. Выявлено, что первичная заболеваемость сахарным диабетом среди детей и подростков к моменту окончания исследования по сравнению с начальным этапом возросла с 7,0 до 8,35 на 100000 детей до 18 лет. В сравнении с данными Государственного Регистра СД показатель Красноярского края ниже, чем в целом по России и Сибирскому Федеральному округу (рис. 2).
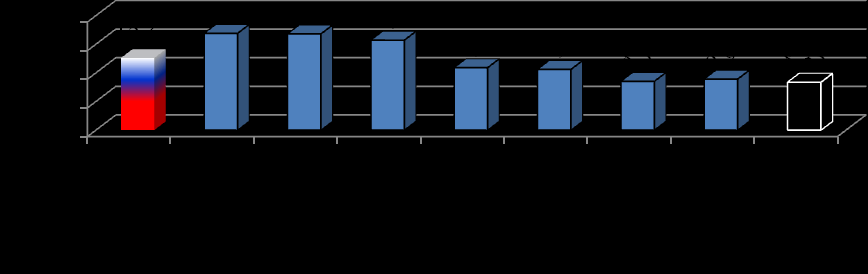
Рис. 2. Первичная заболеваемость сахарным диабетом 1 типа среди детей до 15 лет по округам РФ.
Подростки 15-18 лет заболевают реже, чем дети до 15 летнего возраста (7,46 на 100000 населения). Динамика анализируемого показателя не имеет постоянного тренда и характеризуется периодами подъемов и спадов.
Распространенность сахарного диабета у детей Красноярского края также занимает среднюю позицию в сравнении с другими регионами страны. Следует отметить, что эпидемиологические закономерности, отмеченные во многих странах с более высокой заболеваемостью, прослеживаются в исследуемой нами когорте. Так, распространенность СД у детей мужского и женского пола не имеет различий; среди подростков диабет регистрируется в 2 раза чаще, чем у детей до 15 лет (100,4, против 50,3 на 100 тысяч соответственно). Минимальные показатели были в возрастной группе 0-5 лет – 4,75 на 100 тысяч, без нарастания количества больных за период наблюдения, что возможно обусловлено генетическими особенностями сибирской популяции, поскольку развитие заболевания в возрасте до 5 лет в большей степени зависит именно от наследственных факторов.
Уровень заболеваемости в отдельных территориях Красноярского края оказался неоднородным, наиболее высокие показатели отмечены в южных, центральных и западных группах районов края (в отличие от общепринятом мнении о нарастании больных с юга на север), с существенным преобладанием больных среди городского населения – 97,37 в сравнении с сельским – 72,32.
Рост числа заболевших диабетом детей приходится на осеннее-зимний период года, с пиком в январе месяце, тогда как минимальное количество заболевших выявляется в мае. Зимний пик заболеваемости может быть обусловлен ростом инфекционных болезней у детей и согласуется с теорией разрушения β-клеток поджелудочной железы при воздействии инфекционных агентов (Дедов И.И. и др., 1999, Cotellessa M. et al., 2003), что нашло подтверждение в нашей когорте, где у 43,6% пациентов клинические проявления заболевания начались после перенесенных ОРВИ и сезонного гриппа. Появление симптомов СД после сильных стрессовых ситуаций в жизни отметили 45,5% больных.
Наиболее часто дети заболевали в препубертатном возрасте (46,1%), каждый пятый (23,6%) дебютировал в период пубертата и лишь у 10,7% диабет начался в возрасте до 3 лет. При этом число впервые заболевших детей существенно увеличивается в 8-летнем возрасте. По нашему мнению, отягощенная наследственность по СД не оказывает определяющего влияния на дебют заболевания в периоде детства – только 13,1% пациентов имели родственников 1 линии родства с сахарным диабетом 1 типа.
Последующее углубленное обследование больных сахарным диабетом детей и изучение особенностей метаболических процессов на фоне болезни, проводилось в 4 группах, ранжированных с учетом стажа диабета.
В дебюте заболевания уровень гликированного гемоглобина в общей когорте больных составил 11,8%, с наибольшими значениями у заболевших 3-5 лет назад в сравнении с детьми, диабет у которых выявлен 5-10 лет назад (рис. 3). Этот факт является основанием для более активной просветительной работы среди населения и осуществления мероприятий по ранней диагностике и своевременному лечению СД у детей и подростков.
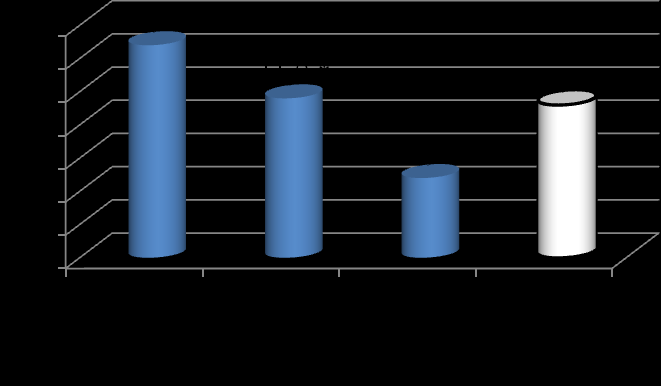
Примечание: * - различия статистически значимы с группой «стаж СД более 5 лет».
Рис. 3. Показатели гликированного гемоглобина в дебюте СД1.
Более чем у 73,8% пациентов диагноз установлен в состоянии выраженной декомпенсации (кетоацидоз), из них у 5,4% диагностирована крайняя степень метаболических нарушений – кома. Полученные данные существенно выше показателей других стран, где частота ДКА выше 20% – показатель слишком поздней диагностики СД (M. Rewers et al., 2009), что является еще один поводом для изменения ситуации в лучшую сторону.
Особенности физического, полового развития и состояния соматического здоровья детей с СД.
Среднее гармоничное физическое развитие отмечено у большинства детей с СД1 (55,7% больных), медиана конечного роста соответствовала целевым параметрам (рекомендованными ВОЗ) как у юношей, так и у девушек.
При небольшом стаже СД1 (до 3 лет) отклонения физических показателей регистрировались только в дебюте болезни и характеризовались начальным снижением массы тела с восстановлением до нормальных значений на фоне инсулинотерапии в первый год течения диабета. У больных со стажем 3-5 лет выявлены отклонения в процессе роста с 4-го года заболевания – значимое снижение медианы стандартного коэффициента отклонения роста (SDS -0,35 против -0,08 в первый год СД1), свидетельствующее о смещении ростовых параметров в сторону минимальных нормативных значений, что согласуется с опубликованными ранее исследованиями (Feltbower R.G. et al., 2004, Kilpatrick E.S. et al., 2006). По мере увеличения стажа СД1 до 5-10 лет на фоне продолжающегося снижения SDS роста после 6 лет болезни увеличивается численность детей, имеющих рост низкий и ниже среднего; при этом пациенты с высоким ростом при указанной длительности СД1 не выявлялись (в отличие предыдущих групп). У обследованных с диабетом свыше 10 лет распределение по росту было 50/50 между детьми, имеющими нормальные и ухудшенные ростовые показатели (рис. 4). Число детей с избыточной массой тела возрастало после 10 лет болезни.
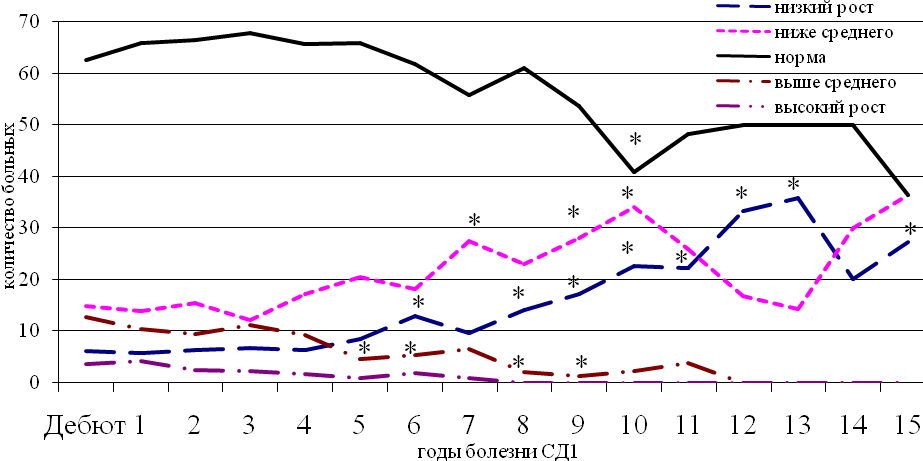
Примечание: * - различия статистически значимы с дебютом СД1, р<0,05. Критерий хи-квадрат.
Рис. 4. Динамика численности больных в рамках процентильных коридоров роста по годам болезни.
Рост больных не имел существенных различий в зависимости от качества компенсации углеводного обмена. Масса тела пациентов всех исследуемых групп была менее изменчивым параметром.
Установлено, что пациенты низкого роста, независимо от продолжительности сахарного диабета (рис. 5, рис. 6), имеют меньшую массу тела (медиана SDS ИМТ в отрицательном диапазоне) и более высокий уровень гликированного гемоглобина при возрастающих количествах вводимого инсулина (1,1 ед/кг/сутки, против 0,63 ед/кг/сутки у высокорослых). Возможно, это отражает особенности остаточной секреции инсулина или резистентность тканей к гормону роста, ИРФ-1 и инсулину у низкорослых детей.
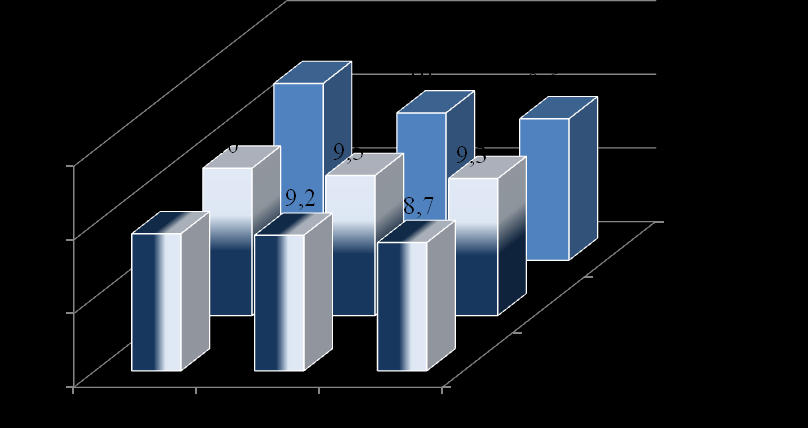
Примечание: р<0,01 между всеми категориями роста и ИМТ, кроме категории «высокий рост» (без различий по ИМТ). Критерий Краскела-Уоллиса.
Рис. 5. Распределение гликированного гемоглобина, %, Ме (95% ДИ) в зависимости от роста и ИМТ.
Примечание: р<0,001 между всеми категориями роста и ИМТ, (критерий Краскела-Уоллиса).
Рис. 6. Распределение среднесуточных доз инсулина в когорте детей и подростков с СД1 в зависимости от роста и ИМТ.
Нарушения полового развития выявлялись значимо реже в 1 группе (11,9% подростков), во 2-4 группах отклонения в половом созревании были диагностированы в 31-42,4% наблюдений. В целом в анализируемой когорте задержка полового развития установлена у 29,4% подростков, преимущественно у девушек; у юношей отклонения в сроках пубертата регистрировались в единичных случаях (3,3%). Следует отметить, что нарушенному половому созреванию в 4 группе и в когорте больных сопутствовали более низкие показатели роста.
Сопутствующая соматическая патология у детей характеризовалась высокой частотой аутоиммунного поражения щитовидной железы (36,5 на 1000 детей с СД, против 12/1000 в популяции), заболеваний пищеварительной (199,4 против 128,7 на 1000 детей соответственно) и мочевой систем (185,4 у больных СД1 и 128,7/1000 по данным статистики). Существенно меньшее количество больных сахарным диабетом детей имеют атопические заболевания (47,8 против 100 в популяции), что соответствует гипотезе об альтернативных путях развития аллергических и аутоиммунных процессов (Meerwaldt R. et al., 2002, Cardwell C.R. et al., 2003). В отличие от результатов других исследований, нами не выявлены случаи сочетания СД1 с целиакией, которая встречается у 10% детей с СД1 в Европе и Америке (Kaspers S. et al., 2004, Ludvigsson J.F., 2006). Вероятно, это обусловлено наследственными особенностями популяции Красноярского края.
Особенности метаболизма углеводов и липидов у детей с сахарным диабетом 1 типа.
В исследуемой когорте больных преобладали пациенты с декомпенсированным углеводным обменом – медиана HbA1c 9,6%, при этом значения гликогемоглобина нарастали по мере увеличения стажа заболевания и возраста больных, и были максимальными у подростков. Высокий уровень HbA1c (> 9%) зарегистрирован более чем у 50% детей, начиная со 2 года течения СД1, тогда как «безопасный» (ниже 7,6%) отмечен у 15,3- 39,7% пациентов в первые 5 лет заболевания и не более чем у 10% в последующие годы (рис. 7).
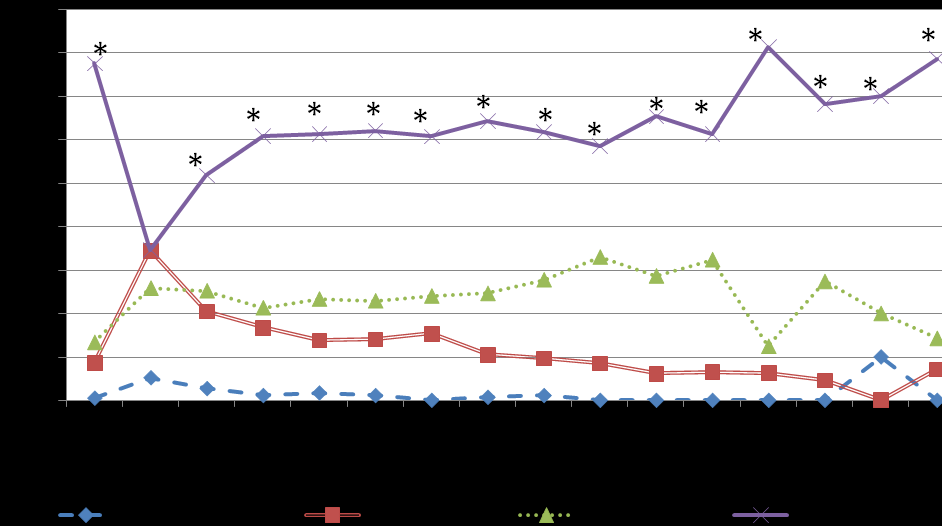
Примечание: * - различия статистически значимы с другими интервалами HbA1c, р<0,05. Критерий хи-квадрат.
Рис. 7. Распределение больных по интервалам гликированного гемоглобина в зависимости от года заболевания.
Показатели суточной гликемии в среднем превышали целевые параметры, и находился в диапазоне 7,2-10,5 ммоль/л; между группами существенно различались только уровни гликемии натощак с более низкими значениями при продолжительности заболевания менее 3 лет (8,7 ммоль/л) и максимальными – при стаже СД1 более 5 лет (10,4 ммоль/л). Выявлена однонаправленность изменений гликемии натощак и концентраций гликированного гемоглобина, что подтверждает мнение о более существенном вкладе утренней глюкозы крови в долгосрочную компенсацию диабета (Nathan D.M. et al., 2006). Постпрандиальная гликемия, которая по данным литературы имеет более значимое влияние на компенсацию (Shiraiwa T. et al., 2005; Woerle H.J. et al., 2007), положительно коррелировала с HbA1c только у детей 1 и 2 группы (r=0,4-0,56 соответственно). Отсутствие корреляционной зависимости между гликемией и HbA1c у детей 4 группы может быть следствием влияния иных факторов (помимо глюкозы крови) на гликирование белков.
Дети с продолжительной хорошей компенсацией СД получали наименьшие суточные дозы инсулина (0,69 ед/кг/сутки), тогда как длительно некомпенсированным пациентам вводились существенно большие количества инсулина – 1,01 ед/кг/сутки (рис. 8). С нашей точки зрения, неадекватные дозы болюсного инсулина в большей степени определяли декомпенсацию углеводного обмена у детей с СД1. Вклад базального инсулина в достижение компенсации не являлся ведущим.
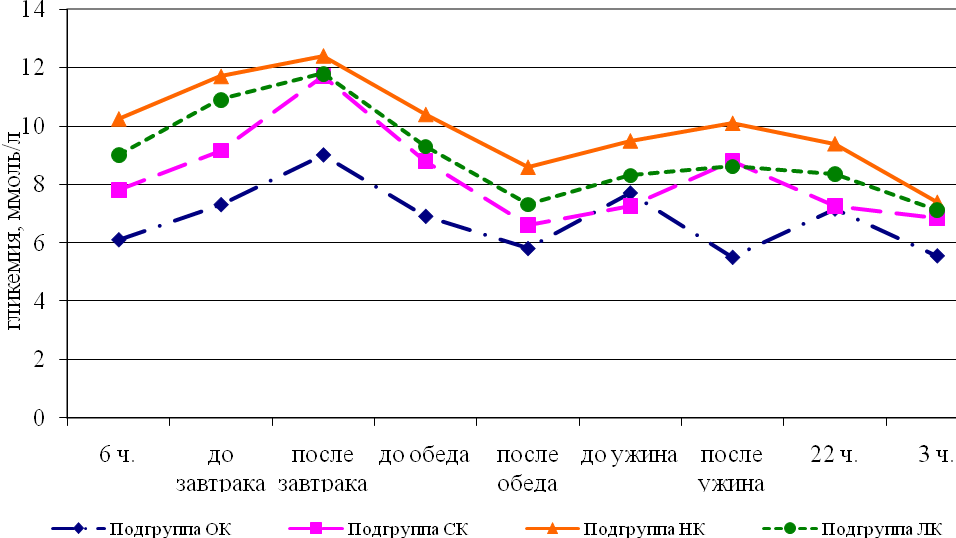
Примечание: различия между подгруппами статистически значимы во всех точках измерения. Критерии Краскела-Уоллиса и Манна-Уитни
Рис. 8. Гликемия в течение суток в когорте пациентов в зависимости от подгруппы, характеризующей качество компенсации.
Уровень липидов также значим в оценке качества метаболической компенсации диабета, и является фактором риска развития сосудистых осложнений. Нарушения обмена липидов регистрировались во всех группах детей с сахарным диабетом. Более чем у 50% обследованных гиперлипидемия выявлялась как минимум однократно (рис. 9), при этом стойкие нарушения липидного обмена (более 2 лет) отмечены у 17% пациентов 1 группы, почти у 40% детей во 2 группе и более чем у половины больных при стаже свыше 5 лет. Представленные значения существенно превышают данные других исследователей (Maahs D.M. et al., 2005; Schwab K.O. et al., 2006).
Негативная динамика атерогенных липидов крови отмечена при увеличении стажа заболевания; дислипидемия в начальные годы СД1 имеет непостоянный характер и чаще выявляется на фоне кетоацидоза в дебюте болезни. Наиболее неблагоприятные показатели липидограммы (преимущественно за счет повышения атерогенных фракций липидов – ХС, ТГ, ЛПНП) зарегистрированы у подростков старше 12 лет (независимо от продолжительности диабета) в сравнении с детьми младших возрастных групп. Более высокие уровни атерогенных липидов выявлялись у пациентов с СД1, имеющих избыточную массу тела, после 3 лет стажа заболевания.
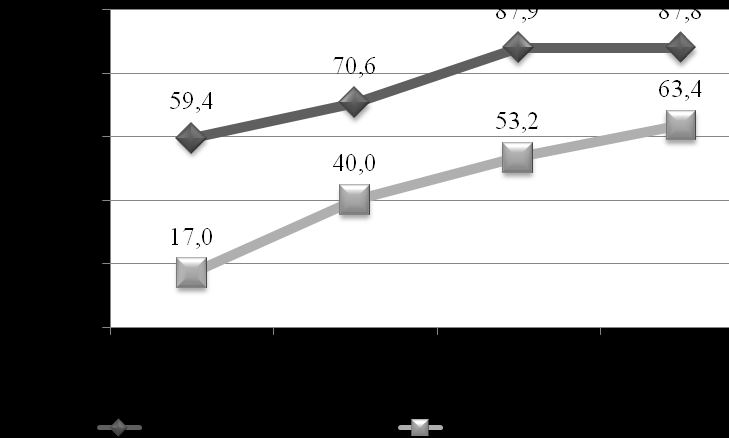
Рис. 9. Количество пациентов с дислипидемией по группам обследованных.
Показатели ЛПВП у детей с СД1 и контрольных групп были сопоставимы, что может свидетельствовать о наличии метаболического компенсаторного механизма, препятствующего ранней манифестации кардиоваскулярных осложнений. Повышение уровня ЛПНП после 3 года заболевания выявлено преимущественно у лиц женского пола с последующим значимым нарастанием дислипидемии у девушек с нарушением полового развития. Протективные липопротеиды высокой плотности у девушек оказались также повышенными, что, возможно, связано с особенностями действия эстрогенов, препятствующих атерогенезу у женщин.
Долговременная декомпенсация углеводного обмена сопровождалась наиболее выраженными изменениями липидов (за счет увеличения ТГ и ХС) с первых лет болезни; после 5 лет признаки дислипидемии выявлялись также у пациентов с нестабильной компенсацией СД1; при этом на начальных этапах болезни гиперлипидемия имела преходящий характер и становилась более постоянной при хронической декомпенсации.
Дислипидемия с повышенными значениями ХС и ТГ сопутствовала микрососудистым осложнениям – нефропатии (вне зависимости от стажа заболевания), нейропатии (после 5 лет заболевания) и ретинопатии (после 10 лет СД1).
Осложнения сахарного диабета 1 типа у детей и подростков.
Как доказало известное исследование DCCT, хронические сосудистые осложнения у детей с сахарным диабетом взаимосвязаны с декомпенсацией углеводного обмена и существенно ухудшают состояние здоровья и качество жизни больного (DCCT Research Group, 1995). При этом механизмы повреждающего действия хронической гипергликемии остаются во многом неясными, нет однозначного мнения о сроках манифестации хронических осложнений в детском и подростковом возрасте.
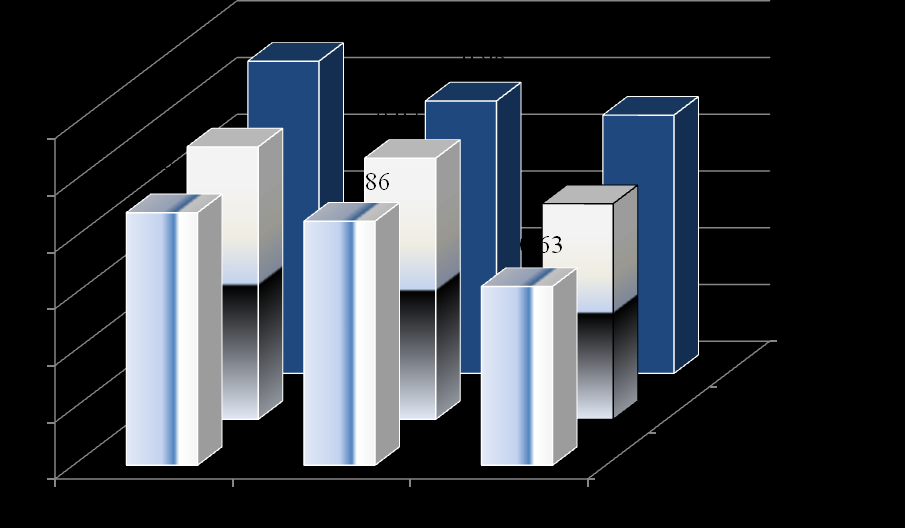
Диабетическая нефропатия является одним из наиболее частых и грозных осложнений СД1, которое сокращает продолжительность жизни больных. В нашем исследовании диагноз ДН установлен 15,4% больных когорты СД1. Наиболее раннее проявление нефропатии – микроальбуминурия – появлялась на 4-5 год заболевания, протеинурия выявлялась после 6 лет болезни. Во всех группах больных часть пациентов имела непостоянную альбуминурию – до 18,8% в когорте (рис. 10), что ниже показателей по данным других исследований, где преходящую МАУ имели до 50% детей с СД1 (Rudberg S., 1996; Perkins B.A. et al., 2003; Stone M.L. et al., 2006). Протеинурия, более поздний и необратимый показатель поражения почек, в общей когорте больных зарегистрирована у 13 пациентов (3,8% обследованных). При анализе по годам заболевания, первый период значимого нарастания числа детей с альбуминурией приходился на 2 и 3 год диабета («первый пик» нефропатии), в последующем количество пациентов с альбуминурией увеличивалось постепенно с максимальным значением прироста больных на 7 году СД1 («второй пик» нефропатии).
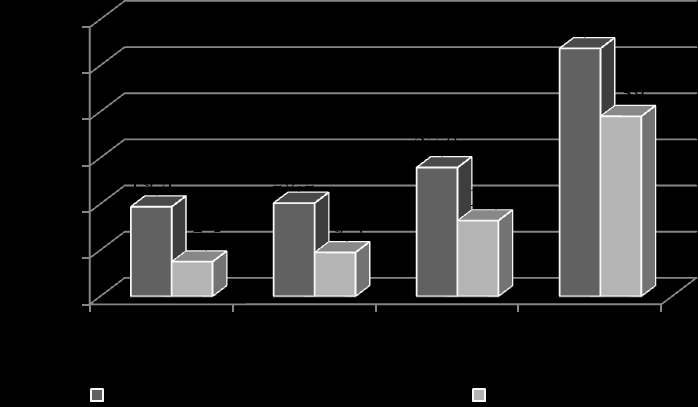
Рис. 10. Количество пациентов с непостоянной альбуминурией и нефропатией к финалу исследования.
Возраст, при котором впервые выявлялась нефропатии у наблюдавшихся нами пациентов, чаще приходился на период пубертата (31,2% пациентов), что не противоречит литературным данным (Schultz C.J. et al., 1999; Moore T.H.M., 2000; Мартынова М.И. и др., 2003), тем не менее, из числа детей, заболевших в раннем возрасте, у 2,3% альбуминурия регистрировалась уже в дошкольном и младшем школьном периодах. Корреляционный анализ в когорте показал более выраженную взаимосвязь альбуминурии со стажем СД1 (r=0,4), чем с возрастом (r=0,24), однако при продолжительности заболевания до 10 лет преобладает влияние возраста больного на появление экскреции альбумина.
Артериальная гипертония выявлена у 46,2% больных с нефропатией в стадии протеинурии и у 13,6% – в стадии микроальбуминурии; начальное повышение систолического артериального давления отмечено у больных с нефропатией при стаже диабета более 3 лет, диастолическое АД увеличивается после 5 лет течения СД1.
Декомпенсация СД1 ухудшает прогноз развития нефропатии, что подтверждено исследованием альбуминурии по подгруппам компенсации и корреляционным анализом. Важно, что при хорошо компенсированном диабете и при лабильной компенсации выявлялось сопоставимое количество пациентов с нормоальбуминурией; это определяет необходимость более настойчивых терапевтических мер по улучшению метаболического контроля (рис. 11).
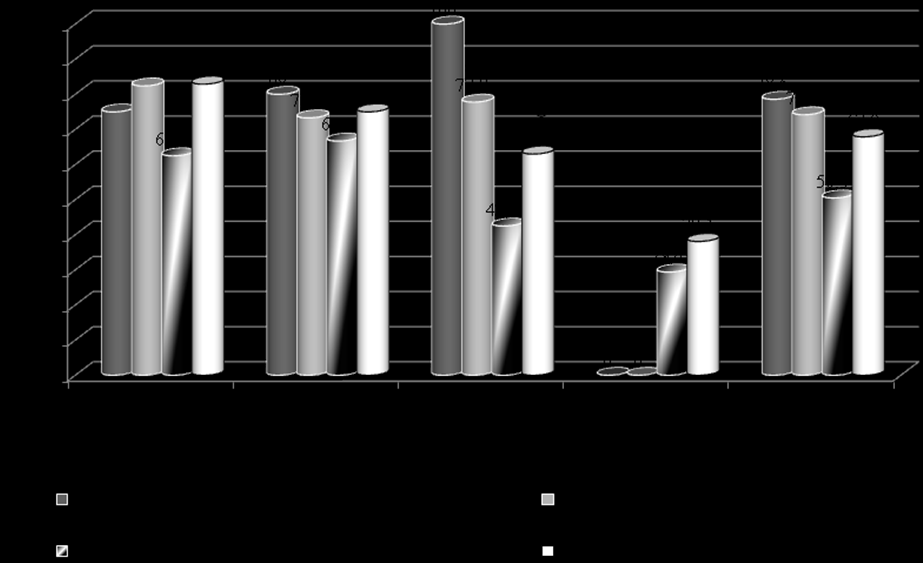
Примечание: * - различия со столбцами «хроническая декомпенсация», критерий хи-квадрат
Рис. 11. Распределение больных с нормальной экскрцией альбумина в зависимости от качества долгосрочной компенсации диабета.
Естественное течение нефропатии сопровождалось нарастанием изменений липидограммы в виде увеличения уровней ХС и ТГ при менее выраженном снижении ЛПВП.
Общепринятое мнение о динамике показателя клубочковой фильтрации не подтверждено в нашем исследовании – анализ по годам заболевания не выявил гиперфильтрации в дебюте СД1 и показал нарастание СКФ только на 2-8 годах болезни. Кроме того, отмечено повышение СКФ при увеличении альбуминурии (114,4 мл/мин/1,73 м2 против 103 мл/мин/1,73 м2 при отсутствии альбумина в моче), т.е. показатель скорости гломерулярной фильтрации недостаточно информативен в оценке почечной функции у детей с СД1 в первые годы болезни.
Латентная бактериурия диагностирована в 6,4% случаев независимо от стажа заболевания («микробный лидер» – кишечная палочка). По нашим данным, влияние бактериурии на уровень экскреции альбумина с мочой не установлено. Это требует дополнительного обсуждения обязательности выполнения дорогостоящего бактериологического исследования мочи при диагностированной альбуминурии (Hernández C., 2004; Дедов И.И. и др., 2007).
Лечение диабетической нефропатии у детей, в отличие от взрослых, остается предметом дискуссий (Nephropathy Trialist Group, 2001; Soffer B. et al., 2003) вследствие низкого риска развития хронической болезни почек, нечасто регистрирующейся артериальной гипертензией, невысокой частоты протеинурической стадии ДН и отсутствия официального разрешения к применению иАПФ в детском возрасте. Нами изучено влияние проводимой терапии иАПФ на уровень экскретируемого с мочой альбумина. Эффект терапии иАПФ отмечен у детей с МАУ независимо от стажа: лечение в течение 6 месяцев позволило достичь снижения уровня АУ в сравнении с начальным этапом (38 мг/л, против 31 мг/л через 6 мес.), продолжение терапии до 1 года снизило медианный показатель АУ до нормы (21 мг/л). Однако, эффект применения иАПФ был непродолжительным, и через 6 мес. после отмены препаратов уровень МАУ значимо увеличился (рис. 12). В общей выборке пациентов с протеинурией лечение иАПФ в субгипотензивных дозах не сопровождалось существенной динамикой альбуминурии, а отмена препарата приводила к нарастанию МАУ в ближайшие полгода.
Положительный эффект от применения иАПФ получен у 78,7% больных общей выборки; отрицательный – зарегистрирован у 21,3% детей с нефропатией; у 5,3% динамики АУ на лечении не было.
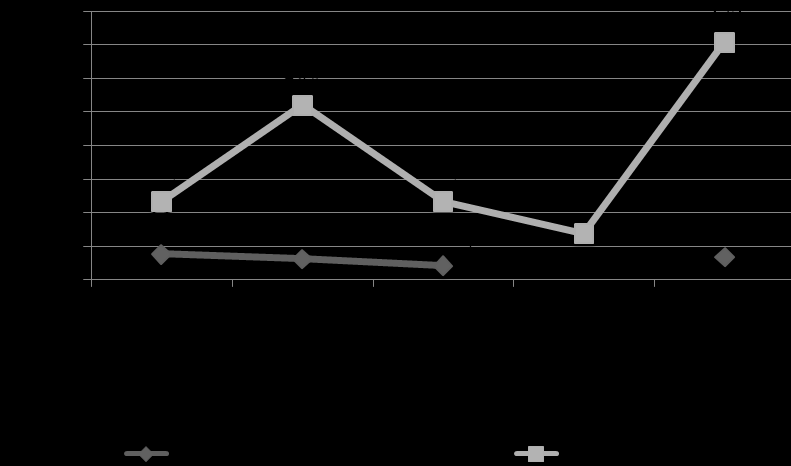
Примечание: * - различия с этапом «до лечения», ** - с 6 мес. лечения, *** - с 12 мес. лечения; использован коэффициент конкордации Кендала.
Рис. 12. Динамика альбуминурии на фоне лечения ингибиторами АПФ.
Особенности нейропатии у детей. Факт наличия и распространенности нейропатии у детей является предметом дискуссии, от полного отрицания ДПН в детском возрасте до высоких показателей выявляемости (Бурса Т.Р.и др., 2004; ISPAD, 2009 г.; Сивоус Г.И. и др., 2003). В нашем исследовании диабетическая дистальная нейропатия диагностирована в общей когорте специалистом – неврологом при рутинном осмотре у 24,2% больных, тогда как при проведении стандартизованного тестирования с использованием рекомендованных шкал нейропатия выявлена у 61,3% обследованных. Несмотря на редкость болевых форм ДПН у детей, по нашим данным боль в нижних конечностях была основной жалобой. Следует отметить невысокую частоту и выраженность симптомов ДПН, что подтверждают количественные показатели средних баллов по шкалам TSS (1,64, б.) и NSS (5 б.), лишь у 6,8% обследованных субъективная симптоматика соответствовала критериям тяжелой нейропатии.
При объективном обследовании, не учитывающем субъективные ощущения ребенка, у 36,6% пациентов отмечалось снижение рефлексов с нижних конечностей, выраженность нарушений была умеренной. Нарушения отдельных типов чувствительности выявлялись у 65,6% детей, без различий по стажу диабета, чаще отмечалось снижение болевого (40,9%) и вибрационного (34,4%) типов; температурная чувствительность была снижена редко (2,1%). Только в 1,1% регистрировались все варианты сенсорных нарушений. Снижение мышечной силы у наших пациентов диагностировано лишь у одного пациента, подтверждая редкость моторных нарушений в детском возрасте.
Сравнение результатов субъективных и объективных тестов показало, что клинические симптомы выявлялись с сопоставимой частотой у детей при наличии или отсутствии жалоб. С нашей точки зрения, оценка детьми субъективных симптомов не всегда позволяет получить достоверные результаты, поскольку может иметь значение как неадекватная реакция ребенка на тесты, так и недооценка имеющихся симптомов, что обусловливает необходимость тщательного объективного обследования.
По данным электронейромиографического исследования ранними проявлениями нарушения иннервации нижних конечностей у детей с диабетом является увеличение времени резидуальной латентности. Скорость распространения нервного возбуждения снижалась при нарастании продолжительности заболевания (медиана СРВ в 1-4 группах 47,45 – 46,85 – 44,1 – 38,5 м/с соответственно) с одновременным увеличением количества детей, имеющих нарушение СРВ.
Амплитуда М-ответа была менее вариабельна, без значимых различий между группами как по средним значениям, так и по количеству больных с ухудшенными показателями. В малоберцовых нервах амплитуда М-ответа оказалась существенно ниже, чем в большеберцовых, независимо от стажа диабета, что свидетельствует о старте нарушений проводимости в более тонких нервных волокнах.
При сопоставлении субъективных симптомов и суммарной частоты ЭМГ-изменений отмечено, что нейрофизиологические признаки чаще регистрируются у пациентов с наличием жалоб, особенно при стаже СД1 до 5 лет (рис. 13).

Примечание: * - различия статистически значимы между пациентами с наличием и отсутствием жалоб (критерий хи-квадрат)
Рис. 13. Количество ЭМГ-изменений в зависимости от наличия субъективных симптомов нейропатии.
В результате комплексного обследования когорта пациентов распределилась по стадиям ДПН следующим образом: субклинические стадии выявлены у 32,3% детей (из них стадия IA – 17,7%, IБ – 14,5%), клиническая стадия 2А диагностирована 29% больных, что согласуется с результатами других исследователей о частоте доклинических вариантов ДПН (Строков И.А. и др., 2003, Сивоус Г.И., 2003).
Отмечено большее количество пациентов с нейропатией при хронической декомпенсации СД1 уже при стаже более 5 лет в сравнении с оптимальной и субоптимальной компенсацией, а также с подгруппой больных, у которых компенсация была нестабильной. У пациентов, имеющих нейропатию, чаще выявлялась диабетическая нефропатия (р<0,001) и дислипидемия (р=0,010), что может свидетельствовать в пользу общих патогенетических механизмов, приводящих к развитию хронических осложнений диабета.
Диабетическая ретинопатия рассмотрена в нашем исследовании для уточнения распространенности поражения сетчатки, что является необходимым для принятия управленческих решений о совершенствовании диагностических и профилактических мероприятий.
Признаки ретинопатии отмечены у 7,26% детей, в единичных случаях с первых лет заболевания. Начальные изменения глазного дна, не отвечающие критериям диагноза ДР, установлены у 38,6% обследованных, чаще после 3 лет стажа СД1. Выявленные изменения сетчатки были стабильными у небольшого числа детей (ретинопатия у 5,03%, начальные изменения – у 21,5% обследованных) и преимущественно при продолжительности СД1 более 10 лет. Полученные цифры распространенности ниже, чем в других исследованиях, что свидетельствует о неудовлетворительной выявляемости изменений глазного дна при рутинной офтальмоскопии. Не обнаружено зависимости патологии глазного дна от состояния долгосрочной компенсации углеводного обмена и количества гипогликемических эпизодов. Прогрессирование изменений на глазном дне с развитием ДР было сопряжено с повышенной экскрецией альбумина с мочой, начиная с 3 лет течения СД1, что указывает на единство патогенетических механизмов в развитии микрососудистых осложнений. Нами также подтверждена взаимосвязь дислипидемии с ретинопатией в т.ч. с развитием макулярного отека (Ciulla T.A. et al., 2003). При стаже заболевания свыше 10 лет изменения офтальмоскопической картины сопровождаются увеличением концентраций ХС и ТГ крови, которые рассматриваются как факторы, усугубляющие поражения мелких сосудов.
Дисфункция эндотелия доказана при СД 2 типа и активно обсуждается при СД 1 типа, однако у детей с сахарным диабетом типа 1 патогенетическая роль ЭД изучена недостаточно, результаты исследований неоднозначны – от отрицания поражения эндотелия до выявления выраженных сосудистых дисфункций (Brands M.W., 1998; Calles-Escandon J., 2001; Davis P.H. et al., 2001; Larsen J.R. et al., 2002; Johansson J. et al., 2003; Frost D., 2003; Ceriello A., 2008).
Вазоконстриктор эндотелин-1 у детей с сахарным диабетом 1 типа.
В выборке детей с СД1 показатель эндотелина-1 был сопоставим с группой контроля, однако при распределении больных по стажу заболевания наиболее высокие значения Э-1 выявлены у пациентов с продолжительностью заболевания более 5 лет, тогда как в начальном этапе диабета уровни вазоконстрикторного пептида сопоставимы с таковыми у здоровых детей (рис. 14).
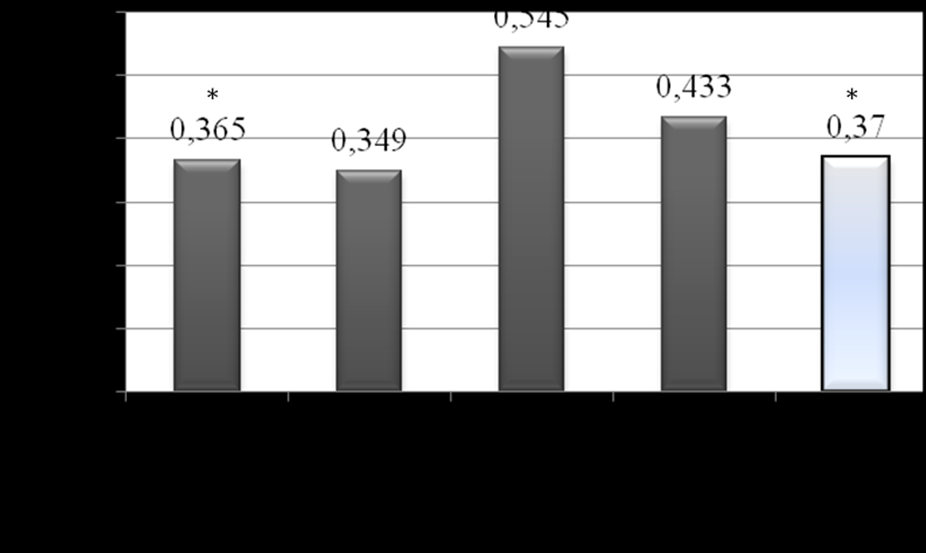
Примечание: * - различия с 3 группой (критерии Краскела-Уоллиса и Манна-Уитни).
Рис. 14. Медианные значения эндотелина-1 в группах обследованных.
При ранжировании показателей Э-1 по процентильным интервалам повышенный уровень Э-1 (выше 75 процентиля) отмечен у 19% детей при стаже диабета менее 3 лет, при продолжительности заболевания свыше 5 лет – у 52,4% обследованных (из них у 50% показатели выше 90 процентиля). В процентильных интервалах «75-90» и «выше 90» средние концентрация эндотелина-1 в плазме превышали нормативные значения в 1,5 и в 2,5 раза соответственно. Указанные высокие значения сильного вазоконстриктора, который даже в минимальных концентрациях существенно влияет на сосудистый тонус, можно расценивать как проявление эндотелиальной дисфункции и хронического окислительного стресса при текущем более 5 лет сахарном диабете.
Изучение иных факторов (кроме продолжительности болезни), которые могут быть взаимосвязаны с повышением изучаемого вазоконстриктора, позволило установить, что длительная декомпенсация углеводного обмена сопровождается нарастанием эндотелина-1 в среднем в 1,5 раза независимо от стажа заболевания. Взаимосвязь дислипидемии и Э-1 проявилась однонаправленным повышением ЛПВП (в том числе, на ранних сроках СД1) и показателей Э-1, что, возможно, является компенсаторным процессом противодействия вазоконстрикторным влияниям на ранних стадиях заболевания. При стабильной дислипидемии повышение эндотелина отмечено преимущественно при более поздних сроках диабета (стаж свыше 5 лет).
Учитывая, что в патогенезе микроангиопатий обсуждается роль эндотелиальной дисфункции (El-Mesallamy H. et al., 2007; Mishra R. et al., 2006), мы проверили возможные зависимости хронических осложнений с уровнем эндотелина-1. Зарегистрированы повышенные значения эндотелина при диабетической нефропатии у больных с постоянной альбуминурией после 3-летней продолжительности диабета. При распределении концентраций эндотелина-1 по стадиям нефропатии отмечены однонаправленные изменения уровней эндотелинемии и АУ: наименьшие показатели вазоконстриктора были при нормоальбуминурии и максимальные – при протеинурии (рис. 15). У детей со стажем СД1 менее 3 лет, в отсутствие МАУ и ПУ, значимо более высокие величины Э-1 оказались при непостоянной альбуминурии в сравнении с нормальной экскрецией альбумина.
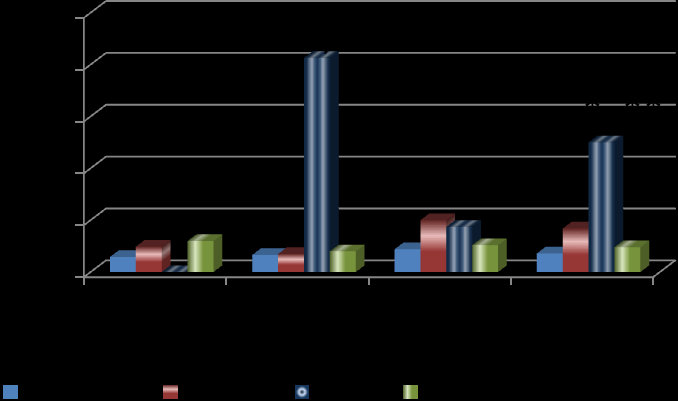
Примечание: * - различия статистически значимы со столбцом «нет АУ, ** - различия со столбцом «МАУ». Критерии Краскела – Уоллиса и Манна-Уитни.
Рис. 15. Концентрации эндотелина-1, фмоль/мл, в зависимости от уровня альбуминурии.
Принимая во внимание сведения о подавляющем влиянии иАПФ на дисфункцию эндотелия и гиперэндотелинемию (Oosterga M. еt al., 2000; Chen Y. et al., 2003), проведен анализ эффективности лечения диабетической нефропатии препаратами иАПФ в зависимости от исходного уровня Э-1. Большее количество положительных исходов терапии выявлено у пациентов со стажем СД1 свыше 5 лет и в общей выборке при исходно повышенных значениях плазменного эндотелина-1 (рис. 16).
Взаимосвязей значений эндотелина-1 с другими микрососудистыми осложнениями диабета не выявлено. Наличие прямой положительной корреляции Э-1 с толщиной интима-медиа позволило предложить схему патогенетического участия изучаемого вазоконстриктора как в поражении сосудов, с развитием нефропатии, вазоконстрикции мышечных сосудов, так и в репарации эндотелия (приложение 1).
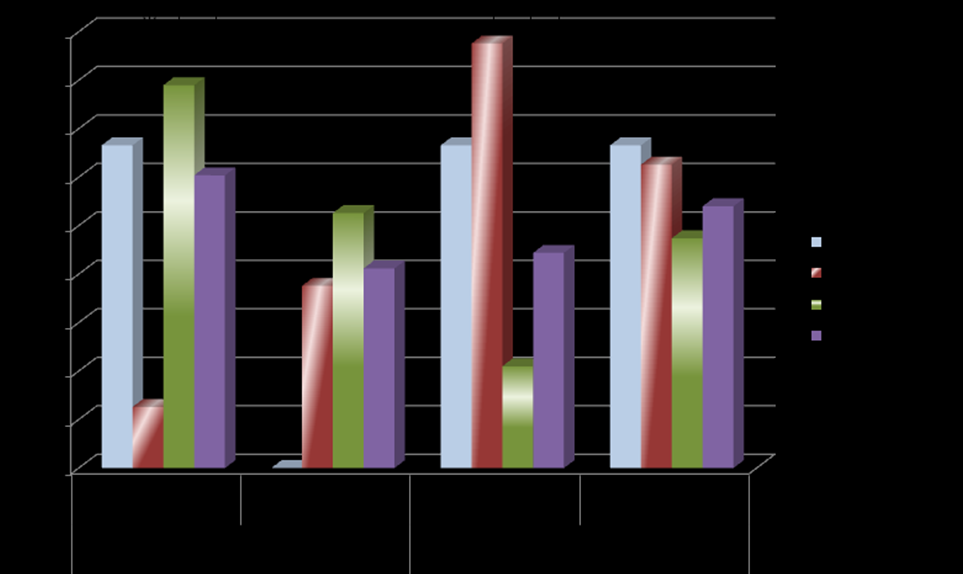
Примечание: использован коэффициент конкордации Кендала.
Рис. 16. Влияние показателей эндотелина-1 на лечение диабетической нефропатии.
С нашей точки зрения, анализируемый пептид Э-1 необходимо рассматривать как показатель стабильной декомпенсации углеводного и липидного обменов у больных СД1, маркер неблагоприятного прогноза по развитию диабетической нефропатии (независимо от стажа заболевания), предиктор эффективности терапии препаратами иАПФ, а также стимулятор репаративных процессов в эндотелии сосудов.
Функциональные нарушения периферических артерий у детей с сахарным диабетом. Общепризнано, что при сахарном диабете у детей сосудистые осложнения обусловлены поражением микроциркуляторного русла (Singh T.P., 2003; Tołwińska J., 2004). Изучение релаксационной способности артерий показало, что у больных расширение диаметра плечевых артерий под влиянием эндотелиальных стимулов менее выражено после 3 лет течения заболевания, с увеличением доли детей (66,7-76,9%), имеющих ухудшенные значения ЭЗВД. Во всех группах больных основной показатель функции эндотелия – процент эндотелий-зависимой вазодилатации – был ниже аналогичного в контрольной группе. Сравнение между группами установило существенное снижение процента ЭЗВД при стаже заболевания более 5-10 лет (рис. 17).
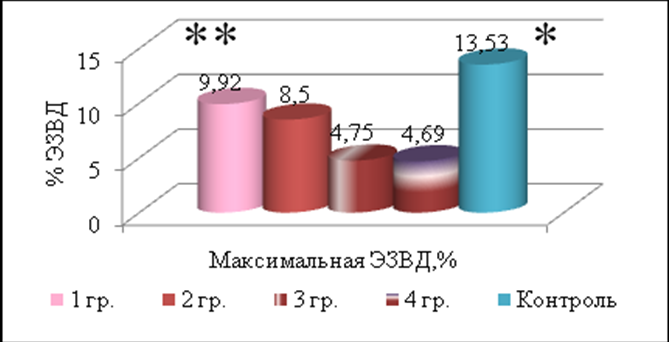
Примечание: * - различия с 1-4 группами, ** - различия с 3,4 группами. Ккритерий Краскела – Уоллиса.
