Урок по химии: «Гидролиз неорганических солей» (11 класс)
| Вид материала | Урок |
- Урок презентация по химии в 8 классе на тему: Предмет химии. Вещества, 263.29kb.
- Реферат Дипломный проект 95 с, 18 таблиц, 7 рисунков, 21 источник, 8.42kb.
- К уроку химии, 391.03kb.
- 2. Диссеминация опыта работы учителя химии и биологии моу баграмовская средняя школа,, 149.21kb.
- Металлургический комплекс. Черная металлургия. Производство чугуна и стали. Влияние, 159.02kb.
- Урок химии в 9 классе. Тема: «Оксиды азота», 68.76kb.
- Рабочая программа по дисциплине "Химическая технология неорганических веществ " Направление:, 112.47kb.
- Урок за курс химии 8-11 класса Тема: «Обобщение и систематизация знаний за курс химии, 164.62kb.
- Видеокурс для 8 класса по базовому уровню обучения (Мир химии, язык химии, кислород,, 97.39kb.
- Диэлектрические свойства водных растворов солей щелочных металлов, галогеноводородных, 191.33kb.
Урок по химии: «Гидролиз неорганических солей» (11 класс)
Учитель химии Кулешов И.В.
Тип урока:
Изучение нового материала и закрепление первичных знаний
Цели урока:
Образовательные:
- расширить знания учащихся о свойствах солей;
- объяснить понятие “гидролиз”;
- научить записывать уравнения гидролиза неорганических солей и определять рН среды водного раствора;
- показать значение и практическое применение гидролиза
Развивающие:
- развивать умение наблюдать, анализировать и делать выводы;
- способствовать развитию логического мышления и участия в проблемном диалоге;
- развивать интерес к предмету, процессу познания и исследования;
- совершенствовать умения коллективной работы и обсуждения
Воспитательные:
- воспитывать культуру обсуждения и общения;
- формировать научное мировоззрение учащихся;
- воспитывать навыки коллективного общения и труда
Основная задача урока:
В результате проведенного занятия учащиеся должны уметь определять возможность гидролиза неорганических солей, составлять уравнения реакций и определять pH среды
Оборудование:
Справочный материал, таблицы растворимости, периодическая система химических элементов Д.И.Менделеева, растворы солей, индикаторы, мультимедиапроектор.
Основные этапы:
- Организационный момент (1 мин)
- Проверка домашнего задания(5 мин)
- Подготовка к восприятию нового материала (6 мин)
- Изучение нового материала (20 мин)
- Закрепление и первичная проверка полученных знаний (10 мин)
- Комментарий домашнего задания (2 мин)
- Подведение итогов (1 мин)
Ход урока:
I. С помощью медиапроектора (можно сделать и традиционную запись на доске) показываем тему урока, основные задачи и цели.
II. Проверяем домашнее задание. (предварительно можно записать практические результаты выполнения домашнего задания на доске), учащиеся отвечают на вопросы учителя.
III. Для подготовки к восприятию нового материала проводим фронтальную беседу-опрос. Примерные вопросы (могут быть изменены в зависимости от уровня подготовки учащихся):
Чем растворы кислот отличаются от растворов оснований?
Как определяется наличие катионов водорода в растворе?
Что такое водородный показатель (pH)?
Чем отличаются сильные кислоты от слабых ( по химическим свойствам, строению, степени диссоциации)? Привести примеры.
Как обнаружить присутствие ионов водорода и гидроксид-ионов в растворах?
Почему одни основания относятся к сильным электролитам, а другие – к слабым? Привести примеры.
Почему вода не изменяет окраски индикаторов подобно кислотам и щелочам, хотя в ней находятся ионы водорода и гидроксид-ионы?
Вспоминаем, что различают три типа сред: нейтральную, щелочную и кислую. В нейтральной среде концентрации ионов водорода и гидроксид –ионов равны:
[H+] = [OH-] = 10-7 моль/л, pH=7
В кислой среде концентрация ионов водорода больше концентрации гидроксид-ионов:
[H+] > [OH-] = 10-7 моль/л, pH<7
В щелочной среде концентрация ионов водорода меньше концентрации гидроксид-ионов:
[H+] < [OH-] = 10-7 моль/л, pH>7
Затем вспоминаем, что любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль KNO2 образована сильным основанием КОН и слабой кислотой HNO2. Далее разбираемся, какими кислотами и основаниями образованы несколько солей, например, CuSO4, LiCl, K2CO3, Al2S3.
В зависимости от силы основания и кислоты, из которых образовались соли, можно выделить 4 типа солей:
- соли, образованные сильным основанием и слабой кислотой; (примеры)
- соли, образованные сильной кислотой и слабым основанием; (примеры)
- соли, образованные слабым основанием и слабой кислотой; (примеры)
- соли, образованные сильной кислотой и сильным основанием (примеры)
IV. Изучение нового материала.
Для начала следует подчеркнуть, что сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирущее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н+ или ОН-, и раствор соли становится кислым или щелочным соответственно.
Растворяем в воде силикат натрия, нитрат меди и хлорид натрия. Проверяем кислотность (pH среды). Убеждаемся, среда растворов слабощелочная, слабокислая и нейтральная соответственно. Переходим к рассмотрению гидролиза 4-х основных типов солей (основные моменты изложенного ниже материала представлены в виде презентации и демонстрируются с помощью медиапроектора)
1. Cоли, образованные сильным основанием и слабой кислотой
Рассмотрим гидролиз силиката натрия. В водном растворе соль полностью диссоциирует, т.к. является сильным электролитом:
Na2SiO3 = 2Na+ + SiO32-
(сильное основание)NaOH H2SiO3(слабая кислота)
Молекулы воды тоже диссоциируют, но в незначительной степени:
Н
 2О ОН- + Н+
2О ОН- + Н+В



 результате имеем:
результате имеем: Na2SiO3 = 2Na+ + SiO32- Эти ионы объединяются
Na2SiO3 = 2Na+ + SiO32- Эти ионы объединяютсяН
 2О ОН- + Н+ в малодиссоциирущий
2О ОН- + Н+ в малодиссоциирущий
 ион
ионЭти ионы остаются в растворе
Полное ионное уравнение происходящего процесса гидролиза:
2
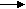
 Na+ + SiO32- +Н2О 2Na+ + OH- + HSiO3-
Na+ + SiO32- +Н2О 2Na+ + OH- + HSiO3-Сокращенное ионное уравнение:
S
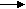
 iO32- +Н2О OH- + HSiO3-
iO32- +Н2О OH- + HSiO3-Это уравнение показывает, что:
а)в растворе есть свободные гидроксид-ионы ОН- и концентрация их больше, чем в чистой воде, поэтому раствор силиката натрия имеет щелочную среду (pH>7),
б)в реакции с водой участвуют анионы SiO32- , т.е. гидролиз идет по аниону
Продукты гидролиза – кислая соль NaHSiO3 гидроксид натрия NaOH
2. Соли, образованные сильной кислотой и слабым основанием
Рассмотрим гидролиз нитрата меди Cu(NO3)2.
Cu(NO3 )2 = Cu2+ + 2NO3-
(слабое основание) Сu(OH)2 HNO3(сильная кислота)
В



 водном растворе:
водном растворе: Cu(NO3)2 = Cu2+ + 2NO3- эти ионы остаются
Cu(NO3)2 = Cu2+ + 2NO3- эти ионы остаютсяН
 2О ОН- + Н+ в растворе
2О ОН- + Н+ в растворе

эти ионы соединяются, т.к. при этом образуется слабый электролит
Полное ионное уравнение гидролиза:
C
 u2+ + 2NO3- +Н2О CuOH+ + H+ + 2NO3-
u2+ + 2NO3- +Н2О CuOH+ + H+ + 2NO3-Сокращенное ионное уравнение гидролиза:
C
 u2+ +Н2О CuOH+ + H+
u2+ +Н2О CuOH+ + H+ Это уравнение показывает, что:
а) в растворе есть свободные ионы водорода Н+ и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислую среду (рН < 7)
б) в реакции с водой участвуют катионы меди Сu2+ , т.е. гидролиз идет по катиону
Продукты гидролиза – основная соль CuOHNO3 и азотная кислота. Гидролиз CuOHNO3 протекает в значительно меньшей степени и им можно пренебречь.
3. Соли, образованные слабым основанием и слабой кислотой.
Разумно предположить, что такие соли подвергаются гидролизу и по катиону и по аниону. Рассмотрим гидролиз нитрита аммония NH4NO2.
NH4NO2 = NH4+ + NO2-
(слабое основание)NH3.H2O HNO2(слабая кислота)
В




 водном растворе:
водном растворе:NH4NO2 = NH4+ + NO2-
Н


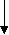 2О ОН- + Н+
2О ОН- + Н+эти ионы соединяются, т.к. при этом образуются слабые электролиты
Ионное уравнение гидролиза
N

 H4+ + NO2- + Н2О NH3.H2O + HNO2
H4+ + NO2- + Н2О NH3.H2O + HNO2Гидролиз обратимый, но равновесие смещено в сторону образования продуктов гидролиза, т.к. в результате реакции образуются слабые электролиты.
Реакция среды в рассматриваемом случае может быть нейтральной, слабокислой или слабощелочной. Это зависит от соотношения констант диссоциации образующегося основания и кислоты.
4. Соли, образованные сильной кислотой и сильным основанием.
Такие соли гидролизу не подвергаются. Например, рассмотрим соль хлорид натрия NaCl:
NaCl = Na+ + Cl-
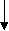
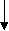
(сильное основание) KOH HCl (сильная кислота)
В
 водном растворе:
водном растворе:NaCl = Na+ + Cl-
Н
 2О ОН- + Н+
2О ОН- + Н+Все ионы останутся в растворе, слабые электролиты не образуются,
гидролиза не происходит.
Среда нейтральная (рН = 7), т.к. концентрации ионов водорода и гидроксид-ионов равны, как в чистой воде.
Таким образом, в зависимости от состава соли возможен гидролиз по катиону, по аниону или катиону и аниону одновременно. А реакция водного раствора может быть нейтральной (рН = 7), слабокислой (рН < 7) или слабощелочной (рН > 7)
Далеее отмечаем, что реакции обратимого гидролиза полностью подчиняются принципу Ле Шателье. Поэтому гидролиз соли можно усилить следующими способами:
- добавить воды
- нагреть раствор
- связать один из продуктов гидролиза в нерастворимое соединение или удалить в виде газа
Подавить гидролиз можно так:
- увеличить концентрацию соли
- охладить раствор
- ввести в раствор один из продуктов гидролиза
(Если остается время можно продемонстрировать реакцию гидролиза хлорида железа (III) при кипячении)
Следует отметить, что гидролиз используют в химической и пищевой промышленности. На нем основаны важнейшие реакции в живых организмах, например гидролиз белков. Моющие средства усиливают свои свойства за счет гидролиза солей, входящих в их состав (в основном фосфатов и карбонатов).
V.Закрепление и первичная проверка полученных знаний
Для закрепления и проверки полученных знаний выполняем небольшую самостоятельную работу.
Задание 1.
Вариант 1 Вариант 2
Кислую среду имеет раствор соли: Щелочную среду имеет раствор соли:
а)CaCl2 б)К2S в)CuCl2 г)Na2SO3 а)NaNO3 б)Al2(SO4)3 в)ZnCl2 г)K2SO3
Задание 2
Установите соответствием между составом соли и типом гидролиза
Вариант 1 Вариант 2
а)(NH4)2CO3 а)Li2CO3 1)по катиону
б)Cu(NO3)2 б)Al2S3 2)по аниону
в)LiNO2 в)Na2SO4 3)по катиону и аниону
г)BaCl2 г)Pb(NO3)2 4)гидролиза нет
Далее проверяем и оцениваем результаты выполнения заданий.
VI.Учитель комментирует домашнее задание.
VII.Рефлексия – обмен мнениями о прошедшем уроке
VIII.Учитель подводит итоги урока
Литература
1.О.С.Габриэлян, Г.Г.Лысова. Химия 11. М.:Дрофа, 2002- с.368
2.И.И.Новошинский, Н.С.Новошинская. Химия 10. М.:Русское слово, 2009-с.424
