Ции различных отраслей, что, в свою очередь, влечет за собой образование огромного количества токсичных и нетоксичных отходов, обладающих слабой биодоступностью
| Вид материала | Документы |
СодержаниеЦель данной работы Задачами исследования Материалы и методы Результаты и обсуждение Trametes hirsutа Список литературы |
- Бабенко Е. А., Воропаева, 50.32kb.
- Государственный комитет СССР по делам строительства полигоны по обезвреживанию и захоронению, 1018.35kb.
- Технология захоронения жидких промышленных отходов, 77.49kb.
- Методика изучения нумерации чисел и арифметических действий 1-го десятка. Особенности, 146.69kb.
- Общественные блага, 37.15kb.
- Доклад на тему: «Основные методы защиты авторского права в сети Интернет», 41.2kb.
- 1. Вводные замечания, 418.06kb.
- Куп “Комплекс по переработке и захоронению токсичных промышленных отходов Гомельской, 24.85kb.
- Полигоны по обезвреживанию и захоронению токсичных промышленных отходов. Основные положения, 380.98kb.
- Методические рекомендации по организации деятельности в сфере сбора, утилизации и безопасного, 823.63kb.
Разработка экологически безопасного способа биотрансформации токсических веществ в сточных водах с использованием иммобилизованного мицелия ксилотрофов
Введение
Темпы роста и развитие национальной экономики стимулируют увеличение производства продукции различных отраслей, что, в свою очередь, влечет за собой образование огромного количества токсичных и нетоксичных отходов, обладающих слабой биодоступностью. Это так называемые ксенобиотики – чужеродные для живых организмов химические вещества, естественно не входящие в биотический круговорот, и, как правило, прямо или косвенно порождённые хозяйственной деятельностью человека. К ним относятся: пестициды, минеральные удобрения, моющие средства (детергенты), радионуклиды, синтетические красители, полиароматические углеводороды и др. Многие из этих соединений характеризуются высокой устойчивостью к химическому и биологическому разложению, они способны сохраняться в окружающей среде в течение десятков лет и переноситься по пищевым цепям, приводя к сокращению биоразнообразия, нарушению экологического баланса в живой природе и развитию серьезных заболеваний человека, таких как рак, аллергические реакции, изменение наследственных признаков, снижение иммунитета, нарушение обмена веществ.
Вредоносность окружающей среды возрастает каждое десятилетие. Для того, чтобы следующие поколения могли существовать, надо остановить этот процесс уже сегодня. Такая проблема стоит перед всеми индустриальными странами. Не менее значима она и для России.
В связи с этим возникает острая необходимость в разработке методов деградации ксенобиотиков, однако очень важно, чтобы при этом использовались экологически чистые методы, исключающие ситуацию, когда при утилизации одного отхода получают другой, менее токсичный, но слабо разлагаемый отход-ксенобиотик.
Одним из наиболее перспективных способов в области деградации загрязняющих веществ является использование микроорганизмов. Преимущество биологических методов деградации ксенобиотиков перед химическими и физическими заключается в том, что данные методы характеризуются относительно небольшим капиталовложением, низким энергопотреблением, способностью к самоподдерживанию и саморегуляции, экологической безопасностью – в большинстве случаев позволяют исключить возможность образования новых загрязнителей. Ряд микроорганизмов, обладающих огромным разнообразием ферментных систем и большой лабильностью метаболизма, способен полностью трансформировать сложную молекулу токсиканта, либо приводить к ее неполному превращению, в результате чего молекула утрачивает токсичность и становится доступной для других микроорганизмов.
Одними из наиболее перспективных биодеструкторов ксенобиотиков являются ксилотрофные базидиомицеты, продуцирующие комплекс внеклеточных лигнолитических ферментов, таких как лигнинпероксидаза, Mn-пероксидаза и лакказа. Данные ферменты катализируют окисление широкого круга органических и неорганических соединений, включая орто- и парадифенолы, аминофенолы, полифенолы и лигниноподобные соединения.
Лакказа – медьсодержащий фермент класса оксидредуктаз (КФ 1.10.3.2 п-дифенол: кислород оксидоредуктаза), катализирующий окисление огромного количества органических и неорганических субстратов молекулярным кислородом с сопутствующим восстановлением последнего непосредственно до воды, минуя стадию образования пероксида водорода.
Лакказа обладает широкой субстратной специфичностью, высокой активностью и стабильностью, что делает возможным ее использование для практических целей, в частности, для биодеградации ксенобиотиков.
Известно использование лакказы для биодеградация фенольных отходов, а именно 2,4-дихлорфенола и пентахлорфенола [Fahr et al., 1999], гербицидов (атразина) [Горбатова др., 2006; Королева и др., 2002; Васильченко и др., 2002; Koroleva et al., 2001], инсектицидов (дихлор-дифенил-трихлорметилметана) [Bumpus et al., 1985, Leontievsky et al., 2000]; для обесцвечивания стоков гидролизного производства [Гаврилова и Гусарова 1986; патент РФ № 2001128771, 2003; Marco-Urrea et al., 2006], сточных вод, содержащих мелассу [Ohmomo et al., 1985], винассу и экстракт кофейной гущи [Rodrigues etn al., 2003].
Показана возможность использовать базидиальные грибы для разрушения таких веществ как 2,3,7,8-тетрахлоробензо-n-диоксина, линдана и бензопирена до СО2 [Bumpus et al., 1985, Leontievsky et al., 2000], а также для обесцвечивания различных промышленных красителей [Trupkin et al., 2003; Lorenzo et al., 2002; Salony et al., 2006; Hao et al., 2006; Eichlerova et al., 2006].
Во многих случаях вопрос о том, разрушаются ли токсические вещества полностью или подвергаются биотрансформации в какие-либо иные соединения, не всегда ясен [Скрябин, Головлева. 1976].
Наиболее эффективным способом биодеградации ксенобиотиков с использованием базидиальных грибов является применение методов, включающих иммобилизацию мицелия гриба на различных носителях [Iqbal M. et al., 2005; Lu Y. et al.,2009; Ortega-Clemente A. et al., 2009; Rodríguez Couto S. et al., 2004; Susla M. et al., 2007 и др.]. Это связано с тем, что большинство грибных культур в природной среде способны самопроизвольно закрепляться на различных поверхностях, поэтому иммобилизация для них является естественным состоянием. В качестве носителей для иммобилизации базидиальных грибов многие авторы предлагают различные материалы, среди которых поликапроамидные волокна [Черных и др., 2005], пеностекло [Ehlers G.A. et al., 2004]], сосновая стружка [Susla M. et al., 2006], частицы вспененного полиуретана [Chairattanamanokorn P et al., 2005], Са-альгинатные шарики [Wu J. et al., 2007; Enayatzamir K. et al.,2009], растительная губка люфа [Iqbal M. et al., 2005], карбоксиметилцеллюлозные шарики [Bayramoğlu G. et al., 2003], радиополимерный гидрогель [Petre M. et al., 2001], губки из нержавеющей стали [Rodríguez Couto S. et al., 2004], криогель ПВС [патент РФ № 2315102, 2008].
Помимо этого использование иммобилизованной биомассы предполагает возможность ее многократного применения, а также простоту отделения биомассы от реакционной среды. Несмотря на очевидные преимущества использования иммобилизованных продуцентов для осуществления процессов биодеградации, промышленного применения данного метода пока не существует.
Цель данной работы заключалась в разработке способов биокаталитической деградации токсических веществ в сточных водах с использованием иммобилизованного на биодеградируемом носителе мицелия высшего базидиального гриба–ксилотрофа – промышленного продуцента фермента лакказы, способного к биотрансформации широкого круга промышленных токсических соединений.
Задачами исследования явились поиск наиболее перспективных и экологичных носителей для иммобилизации штамма-продуцента лакказы, установление наиболее эффективного метода иммобилизации гриба, определение оптимальных параметров для проведения процесса биодеградации ксенобиотиков с использованием иммобилизованного мицелия, разработка экспериментальной установки для биодеградации ксенобиотиков.
- Материалы и методы
- Штамм-продуцент
- Штамм-продуцент
Для проведения исследований был выбран промышленный штамм-продуцент лакказы Trametes hirsuta 56 (Wulfen.) Pilát (=Coriolus hirsutus 56) cем. Polyporaceae. Штамм получен из коллекции МГУИЭ. Данный штамм характеризуется высокой скоростью роста и активным синтезом экстрацеллюлярной лакказы в условиях жидкофазного глубинного культивирования, о чем свидетельствуют различные литературные источники.
Получение посевного материала проводили в несколько этапов (пассажей). Первоначально осуществляли пересев культуры с твердой питательной средой (косяка) в колбу из расчета 1 косяк на 1 колбу и культивировали при температуре 32ºС в течение 4 суток на круговой качалке с частотой вращения 200 об/мин. Затем полученную глубинную культуру первого пассажа повторно пересевали из расчета 20% объемных посевного материала и культивировали при температуре 32ºС в течение 3 суток на круговой качалке с частотой вращения 200 об/мин. Срок хранения посевного материала 10 дней при температуре +4оС.
- Лигноцеллюлозные отходы.
В качестве лигноцеллюлозных отходов в опыте сравнили дубовые опилки, березовые опилки, сосновые опилки, костру льна и подсолнечную лузгу. Лигноцеллюлозные отходы предварительно стерилизовали в сухом виде в пробирках в автоклаве под давлением 1 атм в течение 60 мин и повторно через сутки при том же режиме и вносили при засеве в количестве 2 г/л в колбы со стерильной питательной средой следующего состава (г/л): мука пшеничная – 29.0 г/л; аммоний азотнокислый – 2.0 г/л; калий фосфорнокислый однозамещенный – 1.3 г/л; кукурузный экстракт сгущенный – 6.4 г/л; сульфат меди – 0.05 г/л; вода водопроводная – до 1 л; pH до стерилизации 5,6-5,8.
- Носители
Для проведения экспериментов по иммобилизации в качестве носителей были выбраны: губки из нержавеющей стали, растительная губка люфа, дубовые опилки и костра льна.
Губки из нержавеющей стали были порезаны на кусочки диаметром приблизительно 1,5 см. Перед использованием носитель был подвержен кипячению в течение 10 мин, а затем трижды промыт дистиллированной водой.
Люфа была порезана на диски диаметром 2,5 см и толщиной 2-3 мм. Перед использованием носитель был подвержен кипячению в течение 30 мин, а затем трижды промыт водой.
Все выбранные носители были подвержены стерилизации в автоклаве при температуре 121 ºС в течение 20 мин.
- Иммобилизация продуцента
Иммобилизацию продуцента осуществляли в колбах Эрленмейера объемом 750мл на круговой качалке. В колбы вносили 150 мл питательной среды, 0,75 мл посевного материала и носители в количестве 50 см3, что составляло для дубовых опилок – 2 г, костры льна – 2 г, стальных губок – 6 г, люфы – 3 г.
Питательная среда имела следующий состав: мука пшеничная – 29,0 г/л; кукурузный экстракт – 6,4 г/л; NH4NO3 – 2,0 г/л; КН2РО4 – 1,3 г/л; вода водопроводная – до 1 л. Для стимулирования продуцирования лакказы в среду был добавлен CuSO4 в концентрации 0,05г/л. pH среды до стерилизации – 5,6-5,8. Затем колбы инкубировали на круговой качалке с частотой вращения 200 об/мин при температуре 32 ºС в течение 10 суток.
- Определение активности фермента
Для выбранного штамма-продуцента установлено, что до 80 % оксидазного ферментативного комплекса составляет лакказа. Общую оксидазную активность (ОА) определяли спектрофотометрически при 410 нм с использованием в качестве субстрата пирокатехина (10-2 М) в 0,1 М цитратно-фосфатном буфере (pH 4,5). За единицу оксидазной активности (ЕОА) принимали изменение оптической плотности на 1 ед. за 1 мин в пересчете на 1 мл культурального фильтрата.
- Эксперименты по биодеградации
Для определения эффективности процесса биодеградации в качестве модельного соединения был выбран краситель Methyl Orange (ГОСТ 10816-64).
Краситель вносился в колбы с иммобилизованным мицелием гриба в концентрации 0,15 мг/мл в период максимальной активности лакказы.
Эффективность биодеградации красителя определяли спектрофотометрически в видимой области спектра и оценивали по снижению пика максимума поглощения света для данного красителя (470 нм).
- Результаты и обсуждение
В качестве носителей базидиальных грибов многие авторы предлагают различные материалы, среди которых поликапроамидные волокна, пеностекло, сосновая стружка, дубовые опилки, частицы вспененного полиуретана, Са-альгинатные шарики, растительная губка люфа, карбоксиметилцеллюлозные шарики, губки из нержавеющей стали, криогель ПВС.
С нашей точки зрения наиболее интересным и экологичным является использование в качестве носителей лигноцеллюлозных отходов, так как они не требуют специальных методов утилизации, в отличие от синтетических полимеров и металла, и могут быть подвергнуты биологическому разложению в естественных условиях. Либо они могут быть использованы как удобрение, поскольку такой отработанный носитель будет представлять собой ферментативно размягченный лигноцеллюлозный субстрат, обогащенный белком и ценными биологически-активными веществами грибов. Известно, например, что обогащенный мицелием ксилотрофных базидиомицетов лигноцеллюлозный субстрат является хорошей кормовой добавкой для животных. Кроме того, известно, что лигноцеллюлозные субстраты способны индуцировать синтез лакказы при внесении их в питательную среду [Lorenzo M. et al., 2002].
3.1. Изучение влияния лигноцеллюлозных субстратов на синтез основного фермента-биокатализатора деструкции.
С целью изучения влияния лигноцеллюлозных субстратов на синтез основного фермента-биокатализатора деструкции был проведен эксперимент в условиях глубинного культивирования на качалке. В качестве лигноцеллюлозных отходов в опыте сравнили дубовые опилки, березовые опилки, сосновые опилки, костру льна и подсолнечную лузгу.
Культуру гриба Trametes hirsutа 56 выращивали методом глубинного культивирования в колбах Эрленмейера объемом 750 мл с объемом среды 150 мл на круговой качалке при 200 об/мин и температуре (30-32)0С. Среду инокулировали мицелиальной взвесью в количестве 10 % по объему.
Из графика 1 видно, что все изученные лигноцеллюлозные отходы приводили к повышению оксидазной активности, но наибольшая активность фермента зафиксирована при использовании дубовых опилок (9,7 ЕОА) уже на 4 сутки культивирования.
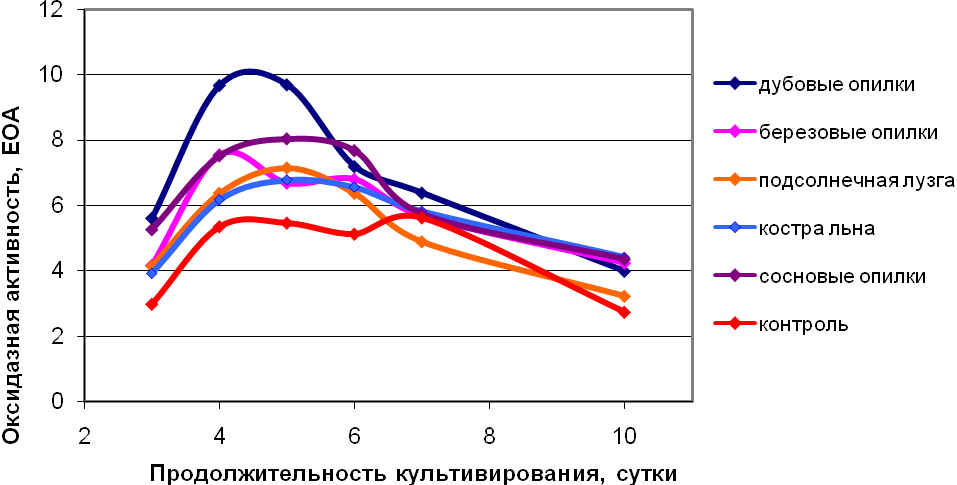
Рисунок – 1. Динамика оксидазной активности по пирокатехину в культуральной среде T.hirsutа 56 в зависимости от типа используемого лигноцеллюлозного субстрата
Таким образом, экспериментально показано, что лигноцеллюлозные отходы, при использовании их в качестве носителя для иммобилизации гриба, будут способствовать повышению синтеза лакказы, что, в свою очередь, будет интенсифицировать процесс биодеградации. В связи с очевидной дефицитностью дубового сырья в качестве носителя возможно использование и других лигноцеллюлозных отходов.
3.2. Изучение эффективности иммобилизации мицелия штамма-деструктора на носителях разных типов
Для проведения экспериментов по иммобилизации были выбраны субстраты, которые по литературным данным являются лучшими носителями: губки из нержавеющей стали [Rodríguez Couto S. et al., 2004], растительная губка люфа [Iqbal M. et al., 2005]; а также дубовые опилки, как показавшие наибольшую способность интенсифицировать синтез лакказы, и костру льна, как доступный отход льноперерабатывающей промышленности.
В результате проведения экспериментов по иммобилизации было установлено, что наиболее перспективными носителями для иммобилизации мицелия гриба Trametes hirsuta 56 качалочным способом являются стальные губки и растительная губка люфа. Об этом свидетельствовало отсутствие биомассы гриба в культуральной жидкости (Рис.2).
а)
 б)
б) 
Рисунок – 2. Иммобилизация биомассы гриба на различных носителях: а – на растительной губке люфе; б – на стальных губках
При этом максимальная активность лакказы при иммобилизации гриба на стальных губках была отмечена на 7 сутки эксперимента (3,5 ЕОА) (Рис.3). Максимум активности лакказы при иммобилизации продуцента на растительной губке люфе пришелся на 5 сутки эксперимента (1,4 ЕОА).
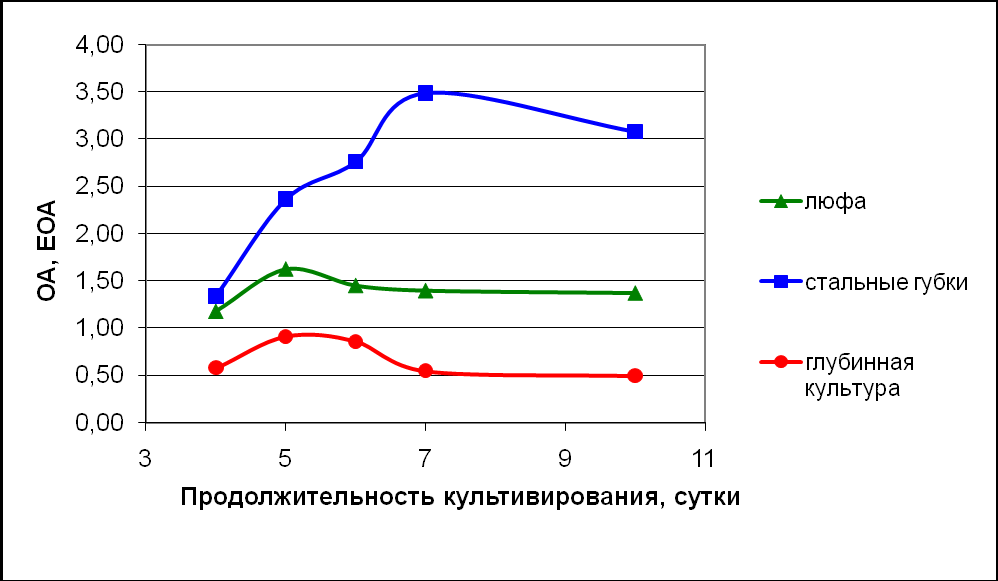
Рисунок – 3. Динамика оксидазной активности базидиального гриба Trametes hirsuta 56, иммобилизованного на различных носителях
Также было установлено, что активность лакказы культуры продуцента, иммобилизованной на различных носителях, превышает активность лакказы неиммобилизованной глубинной культуры (0,6 ЕОА).
Использование дубовых опилок и костры льна в качестве носителей при иммобилизации мицелия гриба качалочным способом оказалось неэффективным, о чем свидетельствовало наличие биомассы в культуральной жидкости.
3.3. Выбор модельного соединения для проведения экспериментов по биодеградации
Для проведения экспериментов по утилизации токсических веществ в промышленных стоках был осуществлен выбор модельного соединения. В качестве промышленных стоков были выбраны стоки текстильных предприятий, а в качестве модельного соединения – краситель Methyl Orange, относящийся к классу азокрасителей (Рис.4), которые применяются для крашения тканей, кожи, бумаги, резины, пластмассы, а также в лакокрасочной, полиграфической и других отраслях [Химия: Энциклопедия / Под ред. И. Л. Кнунянц, 2003].
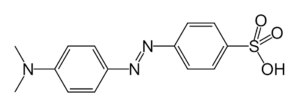
Рисунок – 4. Структурная формула Methyl Orange
Известно, что Methyl Orange подвергается биодеградации лакказой с активностью 20 МЕ (МЕ = 3,38ЕОА), что соответствует 5,92 ЕОА в течение 6 часов при исходной концентрации красителя 0,02 % [Kunamneni A. et al., 2008].
3.4. Изучение процесса биодеградации модельного соединения
Процесс биодеградации модельного соединения изучался в колбах с иммобилизованным мицелием гриба.
Краситель Methyl Orange вносился в колбы в концентрации 0,15 мг/мл в период максимальной активности лакказы. Эксперименты по биодеградации красителя показали, что процесс биодеградации осуществляется полностью уже на первые сутки. Изменение окраски раствора наблюдалось визуально (Рис.5) и было подтверждено спектрофотометрически (Рис.6).


а) б)
Рисунок – 5. Деградация красителя Methyl Orange в колбе мицелием гриба, иммобилизованным на стальных губках: а – начало процесса ; б - через 1 сутки.
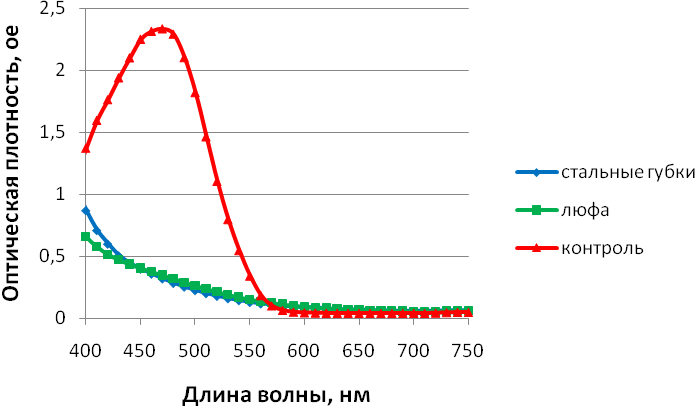
Рисунок – 6. Изменение спектра красителя Methyl Orange через 1 сутки эксперимента.
Максимум поглощения света красителем Methyl Orange наблюдается при 470 нм, о чем свидетельствует наличие пика в соответствующей области на контрольной кривой. Эффективность биодеградации красителя подтверждалась исчезновением пика в соответствующей области на 1 сутки эксперимента.
Таким образом, показано, что эффективность биодеградации ксенобиотиков с помощью иммобилизованного мицелия базидиального гриба Trametes hirsuta 56 (Wulfen.) Pilát (=Coriolus hirsutus 56 ) cем. Polyporaceae достигает 100% в течение суток при исходной концентрации модельного соединения 0,015%.
- 3.5. Разработка экспериментальной установки
На основании полученных данных разработана экспериментальная установка для биодеградации ксенобиотиков в сточных водах с использованием иммобилизованного на твердом носителе мицелия высшего базидиального гриба–ксилотрофа – промышленного продуцента фермента лакказы, способного к биотрансформации широкого круга промышленных токсических соединений (Рис. 7).

Рисунок – 7. Экспериментальная установка для биодеградации ксенобиотиков в сточных водах с использованием иммобилизованного на твердом носителе мицелия высшего базидиального гриба
Выводы
Использование иммобилизованного мицелия высшего базидиального гриба–ксилотрофа – промышленного продуцента фермента лакказы является эффективным, экономичным и экологичным способом деградации токсических веществ, содержащихся в сточных водах.
- Наиболее эффективно процесс иммобилизации грибов-продуцентов лакказы осуществляется на носителе, обладающем пористой воздухопроницаемой структурой.
- Установлено, что лигноцеллюлозные отходы существенно увеличивают синтез фермента-биокатализатора (лакказы), что повышает эффективность биодеградации ксенобиотиков
- Использование в качестве носителей для иммобилизации лигноцеллюлозных отходов дает возможность не только их утилизации, но и исключает образование новых слабо деградируемых отходов отработанного носителя.
- Экспериментально подтверждена эффективность биодеградации ксенобиотиков с помощью иммобилизованного мицелия базидиального гриба Trametes hirsuta, которая по данным спектрофотометрического анализа достигает 100% в течение суток при исходной концентрации модельного соединения 0,015%
- Разработана экспериментальная установка для биодеградации токсических веществ в сточных водах с использованием иммобилизованного мицелия ксилотрофа.
Заключение
Показана принципиальная возможность очистки токсичных сточных вод с помощью биокатализа, осуществляемого ферментом, синтезируемым иммобилизованным ксилотрофным мицелием, без образования дополнительных слабо деградируемых отходов. Полученные результаты могут быть положены в основу НИОКР.
Список литературы:
- Васильченко Л.Г., Хромоныгина В.В., Королева О.В., Ландесман Е.О., Гапоненко В.В., Ковалева Т.А., Козлов Ю.П., Рабинович М.Л. Потребление триазинового гербицида атразина лакказным и безлакказным вариантами почвенного гриба Mycelia sterilia ИНБИ 2-26// Прикладная биохимия и микробиология. –2002. – Т. 38. – № 5. – С. 534-539
- Гаврилова В.П., Гусарова Л.А. Биологическое окисление базидиомицетами гидролизной последрожжевой бражки // Микол. и фитопатол.– 1986. - т. 20, вып. 4.– С. 285-288.
- Горбатова О.Н.; Королева О.В.; Ландесман Е.О.; Степанова Е.В.; Жердев А.В. Индукция биосинтеза лакказы как способ увеличения потенциала детоксификации базидиомицетами. Прикл.биохимия и микробиология, 2006; Т.42,N 4. - С. 468-474
- Королева О.В., Степанова Е.В., Ландесман Е.О. и др. Иммуноферментный анализ разложения гербицида почвенными и древоразрушающими грибами// Прикладная биохимия и микробиология. – 2002. - том 38, №4. - с. 413-418
- Патент РФ. 2003. № 2001128771
- Патент РФ. 2008. № 2315102
- Скрябин Г.К., Головлева Л.А. Использование микроорганизмов в органическом синтезе.– М.: Наука, 1976.–336с.
- Химия: Энциклопедия / Под ред. И. Л. Кнунянц. – М.: Большая Российская энциклопедия, 2003. – 972 с.
- Черных А.М., Леонтьевский А.А., Головлёва Л.А. Новые приемы повышения выхода лакказы гриба Panus tigrinus// Прикладная биохимия и микробиология. - 2005. - том 41, № 5, - с. 578-581
- Bayramoğlu G, Bektaş S, Arica MY. Biosorption of heavy metal ions on immobilized white-rot fungus Trametes versicolor// J Hazard Mater. – 2003. - 101(3). –р. 285-300.
- Bumpus John A., Tien Ming, Wright David, Aust Steven D. Oxidation of persistent environmental pollutants by a white rot fungus// Sience. –1985. – V.228. – № 4706. – р. 1434-1436.
- Chairattanamanokorn P, Imai T, Kondo R, Sekine M, Higuchi T, Ukita M. Decolorization of alcohol distillery wastewater by thermotolerant white-rot fungi// Prikl Biokhim Mikrobiol. – 2005. - 41(6). - р. 662-7.
- Ehlers G.A., Rose P.D. Immobilized white-rot fungal biodegradation of phenol and chlorinated phenol in trickling packed-bed reactors by employing sequencing batch operation// Bioresour Technol. – 2005. - 96(11). – р.1264-75.
- Eichlerova I, Homolka L, Lisa L, Nerud F. The influence of extracellular H2O2 production on decolorization ability in Fungi // J Basic Microbiol. –2006. –46(6). – р. 449-55.
Enayatzamir K, Alikhani HA, Yakhchali B, Tabandeh F, Rodríguez-Couto S. Decolouration of azo dyes by Phanerochaete chrysosporium immobilised into alginate beads // Environ Sci Pollut Res Int. – 2010. -17(1). – р. 145-53.
- Fahr K, Wetzstein HG, Grey R, Schlosser D. Degradation of 2,4-dichlorophenol and pentachlorophenol by two brown rot fungi// FEMS Microbiol Lett. –1999. –Jun 1. –175(1). – р. 127-32.
- Hao J, Song F, Huang F, Yang C, Zhang Z, Zheng Y, Tian X. Production of laccase by a newly isolated deuteromycete fungus Pestalotiopsis sp. and its decolorization of azo dye //J Ind Microbiol Biotechnol. –2007. – Mar.–34(3). – р. 233-40. Epub 2006 Dec 15.
- Iqbal M, Saeed A, Edyvean RG, O'Sullivan B, Styring P. Production of fungal biomass immobilized loofa sponge (FBILS)-discs for the removal of heavy metal ions and chlorinated compounds from aqueous solution// Biotechnol Lett. – 2005. -27(17). –р. 1319-23.
- Kunamneni A., Ghazi I., Camarero S., Ballesteros A., Plou F.J., Alcade M. Decolorization of synthetic dyes by laccase immobilized on epoxy-activated carriers// Process Biochem. – 2008, -43. – р. 169-178.
- Koroleva O.V., Stepanova E.V., Landesman E.O., Vasilchenko L.G., Khromonygina V.V., Zherdev A.V., Rabinovich M.L. In vitro degradation of the herbicide atrazine by soil and wood decay fungi controlled through ELISA technique// Toxicological and Environmental Chemistry. –2001. – vol. 80. – N 3-4. – p. 175-188.
- Leontievsky A.A., Myasoedova NM, Baskunov BP, Evans CS, Golovleva LA. Transformation of 2,4,6-trichlorophenol by the white-rot fungi Panus tigrinus and Coriolus versicolor // Biodegradation. –2000. –№ 11. – p. 331-340.
- Lorenzo M, Moldes D, Rodriguez Couto S, Sanroman A. Improving laccase production by employing different lignocellulosic wastes in submerged cultures of Trametes versicolor// Bioresour Technol. –2002. – Apr. – 82(2). – р.109-13.
- Lu Y., Yan L., Wang Y., Zhou S., Fu J., Zhang J. Biodegradation of phenolic compounds from coking wastewater by immobilized white rot fungus Phanerochaete chrysosporium// J Hazard Mater. – 2009. - 165(1-3). – р. 1091-7.
- Marco-Urrea E, Gabarrell X, Sarra M, Caminal G, Vicent T, Reddy CA. Novel aerobic perchloroethylene degradation by the white-rot fungus Trametes versicolor//Environ Sci Technol. –2006. –Dec 15. –40(24). – р. 7796-802.
- Ohmomo S., Itoh N., Watanabe Y., Kaneko Y., Tozawa Y., Ueda K.. Contunuous decolorization of molasses waste water with mycelia of Coriolus versicolof Ps4a // Agric. biol. chem. – 1985. – vol. 49.– no 9.– Sep.– p. 2552-2555.
- Ortega-Clemente A., Caffarel-Méndez S., Ponce-Noyola M.T., Barrera-Córtes J., Poggi-Varaldo H.M.,2009. Fungal post-treatment of pulp mill effluents for the removal of recalcitrant pollutants// Bioresour Technol. – 2009. - 100(6). – р.1885-94.
- Petre M, Teodorescu ME, Zarnea G, Adrian P, Gheorghiu E, Gheordunescu V. Microbial degradation of cellulose wastes in continuous bioreactors// Meded Rijksuniv Gent Fak Landbouwkd Toegep Biol Wet. – 2001. - 66(3a). – р. 195-8.
- Rodríguez Couto S, Sanromán M.A., Hofer D., Gübitz G.M. Stainless steel sponge: a novel carrier for the immobilisation of the white-rot fungus Trametes hirsuta for decolourization of textile dyes// Biores. Technol. – 2004. – 95. – р. 67-72.
- Salony, Mishra S, Bisaria VS. Production and characterization of laccase from Cyathus bulleri and its use in decolourization of recalcitrant textile dyes // Appl Microbiol Biotechnol. –2006. – Aug. – 71(5). – р. 646-53.
- Susla M, Novotný C, Svobodová K. The implication of Dichomitus squalens laccase isoenzymes in dye decolorization by immobilized fungal cultures// Bioresour Technol. – 2007. - 98(11). – р. 2109-15.
- Trupkin S, Levin L, Forchiassin F, Viale A. Optimization of a culture medium for ligninolytic enzyme production and synthetic dye decolorization using response surface methodology // J Ind Microbiol Biotechnol. – 2003. –Dec. – 30(12). – р. 682-90.
