Курсовой проект изложен на 26 страницах, содержит 3 рисунка, 3 таблицы
| Вид материала | Курсовой проект |
СодержаниеОбъем газообразного сырья 1.Расчет процесса горения Р – число атомов кислорода. где К По данным этой таблицы строим график q-t (рис. 3).КПД печи и расход топлива С При С найдем по графику q-t |
- Курсовая работа По курсу «Организация и планирование производства. Управление предприятием», 358.25kb.
- К курсовой работе по дисциплине «Электроника и схемотехника» на тему: «Автомат для, 253.88kb.
- Курсовой проект по учебной дисциплине «Микропроцессорные средства» на тему «Система, 521.9kb.
- Отчет представлен на 42 страницах; содержит 4 раздела (раздел 2 содержит 5 пунктов);, 20.7kb.
- Проект производственно-технической базы атп на 200 автомобилей с разработкой участка, 496.28kb.
- Пояснительная записка к курсовому проекту по дисциплине 'Основы конструирования механизмов, 375.77kb.
- Пояснительная записка к курсовому проекту по дисциплине 'Основы конструирования механизмов, 345.53kb.
- Реферат дипломный проект содержит 125 страниц, 22 рисунка, 28 таблиц, 17 литературных, 92.85kb.
- Реферат дипломный проект посвящен решению некоторых вопросов эксплуатации и анализу, 22.75kb.
- Учебно-методическое пособие содержит следующие структурные разделы: введение, цели, 335.07kb.
(...В представленной на сайте версии работы изменены числовые данные. Для получения работы с корректными величинами, обратитесь на www.diplomant-spb.ru ...)
Задание на курсовой проект «Установка производства этанола прямой гидратацией этилена».
Выбрать и обосновать технологию получения этанола прямой гидратацией этилена. Разработать технологическую схему установки для производства 1700 кг/ч этанола. Составить материальный баланс производства при степени конверсии этилена за один проход 4,6% и селективности по этанолу 96%. Катализатор — фосфорная кислота на алюмосиликате. Соотношение водяного пара (мольное) и этилена 0,7:1. Выполнить тепловой расчет трубчатой печи для нагрева сырья.
Графическая часть: технологическая часть и расчет реактора.
Реферат.
В курсовом проекте рассмотрены методы получения этанола. Выбран метод получения этанола прямой гидратацией этилена. Разработана технологическая схема производства. В качестве катализатора используется фосфорная кислота на алюмосиликате.
Представлены мат расчеты: расхода сырьевых компонентов, размера реактора
Курсовой проект изложен на 26 страницах, содержит 3 рисунка, 3 таблицы.
Использовано 5 литературных источников.
Графическая часть изображена на 2 листах.
Содержание.
Задание
Реферат
Введение
- Литературный обзор
- Методы получения
- Выбор конструкции реактора
- Методы получения
- Физико-химические основы процесса и веществ. Химическая схема, механизм реакции, выбор катализатора
- Техническая схема
- Расчетная часть
- Материальный баланс
- Тепловой баланс
- Расчет аппарата
- Расчет трубчатой печи
- Материальный баланс
- Графическая часть
- Выводы
- Библиографический список
Введение.
Этанол принадлежит к числу многотоннажных и широко применяемых продуктов органического синтеза. Он является хорошим, хотя и огнеопасным растворителем; в больших количествах используется в пищевой и медицинской промышленности, парфюмерии; служит горючим в жидкостных ракетных двигателях, антифризом и т. д. Как промежуточный продукт органического синтеза этанол имеет важное значение для получения сложных эфиров, хлороформа, хлораля, диэтилового эфира, ацетальдегида. Из него получают синтетический каучук, уксусную кислоту, красители, эссенции, фотопленку, порох, пластмассы.
До недавнего времени производство этанола основывалось на пищевом сырье — сбраживание крахмала из некоторых зерновых культур и картофеля с помощью ферментов, вырабатываемых дрожжевыми грибками. Этот способ сохранился и до сих пор, но он связан с большими затратами пищевого сырья и не может удовлетворить промышленность. Другой метод, также основанный на переработке растительного сырья, заключается в гидролизе древесины (гидролизный спирт). Древесина содержит до 50 % целлюлозы, и при ее гидролизе водой в присутствии серной кислоты образуется глюкоза, которую подвергают затем спиртовому брожению.
Синтетический этиловый спирт требует для своего производства гораздо меньше трудовых затрат, он аналогичен по составу и качеству спирту, получаемому из пищевых продуктов, и широко применяется в различных отраслях промышленности.
Синтетический этанол получают гидратацией этилена.
Цель курсового проекта состоит в выборе технологии получения этанола прямой гидратацией этилена и разработке технологической схемы процесса.
- Литературный обзор.
- Методы получения.
- Методы получения.
В России процесс производства синтетического этанола посредством гидратации этилена осуществляется двумя способами: сернокислотной и прямой гидратацией. Первый способ внедрен в промышленном масштабе с 1952 г., второй получил широкое распространение в последние десятилетия.
При получении синтетического этилового спирта первым способом концентрированная серная кислота реагирует с этиленом, образуя моно- и диалкилсульфат:
С2Н4 + H2SO4 ---------> C2H5SO2OH
моноалкилсульфат
2С2Н4 + H2SO4 ---------> (C2H5O)2SO2
диалкилсульфат
В дальнейшем эти эфиры при взаимодействии с водой превращаются этиловый спирт, выделяя серную кислоту:
C2H5SO2OH + H2O ---------> C2H5OH + H2SO4
(C2H5O)2SO2 + 2H2O ---------> 2C2H5OH + H2SO4
Второй способ —метод получения синтетического этанола путем прямой гидратации этилена.
Прямой гидратацией этилена называется обратимый экзотермический процесс непосредственного (без образования промежуточных продуктов) присоединения воды к этилену в присутствии катализатора с образованием этилового спирта:
CH2=CH2 + H2O ---------> C2H5OH + 10,5 ккал.
Способность этилена присоединять элементы воды была известна ещё в конце ХVIII века. А.М. Бутлеров в 60-тых годах прошлого столетия применил реакцию гидратации при помощи серной кислоты к различным этиленовым углеводородам.
На ход реакции большое влияние оказывает концентрация этилена в исходном газе. При уменьшении концентрации соляной кислоты, t реакции, парционального давления этилена и интенсивности перемешивания реагирующих веществ. С повышением концентрации кислоты скорость поглощения этилена увеличивается (93%-ная кислота поглощает в 10раз медленнее, чем 97,5%-ная), так как увеличивается скорость образования диэтилсульфата. В таком же направлении действует и повышение температуры до определённого предела.
Недостатками сернокислотного метода является большой расход серной кислоты (на 1 кг спирта берётся 1,8-2 кг серной кислоты в пересчёте на моногидрат) и сильная коррозия многих частей аппаратуры.
Непосредственное присоединение воды к этилену давно являлось заманчивым делом, но на пути к осуществлению этой реакции стоял целый ряд затруднений. Реакция является обратимой и идёт с выделением теплоты.
В результате исследований и промышленных испытаний установлены следующие основные условия взаимодействия газообразного этилена и водяных паров:
- Температура 275-300С;
- Давление при гидратации 65-75 атм;
- Концентрация этилена в циркулирующем газе 85% (объёмных);
- Молярное отношение воды к этилену 0,7:1;
- Концентрация применяющейся здесь фосфорной кислоты в плёнке катализатора не ниже 83%;
- За 1 час проходит 1800 м3 газа через кубометр катализатора.
Для сдвига равновесия в сторону гидратации этилена необходимо понижение температуры и повышение давления. Процесс прямой гидратации этилена состоит из несколько непрерывно протекающих стадий:
- Компрессия исходного этилена до давления, необходимого для гидратации, и возвращение не прореагировавшего этилена;
- Приготовление исходной парогазовой смеси;
- Гидратация этилена;
- Нейтрализация фосфорной кислоты, уносимой из зоны реакции;
- Охлаждение парогазовой смеси и конденсация паров спирта и воды;
- Очистка циркулирующего газа.
Парофазная каталитическая гидратация этилена является более перспективным методом, и наша промышленность сейчас ориентируется на этот более прогрессивный метод.
Катализатором процесса служит ортофосфорная кислота на шариковом носителе — силикагеле.
Наряду с указанными реакциями при гидратации этилена (как сернокислотной, так и прямой) протекают многочисленные побочные реакции, приводящие к образованию значительного количества примесных соединений.
- Выбор конструкции реактора (достоинства и недостатки).
Реактор (гидрататор) представляет собой пустотелый цельно-кованный цилиндрический стальной аппарат внутренним диаметром 1260 — 2200 мм и толщиной стенки 70 мм, футерованный слоем меди толщиной 12 — 15 мм (рис. 1). В качестве усовершенствования реактор может быть изготовлен из биметалла сталь — медь. Высота слоя катализатора 7 м. Кроме того, для снижения уноса кислоты в нижнюю часть реактора загружают слой чистого носителя (без кислоты) высотой 1 м. Линейная скорость газа 0,2 м/с; потеря напора 0,3 — 0,4 МПа в начале цикла работы и до 0,6 МПа в конце.
- Физико-химические основы процесса и веществ.
Химическая схема, механизм реакции, выбор катализатора.
Этиловый спирт (этанол) С2Н5ОН — бесцветней жидкость, легко испаряющаяся. Спирт, содержащий 4—5 % воды, называют ректификатом, а содержащий только доли процента воды — абсолютным спиртом. Такой спирт получают химической обработкой в присутствии водоотнимающих средств (например, свежепрокаленного СаО).Этиловый спирт — многотоннажный продукт химической промышленности. Получают его различными способами. Один из них — спиртовое брожение веществ, содержащих сахаристые вещества, в присутствии ферментов (например, зимазы — фермента дрожжей): зимаза
C6H12O6 —зимаза C2H6OH + 2CO2
Такой спирт называют пищевым или винным спиртом.
Этиловый спирт можно получать из целлюлозы, которую предварительно гидролизуют. Образующуюся при этом глюкозу подвергают в дальнейшем спиртовому брожению. Полученный спирт называют гидролизным.
Как известно, для получения этилового спирта существуют и синтетические способы, такие, как сернокислотная или прямая гидратация этилена:
H2C==CH2 + H2 —кат. H3C—CH2OH
Себестоимость спирта, полученного таким способом, намного дешевле, чем приготовленного из пищевых продуктов. Как у всех кислородосодержащих соединений, химические свойства этилового спирта определяются, в первую очередь, функциональными группами и, в известной степени, строением радикала.
Характерной особенностью гидроксильной группы этилового спирта является подвижность атома водорода, что объясняется электронным строением гидроксильной группы. Отсюда способность этилового спирта к некоторым реакциям замещения, например, щелочными металлами. С другой стороны, имеет значение и характер связи углерода с кислородом. Вследствие большой электроотрицательности кислорода по сравнению с углеродом, связь углерод-кислород также в некоторой степени поляризована с частичным положительным зарядом у атома углерода и отрицательным – у кислорода. Однако, эта поляризация не приводит к диссоциации на ионы, спирты не являются электролитами, а представляют собой нейтральные соединения, не изменяющие окраску индикаторов, но они имеют определенный электрический момент диполя .
Влияние температуры.
Реакцию прямой гидратации этилена желательно проводить при невысоких температурах. Однако практически выбор температуры лимитируется скоростью реакции и активностью применяемых катализаторов:с повышением температуры, при прочих равных условиях, равновесная степень превращения этилена в спирт снижается. Однако при низких температурах активность фосфорнокислотного катализатора очень мала. Так, степень конверсии этилена при 280—290°С достигает лишь 4—5%, а при более низких температурах она еще меньше. На практике процесс прямой гидратации в паровой фазе в присутствии фосфорнокислотного катализатора ведут в интервале 260—300°С. Влияние мольного соотношения воды и этилена.
Согласно термодинамическим данным, с увеличением отношения Н2О : C2H4 с 0,5 : 1 до 1 : 1 значительно повышается степень конверсии олефина. Однако экспериментальные данные отличаются от термодинамических: с увеличением отношения Н2О : С2Н4 до 0,7—0,75 степень конверсии этилена действительно возрастает, но при дальнейшем его увеличении она снижается.
Установлено также, что от соотношения Н20: С2Н4 зависит и активность катализатора гидратации. Оптимальная концентрация фосфорной кислоты в жидкостной пленке на пористом носителе составляет 83—85 %. Эта величина зависит от парциального давления водяного пара, которое определяется общим давлением в системе и мольным отношением вода: этилен. Оптимальная концентрация Н3РО4 наблюдается при соотношении Н20 : С2Н4 = 0,75 : 1. С дальнейшим ростом этого соотношения возрастает количество воды в пленке, уменьшается концентрация кислоты и снижается степень конверсии этилена. Поэтому в промышленных условиях принято мольное соотношение Н20 : С2Н4 — (0,6—0,7): 1.
Влияние давления.
Повышение давления благоприятствует реакции гидратации, причем оптимальное давление составляет 6,7—8 МПа. Это давление связано с процессом абсорбции этилена фосфорной кислотой. Оптимальное парциальное давлений водяных паров равно 2,7—3 МПа; оно и определяет мольное соотношение водяных паров и этилена. Оптимальное парциальное давление этилена составляет 3,5—3,7 МПа. Общее давление складывается из парциальных давлений воды, этилена и примесей. При концентрации этилена в циркулирующем газе 80—85 % общее давление системы получается равным 7—8 МПа.
Влияние времени контакта. С увеличением времени контакта степень конверсии этилена возрастает, а производительность единицы реакционного объема снижается. Оптимальное время контакта 17—19 с, что соответствует объемной скорости 1800—2000 ч-1.
В оптимальных условиях степень конверсии этилена не превышает 4,2—4,5 %, а селективность превращения этилена в спирт достигает 95 %-.
Основной особенностью процесса прямой гидратации этилена является малая степень конверсии этилена за один проход — не выше 4,5%. Этим обусловлена необходимость рециркуляции значительных его количеств.
Ввиду высокой кратности циркуляции этилена в системе возможно накопление инертных примесей, поэтому содержание их в исходном этилене не должно превышать 2—5%. Эти примеси представляют собой метан и этан. В результате циркуляции непревращенного этилена концентрация примесей в циркулирующем этилене возрастает, а концентрация этилена снижается. Заданную концентрацию этилена в циркуляционном газе поддерживают путем отдувки части циркулирующего газа в систему газофракционирования.
Поскольку в циркулирующем этилене инертных примесей, больше, чем в свежем, при отдувке можно вывести из системы все поступающие туда инертные примеси.
В производстве этанола прямой гидратацией этилена наиболее широкое применение получил фосфорнокислотный катализатор на твердом носителе.
Катализаторы прямой гидратации не должны разрушаться под действием влаги, поэтому такой катализатор, как фосфорная кислота на кизельгуре, неприменим — он не имеет скелета и легко разрушается. В качестве носителя для фосфорной кислоты применяют силикагель, алюмосиликат, цеолиты, инфузорную землю, монтморрилонит. Чаще всего используют шариковый широкопористый силикагель, обработанный водяным паром с целью снижения удельной поверхности и подавления побочных реакций уплотнения.
Носитель пропитывают 65%-ной фосфорной кислотой и сушат при 100 °С. Готовый катализатор содержит 35—40% НзРО4.
В условиях реакции фосфорная кислота, осажденная на носителе, растворена в пленке воды, адсорбированной на поверхности пор, и- реакция фактически протекает в жидкой пленке фосфорной кислоты. Кислотный катализ, таким образом, сводится к гомогенному катализу в жидкостной пленке катализатора
Существенными недостатками фосфорнокислотного катализатора являются его коррозионная агрессивность и постепенный унос кислоты с поверхности носителя. Эти недостатки могут быть полностью устранены при использовании нейтральных катализаторов — вольфрамовых и кремневольфрамовых.
Разработаны процессы гидратации этилена на нейтральном катализаторе в жидкой фазе при 250 — 300 °С и 30 МПа и при 300 °С и 14 МПа. В этих случаях процесс ведут в колонне высокого давления, где на тарелках помещен катализатор — оксиды вольфрама на силикагеле (15 — 20 % WO3). Этилен и воду подают в верхнюю часть колонны, а снизу отводят 10%-ный спирт. В этом процессе не требуется расходовать большое количество тепла на испарение воды и перегрев водяного пара.
В Советском Союзе были разработаны другие активные вольфрамовые катализаторы, содержащие 40 — 60 % триоксида вольфрама на широкопористом силикагеле типа Si02*12W03*7H2O с добавкой борной кислоты. Катализаторы этого типа готовят, пропитывая силикагель раствором вольфрамата аммония и прокаливая затем при 400 °С. Они не нуждаются в последующем восстановлении. Добавление в состав катализатора 5 — 10 % борной кислоты сущетвенно повышает его активность. Наиболее активный катализатор, содержащий 60 % W03 и 5 % В203 на силикагеле, применяется в . интервале 200—240°С и 1,5—2,5 МП а, т. е. в более мягких условиях — при конверсии 5,5 %.
Вольфрамовые катализаторы более активны, чем фосфорнокис-лотные, и могут работать в более мягких условиях. Однако они значительно дороже, ибо вольфрам — дефицитный материал, поэтому пока такие катализаторы не нашли широкого промышленного применения.
Сравнительная оценка себестоимости синтетического этанола, полученного сернокислотной и прямой гидратацией этилена, показывает, что в случае сернокислотной гидратации основной статьей расхода является сырье и вспомогательные материалы, что связано с применением серной кислоты и с меньшей селективностью процесса, протекающего с образованием значительных количеств побочных продуктов. Себестоимость спирта, полученного сернокислотной гидратацией, на 20% выше, чем при прямой гидратации.
- Технологическая схема (описание).
Схема процесса получения этанола прямой гидратацией этилена изображена на рис. 2.
Свежий и рециркулирующий этилен сжимают до 8 МПа в компрессоре 1 и циркуляционном компрессоре 2, смешивают с рециркулирующим водным конденсатом и нагревают в теплообменнике 4 горячими реакционными газами. Затем смесь дополнительно нагревают до 280—330 °С в трубчатой печи 3 и подают в реактор 5. Реакционные газы содержат пары фосфорной кислоты, и их прежде всего нейтрализуют, впрыскивая водный раствор NaOH. Образующиеся фосфаты отделяют в солеотделителе 6. Тепло газов утилизируют в теплообменнике 4 и после дополнительного охлаждения в водяном
холодильнике 7 разделяют жидкую и газовую фазы в сепараторе 8 высокого давления.
Газы еще содержат пары спирта, которые улавливают водой в абсорбере 9. Освобожденный от спирта газ рециркулируют с помощью компрессора 2, но часть его сбрасывают в линию топливного газа, чтобы избежать чрезмерного накопления инертных примесей. Водный конденсат после сепаратора 8 и жидкость из абсорбера 9 дросселируют и в сепараторе 10 низкого давления отделяют от растворенных газов, которые используют как топливо. Из сепаратора 10 вытекает 15%-й водный раствор этанола, содержащий диэтиловый эфир, ацетальдегид и низкомолекулярные полимеры этилена. Этот раствор подвергают ректификации в колоннах 11 и 12. В первой отгоняют наиболее летучие диэтиловый эфир и ацетальдегид, а во второй — этанол (в виде азеотропной смеси, содержащей 95 % спирта и 5 % воды), причем обогрев осуществляют острым паром. В кубе колонны 12 остается вода, которую очищают на ионообменной установке 13 от солей и возвращают на смешение с этиленом и гидратацию, организуя замкнутый водооборот технологической воды.
- Расчетная часть.
Прямая гидратация этилена протекает по реакции
C2H4 + H2O → C2H5OH
Расход этилена рассчитываем исходя из селективности и стехиометрических уравнений реакции.
Общий расход этилена (кг/ч)
А=Gc Mэ*100/(Мс С)= Gc*28*100/46С=1078 кг/ч
с учетом конверсии Gэ= А*100/К=23435 кг/ч
Количество водяного пара, подаваемого в гидратор:
число кмоль:
этилена Nэ=836,96 кмоль/ч;
водяного пара Nв.п.=836,96*0,7=585,87 кмоль/ч
Gв.п.= 585,87*18=10545кг/ч
- Материальный баланс.
Основой материального баланса является закон сохранения материи, согласно которому количество материала, поступающего в процесс (приходные статьи материального баланса), равняется количеству продуктов, получаемых в результате процесса (расходные статьи материального баланса). Материальный баланс должен составляться как для всего технологического процесса, так и для отдельных его элементов. Материальный баланс составляют за единицу времени — час, сутки, год — или за цикл работы на единицу исходного сырья или готовой продукции, т. е. за тот отрезок времени, в течение которого перерабатывается определенное количество сырья или получается определенное количество продукта. Материальный баланс может быть рассчитан в весовых, мольных или объемных единицах. Материальный баланс процесса представлен в таблице 1.
Таб.1 Материальный баланс
Материальный поток | Количество | |
| кг/ч | кмоль/ч | |
| Приход | | |
| Этилен | 23435 | 836,96 |
| Водяной пар | 10545 | 585,87 |
| Всего | 33980 | 1422,83 |
| Расход | | |
| Этанол | 1700 | 36,96 |
| Этилен | 22357 | 798,46 |
| Водяной пар | 9923 | 551,28 |
| Всего | 33980 | 1386,7 |
- Тепловой баланс.
Тепловой баланс отражает основное содержание закона сохранения энергии, согласно которому количество тепла, введенной в процесс (приходные статьи баланса), равно количеству тепла, получаемой в результате процесса (расходные статьи баланса).
Так же как и материальный баланс, тепловой баланс можно составлять для всего производственного процесса или для отдельных его стадий. тепловой баланс может быть составлен для единицы времени (час, сутки), для цикла работы, а также на единицу исходного сырья или готовой продукции. Тепловой баланс процесса представлен в таблице 2.
Таб.2. Тепловой баланс
| Наименование | G, кг/ч | Q, МДж/ч |
| Приход тепла | | |
| Этилен | 23435 | 10757 |
| Водяной пар | 10545 | 6327 |
| Всего | 33980 | 17084 |
| Расход | | |
| Этанол | 1700 | 870 |
| Этилен | 22357 | 10261 |
| Водяной пар | 9923 | 5953 |
| Всего | 33980 | 17084 |
- Расчет аппарата.
Расчет основных размеров реактора
Объем газообразного сырья
Vг=(Gс/Мс+Gп./Мп.)*22,4*Т*0,101/273*Р=
=1404,8*22,4*0,101*573/273*7=953 м3/ч
Примем среднюю фиктивную скорость 0,2 м/с, тогда
S=953/(0,2*3600)=1,32 м2
D=√S/0,785=√1,32/0,785=1,3 м
Vр=Vг*τ, где τ — среднее фиктивное время пребывания паров реакционной смеси в реакторе. Принимаем τ= 19 с, тогда
Vр=953*19/3600=5м3
Длина реактора l= Vр/ S=3,8 м
- Расчет трубчатой печи для нагрева сырья.
Исходные данные по 1 нагреваемому компоненту – этилен:
- массовый расход этилен Gн = 23435 кг/час;
- температура входа в печь Т1н = 80 С;
- температура выхода из печи Т2н = 300 С;
- давление на выходе из змеевика печи вн = 7МПа.
Исходные данные по 2 компоненту – водяной пар
- массовый расход водяной пар Gн = 10545 кг/час;
- температура входа в печь Т1м = 80 С;
- температура выхода из печи Т2м = 300 С;
давление на выходе из змеевика печи вн = 7МПа
Сжигаемое топливо газ с газоперерабатывающего завода:
- плотность при 20 С
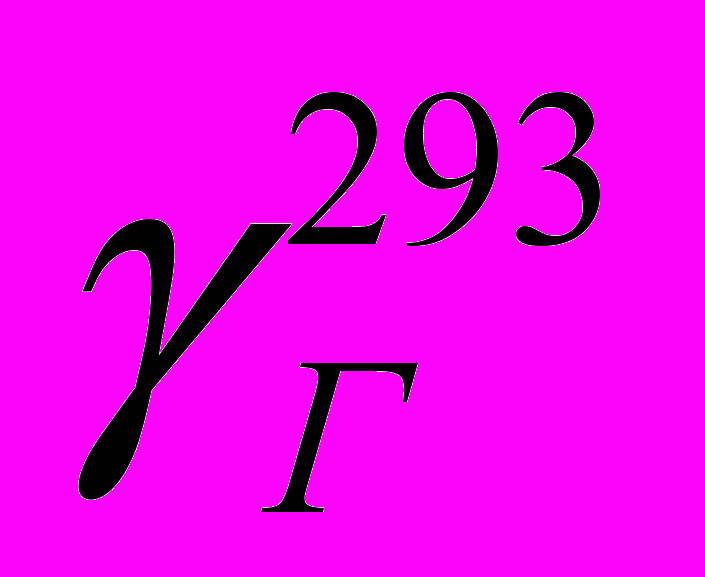 = 0,760 кг/м3;
= 0,760 кг/м3;
- компонентный состав газа табл. 20.
Таблица 3.Компонентный состав газа.
| № п/п | Компонент | Массовая доля gi100, (масс. %) | Мольная (объемная) доля ri | Молекулярная масса, Мi | Miri |
| 1. | N2 | 0,46 | 0,0028 | 34 | 0,0952 |
| 2. | CO2 | 1,78 | 0,0083 | 44 | 0,3652 |
| 3. | CH4 | 64,97 | 0,8352 | 16 | 13,3632 |
| 4. | C2H6 | 7,06 | 0,0484 | 30 | 1,452 |
| 5. | C3H8 | 12,42 | 0,0581 | 44 | 2,5564 |
| 6. | и-C4H10 | 8,83 | 0,0313 | 58 | 1,8154 |
| 7. | н-C4H10 | 4,48 | 0,0159 | 58 | 0,9222 |
| | Итого: | 100 | 1 | | MГ20,57 |
1.Расчет процесса горения
Определим низшую теплоту сгорания топлива по формуле:
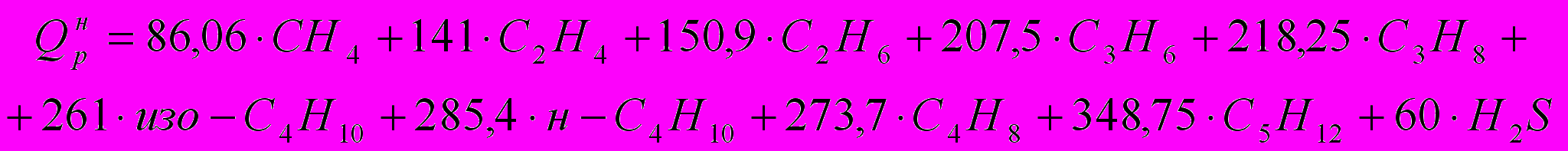
где СН4, С2Н4 и т.д. – содержание компонентов в топливе в объемн. %.
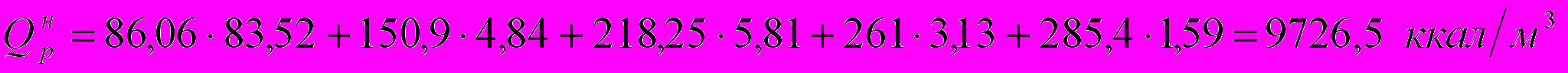
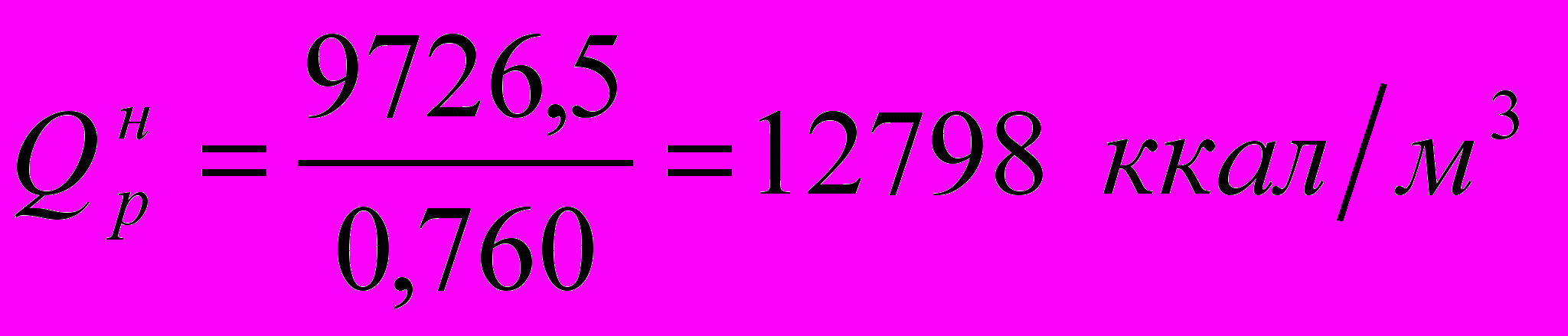
Определим элементный состав топлива в массовых процентах. Содержание углерода в любом i-ом компоненте топлива находим по соотношению:
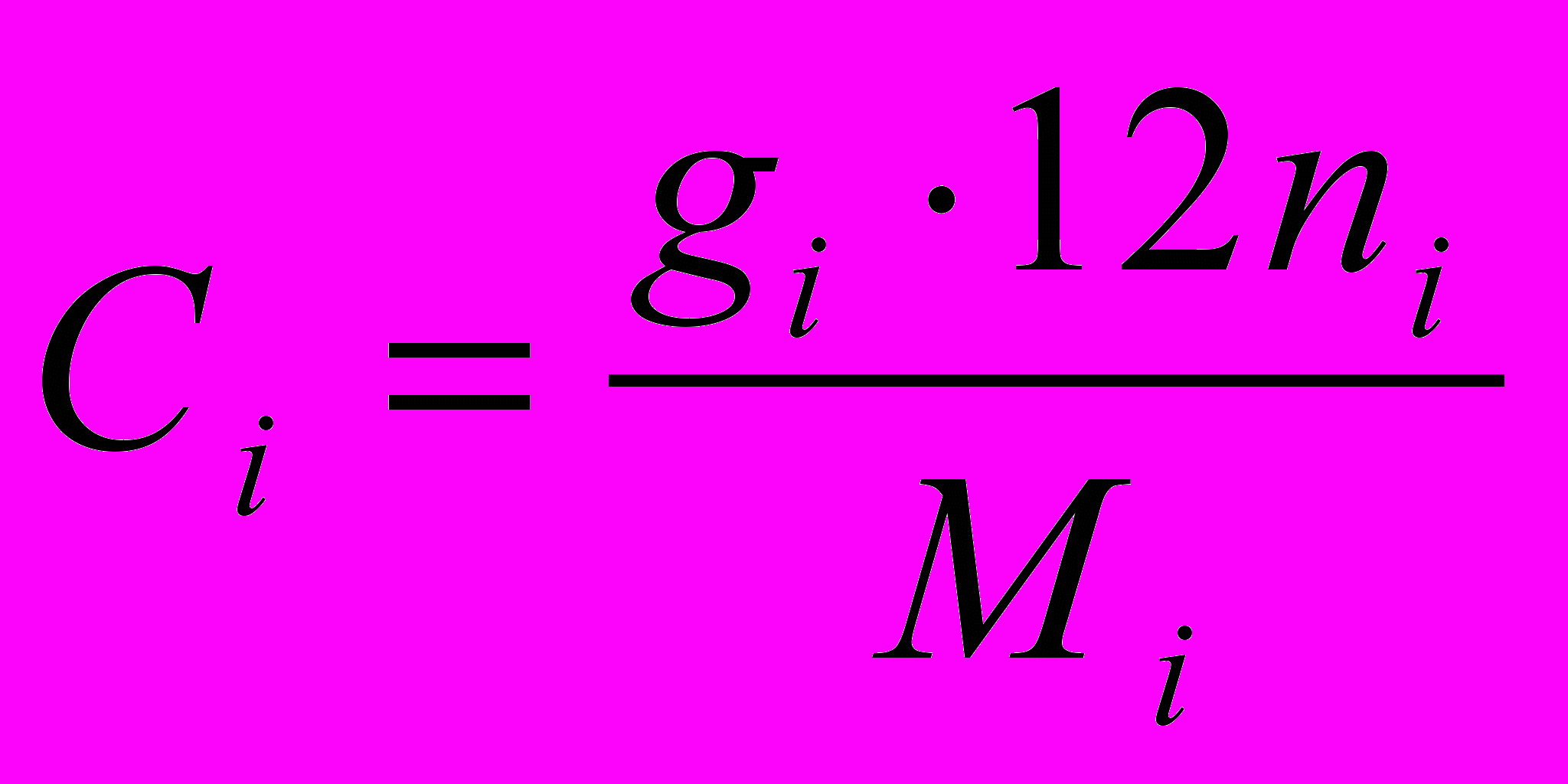
где ni – число атомов углерода в данном компоненте топлива.
Содержание углерода:
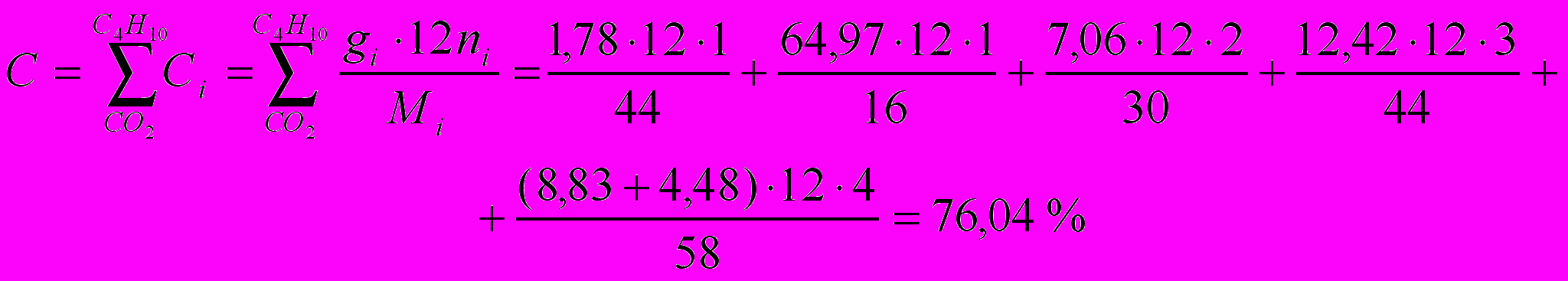
Содержание водорода:
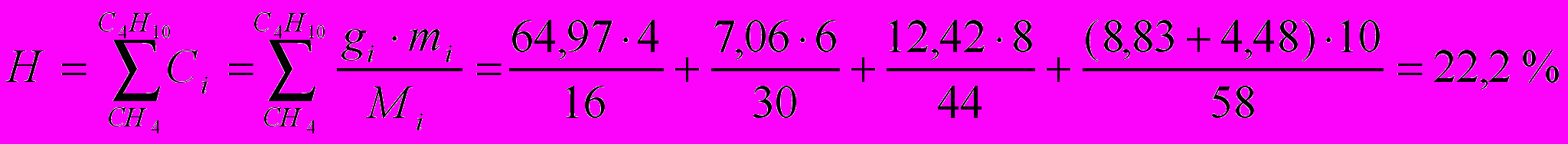
где m – число атомов водорода в данном компоненте топлива.
Содержание кислорода:
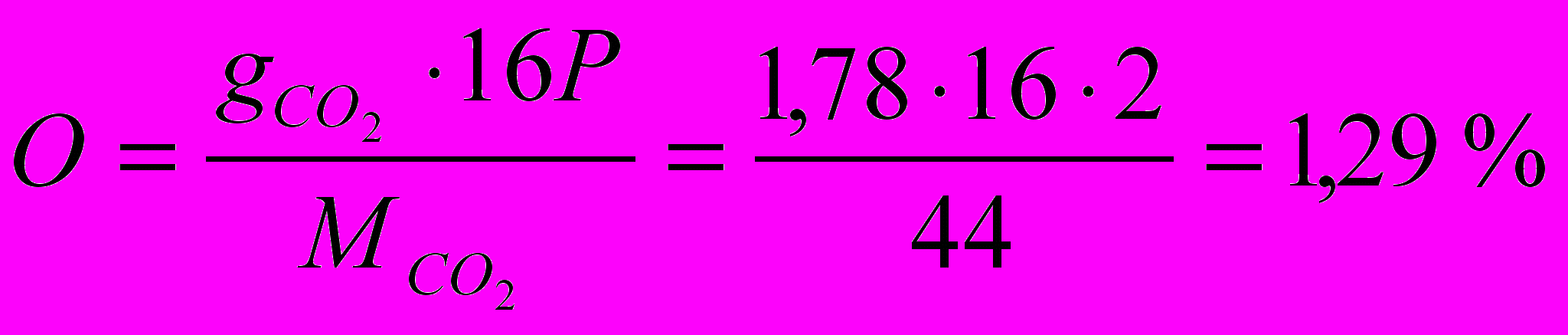
где Р – число атомов кислорода.
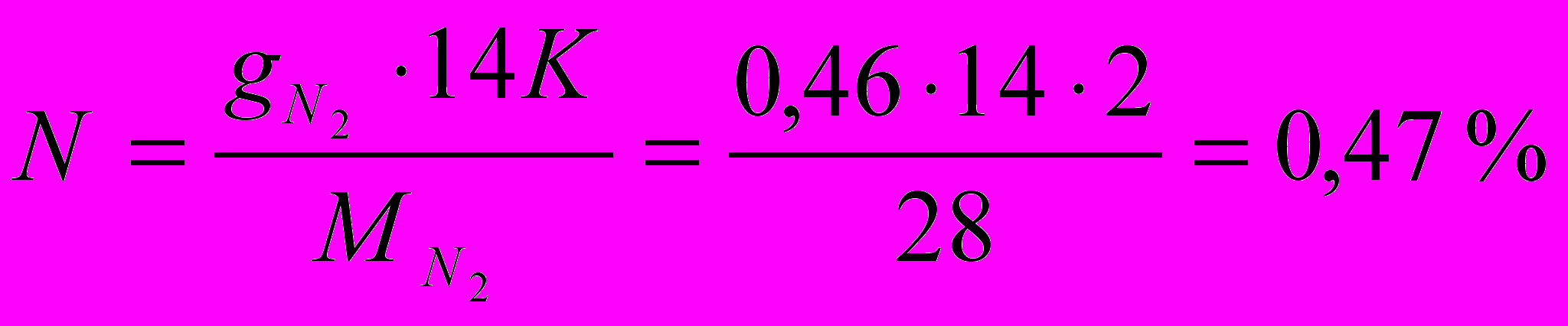
где К – число атомов азота.
Проверка:
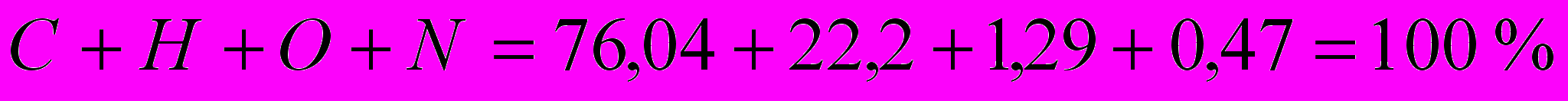
Определим теоретическое количество воздуха, необходимого для сжигания 1 кг газа, по формуле:
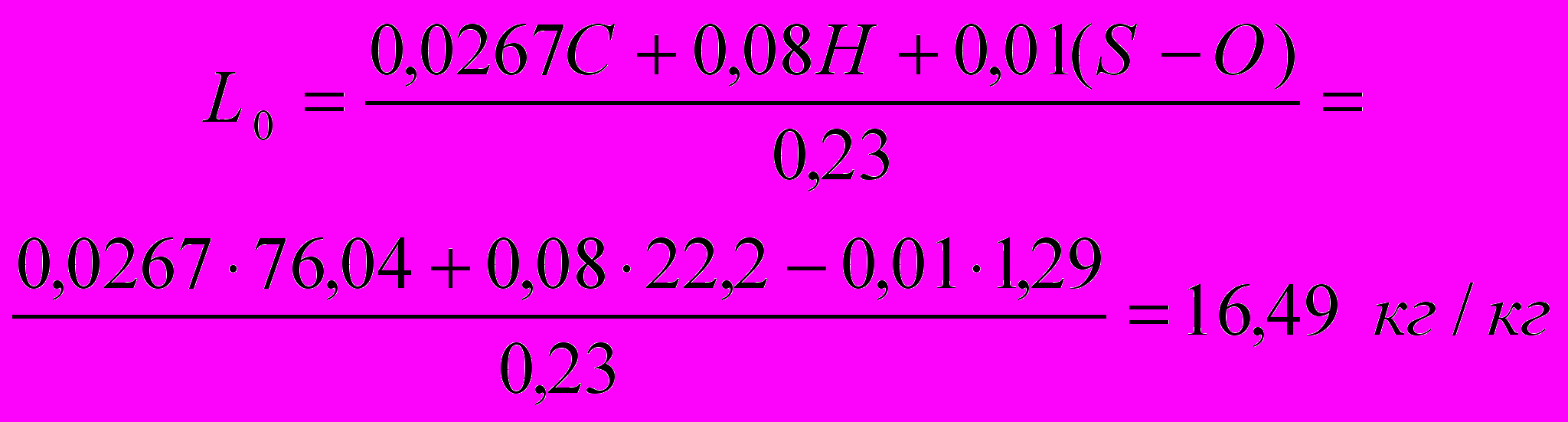
Найдем действительное количество воздуха, которое требуется для сжигания 1 кг газа.
Для печей с излучающими стенками коэффициент избытка воздуха =1,031,07. Принимаем =1,06. Тогда действительное количество воздуха:
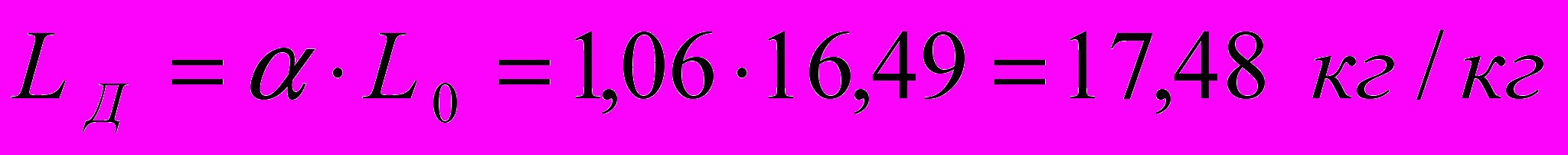
или

где в = 1,293 кг/м3 – плотность воздуха при нормальных условиях (0 С и 760 мм. рт. ст.).
Определим количество продуктов сгорания, образующихся при сжигании 1 кг топлива:
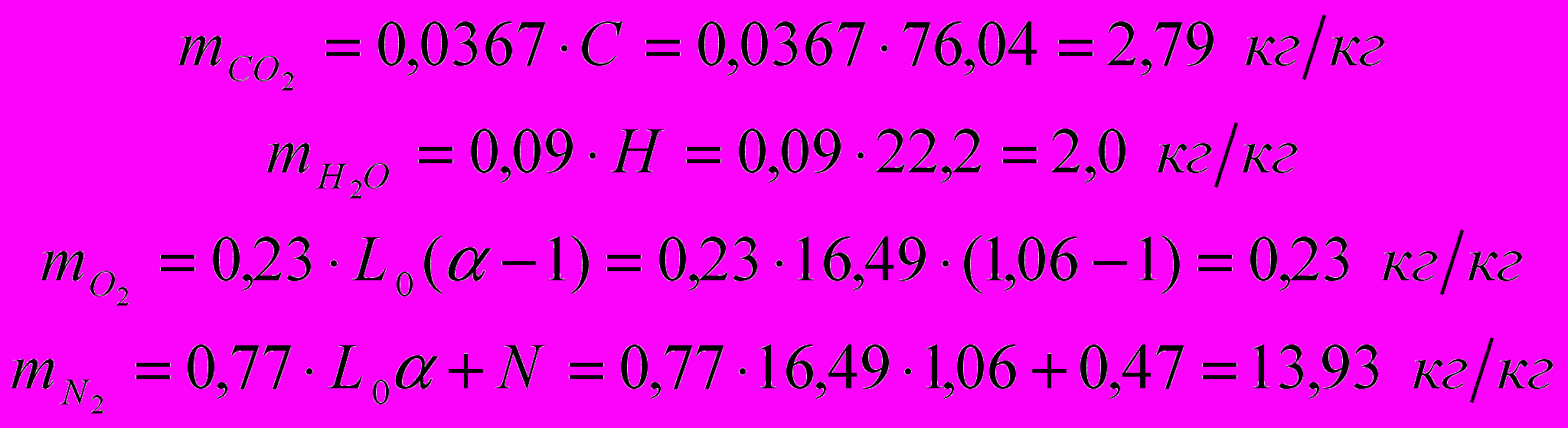
Суммарное количество продуктов сгорания:
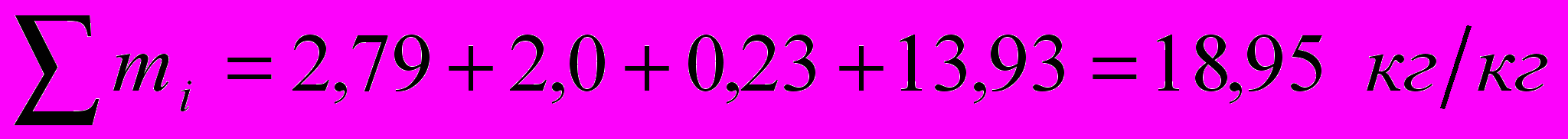
Проверка:
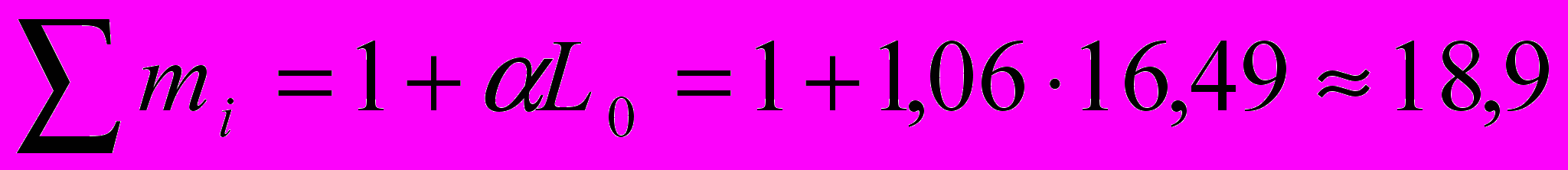
Содержанием влаги в воздухе пренебрегаем.
Найдем объемное количество продуктов сгорания в м3 на 1 кг топлива (при нормальных условиях):
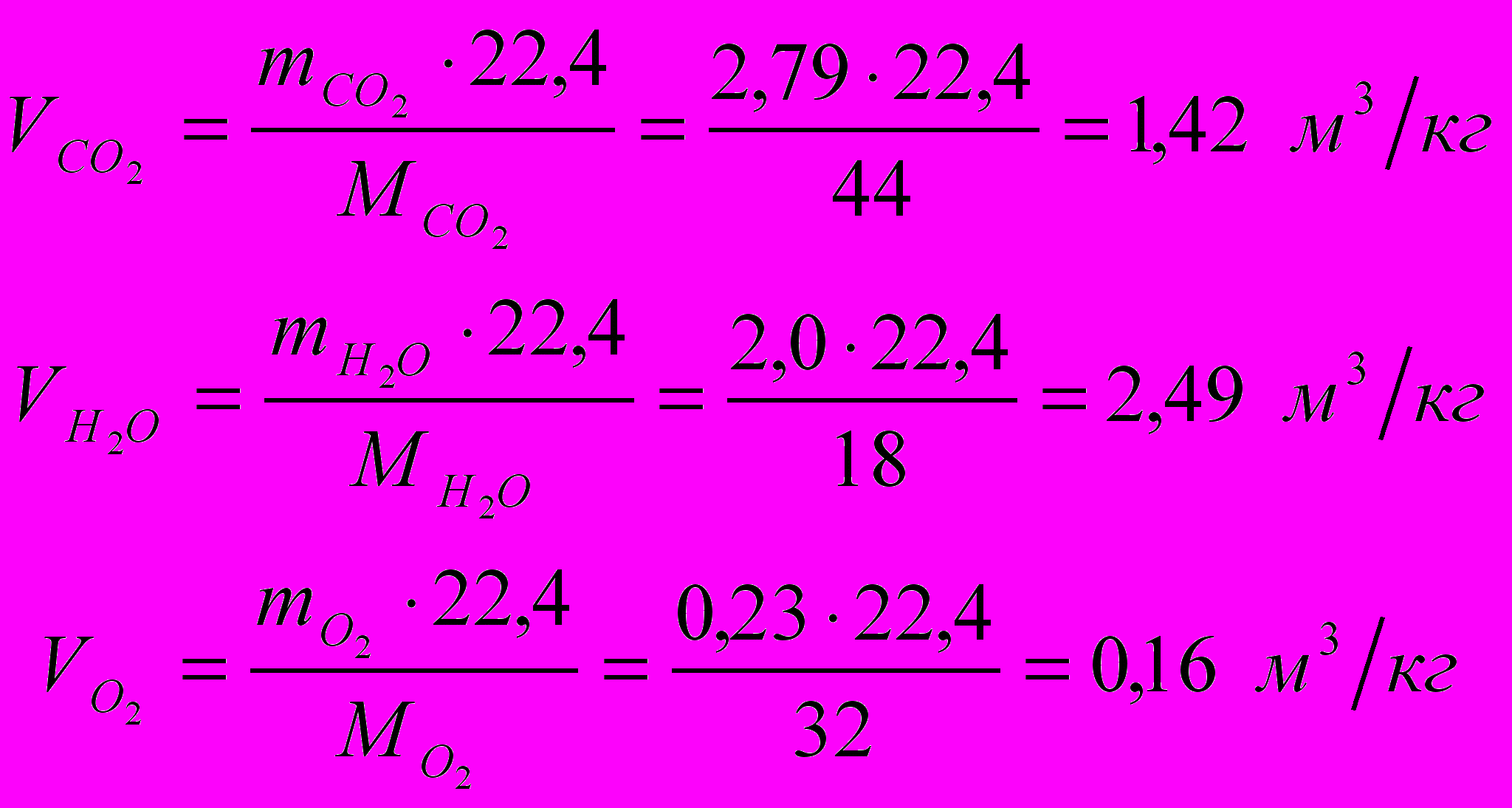
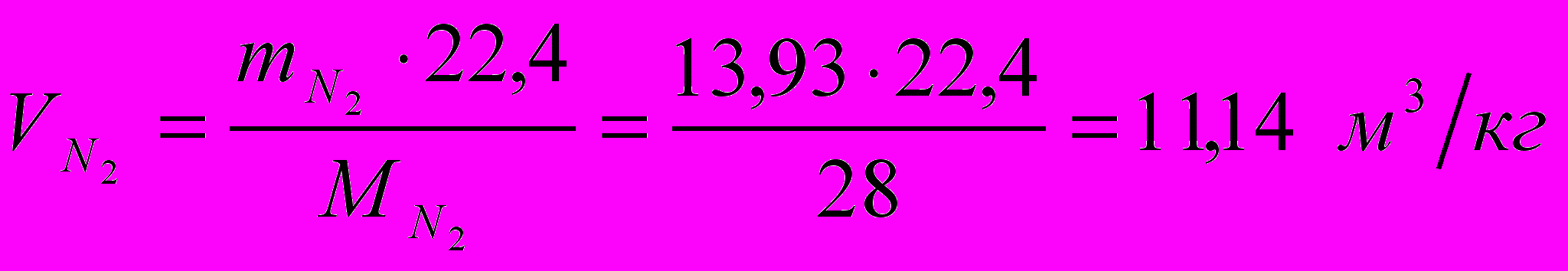
Суммарный объем продуктов сгорания:
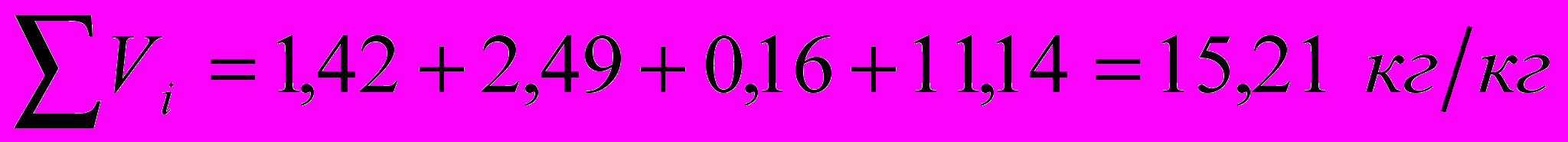
Плотность продуктов сгорания при 0 С и 760 мм. рт. ст.

Определим содержание продуктов сгорания при различных температура по уравнению:

где t – температура продуктов сгорания (дымовых газов), С; с – средние массовые теплоемкости компонентов дымовых газов, определяемые из таблицы [38, стр. 491]
Найдем для примера q200:
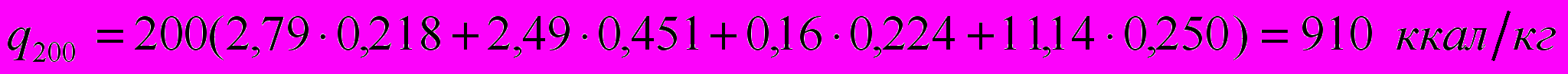
Результаты расчетов сведены в табл. 4
Таблица 4
| t, C | 0 | 200 | 400 | 800 | 1000 | 1400 | 2000 |
| qt, ккал/кг | 0 | 910 | 1820 | 3640 | 4550 | 6370 | 9100 |
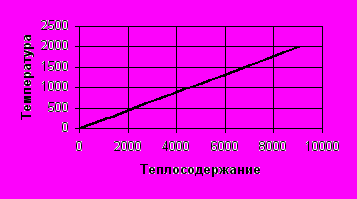 Рис. 3. График зависимости теплосодержания от температуры.
Рис. 3. График зависимости теплосодержания от температуры. По данным этой таблицы строим график q-t (рис. 3).
КПД печи и расход топлива
КПД (коэффициент полезного действия) печи найдем по формуле:
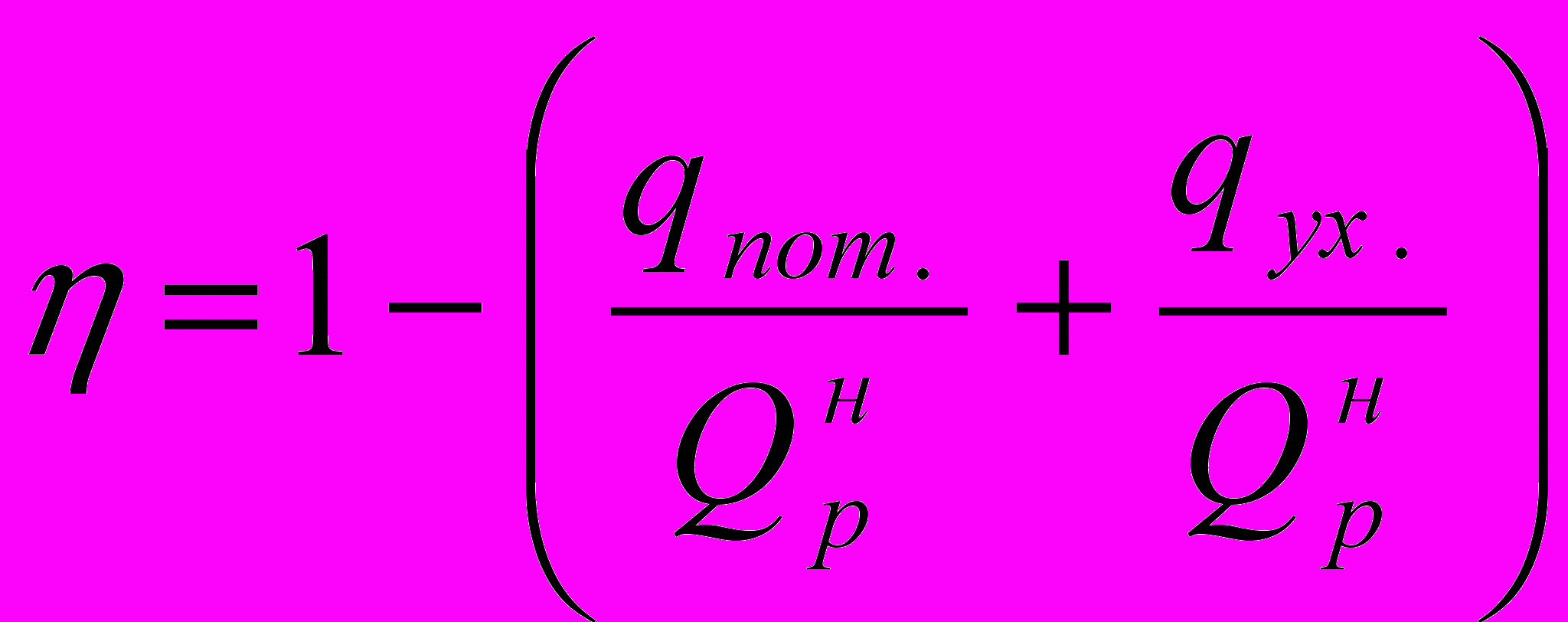
где
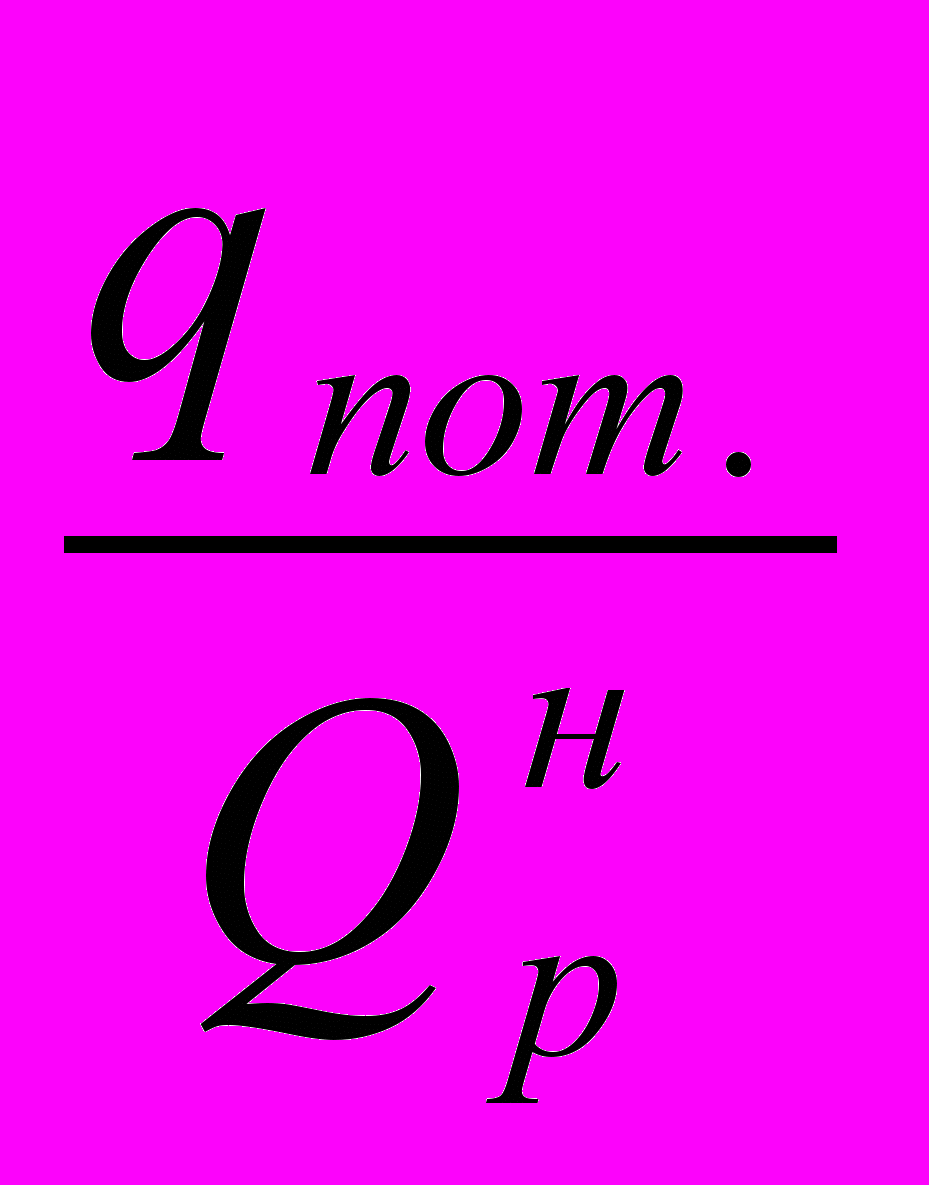 - потери тепла в окружающую среду, в долях от низшей теплоты сгорания топлива;
- потери тепла в окружающую среду, в долях от низшей теплоты сгорания топлива; 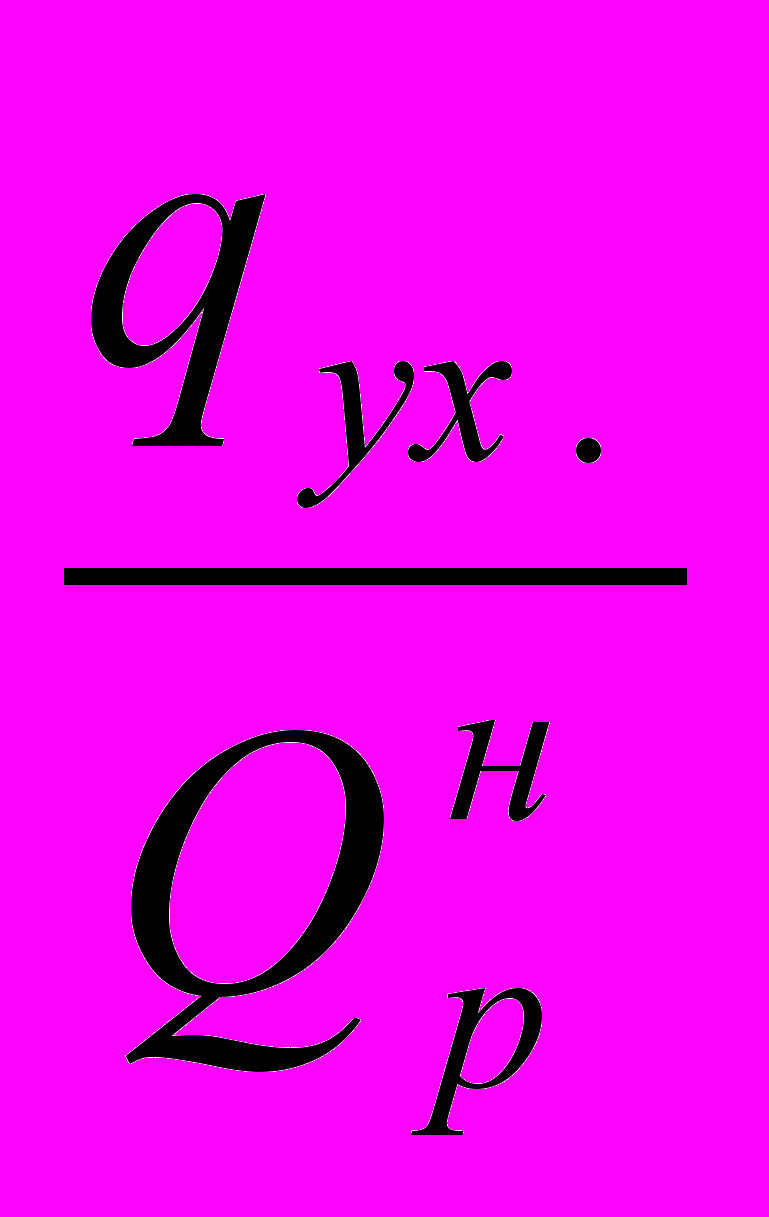 - потери тепла с уходящими дымовыми газами, в долях от низшей теплоты сгорания топлива.
- потери тепла с уходящими дымовыми газами, в долях от низшей теплоты сгорания топлива.Примем, что
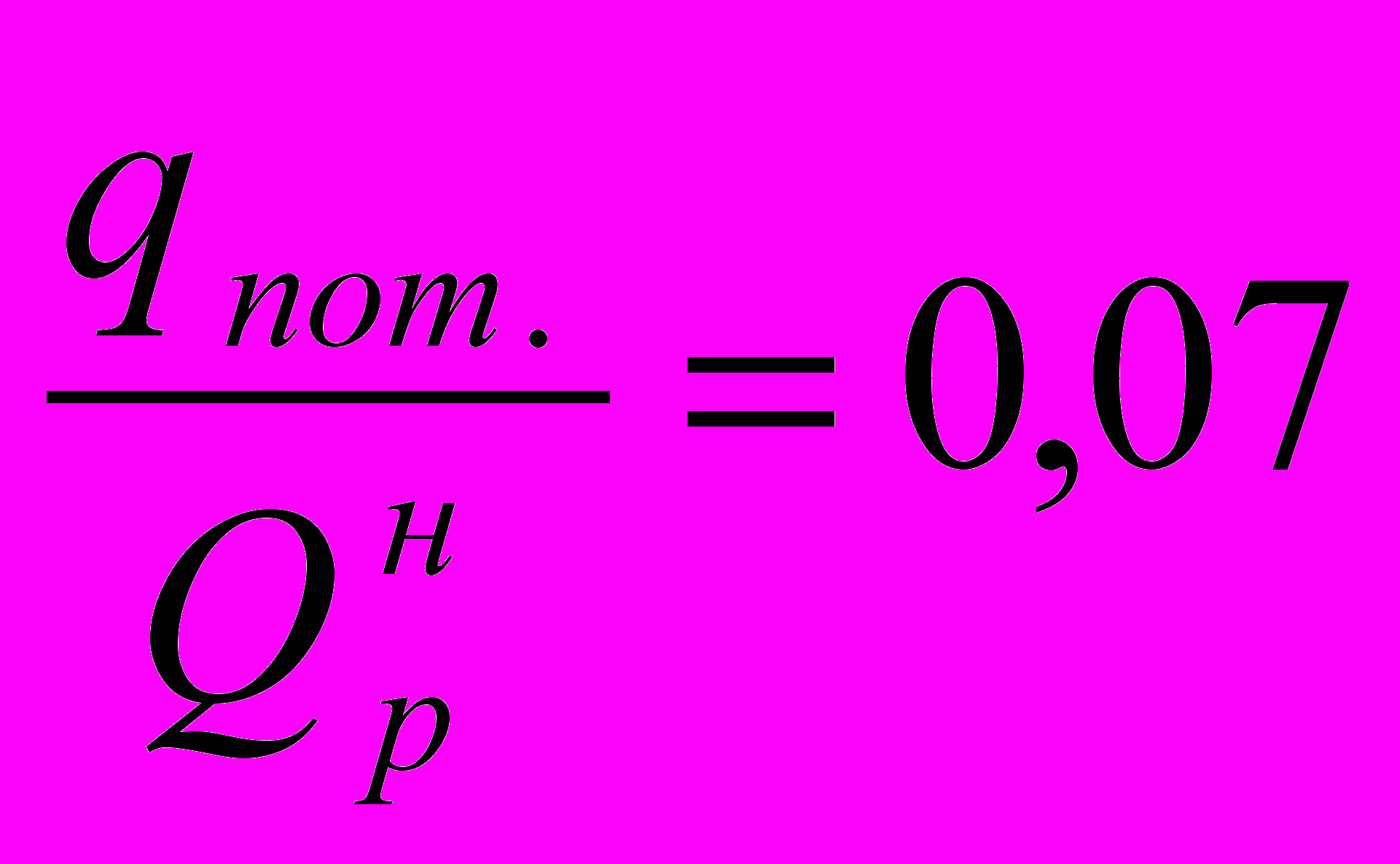 и что температура дымовых газов, покидающих конвекционную камеру печи, на 240 С выше температуры t1п пара поступающего в печь:
и что температура дымовых газов, покидающих конвекционную камеру печи, на 240 С выше температуры t1п пара поступающего в печь: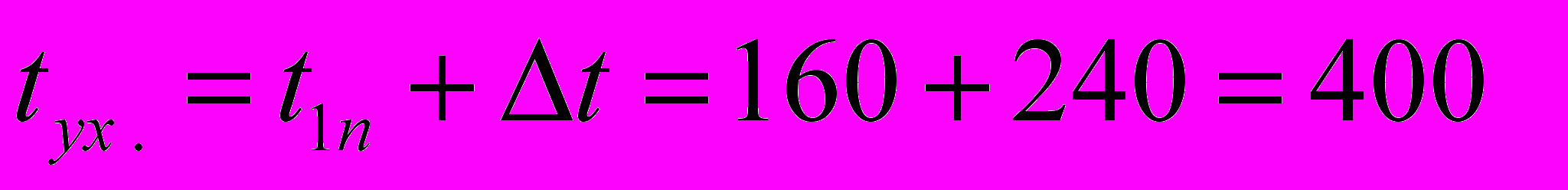 С
СПри
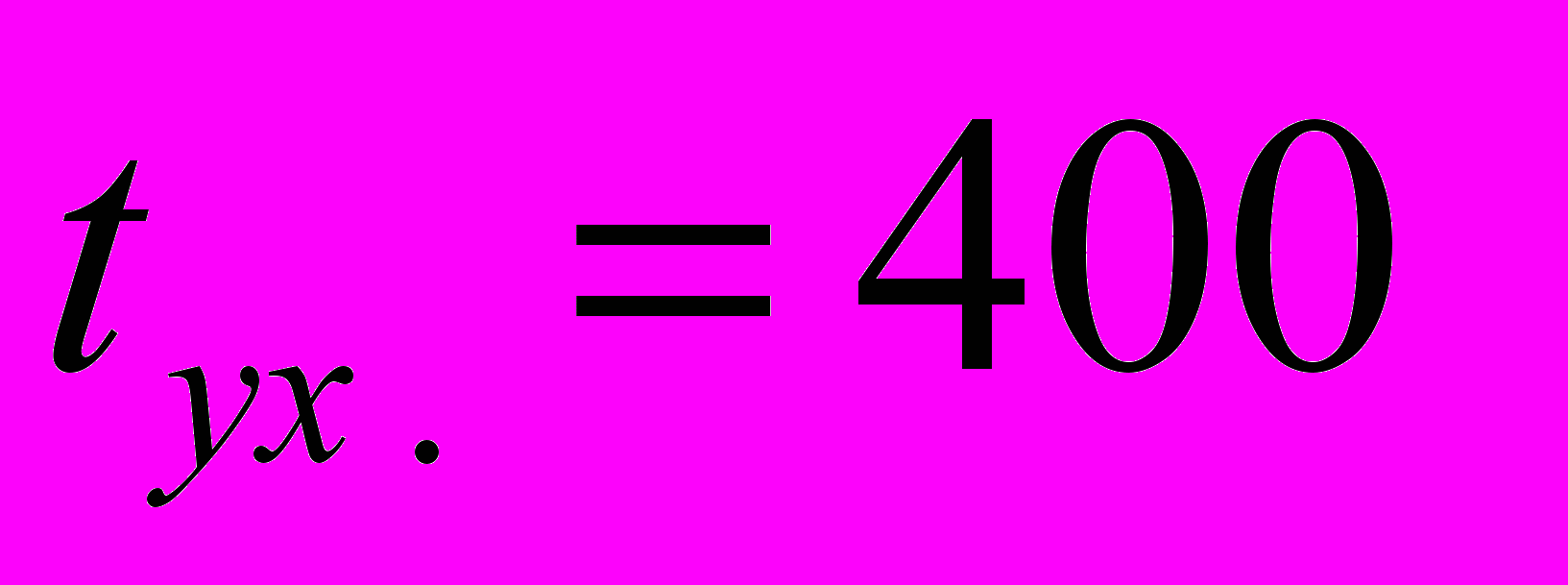 С найдем по графику q-t (см. рис. 40) потерю тепла с уходящими дымовыми газами:
С найдем по графику q-t (см. рис. 40) потерю тепла с уходящими дымовыми газами: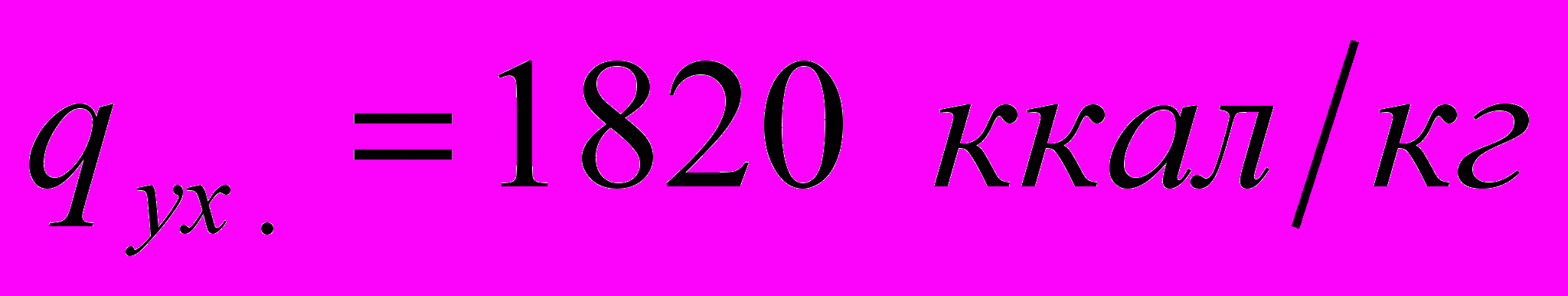
или в долях от низшей теплоты сгорания топлива:
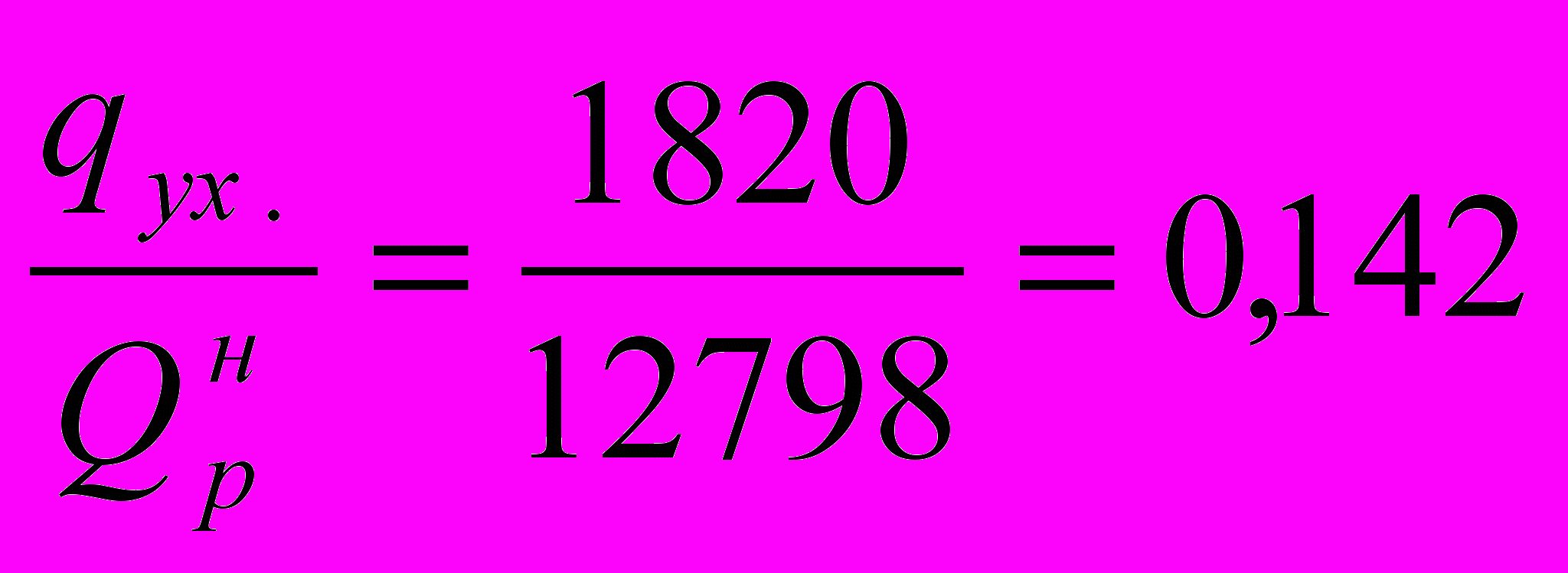
Подставив числовые значения величин, получим, что КПД печи
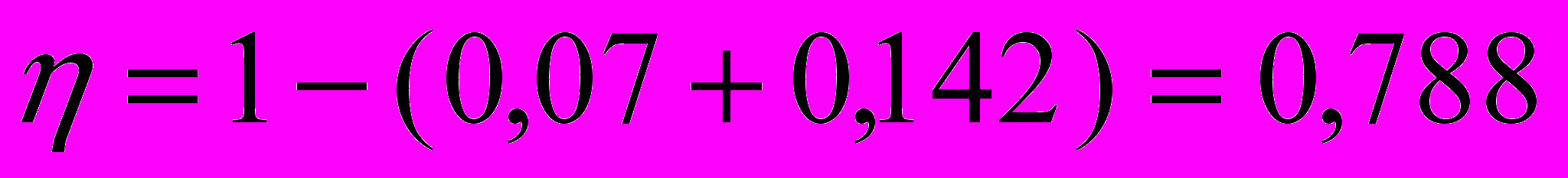
Полную тепловую нагрузку печи, или теплопроизводительность газовых горелок при КПД печи равному 0,823 найдем из формулы:
Qт=Qполез/η
где
 - полезное тепло печи,.
- полезное тепло печи,.Полезное тепло печи рассчитываем по формуле:
Qпол=L(hk-hn)
Qэ=23435*275=6444625
Qв.п=10545*88=927960
Подставляя в формулу заданные и найденные величины, получим:
Qт=7372585/0,788=9356
Часовой расход топлива:
Вэт=639 кг/ч
В в.п.=92 кг\ч
- Графическая часть.
Графическая часть представлена двумя чертежами: технологическая схема и чертеж реактора формата АЗ
- Выводы.
6.1. На основании литературного обзора выбран метод получения этанола прямой гидратацией этилена с использованием катализатора — фосфорная кислота на алюмосиликате.
6.2. Обоснование выбора реакционного устройства. В качестве реактора выбран гидратор, который представляет собой пустотелый цельно-кованный цилиндрический стальной аппарат.
6.3. Составлен материальный баланс процесса получения этанола прямой гидратацией этилена.
7. Библиографический список.
1. Валакин В.П. "Получение синтетического этилового спирта"
Москва, "Химия" 1976г.
2.Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза.-М. «Химия», 1988.
3.Эмирджанов Р.Т., Лемберанский Р.А. Основы технологических расчетов в нефтепереработке и нефтехимии. М. «Химия», 1988.
4. Адельсон С.В. Технология нефтехимического синтеза. М. «Химия», 1985.
5. Справочник нефтехимика. Л. «Химия», 1978.
