Екатерина борисовна
| Вид материала | Автореферат |
- Тиховская Екатерина Борисовна. Цель урок, 35.5kb.
- Ильинская Екатерина Борисовна. Возрождение иконописной традиции. 27 января. На заседании, 31.13kb.
- Кузнецова Алевтина Георгиевна. Хоменко Екатерина Борисовна методическое руководство, 313.16kb.
- Деревня голыгино, 258.86kb.
- Жданова Татьяна Борисовна статья, 81.09kb.
- -, 763.12kb.
- Реферат на тему: екатерина, 336.29kb.
- Новая система оплаты труда – ключевой механизм модернизации образования горбачева наталия, 76.45kb.
- Носова Татьяна Борисовна г. Камешково, огоу нпо «Профессиональное училище №45» г. Камешково, 36.67kb.
- Чесноковой Екатерины Борисовны Чеснокова Екатерина Борисовна окончила в 1989 году Московское, 33.48kb.
На правах рукописи
МЕСХИДЗЕ
ЕКАТЕРИНА БОРИСОВНА
Гипоталамо-гипофизарная нейросекреторная система
в условиях воспаления
(экспериментально-морфологическое исследование)
03.00.25 – гистология, цитология, клеточная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва, 2008
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Российский Государственный Медицинский Университет Росздрава РФ»
Научный руководитель:
академик РАМН, доктор
медицинских наук,
профессор Волкова Ольга Васильевна
Официальные оппоненты:
Доктор медицинских наук,
Профессор Боголепова Ирина Николаевна
(НИИ Мозга РАМН)
Доктор медицинских наук,
Профессор Мамонтов Сергей Григорьевич
(ГОУ ВПО РГМУ Росздрава)
Ведущая организация: ГОУ ВПО «Московская медицинская академия имени И.М. Сеченова Росздрава»
Защита состоится «8» декабря 2008 г. в 14.00 часов на заседании диссертационного совета Д 208.072.04 при ГОУ ВПО РГМУ Росздрава по адресу: 117997, Москва, ул. Островитянова, д.1
Автореферат разослан «7» ноября 2008 г.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РГМУ РосЗдрава (г. Москва, ул. Островитянова, д.1)
Ученый секретарь диссертационного совета
д.м.н., профессор А.И. Щеголев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. На рубеже XX и XXI веков зародилась новая интегральная медико-биологическая дисциплина – нейроиммуноэндокринология, которая объединяет и координирует исследования, направленные на изучение механизмов взаимодействия основных регулирующих систем – нервной, эндокринной и иммунной (Акмаев И.Г., 1996, 1999; Basedovski et al, 1996).
В нейроиммуноэндокринную систему входят гипоталамо-гипофизарно-адреналовая система, гипоталамо-гипофизарная нейросекреторная система, а со стороны иммунной системы – комплекс цитокинов – сигнальных молекул, вырабатываемых клетками лимфоцитарного и моноцитарно-макрофагального ряда.
Единство регуляторных систем наиболее ярко проявляется при состояниях, угрожающих целостности и жизни организма, например воспалительной реакции. Цитокины, как главные медиаторы воспаления, оказывают разнообразные эффекты на нейроэндокринные нейроны гипоталамуса и клетки эндокринных желез, изменяя активность гормональных систем, которые, в свою очередь, компенсируют вызванные воспалением нарушения. Гипоталамо-гипофизарно-адреналовая система и ее конечный продукт – глюкокортикоиды являются главным биологическим инструментом адаптации организма к стрессу различной природы, в том числе и «иммунному».
Гипоталамо-гипофизарная нейросекреторная система, менее изученная система, состоит из крупноклеточных ядер гипоталамуса, нейроны которых синтезируют гормон вазопрессин. Значение системного вазопрессина при воспалении определяется, в первую очередь, его потенциальной возможностью компенсировать потери воды, обусловленные симптомами воспаления. На сегодняшний день описан широкий спектр эффектов антидиуретического гормона на метаболизм, температуру тела, поведение, сосудистый тонус, а также локальных - ауто\паракринных. (Murphy et al., 1993; Гриневич В.В., Поленов А.Л., 1994; Гриневич В.В. и др., 1997, 2003; Verbalis, 1999; Wang et al., 1998; Hurbin А et al, 2002).
Из всего многообразия этиологических факторов воспаления (бактерии, вирусы, простейшие) в настоящее время приобретает актуальность изучение влияния бактериального эндотоксина липополисахарида (ЛПС) на гипоталамо-гипофизарную нейросекреторную систему. ЛПС является одним из наиболее мощных бактериальных антигенов, приводящих к запуску воспалительной реакции через специфические рецепторы (CD14, TLR4) на макрофагах, дендритных клетках и др. (Medzitov, Janeway., 1997; Akira et al., 2001; von Meyenburg et al., 2004). При этом происходит усиление секреции и выброс различных медиаторов воспаления, изменяющих тканевой метаболизм, микроциркуляцию, активирующих Т- и В- лимфоциты, которые в свою очередь вырабатывают каскады цитокинов – интерлейкин-1 (ИЛ-1), интерлейкин-6 (ИЛ-6) и фактор некроза опухолей α (ФНО-α), осуществляющие межклеточную кооперацию при иммунном ответе. В работах как наших, так и зарубежных авторов показано на примере гипоталамо-гипофизарно-адреналовой системы, что ЛПС непосредственно не изменяет активности нейросекреторных клеток и клеток аденогипофиза, а является мощным индуктором синтеза ИЛ-1 – основного медиатора эффектов бактериального эндотоксина липополисахарида. (Гриневич В.В. и др., 1999; Акмаев И.Г., Гриневич В.В., 2003; Chrousos, 1995; Turnbull, Rivier., 1999).
Цель исследования: изучить морфофункциональное состояние гипоталамо-гипофизарной нейросекреторной системы у крыс и факторы, регулирующие секрецию крупноклеточного вазопрессина, в условиях острого воспаления в эксперименте.
Задачи исследования:
- Исследовать транскрипцию, трансляцию вазопрессина в крупноклеточных нейронах гипоталамуса и его секрецию в кровь у крыс после однократной внутрибрюшинной инъекции бактериального эндотоксина липополисахарида в низкой дозе (25 мкг\100г веса) и высокой дозе (250мг\100г веса) в динамике (0, 30мин, 3ч, 6ч).
- Изучить эффект однократной внутрибрюшинной инъекции бактериального эндотоксина липополисахарида (250мг\100г веса) на экспрессию и секрецию крупноклеточного вазопрессина в условиях физиологической осмотической стимуляции.
- Исследовать транскрипцию, трансляцию вазопрессина в крупноклеточных нейронах гипоталамуса и его секрецию у адреналэктомированных и ложнооперированных крыс после однократной инъекции бактериального эндотоксина липополисахарида в дозе 25 мкг\100г веса.
Научная новизна. В настоящем исследовании получены новые данные о морфофункциональной характеристике гипоталамо-гипофизарной нейросекреторной системы у крыс в условиях острого воспаления (в эксперименте).
Проведена сравнительная оценка влияния однократного внутрибрюшинного введения низких и высоких доз липополисахарида (25мкг\100г и 250 мкг/100г) на синтез и секрецию крупноклеточного вазопрессина у крыс в базальных условиях, так и при физиологической осмотической стимуляции гипоталамо-гипофизарной нейросекреторной системы с помощью морфологических, электронно-микроскопических, иммуноцитохимических методов исследования.
Используя метод авторадиографической гибридизации «in situ» выявлен новый «неосмотический» механизм регуляции крупноклеточного вазопрессин-ергического нейрона в условиях острого воспаления (липополисахарид, 250мкг\100г).
Получены достоверные данные об усилении синтеза и секреции крупноклеточного вазопрессина при однократном интраперитонеальном введении липополисахарида (25 мкг\100г) на фоне двусторонней адреналэктомии, что свидетельствует подавляющей роли глюкокортикоидов в регуляции крупноклеточного вазопрессин-синтезирующего нейрона гипоталамуса при воспалении.
Теоретическая и практическая значимость. Воспалительный процесс, имеющий глубокие эволюционные корни, неизменно привлекает специалистов в области биологии и медицины, как с точки зрения своей феноменологии, так и практического здравоохранения. Все исследования, проливающие свет на механизмы его реализации и понимания роли в этих механизмах взаимодействия основных регулирующих систем организма, представляются важными в своей концептуальной основе и значимыми для практической медицины, поскольку подводят теоретический базис к разработке новых диагностических критериев и терапевтических подходов к лечению и профилактике воспалительных процессов.
Внедрение в практику. В результате проведенного экспериментального исследования получены данные о морфофункциональной характеристике гипоталамо-гипофизарной нейросекреторной системы в условиях острого воспаления (в эксперименте), которые используются в учебном процессе и научной работе кафедры гистологии и эмбриологии педиатрического факультета ГОУ ВПО РГМУ РосЗдрава РФ.
Апробация работы. Основные положения диссертации доложены и обсуждены на:
- Всероссийской конференции с международным участием «Нейроэндокринология-2003» 23-25 сентября 2003 г.-Санкт-Петергбург, Россия.
- I Всероссийской конференции «Физиология иммунной системы» 11-14 октября 2003г, Сочи, Дагомыс.
- Всероссийской научной конференции «Гистологическая наука России в начале XXI века: итоги, задачи, перспективы», Москва, 2003г.
- 3-ем Российском Конгрессе по патофизиологии с международным участием, Москва, 9-12 ноября 2004г.
- VII Всероссийской конференции по патологии клетки, Москва, 2005г.
- Межкафедральном заседании сотрудников кафедр гистологии и эмбриологии педиатрического и лечебного факультетов ГОУ ВПО РГМУ РосЗдрава.
Публикации. По теме диссертации опубликовано 9 печатных работ, в том числе 1 статья – в журнале, рекомендованных ВАК РФ.
Структура и объем диссертации. Диссертация изложена на 114 страницах машинописного текста, состоит из введения, 8 глав, включающих обзор литературы и обсуждение полученных результатов, выводов, практических рекомендаций, библиографического указателя используемой литературы, включающего 71 отечественных и 144 зарубежных источников.
База проведения исследования. Кафедра гистологии и эмбриологии педиатрического факультета ГОУ ВПО РГМУ МЗ РФ, лаборатория электронной микроскопии ЦНИЛ ГОУ ВПО РГМУ МЗ РФ под рук. член-корр. РАМН, д.м.н., профессора Банина В.В., лаборатория гормонов и рецепторов под рук. д.б.н. П.М.Рубцова Института молекулярной биологии им. В.А. Энгельгардта, Москва, Россия.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Все эксперименты проводились на крысах-самцах линии Wistar (n=97) весом 250-300г в начале эксперимента. Животные содержались по 2-3 в клетке, получали свободный доступ к воде и сухому корму. Световой день составлял 12 часов. Адаптация к условиям вивария (кафедра гистологии и эмбриологии педиатрического факультета ГОУ ВПО РГМУ МЗ РФ) проводилась 2 недели, в течение которых крыс приучали к рукам ухаживающего персонала. За день до проведения эксперимента животных взвешивали и рассчитывали дозировки бактериального эндотоксина липополисахарида.
1. Для оценки состояния гипоталамо-гипофизарной нейросекреторной системы в условиях острого воспаления проводилась однократная внутрибрюшинная инъекция липополисахарида 1 в дозе 250 мкг\100г (30 крыс), выводили животных из эксперимента через 30 мин (n=6), 1 ч (n=6), 3 ч (n=6), 6 ч (n=6), 12 ч (n=6) после инъекции. Крысы контрольной группы получали интраперитонеальную инъекцию стерильного физиологического раствора (300мкл).
2. Для изучения эффекта липополисахарида на активность гипоталамо-гипофизарной нейросекреторной системы в условиях осмотической стимуляции животных разделили на 4 группы:
1) Контроль (n=5),
2) 1-я опытная группа (n=17) - однократное интраперитонеальное введение липополисахарида (250 мкг\100г),
3) 2-я опытная группа (n=6) - животных в течение 6 дней подвергались солевой нагрузке (для этого воду в поилках замещали 2% раствором NaCl),
4) 3-я опытная группа (n=14). Животных этой группы на седьмой день солевой нагрузки (2% раствор NaCl) через 3ч (n=7) и 6 ч (n=7) после внутрибрюшинной инъекции липополисахарида в дозе 250 мкг\100г веса выводили из эксперимента.
3. Эффект бактериального эндотоксина на активность гипоталамо-гипофизарной нейросекреторной системы у адреналэктомированных крыс оценивался по материалам 3 групп животных:
1-я группа – контроль - (n=20) – животным однократно внутрибрюшинное вводили липополисахарид в дозе 25 мкг\100г веса, с последующим выведением их из эксперимента через 30 мин, 1ч, 3ч, 6ч. после инъекции.
2-я группа – (n=20) – животным этой группы произведена двухсторонняя адреналэктомия под комбинированным наркозом (эфир для наркоза, тиопентал натрия). После операции крысы получали 0,9% раствор NaCl для компенсации потерь натрия в отсутствии альдостерона.
3-я группа крыс – (n=20) животные подвергалась ложной операции, которая воспроизводила все этапы операционного стресса. Под комбинированным наркозом крысам производилось вскрытие забрюшинного пространства – животное располагается лежа на животе, производится послойный разрез в паравертебральной области чуть ниже реберной дуги с обеих сторон, затем разведение тканей в этой области с помощью кончиков сосудистого зажима, после чего накладывались послойные швы.
Через 2 недели после операции каждому животному 2-ой и 3–ей группы вводили липополисахарид (25мкг\100г) путем однократной внутрибрюшинной инъекцией, материал забирали через 30 мин, 1ч, 3ч, 6 ч после инъекции.
Кровь собирали, гепаринизировали, центрифугировали, собирали плазму и замораживали при -800С для определения уровней вазопрессина и натрия.
Для проведения авторадиографической гибридизации in situ мозг быстро извлекали из черепной коробки и целиком замораживались на сухом льду.
Гипофиз заливали в среду Tissue Teck (Sacura Finetek Inc.USA), полимеризующуюся при охлаждении (-20С), и замораживали на сухом льду. Затем на криостате изготавливали срезы толщиной 12 мкм, монтировали их на стекла, и хранили при -800С. Часть материала забирали для заливки в парафин (для иммунной гистохимии, ДАБ-глюкозооксидазный метод) и в эпон (для трансмиссионной электронной микроскопии).
Для оценки гибридизационных сигналов срезы экспонировались на высокочувствительной авторадиографической (рентгеновской) пленке BIOMAX MR (Kodak, IBI, New Heaven, CT, USA) с опытным выбором оптимального времени экспозиции для каждой из проб: 12ч для гнРНК и 15 мин мРНК.
После проявления пленки оптическая плотность сигнала определялась с помощью компьютеризированной системы анализа изображений (Imaging Research, St Catherine, Ontario, Canada), используя публичный домен программы анализа изображений Национального института Здоровья США (Интернет сайт: ссылка скрыта). Оптическую плотность определяли как минимум на 2 последовательных срезах, вычисляли среднее значение для каждого животного, а потом – для всей группы.
Статистическая обработка проводилась с помощью комплексного пакета программ ANOVA, включающего тест Fisher’а (least significant difference procedure – PLSD). P<0.05 считалось статистически достоверной разницей между экспериментальными группами. Данные представлены в виде среднего и ошибки среднего. Плотность сигнала (уровни гнРНК и мРНК ВП) представлены в виде абсолютных единиц оптической плотности - пикселях.
Приготовление проб, гибридизации и анализ результатов проводились совместно с проф. В.В.Гриневичем в лаборатории гормонов и рецепторов под руководством д.б.н. П.М.Рубцова (Институт молекулярной биологии им. В.А. Энгельгардта, Москва, Россия).
Результаты собственных исследований и их обсуждение
Вазопрессин – один из древнейших нейрогормонов (А.Л.Поленов, 1968), выполняющий широкий спектр функций в организме животных и человека. Однако главной его функцией считается регуляция реабсорбции воды в собирательных трубочках почки. И именно эта направленность действия ВП становится особенно важной и достойной изучения в условиях, когда организм теряет воду. Наиболее частой причиной обезвоживания является системное воспаление. И чем оно тяжелее, тем более высока потеря воды.
Поэтому свою работу мы начали с изучения секреции вазопрессина в системный кровоток и экспрессии его гена (гетеронуклеарной (гн) рибонуклеиновой кислоты (РНК) и матричной (м) РНК) после инъекции бактериального эндотоксина E. coli. Ранее было показано, что введение липополисахарида вызывает слабое, недостоверное снижение концентрации вазопрессина в крови через 6 и 12 часов без изменения концентрации натрия в плазме крови. При этом не происходит существенных изменений в транскрипции гена вазопрессина (гнРНК), но отмечается снижение уровней мРНК вазопрессина в ядрах гипоталамуса. Это снижение не велико, но достоверно составляет около 25% по сравнению с контролем (Гриневич В.В. и др., 2000; Aguilera, Grinevich, Akmayev, 1999; Grinevich et al., 1999; Grinevich et al, 2001), и может отражать усиленный транспорт или ускоренную деградацию мРНК вазопрессина при воспалении.
Обобщая литературные и собственные данные, можно лишь предполагать, что при моделировании острого воспаления с помощью бактериального эндотоксина липополисахарида у крыс (как и других видов млекопитающих) (Kasting et al., 1985; Rivest, Laflamme, 1995; Parrot et al., 1997; Dadoun et al., 1998; Velluci, Parrot, 1998) in vivo не происходит достоверной активации и стойкого повышения уровня вазопрессина в крови, чего следовало бы ожидать, исходя из общей логики. Поэтому мы решили продолжить исследовать эффект липополисахарида, как воспалительного агента, но уже в условиях физиологической стимуляции крупноклеточных нейронов – солевой нагрузки (питьевой режим: замена воды на 2% р-р натрия хлорида в течение 6 дней). В данной модели осмотической стимуляции нами показано, что происходит потенциация секреции вазопрессина под действием липополисахарида, что соответствует ранее описанным данным в других экспериментальных моделях (Grinevich et al, 2001, 2003) и подтверждает общий характер реакции крупноклеточных нейронов гипоталамуса. При этом нарастание уровней вазопрессина в крови менее выражено, чем в других моделях (введение гипертонического раствора или водная депривация), что вероятно, обуславливается умеренностью осмотической стимуляции в виде солевой нагрузки 2% р-р натрия хлорида в течение 6 дней (табл.1).
Усиление секреции гормона вазопрессина сопровождается значимым снижением уровней его мРНК в крупноклеточных ядрах гипоталамуса. Последнее может отражать нарастание трансляции мРНК вазопрессина. Параллельно происходит небольшое увеличение метки гнРНК вазопрессина в супраоптическом ядре гипоталамуса, свидетельствующее о нарастании транскрипционной активности гена вазопрессина. Однако увеличение гнРНК вазопрессина не достигает достоверных значений, что
Таблица 1. Влияние бактериального эндотоксина ЛПС на концентрацию ВП и Na+ в плазме крови через 3 и 6 ч после инъекции на фоне солевой нагрузки.
| Группа | До введения | После введения | ||||
| 3ч | 6ч | |||||
| ВП, пг/мл | Na+ , мМ/л | ВП, пг/мл | Na+ , мМ/л | ВП, пг/мл | Na+ , мМ/л | |
| Контроль | 1,85±0,4 | 140,52±3,3 | 2,25±1,3 | 138,36±3,34 | 1,48±0,35 | 145,42±2,79 |
| Солевая нагрузка | 2,16±0,8 | 140,78±4,1 | 7,6±3,56* | 148,34±4,55 | 4,87±0,95* | 142,1±3,7 |
(М±m). Примечание. *p<0,05 по сравнению со значением до введения.
может быть объяснено недостаточной чувствительностью метода in situ гибридизации при оценке небольших изменений. Поэтому нельзя исключить, что даже небольшое нарастание транскрипции гена вазопрессина (по уровню гнРНК) и его трансляции (по уровню мРНК) достаточно для увеличения секреции этого нейрогормона в кровь. Доминирующую роль в этой потенциации играет супраоптическое ядро, как более реактивная, чем паравентрикулярное ядро, структура.
Следует подчеркнуть, что описанная реакция вазопрессин-синтезирующих нейронов гипоталамуса не зависит от колебаний осмолярности плазмы крови и параметров гемодинамики и отражает новый «неосмотический» механизм регуляции крупноклеточных нейронов в условиях воспаления.
Возможными факторами в данном случае могут явиться провоспалительные цитокины ИЛ-1, ИЛ-6, учитывая их роль в ауто- и паракринной регуляции вазопрессин-ергических крупноклеточных нейронов. По последним данным показано, например, что ИЛ-6 коэкспрессируется одновременно с геном ВП в крупноклеточном нейроне в условиях 3-х дневной депривации, возможно стимулируя секрецию ВП в системный кровоток в условиях осмотической нагрузки (Ghorbel M.N., Murphy D. et al, 2003; Mochamed et al. 2003; Summy-Long J.Y. et al, 2006). Помимо гипоталамических нейронов локальный синтез ИЛ-1 и ИЛ-6 был описан и в ЗДГ под действием ЛПС (Акмаев И.Г, Волкова О.В., Гриневич В.В. и др, 2001; Turnbull A.V., River C.L.,1999). Однако в условиях комплексного воздействия множества факторов воспаления, включающихся после инъекции эндотоксина липополисахарида, нарастания концентраций вазопрессина в крови не происходит.
Поэтому наше основное внимание было направлено на изучение факторов, которые могут блокировать активацию крупноклеточного нейрона при остром воспалении. Возможными кандидатами на эту роль могут служить глюкокортикоидные гормоны. Во-первых, уровень глюкокортикоидов чудовищно нарастает при введении липополисахарида (как ни при другом стрессе). Во-вторых, существует ряд свидетельств об угнетающем эффекте глюкокортикоидов на синтез вазопрессина. Хотя эти данные не нашли всеобщего признания, мы постарались внести их в патогенез модели воспаления.
Используя модель адреналэктомии у крыс, которая сама по себе слабо (не ярко выражено) влияет на синтез и транспорт вазопрессина, мы обнаружили, что на фоне отсутствия естественных глюкокортикоидов однократное введение бактериального эндотоксина липополисахарида действительно стимулирует гипоталамо-гипофизарную нейросекреторную систему на всех её иерархических уровнях. Так нарастает транскрипция гена вазопрессина (рис.1), содержание этого нейрогормона в гипоталамусе и по ходу гипоталамо-нейрогипофизарного тракта и, что наиболее важно,- повышение уровня вазопрессина в крови (табл. 2, рис 2,3 на вкладке). Выявленные факты свидетельствуют о подавляющей роли глюкокортикоидов на синтез и секрецию вазопрессина.
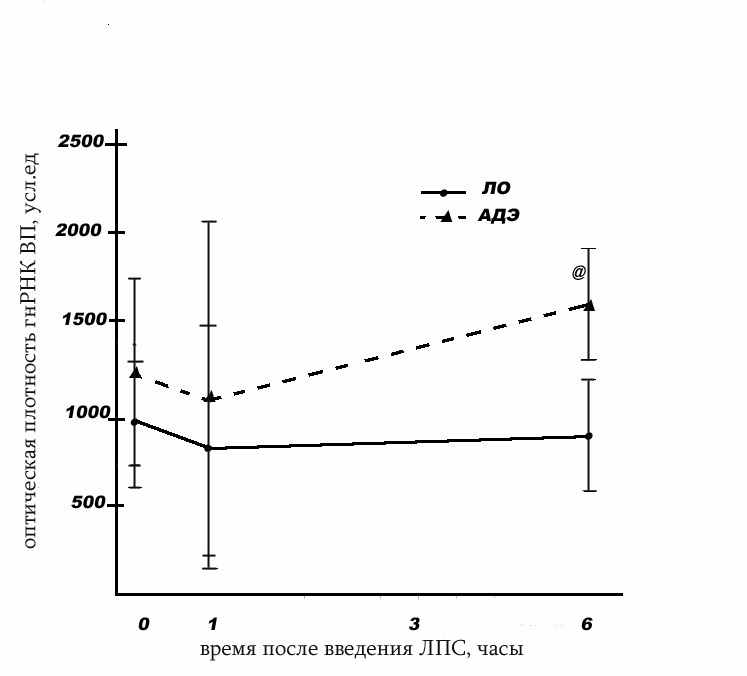
Рис. 1. Динамика синтеза гнРНК вазопрессина в паравентрикулярных ядрах гипоталамуса у ложнооперированных и адреналэктомированных крыс после интраперитонеальной инъекции бактериального эндотоксина липополисахарида (25мкг\100г) веса. (P<0,01) по сравнению с ЛО.
Таблица 2. Динамика уровня вазопрессина и осмолярности крови после интраперитонеальной инъекции липополисахарида (25 мкг\100г) у ложнооперированных и адреналэктомированных крыс.
| Групп-па | До введения | После введения | ||||
| 3ч | 6ч | |||||
| ВП, пг/мл | Осмоляр- ность, мOсм\л | ВП, пг/мл | Осмоляр-ность, мOсм\л | ВП, пг/мл | Осмоляр- ность, мOсм\л | |
| ЛО | 1,7±0,2 | 291,0±1,32 | 1,1±0,5 | 291,7±2,3 | 3,5±0,4* | 291,0±1,79 |
| АДЭ | 2,7±0,7 | 291,3±2,08 | 3,0±0,7 | 291,1±0,6 | 5,0±0,5* | 291,1±0,7 |
Примечание. *p<0,05 по сравнению со значением до введения.
ВЫВОДЫ
1. В настоящем исследовании показано, что однократное внутрибрюшинное введение как низких (25мкг\100г), так и высоких (250 мкг/ 100г) доз бактериального эндотоксина липополисахарида не вызывает значимого нарастания синтеза и секреции вазопрессина через 3, 6, 12, 24 часа после инъекции.
2. Введение бактериального эндотоксина (250мкг\100г, и\п инъекция, однократно) приводит к повышению чувствительности крупноклеточных нейронов к осмотическим стимулам, что выражается в потенциации синтеза и секреции антидиуретического гормона в системный кровоток после 6-ти дневной солевой нагрузки (питьевой режим: замена воды на 2% раствор NaCl).
3. Описанная реакция вазопрессин-ергических нейронов гипоталамуса не зависит от колебаний осмолярности плазмы крови и параметров гемодинамики и отражает новый «не осмотический» механизм регуляции крупноклеточных нейронов в условиях воспаления
4. Адреналэктомия (как модель устранения действия мощных противовоспалительных агентов – глюкокортикоидов) сама по себе слабо влияет на синтез и транспорт вазопрессина.
5. На фоне двухсторонней адреналэктомии под действием липополисахарида (25 мкг\100г веса, интраперитонеальная инъекция, однократно) происходит усиление транскрипции, трансляции гена вазопрессина и секреции гормона в кровь к 3, 6 часам, что свидетельствует о подавляющей роли глюкокортикоидов в регуляции крупноклеточных вазопрессин-синтезирующих нейронов гипоталамо-гипофизарной нейросекреторной системы при воспалении.
Список опубликованных работ по теме диссертации
- Месхидзе (Лискина) Е.Б., Гриневич В.В., Волкова О.В., Акмаев И.Г. Эффекты бактериального эндотоксина на секрецию и синтез вазопрессина при солевой нагрузке у крыс. // Бюлл. эксперим. биол. и медицины.- 2003.-Т. 136 - № 8.- С. 148-150.
- Гриневич В.В., Ресненко А.Б., Мишарин А.В., Месхидзе (Лискина) Е.Б., Акмаев И.Г. Иммунный стресс и гипоталамо-гипофизарно-адреналовая система.// Материалы международного конгресса «Прогрессивные научные технологии для здоровья человека». – Кара-Даг, Феодосия, Украина.- 2003.- С.173-174.
- Месхидзе (Лискина) Е.Б., Ресненко А.Б., Поскребышева Е.А., Волкова О.В., Гриневич В.В. Эффекты бактериального эндотоксина липополисахарида на синтез и секрецию вазопрессина в условиях депривации воды и солевой нагрузки.// Тезисы докладов Всероссийской конференции с международным участием «Нейроэндокринология-2003» 23-25 сентября 2003 г.-Санкт-Петергбург, Россия.-С.194-195.
- Ресненко А.Б., Месхидзе (Лискина) Е.Б., Мишарин А.В., Поскребышева Е.А., Гриневич В.В., Акмаев И.Г. Роль интерлейкина (ИЛ) -1β и ИЛ-6 в регуляции гипоталамо-гипофизарно-адренокортикальной системы при длительном воспалении у крыс //Материалы доклада на I Всероссийской конференции «Физиология иммунной системы» 11-14 октября 2003г, Сочи, Дагомыс.- Ж.: International Journal on immunorehabilitation. -2003 -Т. 5 - №2 -С. 173-174.
- Месхидзе (Лискина) Е.Б., Гриневич В.В., Пекарский М.И. Гистофизиология периферического отдела гипоталамо-гипофизарной нейросекреторной системы (ГГНС) у крыс в условиях воспаления.// Материалы Всероссийской научной конференции «Гистологическая наука России в начале XXI века: итоги, задачи, перспективы».- Москва.- 2003.-С. 169-171.
- Месхидзе (Лискина) Е.Б., Пекарский М.И., Гриневич М.И. Реакция структур задней доли гипофиза на острое системное воспаление у крыс.// «Актуальные вопросы морфогенеза в норме и патологии». Сборник научных трудов. - Москва.- 2004. – С.61-63.
- Гриневич В.В., Поскребышева Е.А., Ресненко А.Б., Месхидзе (Лискина) Е.Б., О.В. Волкова. Гипоталамо-гипофизарно-адреналовая система в условиях иммунного стресса.// Морфология.-2004.-Т.126.-№4.-С.38-39.
- Месхидзе (Лискина) Е.Б., В.В. Гриневич, Волкова О.В., Акмаев И.Г.. Влияние липополисахарида на гипоталамо-гипофизарную нейросекреторную (ГГНС) систему у крыс.// Материалы доклада на 3-ем Российском Конгрессе по патофизиологии с международным участием, Москва, 9-12 ноября 2004г. - Тезисы докладов. - Москва.-2004.-С.103.
- Месхидзе (Лискина) Е.Б. Влияние липополисахарида (ЛПС) на гипоталамо-гипофизарную нейросекреторную систему (ГГНС) у крыс. Материалы доклада на VII Всероссийской конференции по патологии клетки. Сборник научных трудов.- Москва.-2005.-С. 77-78.
1 Во всех экспериментах мы использовали ЛПС, полученный из культуры Escherichia coli (Серотип 0111:В4, №L-3012, лот № 36Н4130, Sigma, США). Дозировка липополисахарида составляла 250мкг/100г веса животного.
